Анод, катод, положительный и отрицательный: основы химии батарей
04 мая 2020г.
В последнее время были совершены важные открытия в области аккумуляторных батарей (иногда называемых вторичными элементами), и большую часть этой работы можно отнести к разработке электромобилей. Эта работа помогла получить Нобелевскую химическую премию 2019 года за разработку литий-ионных аккумуляторов. Следовательно, термины «анод», «катод», «положительный» и «отрицательный» приобрели все большую важность.
В статьях о новых батарейных электродах и станциях циклирования батарей часто используются названия анод и катод без указания того, разряжается ли батарея или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, их иногда можно спутать, что может привести к ошибкам.
Цель этой статьи — прояснить и четко определить эти разные термины.
Реакции окисления и восстановления
Реакция окисления является электрохимической реакцией, которая производит электроны./Standardreductionpotential-5b551731c9e77c003ec223b3.jpg)
Zn + 4OH— → Zn (OH) 2-4 + 2e—
реакция окисления. Окисление — это потеря электронов.
Реакция восстановления — это электрохимическая реакция, которая потребляет электроны. Электрохимическая реакция, происходящая на положительной стороне литий-ионного аккумулятора во время разряда:
Li1 — xCoO2
является реакцией восстановления. Сокращение — это выигрыш электронов.
Анод, катод
- Анод — это электрод, в котором происходит реакция окисления. Потенциал анода, через который протекает ток, выше его равновесного потенциала: Ea (I)> EI = 0 (рис. 1).
- Катод — это электрод, в котором происходит реакция восстановления.
 Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Рис.1: (E
I≠0−EI=0) I > 0Положительные и отрицательные электроды
Два электрода батареи или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом упоминается как положительный, электрод с более низким потенциалом упоминается как отрицательный. Электродвижущая сила, эдс в V батареи — это разность потенциалов положительного и отрицательного электродов, когда батарея не работает.
Исследуя батарею
Разряд батареи
Во время разряда напряжение элемента U, разность между положительным и отрицательным, уменьшается (рис. 2, 3).
- Потенциал положительного электрода E+I≠0 становится меньше его значения в состоянии покоя E+I = 0 : E

- Потенциал отрицательного электрода E—I≠0 становится больше его значения в состоянии покоя E—I=0 : E—I>0 > E—I=0 → отрицательный электрод является анодом.
Рис. 2: Разряд и заряд батареи: слева — потенциальное изменение положительного и отрицательного электродов; справа — изменение напряжения батареи
Зарядка аккумулятора
Во время зарядки напряжение элемента U, разность между положительным и отрицательным, увеличивается (рис. 2, 3).
- Потенциал положительного электрода E+I≠0 становится больше его значения в состоянии покоя E
- Потенциал отрицательного электрода E—I≠0 становится меньше его значения в состоянии покоя E—I=0 : E—I<0 < E—I=0 → отрицательный электрод является катодом.

Рис. 3: Разрядка / зарядка вторичной батареи, представленной в виде электрохимической ячейки, с электронами и направлением тока.
Вывод
При обычном использовании перезаряжаемой батареи потенциал положительного электрода как при разряде, так и при перезарядке остается больше, чем потенциал отрицательного электрода. С другой стороны, роль каждого электрода переключается во время цикла разрядки / зарядки.
- Во время разряда положительным является катод, отрицательным является анод.
- Во время заряда положительным является анод, отрицательным является катод.
Тексты, описывающие аккумуляторные аноды или катоды, безусловно, косвенно рассматривают случай разряда, что является неполным предсталением о процессах, происходящих внутри вторичного элемента.
Поделиться в соцсетях:
Анод — это… Что такое Анод?
Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания.
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины.
Анод в вакуумных электронных приборах
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Анод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.
См. также
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
АНОД — Что такое АНОД?
Слово анод английскими буквами(транслитом) — anod
Значения слова анод.
 Что такое анод?
Что такое анод?Анод
Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода.
ru.wikipedia.org
Ано́д положительный электрод источника электрического тока, напр. положительный полюс гальванического элемента или электрического аккумулятора; электрод электронного прибора (ионного прибора)…
Энциклопедия техники
Анод так называется по терминологии, введенной английским физиком Фарадеем в учение об электричестве (в 1832 г.), одна из двух металлических пластинок или проволок, по которым вступает или выходит из жидкости электрический ток.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Ано́д
Ано́д — положительный электрод источника электрического тока, напр. положительный полюс гальванического элемента или электрического аккумулятора; электрод электронного прибора (ионного прибора)…
Энциклопедия техники
Анода
Анода (лат. Anoda) — род цветковых растений семейства Мальвовые (Malvaceae). Цветы состоят из пятилопастной чашечки без подчашия, пяти лепестков, большого числа тычинок и нескольких сросшихся плодников, образующих звездчатую многолопастную завязь.
ru.wikipedia.org
Анода (Anoda) — установленный ботаником Каваниле род из семейства просвирняковых (Malvaceae). Все представители этого рода растут в Мексике. Цветы состоят из пятилопастной чашечки без подчашия, пяти лепестков…
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Гальванотехника
Гальванопластика Г. заключается в процессе получения металлических осадков желаемого вида и формы посредством электрического тока, через разложение им металлических растворов.Аноды должны быть из чистого никеля, как, например, вальцованного; трудно производить хорошее…
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
ГАЛЬВАНОТЕХНИКА, получение на пов-сти изделия или основы (формы) слоев металлов из р-ров их солей под действием постоянного электрич. тока. Различают: 1) гальваностегию-нанесение на пов-сть изделия тонких, обычно до неск. десятков мкм…При прохождении тока через р-р соли положит. ионы металла, образующиеся на аноде, присоединяя электроны, образуют на катоде нейтральные атомы, металл кристаллизуется и покрывает катод..
Химическая энциклопедия.
ГАЛЬВАНОСТЕГИЯ (от гальвано… и греч. stego — покрываю) — нанесение защитных или декоративных металлич. покрытий на изделия электролитич. осаждением. Г. предшествуют обезжиривание поверхности, травление (декапирование), шлифовка и полирование.Г. производят в гальванич. ванне, где анодом служат металлы, растворяющиеся в электролите для компенсации осаждаемого металла, а катодом — изделия.
Большой энциклопедический политехнический словарь
Русский язык
Ано́д, -а.
Орфографический словарь. — 2004
Примеры употребления слова анод
По сообщению сайта Engadget, NHK усовершенствовала OLED матрицу, поменяв местами анод и катод, по сравнению с традиционной конфигурацией слоёв, и добавив дополнительное защитное покрытие поверх катода.
Главные анод и катод соединяются подобно двум микроскопическим гребенкам на стеклянной подложке.
- анодируются
- анодный
- анодонта
- анод
- аноксибионт
- аноксия
- аномалистический
Что такое анод, а что такое катод | Инженерные знания
В статьях и заметках на нашем канале частенько проскакивают слова анод и катод. Эти термины пронизываются все технические науки и будут встречаться регулярно. На первый взгляд они должны быть знакомы нам ещё этак класса из 8 школьной программы, но кто же её когда помнит 🙂 Давайте раз и навсегда разберемся с тем, что такое анод и что такое катод и когда используются эти термины.
Начнем с самого простого. Анод и катод впервые встречаются нам в курсе химии. Катод от греческого «ход вниз», анод от греческого «ход вверх».
На момент появления этих хитрых слов мы ещё не до конца понимаем, что такое электричество (советую прочитать вот эту статейку) и знаем только самые основы электрофизики. Главная путаница тут с тем, где плюс, а где минус. Однозначно тут ответить нельзя, так как зависит всё от ситуации.
Главная путаница тут с тем, где плюс, а где минус. Однозначно тут ответить нельзя, так как зависит всё от ситуации.
Электрический ток, как нам известно, есть упорядоченное направленное движение частиц. Если всё сильно упростить (и даже немного исказить, что допустимо для общего понимания вопроса), то для существования этого тока нужны сами частицы. Их нужно где-то брать. Берутся они из источника тока. Рассматривая устройство обычной батарейки, где электрический ток получается «химическим» образом, мы наблюдаем следующую картинку.
Частицы берутся из протекающей химической реакции. На одном электроде идёт окисление, на другом — восстановление. Помним, что окисление — это отдача электронов, а восстановление — это принятие электронов. Чем не электрический ток, если увязать всё это в единую систему :)…Так, собственно говоря, и поступили.
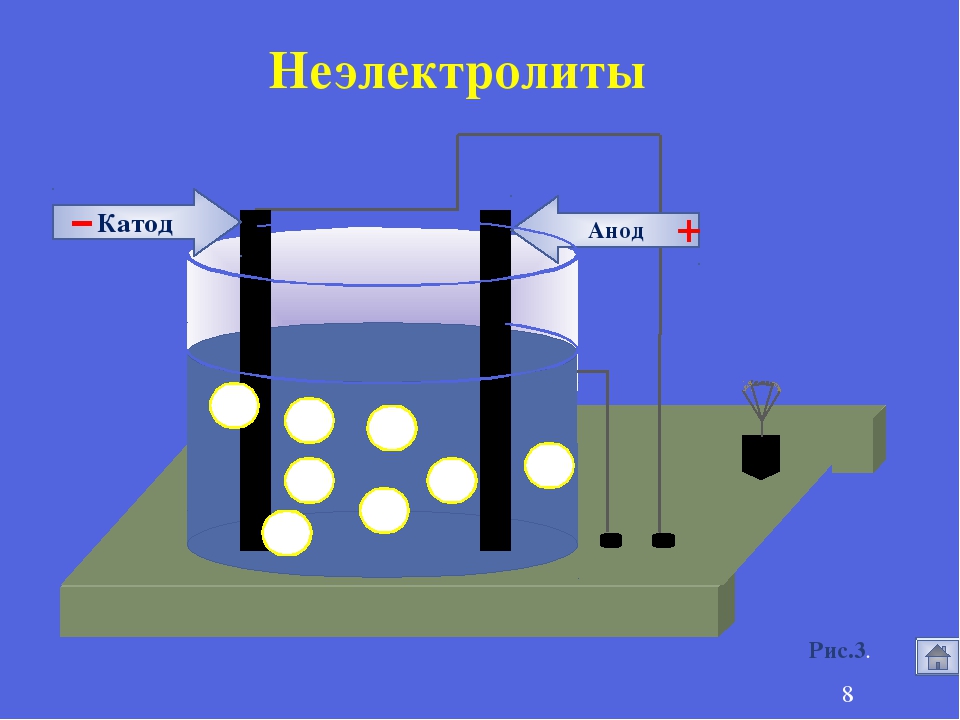
Поместили два электрода из разных металлов в раствор электролита. Раствор электролита начал реагировать с каждым из электродов параллельно выполняя транспортную функцию для переноса заряженных частиц от одной пластины к другой пластине.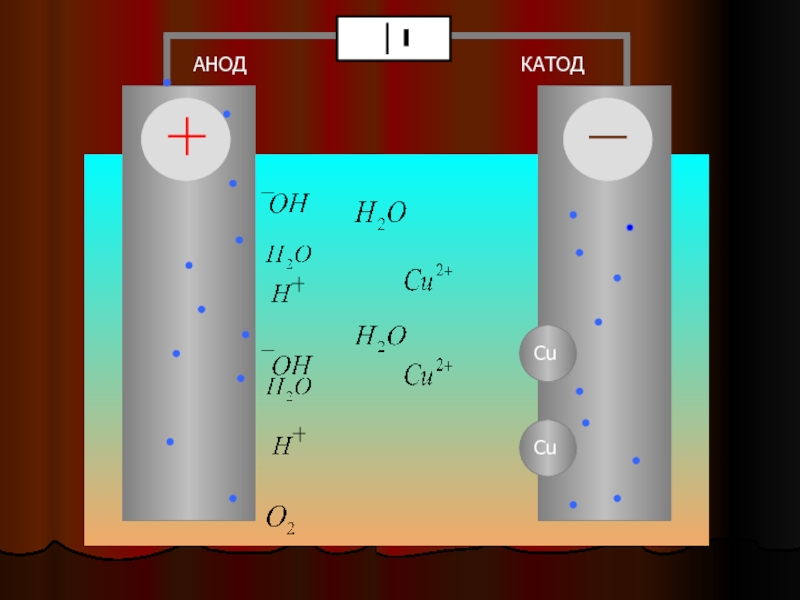 Один электрод восстанавливается, а другой окисляется. Получается электрический ток. Если к этим электродам подключить внешнюю нагрузку, то получится электрическая цепь. Заряд будет «пробегать» по этой внешней нагрузке (например по лампочке) и появится электрический ток.
Один электрод восстанавливается, а другой окисляется. Получается электрический ток. Если к этим электродам подключить внешнюю нагрузку, то получится электрическая цепь. Заряд будет «пробегать» по этой внешней нагрузке (например по лампочке) и появится электрический ток.
Если же запустить процесс в обратном направлении, то при правильном подборе химии процесса, мы сможем зарядить этот элемент питания и получится аккумулятор.
Ну а катод и анод — это просто заумные названия положительного и отрицательного электрода в такой системе.
На аноде происходит окислительная реакция а сам он восстановитель в системе. С него уходят заряженные частицы в цепь. На катоде происходит восстановительная реакция, а сам он окислитель. В цепи он принимает заряженные частицы.
Есть тут и заковырка, куда же без неё 🙂 Мало запомнить, что анод — это минус, а катод — это плюс. Очень важно понимать логику процесса и анализировать его химию. Пока мы находимся в рамках системы «элемент питания» всё будет действительно так, как мы описали выше. Но что, если мы рассматриваем электролиз? Про электролиз можно написать ещё одну огромную статью, но пока рано. Усвоим главное!
Пока мы находимся в рамках системы «элемент питания» всё будет действительно так, как мы описали выше. Но что, если мы рассматриваем электролиз? Про электролиз можно написать ещё одну огромную статью, но пока рано. Усвоим главное!
Электролиз есть процесс выделения на электродах растворённых веществ из электролита. Те самые хромированные детали, как вариант, делают именно этим способом.
В этом процессе необходим внешний источник тока, который создаст разность потенциалов между электрическими проводниками. Нужен внешний источник тока, который будет вкачивать ток в систему. Тогда на аноде будет плюс, а на катоде — противоположно.
Ещё полезно запомнить, что особенности процессов на анодах и катодах породили множество разных методик обработки. Анодировка, хромирование, различные прочие процессы гальванической обработки и активно используются в технике. Про обработку металла подобным образом я рассказывал здесь.
Ещё некоторая путаница встречается и в полупроводниках. Там тоже катод минус, а анод — плюс.
Там тоже катод минус, а анод — плюс.
Для того, чтобы «открыть» прибор, нужно подать на анод плюс, а на катод минус. Полезно почитать вот этот материал.
Что такое анод и катод, в чем их практическое применение
Анод и катод известны многим людям, даже тем, которые не связаны с электрикой или электроникой. Катод это электрод, имеющий отрицательный заряд, а анод заряжен положительно. Чтобы это легко и быстро запомнить, есть одно правило. В слове «катод» пять букв, также как и в слове «минус», а «анод» – четыре буквы, аналогично слову «плюс». Катоды и аноды используются для электролиза, в том числе для получения многих металлов, например алюминия. Они нашли широкое применения в современной промышленности, электроники и других сферах.
В статье будет подробно рассказано о том, что такое Анод и катод, а также для чего именно они нужны и какие физические законы за ними стоят. В качестве дополнения, настоящая статья имеет два ролика и статью, которую можно скачать по ссылке.
Анод и катод
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал.
На анод подают более высокий и положительный относительно катода потенциал.
В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность. Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы.
Химия электролиза.
Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду. У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху.
Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду. При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию). Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.
Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора.
Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс). Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. В табл. 1 даны нормальные электродные потенциалы некоторых водных растворов веществ при +25° С.
Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс). Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. В табл. 1 даны нормальные электродные потенциалы некоторых водных растворов веществ при +25° С.
Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Два разнополярных электрода
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе. С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Это интересно! Все о полупроводниковых диодах.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
- Масса вещества mэ, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ: mэ = α/τ,здесь а – электрохимический эквивалент вещества, г/Кл.
- Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n: mэ= А / 96480n, здесь 96480 – число Фарадея, Кл х моль-1.
Таким образом, электрохимический эквивалент вещества α= А / 96480n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества – кулоном (ампер-секундой).
Для меди А = 63,54, n =2, α =63,54/96480-2= 0,000329 г/Кл, для никеля α =0,000304 г/Кл, для цинка α=0,00034 г/Кл. В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами. Отношение массы фактически выделившегося вещества к массе его, которая должна была бы выделиться по закону Фарадея, носит название выхода вещества по току η1.
Следовательно, для реального процесса mэ = η1 х (А / 96480n) х It. Естественно, всегда η1<1. Выход по току существенно зависит от плотности тока на электроде. С увеличением плотности тока на электроде выход по току растет и повышается эффективность процесса.
Напряжение Uэл, которое необходимо подвести к электролизеру, состоит из: напряжения разложения Ер (разность потенциалов анодной и катодной реакций), суммы анодного и катодного перенапряжений падения напряжения в электролите Еп, падения напряжения в электролите Uэ = IRэп (Rэп – сопротивление электролита), падения напряжения в шинах, контактах, электродах Uс = I(Rш+Rк+Rэ). Получаем: Uэл = Ер + Еп + Uэ + Uс.
Устройство гальванической цепи.
Мощность, потребляемая при электролизе, равна: Рэл = IUэл = I(Ер + Еп + Uэ + Uс). Из этой мощности только первая составляющая расходуется на проведение реакций, остальные являются тепловыми потерями процесса. Лишь при электролизе расплавленных солей часть теплоты, выделяющейся в электролите IUэ, используется полезно, так как расходуется на расплавление загружаемых в электролизер солей.
Эффективность работы электролизной ванны, может быть оценена массой вещества в граммах, выделяемого на 1 Дж затраченной электроэнергии. Эта величина носит название выхода вещества по энергии.Ее можно найти по выражению qэ = (αη1)/Uэл100, здесь α – электрохимический эквивалент вещества, г/Кл, η1 – выход по току, Uэл – напряжение на электролизере, В.
Определение анода и катода
Для начала возьмем очень серьезный документ, который является ЗАКОНОМ для науки, техники и, конечно, школы. Это «ГОСТ 15596-82. ИСТОЧНИКИ ТОКА ХИМИЧЕСКИЕ. Термины и определения». Там на странице 3 можно прочесть следующее: «Отрицательный электрод химического источника тока это электрод, который при разряде источника является анодом». То же самое, «Положительный электрод химического источника тока это электрод, который при разряде источника является катодом». (Термины выделены мной. БХ). Но тексты правила и ГОСТа противоречат друг-другу. В чем же дело?
Материал по теме: Как подключить конденсатор
А всё дело в том, что, например, деталь, опущенная в электролит для никелирования или для электрохимического полирования, может быть и анодом и катодом в зависимости от того наносится на нее другой слой металла или, наоборот, снимается. Электрический аккумулятор является классическим примером возобновляемого химического источника электрического тока. Он может быть в двух режимах – зарядки и разрядки. Направление электрического тока в этих разных случаях будет в самом аккумуляторе прямо противоположным, хотя полярность электродов не меняется.
В зависимости от этого назначение электродов будет разным. При зарядке положительный электрод будет принимать электрический ток, а отрицательный отпускать. При разрядке – наоборот. При отсутствии движения электрического тока разговоры об аноде и катоде бессмысленны.
«Поэтому, во избежание неясности и неопределенности, а также ради большей точности, – записал в своих исследованиях М.Фарадей в январе 1834г., – я в дальнейшем предполагаю применять термины, определение которых сейчас дам».
Каковы же причины введения новых терминов в науку Фарадеем? А вот они: «Поверхности, у которых, согласно обычной терминологии, электрический ток входит в вещество и из него выходит, являются весьма важными местами действия и их необходимо отличать от полюсов». В те времена после открытия Т. Зеебеком явления термоэлектричества имела хождение гипотеза о том, что магнетизм Земли обусловлен разностью температур полюсов и экватора, вследствие чего возникают токи вдоль экватора. Она не подтвердилась, но послужила Фарадею в качестве «естественного указателя» при создании новых терминов. Магнетизм Земли имеет такую полярность, как если бы электрический ток шел вдоль экватора по направлению кажущегося движения солнца.
Обозначение анода и катода
Фарадей записывает: «На основании этого представления мы предлагаем назвать ту поверхность, которая направлена на восток – анодом, а ту, которая направлена на запад – катодом». В основе новых терминов лежал древнегреческий язык и в переводе они значили: анод – путь (солнца) вверх, катод – путь (солнца) вниз.
В русском языке есть прекрасные термины ВОСХОД и ЗАХОД, которые легко применить для данного случая, но почему-то переводчики Фарадея этого не сделали. Мы же рекомендуем пользоваться ими, ибо в них корнем слова является ХОД и, во всяком случае, это напомнит пользователю термина, что без движения тока термин не применим. Для желающего проверить рассуждения создателя термина с помощью других правил, например правила пробочника, сообщаем, что северный магнитный полюс Земли лежит в Антарктиде, возле Южного географического полюса.
Ошибкам в применениях терминов АНОД и КАТОД нет числа. В том числе и в зарубежных справочниках и энциклопедиях. Поэтому в электрохимии пользуются другими определениями, более понятными читателю. У них анод – это электрод, где протекают окислительные процессы, а катод – это электрод, где протекают восстановительные процессы. В этой терминологии нет места электронным приборам, но при электротехнической терминологии указать анод радиолампы, например, легко. В него входит электрический ток. (Не путать с направлением электронов).
Как работает батарейка.
Основные свойства катодов
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал. Катод должен отдавать с единицы поверхности большой ток эмиссии при возможно низкой температуре нагрева и обладать большим сроком службы. Нагрев катода в электровакуумном приборе производится протекающим по нему током.
Такие термоэлектронные катоды разделяются на две основные группы:
- катоды прямого накала,
- катоды косвенного накала (подогревные).
Катоды прямого накала представляют собой металлическую нить, которая непосредственно разогревается током накала и служит для излучения электронов.Поверхность излучения катодов прямого накала невелика, поэтому от них нельзя получить большой ток эмиссии. Малая теплоемкость нити не позволяет использовать для нагрева переменный ток. Кроме того, при нагреве переменным током температура катода не постоянна во времени, а следовательно, меняется во времени и ток эмиссии.
Положительным свойством катода прямого накала является его экономичность, которая достигается благодаря малому количеству тепла, излучаемого в окружающую среду вследствие малой поверхности катода. Катоды прямого накала изготовляются из вольфрамовой и никелевой проволоки. Однако большая работа выхода (W = 4,2÷4,5 в) определяет высокую рабочую температуру катода, вследствие чего катод становится неэкономичным. Для повышения экономичности катода вольфрамовую или никелевую проволоку (керн) «активируют» — покрывают пленкой другого элемента. Такие катоды называются активированными.
Если на поверхность керна нанесена электроположительная пленка (пленка из цезия, тория или бария, имеющих меньшую работу выхода, чем материал керна), то происходит поляризация пленки: валентные электроны переходят в керн, и между положительно заряженной пленкой и керном возникает разность потенциалов, ускоряющая движение электрона при выходе его из керна.
Работа выхода катода с такой мономолекулярной электроположительной пленкой оказывается меньше работы выхода электрона как из основного металла, так и из металла пленки. При покрытии керна электроотрицательной пленкой, например кислородом, работа выхода катода увеличивается. Подогревные катоды выполняются в виде никелевых гильз, поверхность которых покрывается активным слоем металла, имеющим малую работу выхода. Внутри катода помещается подогреватель— вольфрамовая нить или спираль, подогрев которой может осуществляться как постоянным, так и переменным
Как работает гальванизация.
током.
Для изоляции подогревателя от гильзы внутренность последней покрывается алундом (Аl2O3). Подогревные катоды, благодаря их большой тепловой инерции, обычно питают переменным током, значительная поверхность гильзы обеспечивает большой эмиссионный ток. Подогревные катоды, однако, менее экономичны и разогреваются значительно дольше, чем катоды прямого накала.
Заключение
Рейтинг автора
Автор статьи
Инженер по специальности «Программное обеспечение вычислительной техники и автоматизированных систем», МИФИ, 2005–2010 гг.
Написано статей
Принцип работы анода и катода можно более подробно изучить из статьи Анод и катод в диодах. Если у вас остались вопросы, можно задать их в комментариях на сайте.
Также в нашей группе ВК можно задавать вопросы и получать на них подробные ответы от профессионалов. Для этого приглашаем читателей подписаться и вступить в группу. В завершение статьи хочу выразить благодарность источникам, откуда мы черпали информацию во время подготовки материала:
www.electricalschool.infol
www.meanders.ru
www.electrik.info
www.elel.ru
www.kristallikov.net
www.obrazovaka.ru
ПредыдущаяТеорияЧто такое индуктивность
СледующаяТеорияЗаконы Кирхгофа простыми словами: определение для электрической цепи
Анод и катод: что это такое
Эти физические термины затрагивают области гальваники, химии, а также источников питания, полупроводниковой и вакуумной электроники. Зная, что такое анод и катод можно, к примеру, разобраться почему греется телефон. В статье описывается, что из себя представляют анод и катод, объясняется катод и анод – это плюс или минус. Помимо этого, затрагиваются аспекты и нюансы заряда катода и анода.
Анод и катод. Что это такое
Анод – является электродом, через который электрический ток проникает в устройство. Он является противоположностью катоду, электроду, через который электрический ток покидает электрическое устройство. Направление электрического тока в цепи отличается вектора потока электронов. В связи с этим (отрицательно заряженные) электроны вытекают из анода во внешний контур. Анод в гальваническом элементе представлен электродом, где происходит реакция окисления.
Эти понятия обусловлены не полярностью напряжения электродов, а направлением тока через электрод. Если ток, который идёт через электроды, изменяет своё направление, как это происходит, например, в перезаряжаемой батарее (во время зарядки), анод и катод меняются местами.
Обычный ток зависит не только от направления движения носителей заряда, но и от электрозаряда носителей. Электрический ток вне устройства обычно переносится электронами в проводнике из металла. Так как электроны обладают зарядом со значением «минус», направление их потока противопоставляется направлению стандартного тока. Из этого следует, что электроны уходят из аппарата через анод и попадают в устройство через катод.
Полярность напряжения на аноде по отношению к связанному катоду меняется из-за разновидности аппарата и его режима работы. В представленных примерах анод является отрицательным в устройстве (обеспечивает питание) и положительным в устройстве, которое потребляет энергию. В разных областях применения анод может быть положительным или отрицательный.
Анод в гальваническом элементе
Тут он является отрицательным выводом, потому что именно там обычный ток протекает в устройство (элемент аккумулятора). Этот внутренний электрический ток переносится извне электронами, движущимися наружу. Притом отрицательный заряд, протекающий в одном направлении, электрически эквивалентен положительному заряду, который протекает противоположном направлении.
В перезаряжаемой батарее или в электролизере
Здесь же анод является положительным выводом, который получает ток от внешнего генератора. Ток через перезаряжаемую батарею противоположен направлению тока во время разряда. Иными словами, электрод, который был катодом во время разрядки батареи, становится анодом во время процесса её зарядки.
Электронно-лучевая труба
Тут является положительным выводом, через который электроны вытекают из устройства. Иначе: туда, где течет положительный электрический ток.
Вакуумная трубка анода
В электронных вакуумных устройствах, таких как электронно-лучевая трубка, анод – это положительно заряженный электронным коллектор. В трубке анод представляет собой заряженную положительную пластину, которая собирает электроны, испускаемые катодом через электрическое притяжение. Это параллельно ускоряет поток этих электронов.
В электрохимии анод находится там, где происходит окисление, и является контактом с положительной полярностью в электролизере. На аноде электрические потенциалы заставляют анионы (отрицательные ионы) вступать в химическую реакцию и испускать электроны (окисление), которые затем попадают в цепь управления.
Диодный анод
В полупроводниковом диоде анодом является легированным слоем P, который изначально создает отверстия для соединения. В области соединения отверстия, подаваемые анодом, объединяются с электронами, подаваемыми из области с N-легированием, создавая истощённую зону. Когда положительное напряжение подается на анод диода из схемы, большее количество отверстий может быть перенесено в обедненную область, и это приводит к тому, что диод становится проводящим, позволяя току протекать по цепи.
Термины «анод» и «катод» не должны применяться к стабилитрону, так как он даёт возможность протекать току в любом направлении в зависимости от полярности напряжения.
В электрохимии
Тут анод расположен там, где происходит окисление, и является контактом с положительной полярностью в электролизере. На аноде электрические потенциалы заставляют анионы (отрицательные ионы) вступать в химическую реакцию и испускать электроны (окисление), которые затем попадают в цепь управления.
Такой процесс широко применяется для рафинирования металлов. При рафинировании меди медные аноды (те промежуточные продукты из печей) претерпевают электролиз в подходящем растворе (таком как серная кислота) для получения катодов высокой чистоты. Медные катоды, полученные с использованием этого метода, также называют электролитической медью.
Катод – это электрод, от которого обычный ток покидает электрический аппарат. Тут у электронов заряд электрический заряд под знаком «минус», поэтому движение электронов противоположно движению обычного потока тока. Катодный электрический ток отходит, что также означает, что электроны поступают в катод устройства из внешней цепи.
Полярность катода и анода – это положительное или отрицательное значение, что зависит от работы устройства. Хотя положительно заряженные катионы всегда движутся к катоду (отсюда и их название), а отрицательно заряженные анионы удаляются от него, полярность катода зависит от типа устройства и может даже варьироваться в зависимости от режима работы.
В устройстве, поглощающем энергию заряда (зарядка батареи), катод является отрицательным (электроны вытекают из катода, и заряд проникает туда) и в аппарате, который снабжает энергией (используемая батарея), катод положительный (электроны втекают в него и заряд уходит). Используемая батарея обладает катодом (положительный вывод), поскольку именно там ток течет из устройства. Этот внешний ток переносится изнутри положительными ионами, движущимися от электролита к положительному катоду (химическая энергия отвечает за движение в гору). Это поддерживается электронами, которые направляются к батарее.
Например, медный электрод гальванического элемента Даниэля является положительным выводом и одновременно катодом. Это происходит тогда, когда заряд поступает в батарею. Например, изменение направления тока в гальваническом элементе Даниэля превращает его в электролизер. Тут медный электрод одновременно является как положительным выводом, так и анодом. В диоде катод является отрицательным выводом на остроконечном конце символа стрелки, откуда ток течет из устройства.
В электролизере на катоде применяется отрицательная полярность для активации элемента. Общими результатами восстановления на катоде являются газообразный водород или чистый металл из ионов металлов. Говоря об относительной восстановительной способности двух окислительно-восстановительных агентов, считается, что пара для генерирования большего количества восстанавливающих веществ является более «катодной» по сравнению с более легко восстанавливаемым реагентом.
Как определить анод и катод
Электрическая схема катода и анода:
Различие между катодом и анодом основано исключительно на токе, а не на напряжении. Металл, используемый для катода, имеет значительно большее количество электронов, чем нейтроны или протоны.
Например, один из потребителей энергии находится в прямом включении. Далее, ток по аноду из внешней цепи проникает в элемент. Во внешнюю цепь прямо через катод из элемента выходит электрический ток. Это чем-то напоминает перевёрнутое изображение. Если данные обозначения сложные, то тут разобраться с ними могут только химики. Теперь надо сделать обратное включение. В этом случае диоды полупроводникового типа почти не будут проводить электрический ток. Тем не менее, есть вероятность обратного пробоя у элементов.
Электровакуумные диоды (например, радиолампы) совсем не обладают способностью проводить ток обратного типа. Условно принято считать, что ток через них не протекает. В связи с этим формально выводы анода и катода у диодов не отвечают за выполнение этих функций.
При катодной защите металлический анод электрически связан с защищаемой системой и частично разъедает или растворяет металл защищаемой системы. Этот металлический анод большей степени реагирует на коррозионную среду защищаемой системы. Корпус железного или стального судна может быть защищен цинковым анодом, который растворяется в морской воде и предотвращает коррозию корпуса.
Менее очевидным примером такого типа защиты является процесс цинкования железа. Такой процесс покрывает железные конструкции (такие как ограждение) покрытием из металлического цинка. Пока цинк остается неповрежденным, железо защищено от коррозии. С течением времени цинковое покрытие становится поврежденным, в результате потрескивания или физического повреждения.
Знание того, что такое анод и катод, является ключевым в электрохимии и помогает понять основные принципы работы простейших аккумуляторов и гальванических элементов.
РАЗНИЦА МЕЖДУ АНОДОМ И КАТОДОМ | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ — НАУКА
В ключевое отличие между анодом и катодом это то, что анод — это положительный вывод, а катод — отрицательный вывод.Аноды и катоды — это электроды с противоположной полярностью. Чтобы узнать разницу м
В ключевое отличие между анодом и катодом это то, что анод — это положительный вывод, а катод — отрицательный вывод.
Аноды и катоды — это электроды с противоположной полярностью. Чтобы узнать разницу между анодом и катодом, нам сначала нужно понять, что они собой представляют. Аноды и катоды — это электроды, которые используются для подачи электрического тока в любое устройство, использующее электричество, или из него. Электрод — это проводящий материал, который позволяет току проходить через него. Электроды обычно изготавливаются из металлов, таких как медь, никель, цинк и т. Д., Но некоторые электроды также сделаны из неметаллов, таких как углерод. Кроме того, электрод замыкает цепь, пропуская через него ток.
1. Обзор и основные отличия
2. Что такое анод
3. Что такое катод
4. Параллельное сравнение — анод и катод в табличной форме
5. Резюме
Что такое анод?
Анод — это электрод, на котором ток покидает ячейку и где происходит окисление. Мы также называем его положительным электродом. Простая батарея состоит из трех основных частей: анода, катода и электролита. Традиционно электроды находятся на концах батареи. Когда мы соединяем эти концы с электричеством, внутри батареи начинается химическая реакция. Здесь электроны возмущаются и должны реорганизоваться. Они отталкиваются друг от друга и движутся к катоду, на котором меньше электронов. Это уравновешивает электроны во всем растворе (электролите).
Как правило, ток течет через катод, когда устройство разряжается. Однако направление тока меняется на противоположное, когда устройство заряжается, и катод начинает работать как анод, а анод становится катодом.
В первичном элементе или батарее выводы необратимы, а это означает, что анод всегда будет положительным. Это потому, что мы всегда используем это устройство для разряда электрического тока. Но в случае вторичных элементов или батарей электроды обратимы, поскольку устройство разряжается, но также получают ток для зарядки.
Что такое катод?
Катод — это электрод, по которому ток входит в ячейку и происходит восстановление. Мы также можем назвать это отрицательным электродом. Однако катод может быть отрицательным в электролитических ячейках и положительным в гальванических элементах.
Катод обеспечивает электроны для катионов (положительно заряженных ионов). Эти ионы попадают на катод через электролит. Более того, катодный ток — это поток электронов от катода к катионам в растворе. Однако термины катод и анод могут иметь разные значения в разных приложениях.
В чем разница между анодом и катодом?
Анод — это электрод, на котором ток покидает ячейку и где происходит окисление, а катод — это электрод, через который ток входит в ячейку и происходит восстановление. Ключевое различие между анодом и катодом состоит в том, что анод является положительным выводом, а катод — отрицательным выводом. Однако есть также биполярные электроды, которые могут работать как аноды, так и катоды. Обычно анод притягивает анионы, а катод притягивает катионы, что привело к названию этих электродов именно так.
Резюме — анод против катода
Анод — это электрод, на котором ток покидает ячейку и где происходит окисление, а катод — это электрод, через который ток входит в ячейку и происходит восстановление. Ключевое различие между анодом и катодом состоит в том, что анод является положительным выводом, а катод — отрицательным выводом.
Катод и анод — определение и различие между анодом и катодом
Что такое анод и катод?
Прежде чем мы познакомимся с терминами катод и анод, сначала нам необходимо понять, что такое электрод. Согласно общему определению, электрод — это вещество, которое способствует проводимости электричества, при этом электрический ток либо выходит, либо входит в неметаллическую среду, такую как электролитическая ячейка.
В чистом виде электрод можно определить как проводник, который помогает установить электрический контакт с неметаллической частью цепи.Электроды состоят из двух основных точек, называемых катодом и анодом, которые в основном описывают направление потока тока.
Объяснение анода и катода
Давайте обсудим, что именно означают катод и анод. Оба эти термина можно определить по течению тока. Таким образом, катод можно рассматривать как электрод, с которого ток выходит из поляризованного электрического устройства. Таким же образом анод можно описать как электрод, от которого ток входит в поляризованное электрическое устройство.
Термины «катод» и «анод» были окончательно определены в 1834 году Уильямом Уэвеллом. Он адаптировал слова из греческого слова (имя, катодос), «путь вниз» или «спуск». Уильям консультировался с Майклом Фарадеем при разработке терминов.
Графическое изображение катода и анода приведено ниже.
[Изображение скоро будет загружено]
Что такое катод?
Когда мы говорим о катоде в химии, можно сказать, что это электрод, на котором происходит восстановление.В электрохимической ячейке это обычное дело. Здесь катод дает отрицательные результаты из-за того, что электрическая энергия, подаваемая в элемент, приводит к разложению химических соединений. Однако можно также сказать, что он положительный, как и в случае гальванического элемента, в котором химическая реакция имеет тенденцию к выработке электрической энергии.
Также говорят, что катод является либо холодным катодом, либо горячим катодом. Катод, который нагревается в присутствии нити накала для испускания электронов с помощью термоэлектронной эмиссии, называется горячим катодом, тогда как холодные катоды не нагреваются никакой нитью накала.В общем, катод помечается как «холодный», если он испускает больше электронов, чем те, которые генерируются только термоэлектронной эмиссией.
Что такое анод?
В самом общем виде анод в электрохимии определяется как точка, в которой происходит реакция окисления. Как правило, на аноде анионы или отрицательные ионы из-за своего электрического потенциала имеют тенденцию реагировать и испускать электроны. Затем эти электроны движутся вверх и попадают в цепь управления.
Если рассматривать гальванический элемент, анод имеет отрицательную природу, и в основном электроны движутся к внешней части цепи.Тогда как в электролитической ячейке он снова дается как положительный. Кроме того, анодом может быть проволока или пластина, имеющая избыточный положительный заряд.
Давайте обсудим некоторые ключевые различия между анодом и катодом:
Разница между анодом и катодом
Катод | Анод |
Катод является электродом течет из или выдано. | Анод — это электрод, в который проникает электричество. |
Катод — это электрод с отрицательной стороной. | Анод — это электрод с положительной стороной. |
Катод действует как акцептор электронов. | Анод действует как донор электронов. |
Реакция восстановления происходит на катоде в электролитической ячейке. | На аноде электролитической ячейки происходит реакция окисления. |
Катод может стать анодом в гальванических элементах. | Анод может стать катодом в гальванических элементах. |
Заряд на аноде и катоде
На аноде наблюдается реакция окисления. Окисленные частицы потеряют электроны, оставив на этом электроде скопление электронов. Таким образом, анод заряжен отрицательно.
Но, в отличие от катода, существует реакция восстановления, при которой разновидности уменьшенных частиц будут получать электроны.Следовательно, электрод, то есть катод, не имеет электронов и поэтому заряжен положительно.
Причина, по которой катод отрицательный, а анод положительный
Это из-за того, как они были определены изначально, что датируется временем до открытия электронов. Катод был образован от греческого слова «kathodos», что означает «путь вниз», как терминала, с которого обычный ток («течет» от положительного электрода к отрицательному, противоположно направлению движения электронов) покидает устройство (с анод является выводом, куда входит обычный ток).
Катод не всегда бывает положительным или отрицательным. Но в разряженной батарее катод действует как положительный вывод, в то время как в вакуумной лампе или диоде катод действует как отрицательный вывод, поскольку обычный ток входит в них через анод или положительный вывод.
Заряды катода и анода гальванического элемента
Окислительно-восстановительные реакции в обоих полуэлементах гальванического элемента являются спонтанными. На катоде происходит восстановление, создавая положительный заряд и расходуя электроны.В то время как на аноде происходит реакция окисления, и избыточные электроны создают отрицательный заряд.
Электрохимия — Что такое анод, а какой катод?
В электрохимическом элементе нет законченной электронной схемы
В электрохимической ячейке анод является источником электронов для внешней цепи, а катод — стоком. Цепь переноса заряда завершается перемещением ионов внутри клетки. Солнечный элемент отличается от электрохимического элемента тем, что в нем нет чистой химической реакции.В солнечном элементе электроны текут по замкнутому контуру — по кругу во внешней цепи и через устройство.
Обозначение анода и катода
Таким образом, маркировка анода и катода основана на аналогии между гальваническим элементом и фотоэлектрическим элементом как источником электрической работы. Имеет смысл использовать направление потока электронов во внешней цепи для определения анода и катода (электроны текут от анода к катоду во внешней цепи).В гальванической ячейке нет потока электронов внутри ячейки (вместо этого есть поток ионов, чтобы уравновесить заряды). В фотоэлементе электроны текут от перехода к аноду, а дырки текут от перехода к катоду (или, можно сказать, электроны текут от катода к переходу).
К сожалению, анод и катод названы с использованием разных условных обозначений в зависимости от типа устройства, см. Этот обзор (и имейте в виду, что ток I иногда идет в том же направлении, что и электроны, а иногда и нет, опять же, в зависимости от условных обозначений).
Отрицательный и положительный электрод
Обозначения (+) и (-) сбивают с толку даже только для электрохимических ячеек. Хотя обозначения анода и катода одинаковы для гальванических и электролитических элементов (т. Е. При использовании и зарядке аккумулятора), обозначения (+) и (-) переключаются, поэтому они не связаны с направлением потока электронов через внешний провод.
Направление электронного потока
Для фотоэлементов, возможно, поможет следующая картина: до того, как свет попадает на элемент, анод и катод не являются ни отрицательными, ни положительными.Как только свет попадает на ячейку, анод становится отрицательным, потому что электроны движутся к нему от перехода, а катод становится положительным, потому что электроны прыгают из него в дырки, выходящие из перехода. Если вы затем подключите внешний потребитель электрической работы, вы можете предсказать направление потока электронов через внешнюю цепь.
физическая химия — положительный или отрицательный анод / катод в электролитической / гальванической ячейке
Анод — это электрод, в котором протекает реакция окисления
\ begin {align} \ ce {Красный -> Ox + e-} \ end {align}
имеет место, в то время как катод является электродом, где протекает реакция восстановления
\ begin {align} \ ce {Ox + e- -> Красный} \ end {align}
занимает место.Вот как определяются катод и анод.
Гальванический элемент
Итак, в гальваническом элементе реакция протекает без помощи внешнего потенциала. Поскольку на аноде происходит реакция окисления, в результате которой образуются электроны, в ходе реакции накапливается отрицательный заряд, пока не будет достигнуто электрохимическое равновесие. Таким образом, анод отрицательный.
На катоде, с другой стороны, у вас есть реакция восстановления, которая потребляет электроны (оставляя положительные (металлические) ионы на электроде) и, таким образом, приводит к накоплению положительного заряда в ходе реакции до электрохимического равновесия. достигается.Таким образом, катод положительный.
Электролитическая ячейка
В электролитической ячейке вы прикладываете внешний потенциал, чтобы заставить реакцию идти в противоположном направлении. Теперь рассуждение обратное. На отрицательном электроде, где вы создали высокий электронный потенциал через внешний источник напряжения, электроны «выталкиваются» из электрода, тем самым уменьшая окисленные частицы $ \ ce {Ox} $, потому что уровень энергии электронов внутри электрода (Ферми Level) выше, чем уровень энергии НСМО $ \ ce {Ox} $, и электроны могут снизить свою энергию, занимая эту орбиталь — у вас, так сказать, очень реактивные электроны.Таким образом, отрицательный электрод будет тем, где будет происходить реакция восстановления, и, следовательно, это будет катод.
На положительном электроде, где вы создали низкий потенциал электронов через внешний источник напряжения, электроны «засасываются» в электрод, оставляя после себя восстановленные частицы $ \ ce {Red} $, потому что уровень энергии электронов внутри электрода (уровень Ферми ) ниже уровня энергии ВЗМО $ \ ce {Red} $. Таким образом, положительный электрод будет тем, где будет происходить реакция окисления, и, следовательно, это будет анод.
Сказка об электронах и водопадах
Поскольку существует некоторая путаница в отношении принципов, на которых работает электролиз, я попробую использовать метафору, чтобы объяснить это. Электроны текут из области с высоким потенциалом в область с низким потенциалом, подобно тому, как вода падает с водопада или стекает по наклонной плоскости. Причина та же: таким образом вода и электроны могут понижать свою энергию. Теперь внешний источник напряжения действует как две большие реки, соединенные с водопадами: одна на большой высоте, которая ведет к водопаду — это будет минусовой полюс — и одна на низкой высоте, которая ведет от водопада — это будет плюс. столб.Электроды будут похожи на точки реки незадолго до или после водопадов на этой картинке: катод похож на край водопада, на который падает вода, а анод похож на точку, в которую падает вода.
Хорошо, что происходит при реакции электролиза? На катоде у вас высотная ситуация. Так электроны устремляются к «краю своего водопада». Они хотят «упасть», потому что за ними река подталкивается к краю, оказывая какое-то «давление».Но куда они могут упасть? Другой электрод отделен от них раствором и обычно диафрагмой. Но есть молекулы $ \ ce {Ox} $, которые имеют пустые состояния, расположенные энергетически ниже состояния электрода. Эти пустые состояния похожи на маленькие пруды, лежащие на более низкой высоте, куда может упасть немного воды из реки. Таким образом, каждый раз, когда такая молекула $ \ ce {Ox} $ приближается к электроду, электрон использует возможность прыгнуть на нее и уменьшить ее до $ \ ce {Red} $. Но это не означает, что в электроде внезапно отсутствует электрон, потому что река немедленно заменяет «вытолкнутый» электрон.И источник напряжения (источник реки) не может исчерпать электроны, потому что он получает электроны из розетки.
Теперь анод: у анода у вас ситуация на малой высоте. Так что здесь река ниже всего. Теперь вы можете представить себе ВЗМО-состояния молекул $ \ ce {Red} $ в виде небольших барьерных озер, лежащих на большей высоте, чем наша река. Когда молекула $ \ ce {Red} $ приближается к электроду, это как будто кто-то открывает шлюзы плотины барьерного озера.Электроны перетекают из ВЗМО в электрод, образуя молекулу $ \ ce {Ox} $. Но электроны не остаются в электроде, так сказать, их уносит река. А поскольку река такая огромная (много воды) и обычно впадает в океан, то небольшое количество «воды», добавляемое к ней, не сильно меняет реку. Он остается неизменным, так что каждый раз, когда открывается наводнение, вода из барьерного озера будет падать на одно и то же расстояние.
электрохимия — катод + анод + аккумулятор
Меня смущает следующее с этой веб-страницы:
Катод — это оксид металла, а анод — из пористого углерода.Во время разряда ионы текут от анода к катоду через электролит и сепаратор; заряд меняет направление, и ионы текут от катода к аноду.
При разряде анод подвергается окислению или потере электронов, а катод — восстановлению или увеличению количества электронов. Заряд переворачивает движение.
Это говорит о том, что электрод из оксида металла всегда является катодом, а электрод из пористого углерода всегда является анодом. Насколько мне известно, это обозначение должно быть правильным при разряде, но наоборот при зарядке.Анодом всегда является электрод, выполняющий окисление, а катод — электрод, выполняющий восстановление.
Мое наивное понимание было бы таким:
- Катод — электрод с полуреакцией восстановления. Анод — это электрод с полуреакцией окисления. Это верно как для заряда / разряда.
- Анод — это тот, который производит электроны, а катод принимает электроны. Это актуально как для заряда / разряда.
- При переключении между зарядкой / разрядом окислительно-восстановительные реакции меняются, и обозначения катода / анода также меняются, чтобы сохранить катод == восстановление и анод == окисление.
- Во время разряда батарея функционирует как гальванический элемент, где окислительно-восстановительная реакция производит электрическую энергию, электроны опускаются по своему электрическому градиенту от отрицательного электрода к положительному. Анод — отрицательный электрод, катод — положительный электрод.
- Во время зарядки аккумулятор функционирует как электролитическая ячейка, где электрическая энергия вызывает неспонтанную окислительно-восстановительную реакцию, электроны поднимаются по своему электрическому градиенту от положительного электрода к отрицательному.Анод — это положительный электрод, катод — отрицательный электрод.
- В литий-ионной батарее положительный электрод представляет собой оксид металла, а отрицательный электрод — пористый углерод. Обозначения анода / катода меняются в зависимости от того, заряжается или разряжается батарея.
Помогите, пожалуйста, разобраться в этом.
Что такое анод? — Определение из Corrosionpedia
Что означает анод?
Анод — это сильно поляризованный электрод, по которому электрический ток проходит в электрическое устройство.Обычно направление тока всегда противоположно потоку электронов.
Для иллюстрации: электроны перемещаются от положительного заряда или анода в электрическую цепь. Мнемоника, которая широко используется для определения анода, — это ACID, что означает «анод: ток в устройство».
Corrosionpedia объясняет анод
Распространенное заблуждение относительно полярности анода состоит в том, что он всегда несет положительный заряд.Это связано с тем, что анионы или отрицательно заряженные частицы перемещаются в положительно заряженные электроды. Дело в том, что полярность анода зависит от типа устройства или режима его работы. В большинстве случаев анод имеет положительный заряд в любом устройстве, которое принимает энергию, и несет отрицательный заряд, когда он используется в устройстве, которое выделяет энергию.
Ниже приведены примеры анодов:
- В гальваническом элементе или разряженной батарее анод соответствует отрицательной клемме, поскольку именно там ток проходит в батарею.
- В электролитической ячейке или перезаряжаемой батарее анод положительный, поскольку он получает ток от других источников.
- В электронно-лучевых трубках анод является положительным, поскольку именно в нем электроны выходят из трубки, а положительный ток входит.
Существует несколько типов анодов:
- Анод гальванического элемента — Этот тип анода представляет собой отрицательно заряженный электрод, в котором электроны проходят через внешнюю часть цепи.
- Электролитический анод — В области электрохимии анод является местом окисления и содержит положительный заряд, контактирующий с электролитической ячейкой.
- Диодный анод — В полупроводниковых диодах часть, легированная P, соответствует аноду и дает отверстия в области соединения. Отверстия, через которые подается анод, соединяются с электронами из области, легированной азотом, что приводит к обедненной области.
- Вакуумная трубка — В вакуумных устройствах, таких как электронно-лучевые трубки, анод всегда заряжен положительно и собирает электроны, выпущенные катодом за счет электрического притяжения.
Аноды и катоды — обзор
9.3 Концентрационная поляризация
В топливных элементах реагирующие частицы являются газообразными; на аноде H 2 (или H 2 + CO), а на катоде O 2 . На аноде H 2 (или H 2 + CO) должен транспортироваться из потока топлива через пористый анод к (или вблизи) поверхности раздела анод / электролит. Затем водород (или H 2 + CO) вступает в реакцию с ионами оксида, переносимыми через электролит, на границе анод / электролит или рядом с ней, с образованием H 2 O (или H 2 O + CO 2 ), и высвобождают электроны к аноду для их последующей транспортировки к катоду через внешнюю цепь.Образовавшийся H 2 O (или H 2 O + CO 2 ) должен транспортироваться от поверхности раздела электролит / анод через пористый анод в поток топлива. Этот перенос H 2 (H 2 + CO) и H 2 O (H 2 O + CO 2 ) должен соответствовать чистому току, протекающему через элемент, с поправкой на соответствующий баланс заряда. / параметры баланса массы. В установившемся режиме должно выполняться равенство
(6) | jh3 | + | jco | = | jh3O | + | jco2 | = 2 | jO2 | = iNA2F
, где j H 2 и jco — соответственно потоки водорода и окиси углерода через пористый анод к границе раздела анод / электролит, j H 2 O и jco 2 — соответственно потоки водяной пар и диоксид углерода через пористый анод, вдали от границы раздела анод / электролит, jo 2 , представляет собой поток кислорода через пористый катод к границе раздела катод / электролит, и N — это номер Авогадро.
Для простоты следующее обсуждение ограничивается чистым водородом в качестве топлива. Таким образом, уравнение (6) сводится к
(7) | jh3 | = | jh3O | + = 2 | jO2 | = iNA2F
Перенос газообразных частиц обычно происходит за счет бинарной диффузии, где эффективный бинарный коэффициент диффузии является функцией фундаментальный бинарный коэффициент диффузии D H 2 -H 2 O и микроструктурные параметры анода [3,4]. В микроструктурах электродов с очень маленькими размерами пор также могут присутствовать возможные эффекты диффузии Кнудсена, адсорбции / десорбции и поверхностной диффузии.Физическое «сопротивление» переносу газообразных веществ через анод при заданной плотности тока отражается как «потеря электрического напряжения». Эта потеря поляризации известна как концентрационная поляризация, η a конц , и является функцией нескольких параметров, заданных как
(8) ηconca = f (Dh3-h3O, микроструктура, парциальное давление, ток Плотность)
, где D H 2 -H 2 O — бинарный H 2 -H 2 O коэффициент диффузии.Здесь предполагается, что эффектами диффузии Кнудсена, адсорбции / десорбции и поверхностной диффузии можно пренебречь. Η a conc увеличивается с увеличением плотности тока, но не линейно. Упрощенная эквивалентная схема может использоваться для описания процесса с использованием так называемого элемента Варбурга, который состоит из ряда резисторов и конденсаторов [5]. Наличие конденсаторов гарантирует, что время отклика или постоянная времени не равны нулю.Поскольку соответствующие временные зависимости не описываются простой кинетикой первого порядка, нецелесообразно описывать время отклика как постоянную времени. Тем не менее, характерное время может быть определено, которое зависит от толщины электрода, микроструктуры электрода и характерного коэффициента диффузии.
Что касается физически измеряемых параметров, были получены аналитические выражения для анодной концентрационной поляризации, которые позволяют явно определять ее как функцию ряда параметров.Одним из важных параметров является плотность тока, ограничивающая анод, то есть плотность тока, при которой парциальное давление топлива, например H 2 на границе анод / электролит близок к нулю, так что элемент испытывает нехватку топлива. Если это условие реализуется во время работы, напряжение резко падает почти до нуля. Эта ограничивающая анод плотность тока, i as , имеет следующий вид [6]
(9) ias = 2Fph3aDa (eff) RTla
, где D a (eff) — эффективный коэффициент диффузии газа через анод, а l a — толщина анода.Эффективный коэффициент диффузии анода содержит бинарный коэффициент диффузии соответствующих частиц, а именно H 2 и H 2 O, D H 2 -H 2 O . объемная доля пористости V v (α) и коэффициент извилистости τ a [3,4]. Если топливо содержит углеводороды, необходимо учитывать многокомпонентный характер газовой диффузии. Фактор извилистости является мерой извилистой природы анода, через которую должна происходить диффузия.В очень мелких микроструктурах извилистость как феноменологический параметр может включать эффекты диффузии Кнудсена, поверхностной диффузии и возможные эффекты адсорбции / десорбции. Поляризация анодной концентрации имеет тогда форму [6]
(10) ηconca = −RT2Fln (1 − iias) + RT2Fln (1 + ph3aiph3Oaias)
Обратите внимание, что когда плотность тока приближается к плотности тока, ограничивающей анод, то есть когда я → я как , первый член стремится к бесконечности. Максимальное значение η a конц ограничено OCV.Таким образом, максимально достижимая плотность тока всегда будет меньше i как . Зависимость анодной концентрационной поляризации, определяемая уравнением (10), от различных параметров может быть качественно описана следующим образом: с точки зрения физических размеров и микроструктурных параметров, чем меньше пористость объемной доли, тем выше коэффициент извилистости и тем больше Чем больше толщина анода, тем больше η a конц .С точки зрения состава топливного газа, чем ниже парциальное давление водорода, p a H 2 , тем выше η a conc . Температурная зависимость сложная. Видно, что i as αT 1/2 , поскольку D a (eff) α T 3/2 , что означает η a конц увеличивается при понижении температуры.В то же время, как видно из уравнения (10), η a конц линейно зависит от температуры, что означает, что η a конц уменьшается с понижением температуры. В общем, η a conc не очень сильно зависит от температуры.
Как указывалось ранее, процесс переноса газа через пористые электроды не описывается кинетикой первого порядка; тем не менее, характеристическая постоянная времени может быть приблизительно равна:
(11) tcharacteristic∼Ia2Da (eff)
Для типичного элемента с опорой на анод l a равно 0.От 5 до 1 мм, а D a (eff) составляет от ∼0,1 до ∼0,5 см 2 / сек. Таким образом, соответствующее характеристическое время составляет от нескольких миллисекунд до нескольких десятых секунды. Расчетные коэффициенты извилистости, основанные на измерениях производительности ячейки, находятся в диапазоне от ∼5 или 6 до 15-20. Расчетный коэффициент извилистости, основанный на геометрическом пути, по которому проходит молекула, обычно составляет менее 5 или 6. Высокие значения факторов извилистости таким образом, оцененные на основе данных о характеристиках ячеек, нельзя описать исключительно на основе геометрических соображений; другие эффекты, такие как диффузия Кнудсена, адсорбция и поверхностная диффузия, вероятно, также играют роль.Однако следует подчеркнуть, что очень высокие коэффициенты извилистости действительно были измерены во многих других случаях, связанных с переносом газов через пористые тела с низкой пористостью и малым размером пор [7]. Несмотря на то, что высокий коэффициент извилистости не может быть оправдан только геометрическими аргументами, он все же является полезным параметром для описания концентрационной поляризации.
Концентрационная поляризация на катоде аналогичным образом связана с переносом O 2 и N 2 через пористый катод.Чистый поток O 2 из потока окислителя через катод к границе раздела катод / электролит линейно пропорционален чистой плотности тока. В этом случае также газовый перенос является функцией фундаментального бинарного коэффициента диффузии, D O 2 −n 2 и микроструктуры катода. Физическое «сопротивление» переносу газообразных веществ через катод отражается как потеря «электрического напряжения». Эта потеря поляризации известна как катодная концентрационная поляризация, η c конц , и задается как
(12) ηconcc = f (DO2-N2, микроструктура, парциальное давление, плотность тока)
η c canc увеличивается с увеличением плотности тока, но не линейно.Постоянная времени или время отклика должны быть функцией коэффициента диффузии и характерного диффузионного расстояния, и, таким образом, время отклика является конечным, отличным от нуля. Подобно аноду, характеристическое время для катода может быть задано как:
(13) tcharacteristic∼Ic2Dc (eff)
, где D c (eff) — эффективный коэффициент диффузии через катод. , а l c — толщина катода. Для ячейки с опорой на анод, при толщине катода ~ 200 мкм и эффективном коэффициенте диффузии катода D c ( eff ) ~ 0.05 см 2 / с, характерное время ∼8 миллисекунд; то есть в миллисекундном диапазоне. Что касается физически измеряемых параметров, были получены аналитические выражения для катодной концентрационной поляризации, которые позволяют явно определять ее как функцию ряда параметров. Как и в случае с анодом, одним из важных параметров является ограничивающая катод плотность тока, которая представляет собой плотность тока, при которой парциальное давление окислителя, например O 2 , на границе раздела катод / электролит близка к нулю, так что элемент испытывает недостаток окислителя.В зависимости от вкладов других условий такое условие может не реализоваться при работе ячейки. Однако, если это условие реализуется во время работы, то напряжение резко падает почти до нуля. Эта катодно-ограничивающая плотность тока, i cs , имеет следующий вид [6]
(14) ics = 4FpO2cDc (eff) (p − po2cp) RTIc
Эффективный коэффициент диффузии катода содержит бинарный коэффициент диффузии соответствующих частиц, D O 2 -N 2 , объемная доля пористости в катоде, V v (c) , и извилистость, τ c .В терминах плотности тока i и предельной плотности тока катода i cs катодная концентрационная поляризация может быть задана как [6]
(15) ηconcc = −RT4Fln (1 − iics)
Для При сопоставимых толщинах катода и анода и микроструктуре анодная концентрационная поляризация обычно намного ниже, чем катодная концентрационная поляризация по двум причинам: (1) бинарный коэффициент диффузии H 2 -H 2 O, D H 2 -H 2 O 2 примерно в четыре-пять раз больше, чем бинарный коэффициент диффузии O 2 -N 2 . D O 2 -N 2 , из-за более низкой молекулярной массы H 2 по сравнению с другими видами; (2) Типичное парциальное давление водорода в топливе, P a H 2 , намного больше, чем типичное парциальное давление кислорода в окислителе, p c О 2 . Таким образом, для сравнимых толщин анода и катода и микроструктуры ограничивающая анод плотность тока намного больше, чем ограничивающая катод плотность тока, т.е.e., i as >> i cs . На практике один из электродов толще другого в конструкции с опорой на электроды. В конструкции с опорой на анод толщина анода намного больше, чем толщина катода, т. Е. l a >> l c , и в таком случае часто i cs > i as .Однако даже в конструкции с опорой на анод часто концентрационная поляризация катода может быть сопоставима с поляризацией концентрации анода. На рисунке 9.2 показана расчетная катодная концентрационная поляризация как функция плотности тока для катода толщиной 50 микрон с различным количеством углерода, добавленным для создания различной пористости [8]. Соответствующие эффективные коэффициенты диффузии через пористые катоды, необходимые для оценки концентрационной поляризации, были измерены экспериментально.
Рисунок 9.2. Расчетная катодная концентрационная поляризация в зависимости от плотности тока для катода толщиной SO микрон с различной степенью пористости [8]. Открытая пористость находилась в диапазоне от ∼15% до ∼43%.
Аналогичные поляризационные кривые концентрации анода могут быть построены с использованием уравнения (10) для различных эффективных коэффициентов диффузии анода. На практике топливо почти всегда представляет собой преобразованный (хотя бы частично) углеводород. В таком случае необходимо учитывать внутренние реакции реформирования и сдвига, а также многокомпонентный перенос.
Присутствие газообразного водорода в топливе облегчает транспортировку газа, тем самым снижая поляризацию анодной концентрации, даже когда присутствуют CO и CO 2 . С чистым водородом в качестве топлива при толщине анода порядка ~ 1 мм, со свежим топливом i as может достигать 5 А / см 2 при 800 ° C или даже больше. Это позволяет изготавливать относительно толстые ячейки с опорой на анод без чрезмерного увеличения концентрационной поляризации.Это одно из основных преимуществ конструкции с опорой на анод по сравнению с другими конструкциями. Однако следует проявлять большую осторожность при работе с конструкциями с катодной опорой, чтобы убедиться, что катодная концентрационная поляризация не ограничивает производительность элемента.
13.4 Процессы в электрохимических ячейках | Электрохимические реакции
Дайте катодную половинную реакцию.
Катод написан справа, значит, катод — марганец.{2 +} (\ text {aq}) + \ text {Mn} (\ text {s}) \)
Какие металлы можно использовать для электродов в этой электрохимической ячейке?
Металлический магний и металлический марганец
Предложите два электролита для этой электрохимической ячейки.
Сульфат магния и сульфат марганца или нитрат магния и нитрат марганца
В каком направлении будет течь ток?
Твердое тело \ (\ text {Mg} \) окисляется с образованием ионов \ (\ text {Mg} ^ {2 +} \) на аноде.
 Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).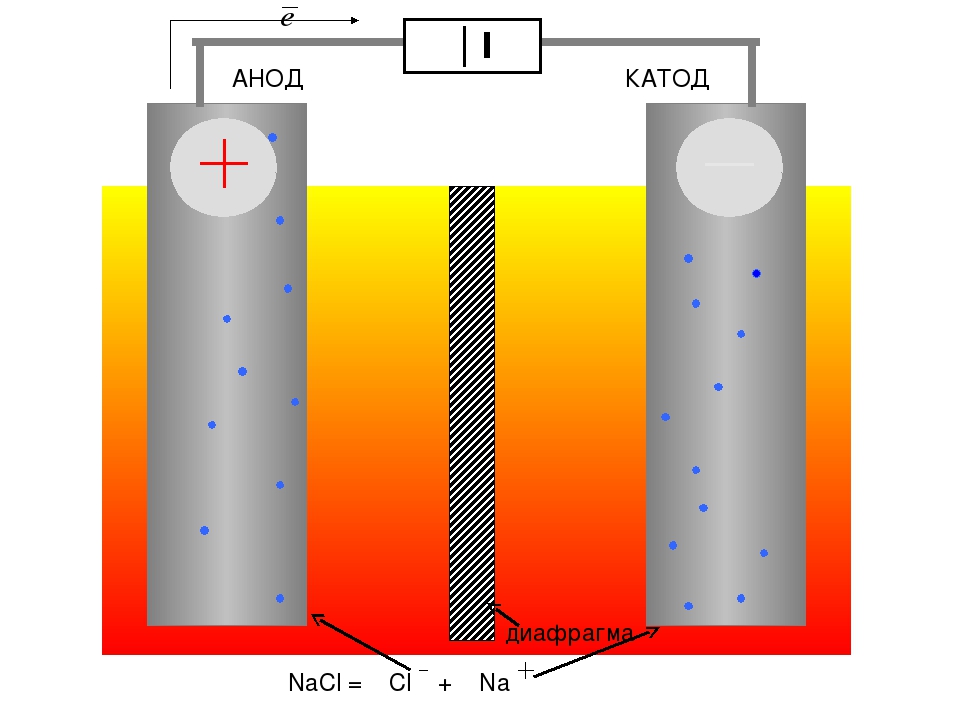

 А. Ефрона. — 1890-1907
А. Ефрона. — 1890-1907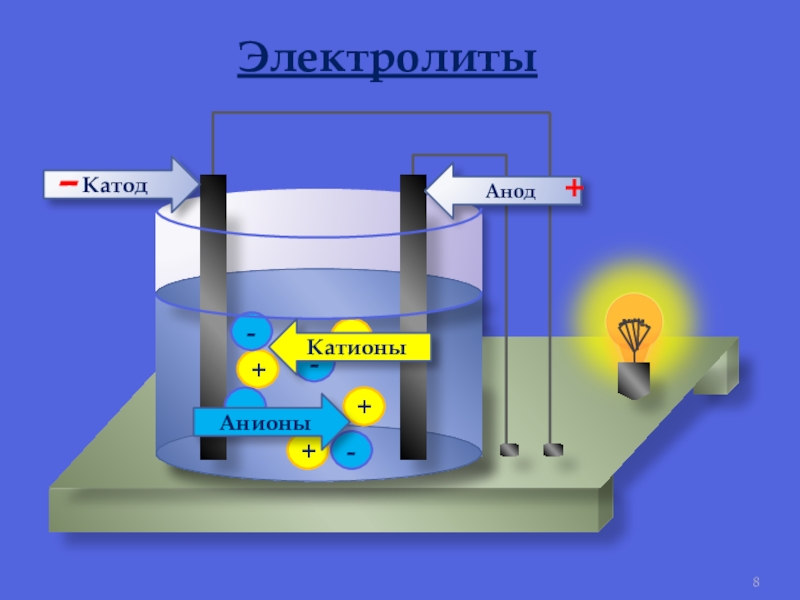 А. Брокгауза и И.А. Ефрона. — 1890-1907
А. Брокгауза и И.А. Ефрона. — 1890-1907 .
.