Линолевая кислота димерная — Справочник химика 21
Используемую для испытаний двухосновную кислоту Сзе получали димеризацией линолевой кислоты ia образовавшаяся смесь состояла из 95% димера, 4% тримера и 1% мономера. Предлагается такая структура димерной кислоты [70] [c.114]Одним из наиболее удобных лабораторных способов получения чистых алюминиевых мыл является взаимодействие жирной кислоты с алкоголятом алюминия. Такой метод в несколько измененном виде был предложен для получения этих мыл в заводском масштабе [101. В литературе описаны также алюминиевые мыла различных (ставших доступными совсем недавно) жирных кислот, например димерной кислоты (димеризованная линолевая кислота) [Ц] смешанные алюминиевые мыла ароматических и алифатических кислот можно применять в смазках [12]. [c.27]
Для синтеза сложных полиэфиров чаще всего применяют адипиновую кислоту, фталевый ангидрид, димери-зованную линолевую кислоту ( димерная кислота), гликоли (этилен-, пропилен-, бутилен-1,3-, бутилен-1,4- и диэтиленгликоли) и триолы (глицерин, гексантриол-1,2,6, триметилолпропан и триметилолэтан).
Наиболее употребительна для этой цели димерная линолевая кислота или ее метиловый эфир. По аналогии с димеризацией пентадиена-1,411 и метилсорбата образование димерной линоле-вой кислоты объясняют частичной перегруппировкой нормального 9,12-метиллинолеата в содержащий сопряженные двойные связи 9,11-метиллинолеат, причем эквимолекулярные количества
Для модификации алкидов за рубежом нашли применение димерные жирные кислоты высыхающих и полувысыхающих масел (льняного, дегидратированного касторового, соевого и др.). Например, димер 9,11-линолевой кислоты имеет строение [c.212]
Димеризация линолевой кислоты—процесс, уже применяющийся в промышленности имеются сведения,что выход так называемой димерной кислоты достигает 90% [27]. Получение, свойства и применение димерной кислоты детально описаны Уиткофом [281. Кроме основного ее применения в технологии пластмасс и покрытий, димерная кислота используется в качестве промежуточного продукта для получения различных поверхностноактивных веществ.
Кроме основного ее применения в технологии пластмасс и покрытий, димерная кислота используется в качестве промежуточного продукта для получения различных поверхностноактивных веществ.
Из жиров готовят также пальмитиновую и стеариновую кислоты. Воск лавровой ягоды, например, состоит главным образом из миристина и пальмитина. Проблема разделения кислот оказывается весьма трудной, поскольку разгонка и перекристаллизация малоэффективны ввиду того, что кислоты находятся в димерной форме (см. стр. 15) и, кроме того, всегда присутствует смешанный димер. Поэтому жирные кислоты, содержащиеся в жирах, превращают в метиловые эфиры, которые затем подвергают фракционированию (СОП, 3, 311). Аналогично из масла кокосовых орехов получают этиловые эфиры лауриловой, каприловой и миристиновой кислот (СОП, 3, 312). Гидролизом их этиловых эфиров получают также линолевую (СОП, 3, 277) и линоленовую (СОП, 3, 283) кислоты.
Димерные кислоты (Сзе) и их эфиры являются ценными продукт тами в производстве клеев-расплавов, отвердителей эпоксидных смол> лакокрасочных покрытий, микроэлектронной и кожевенной промышленности. Основной метод нх получения базируется на димеризацчи линолевой и линоленовой кислот, входящих в состав льняного и талло-вого масла [1—4]. В то же время структура димерных кислот, полученных таким образом, до сих пор однозначно не установлена, что в значительной мере сдерживает разработку синтетических методов н.х получения. Целью настоящей работы явилось изучение продуктов каталитической димеризации метиловых эфиров жирных кнслот таллово-] 0 масла (Л КТМ) и установление их структуры.
Основной метод нх получения базируется на димеризацчи линолевой и линоленовой кислот, входящих в состав льняного и талло-вого масла [1—4]. В то же время структура димерных кислот, полученных таким образом, до сих пор однозначно не установлена, что в значительной мере сдерживает разработку синтетических методов н.х получения. Целью настоящей работы явилось изучение продуктов каталитической димеризации метиловых эфиров жирных кнслот таллово-] 0 масла (Л КТМ) и установление их структуры.
Димерная кислота — Справочник химика 21
Интересно отметить тот факт, что при декарбоксилировании жирных кислот по кетонному механизму, сопровождающемуся расщеплением димерных кислот, из димеров кислот с четным числом атомов углерода получаются парафиновые УВ с удвоенным, но нечетным числом атомов углерода в результате потери одного карбоксила. Установлено, что в молодых осадочных образованиях преобладают парафиновые УВ с нечетным числом атомов, в то время как для нефтей отношение парафинов с четным и нечетным числом атомов обычно близко к единице.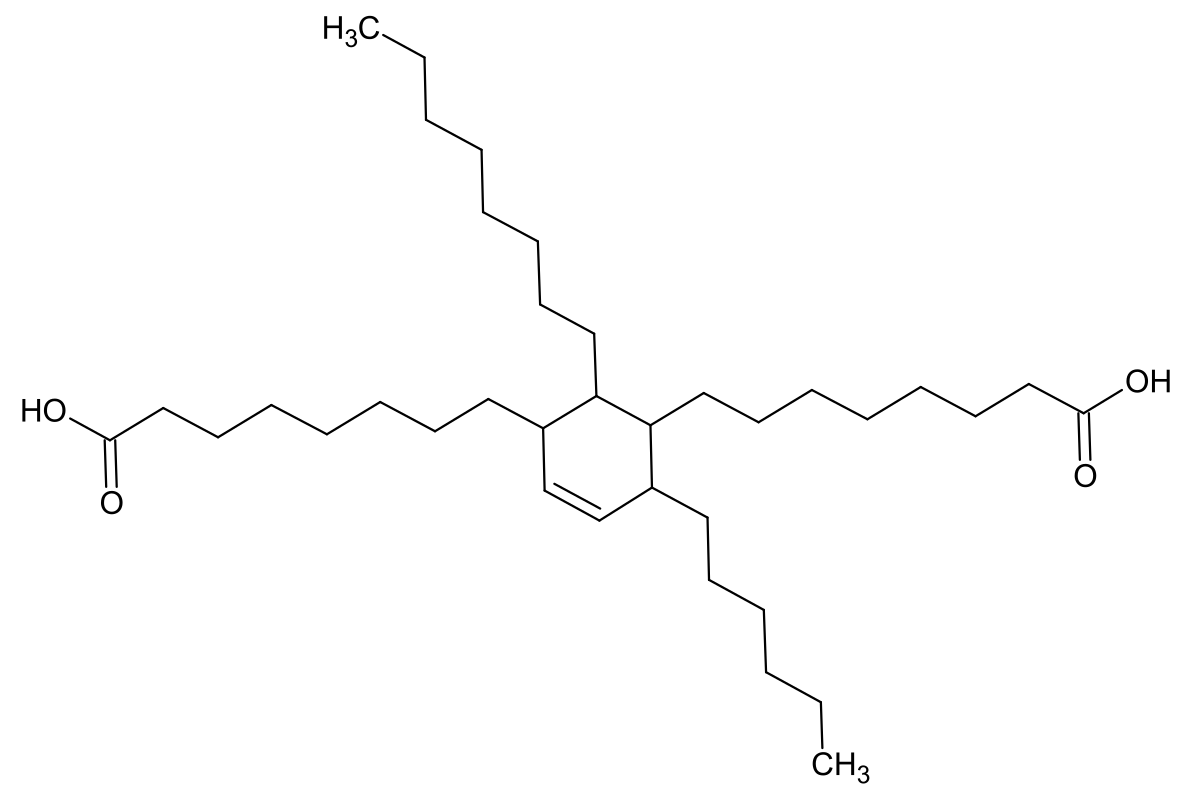
Димерные кислоты образуются аналогичным путем из соответствующих 3-метил- и 5-хлорпроизводных. [c.265]
Гидроксильные группы эпоксидной смолы могут реагировать с жирными кислотами с образованием эфиров, растворимых в углеводородах и маслах. При использовании ненасыщенных жирных кислот, полученных, например, из дегидратированного касторового и льняного масел, или из смоляного и таллового масла, или из димерных кислот, образуются высыхающие смолы, при дальнейшей сополимеризации которых получаются сшитые блок-сополимеры.
Мономерные и димерные кислоты в алкидах определяли после гидролиза путем их превращения в метиловые эфиры, в работе [13] — с помощью метанольного раствора трехфтористого бора. Применение короткой [c.199]
ПОЛУЧЕНИЕ ДИМЕТИЛОВЫХ ЭФИРОВ ДИМЕРНЫХ КИСЛОТ [c.21]
Структура полученного диметилового эфира димерной кислоты изучалась методами ЯМР-, ИК- и УФ-спектроскопии.
Жилина Р. Д., Бондарева Е. А. Получение диметиловых эфиров димерных кислот льняного масла. ……………. 21 [c.69]
Производные димерных кислот остаются жидкими при очень низких температурах и могут быть использованы в качестве поверхностно-активных веществ, ингибиторов коррозии, смазочных материалов и исходных веществ для получения алкидных смол с улучшенными свойствами. При действии на сложные эфнры веществ, являющихся источниками свободных радикалов, например ди-грег-бутилпероксида, образуются ациклические димеры, в которых сохранены все исходные двойные связи. Из стеарата и других насыщенных эфиров образуется 2,2 -димер (68), тогда как из метнлолеата получаются смешанные димеры типа (69), содержащие новые двойные связи на участках С-8 — С-11 обеих молекул эти двойные связи имеют в основном гранс-конфигурацию. Линолеат и линоленат образуют сходные ациклические димеры с четырьмя и шестью двойными связями, соответственно.
В случае дезактивации катализатора процесс окисления протекает при более высокой концентрации алкилгидроперекисей, альдегидов, ке-тонов, оксикислот, лактонов, кетокислот и др. В этих условиях создаются благоприятные возможности для протекания параллельно с окислением процессов конденсации альдегидов, кетонов, лактонов, гидро-ксикислот и др., в результате которых образуются продукты с большим молекулярным весом — изокислоты, димерные кислоты, непредельные кислоты (образующиеся при термообработке натриевых солей, оксикислот), дикарбоновые кислоты и др., часть из которых перегоняется и остается во фракциях кислот, другая остается в кубовой остатке, увели-чцвая его выход.
Другим примером является окисление дикарбоновых кислот, механизм которого практически не изучен. Известно лишь, что дикарбо-новые кислоты не дают при электроокислении нормальных продуктов Кольбе димерных кислот или циклоалканов.
Глпцидиловые эфиры поликарбоновых кислот были получены недавно при взаимодействии этих кислот с эпихлоргидрином [32а, 326]. Наиболее широко используемые полиглицидиловые сложные эфиры являются эфирами димерных кислот, как это было обнаружено при термической полимеризации диеновых жирных кислот. Эти смолы часто используются в комбинации с другими эпоксидными смолами в качестве эластомеров, содержащих концевые реакционноспособные группы.
Другой тип катализатора на основе полиамина, имеющий промышленное значение, получается при взаимодействии полиаминов с димерными кислотами. Димерные кислоты в свою очередь получают при термическом разложении диеновых жирных кислот (особенно 9,12-линоле-новой кислоты).
Метиловые эфиры жирных кислот льняного масла (ЖКЛМ) являются исходным продуктом для получения диметиловых эфиров димерных кислот — ценного мономера в производстве олигоамидов и ряда других синтезов [1, 2]. Эти эфиры получают ме-танолизом триглицеридов, составляющих основу льняного масла в присутствии различных катализаторов по следующей схеме [c.16]
С целью проверки длительности работы катализатора, а также наработки опытных образцов эфиров димерной кислоты, процесс диме-ризацин метиловых эфиров жирных, кислот, 1ькяного масла был освоен на лабо1раториой проточной установке (рис. 4) производительностью-50 мл катализата в час, шмполнен-иой в металле, не теряет своей активности в течение- [c. 24]
24]
Найдены условия получения диметиловых эфиров димерных кислот льняного масла. Изучены основные кинетические закономерности процесса. Полученные данные лодтверждены на непрерывной )становке производительнсотью 20 мл/ч, [c.71]
Примечание. При карбоксилировании гриньяровских реактивов двуокисью уг.перода обычно образуется и димерная кислота , которая легко выделяется упаривание1Ч этого маточного раствора. [c.130]
Соловьев В. В. Технический синтез эфиров димерных кислот Дис.. .. канд. техн. наук / Яросл. политехи, ин-и. — Ярославль, 1983. — 180 с. [c.47]
Для синтеза сложных полиэфиров чаще всего применяют адипиновую кислоту, фталевый ангидрид, димери-зованную линолевую кислоту ( димерная кислота), гликоли (этилен-, пропилен-, бутилен-1,3-, бутилен-1,4- и диэтиленгликоли) и триолы (глицерин, гексантриол-1,2,6, триметилолпропан и триметилолэтан). Пентаэритрит можно применять для получения сшитых полиуретанов. Для синтеза полиэфиров используют и лактоны, например капролактон [c.54]
Пентаэритрит можно применять для получения сшитых полиуретанов. Для синтеза полиэфиров используют и лактоны, например капролактон [c.54]
Сложные полиэфиры обычно почти не окисляются. Однако в некоторых случаях окисление может произойти, особенно если в состав полимера входят ненасыщенные соединения ( димерная кислота, диэтиленгликоль или вещества с алкильными группами, соединенными с ароматическим кольцом, как, например, а,ос -диоксиксилол). При введении в полиэфиры антиоксидантов их стабильность увеличивается. [c.58]
Димерные кислоты (Сзе) и их эфиры являются ценными продукт тами в производстве клеев-расплавов, отвердителей эпоксидных смол> лакокрасочных покрытий, микроэлектронной и кожевенной промышленности. Основной метод нх получения базируется на димеризацчи линолевой и линоленовой кислот, входящих в состав льняного и талло-вого масла [1—4]. В то же время структура димерных кислот, полученных таким образом, до сих пор однозначно не установлена, что в значительной мере сдерживает разработку синтетических методов н. х получения. Целью настоящей работы явилось изучение продуктов каталитической димеризации метиловых эфиров жирных кнслот таллово-] 0 масла (Л КТМ) и установление их структуры. [c.16]
х получения. Целью настоящей работы явилось изучение продуктов каталитической димеризации метиловых эфиров жирных кнслот таллово-] 0 масла (Л КТМ) и установление их структуры. [c.16]
Ркпользование вышеприведенных методов и газо-жидкостной хро . матографии позволили заключить, что продукт димеризации более чем на 95% состоит из диметилового эфира димерной кислоты. [c.17]
Методами гель-проникающей, газо-жидкостной и тонкослойной хроматографии, ЯМР-, ИК- и УФ-спектроскопии были идентифицированы продукты каталитической днмеризации метиловых эфиров жирных кислот таллового масла. Установлена структура диметилового эфира димерной кислоты. [c.77]
Лампа светодиодная Videx Filament ST64FD 6 Вт E27 4100K димерная (VL-ST64FD-06274)
Описание Лампа светодиодная Videx Filament ST64FD 6 Вт E27 4100K димерная (VL-ST64FD-06274)
Светодиодная лампа VIDEX Filament — высокотехнологичный источник света. Обеспечивает ровный световой поток и максимальную мощность с первой секунды работы. Предназначена для всех типов бытовых светильников, подходит для общего освещения помещений, торговых залов и витрин, промышленных предприятий. Идеальна для декоративного, местного и направленного освещения. Светодиодная лампа VIDEX Filament — оптимальная замена ламп накаливания и люминесцентных ламп. Позволяет экономить до 90% энергии, имеет длительный срок эксплуатации и высокую стойкость к нагрузкам во время включения и выключения. Не содержит вредных веществ. Срок годности к использованию неограничен. Не подлежит утилизации в виде бытовых отходов.
Особенности:
— Совместимая с выключателями с подсветкой
— Хороший показатель энергоэффективности
— Высокий индекс цветопередачи
— Длительный срок службы
— Эффективный теплоотвод через корпус лампы
— Защита от перепадов напряжения
— Ровный световой поток
Обеспечивает ровный световой поток и максимальную мощность с первой секунды работы. Предназначена для всех типов бытовых светильников, подходит для общего освещения помещений, торговых залов и витрин, промышленных предприятий. Идеальна для декоративного, местного и направленного освещения. Светодиодная лампа VIDEX Filament — оптимальная замена ламп накаливания и люминесцентных ламп. Позволяет экономить до 90% энергии, имеет длительный срок эксплуатации и высокую стойкость к нагрузкам во время включения и выключения. Не содержит вредных веществ. Срок годности к использованию неограничен. Не подлежит утилизации в виде бытовых отходов.
Особенности:
— Совместимая с выключателями с подсветкой
— Хороший показатель энергоэффективности
— Высокий индекс цветопередачи
— Длительный срок службы
— Эффективный теплоотвод через корпус лампы
— Защита от перепадов напряжения
— Ровный световой поток
Характеристики Лампа светодиодная Videx Filament ST64FD 6 Вт E27 4100K димерная (VL-ST64FD-06274)
- Аналог лампы накаливания 60 Вт
- Цвет производителя прозрачный
- Форма цилиндрическая
- Тип товара лампа светодиодная
- Гарантия 36 мес.

- Световой поток 700 Лм
- Мощность 6 Вт
- Цветовая температура 4100 К
- Размеры 64х142 мм
- Напряжение 220 В
- Цветовая температура, К 4100
- Класс энергопотребления A++
- Длина лампы 140 мм
- Бренд Videx
- Номинальное напряжение 198-242 В
- Цвет свечения белый, дневной
- Диммирование (функция регулировки яркости) c диммированием
- Страна-производитель Китай, Украина
- Световая отдача 117 Лм/Вт
- Тип колбы ST64
- Тип лампы филаментная (LED)
- Индекс цветопередачи 90 Ra
- Рассеиватель прозрачная
- Срок службы 40000 ч
- Тип цоколя E27
- Угол освещения 360 град
LED лампа VIDEX Filament C37FD 4W E14 4100K 220V 440Lm,димерная
Аналог лампы накаливания:40
Гарантийный срок:24
Диапазон рабочих напряжений:от 170 В до 250 В
Диммируемость:нет
Производитель:Videx
Страна брэнда:Украина
Температура света:4100 К
Тип источника света:светодиод
Тип лампы:светодиодная LED
Форма колбы:свеча
Цвет свечения:нейтральный дневной свет
Цветовая температура:4100
Цветопередача:90 Ra
Тип изделия:лампа
Диапазон рабочих температур:от -30 С до +50 С
Материал корпуса:алюмопласт
Тип товара:лампа cветодиодная LED
Номинальное напряжение:220
LED-люстра потолочная светодиодная димерная цвет белый 65W Diasha&MX2503/1+1+1WH LED 3color dimmer
Качественные заводские люстры по лучшей цене !!! На фото люстра коричневого цвета. Цвет данной модели: Цвет основания: Белый Цвет веток: Белый Так же данные модели есть в других цветах: уточняйте у менеджера Диаметр крепления: 25 см Ширина: 50 см Высота: 12 см Источник света: Светодиодная лента (LED) Пульт: диммер Регулировка яркости: есть Режим ночника: есть Подсветка: три цвета красный, сиреневый, синий Тип крепления: планка Напряжение ламп: 220V Мощность: 65 Ват В переводе на обычные лампы накаливания: 520 Вата Площадь освещения: 5-18 Кв.м Срок службы: 50000 Часов Количество источников света: 3 + подсветка Тип выключателя: Настенный Только в нашем магазине самые лучшие светодиодные (LED) люстры !!! Только в нашем магазине гарантия на светодиодные люстры 3 года !!! ПРЕИМУЩЕСТВА Экономия электроэнергии Девять режимов работы Можно управлять люстрой с телефона через приложение (уточняйте у менеджера) Ссылка для скачивания приложения : Скачать Либо можете отсканировать код : Матовый рассеиватель который равномерно освещает все помещение Современный дизайн Собрана и подключена на заводе Длительный режим работы Пульт димер (регулировка яркости) !!! Подходит для любых типов потолков ( натяжных , бетонных, гипсокартонных , деревянных ) Внутри каждого светящегося элемента идет лед лента 12 В , которая подлежит замене .
Цвет данной модели: Цвет основания: Белый Цвет веток: Белый Так же данные модели есть в других цветах: уточняйте у менеджера Диаметр крепления: 25 см Ширина: 50 см Высота: 12 см Источник света: Светодиодная лента (LED) Пульт: диммер Регулировка яркости: есть Режим ночника: есть Подсветка: три цвета красный, сиреневый, синий Тип крепления: планка Напряжение ламп: 220V Мощность: 65 Ват В переводе на обычные лампы накаливания: 520 Вата Площадь освещения: 5-18 Кв.м Срок службы: 50000 Часов Количество источников света: 3 + подсветка Тип выключателя: Настенный Только в нашем магазине самые лучшие светодиодные (LED) люстры !!! Только в нашем магазине гарантия на светодиодные люстры 3 года !!! ПРЕИМУЩЕСТВА Экономия электроэнергии Девять режимов работы Можно управлять люстрой с телефона через приложение (уточняйте у менеджера) Ссылка для скачивания приложения : Скачать Либо можете отсканировать код : Матовый рассеиватель который равномерно освещает все помещение Современный дизайн Собрана и подключена на заводе Длительный режим работы Пульт димер (регулировка яркости) !!! Подходит для любых типов потолков ( натяжных , бетонных, гипсокартонных , деревянных ) Внутри каждого светящегося элемента идет лед лента 12 В , которая подлежит замене . ПРЕИМУЩЕСТВА ДЛЯ ПОКУПКИ Наложенный платеж !!! Бесплатная доставка при покупке от двух люстр данной категории !!! Бесплатная доставка при оформлении заказа по телефону и оплате на карту !!! Гарантия 3 года !!! Все люстры проверяются на целостность и работоспособность перед отправкой !!! При заказе до 14.00 отправка в день заказа , кроме пятницы и воскресенья Если вы любитель минимализма, то эта люстра идеальный вариант. Данная модель люстры оснащена дополнительной светодиодной подсветкой из трех цветов. А ее мощности в 65W хватает, чтобы осветить до 18 квадратных метров. Люстра светодиодная Современная светодиодная (LED)люстра !!! Подойдет для любого помещения в вашей квартире, доме, офисе, гостинице !!! Станет несомненно прекрасным украшением вашего помещения !!! В комплекте со многими люстрами этой серии идет пульт управления с помощью которого можно включать и выключать люстру, изменять уровень яркости света, менять цветовую температуру, включать один из предустановленных режимов освещения теплый свет, нейтральный свет, холодный свет, включать синюю подсветку или режим «ночника»(люстра будет включена на 5% мощности LED люстры) Также во многих моделях присутствует управление с телефона: уточняйте у менеджеров С выключателя люстра переключается как и любая светодиодная люстра.
ПРЕИМУЩЕСТВА ДЛЯ ПОКУПКИ Наложенный платеж !!! Бесплатная доставка при покупке от двух люстр данной категории !!! Бесплатная доставка при оформлении заказа по телефону и оплате на карту !!! Гарантия 3 года !!! Все люстры проверяются на целостность и работоспособность перед отправкой !!! При заказе до 14.00 отправка в день заказа , кроме пятницы и воскресенья Если вы любитель минимализма, то эта люстра идеальный вариант. Данная модель люстры оснащена дополнительной светодиодной подсветкой из трех цветов. А ее мощности в 65W хватает, чтобы осветить до 18 квадратных метров. Люстра светодиодная Современная светодиодная (LED)люстра !!! Подойдет для любого помещения в вашей квартире, доме, офисе, гостинице !!! Станет несомненно прекрасным украшением вашего помещения !!! В комплекте со многими люстрами этой серии идет пульт управления с помощью которого можно включать и выключать люстру, изменять уровень яркости света, менять цветовую температуру, включать один из предустановленных режимов освещения теплый свет, нейтральный свет, холодный свет, включать синюю подсветку или режим «ночника»(люстра будет включена на 5% мощности LED люстры) Также во многих моделях присутствует управление с телефона: уточняйте у менеджеров С выключателя люстра переключается как и любая светодиодная люстра. Каждое включение выключение поочередно переводит люстру по следующим режимам: подсветка, холодный свет, теплый свет, нейтральный свет. Эта люстра превосходно впишется в любой интерьер, она выглядит очень красиво, необычно и дорого !!! Еще одно достоинство этих люстр это матовый рассеиватель который равномерно рассеивает свет по всему помещению!!! Так же преимущество этих люстр, это синяя либо трехцветная подсветка красный, сиреневый, синий цвет вокруг основания, которая прекрасно подойдет в роли ночника !!! Практически для всех люстр есть родные настенные бра: уточняйте у менеджера Если у вас остались какие либо вопросы звоните нам мы с радостью на них ответим +38 (098) 195 02 36 +38 (097) 248 78 83 +38 (048) 771 17 22 Выбирай удобный для вас способ доставки Новая почта: Бесплатная доставка от 3000 грн либо по договоренности Укр почта: Бесплатная доставка от 3000 грн либо по договоренности Джастин: Бесплатная доставка от 3000 грн либо по договоренности Самовывоз Доставка курьером по Одессе: Бесплатная при заказе от 500 грн Выбирайте удобный для вас способ оплаты Наложенный платеж Приват 24 Оплата картой Visa, Mastercard — LiqPay Оплата картой Visa, Mastercard — WayForPay Наличными Если у вас остались какие либо вопросы звоните нам мы с радостью на них ответим !!! +38 (097) 248 78 83 +38 (098) 195 02 36 +38 (048) 771 17 22 Лучшая ЦЕНА так как все товары на прямую от поставщика !!!! Оптовым покупателям дополнительные скидки !!! Отправка светодиодных люстр по всей Украине
Каждое включение выключение поочередно переводит люстру по следующим режимам: подсветка, холодный свет, теплый свет, нейтральный свет. Эта люстра превосходно впишется в любой интерьер, она выглядит очень красиво, необычно и дорого !!! Еще одно достоинство этих люстр это матовый рассеиватель который равномерно рассеивает свет по всему помещению!!! Так же преимущество этих люстр, это синяя либо трехцветная подсветка красный, сиреневый, синий цвет вокруг основания, которая прекрасно подойдет в роли ночника !!! Практически для всех люстр есть родные настенные бра: уточняйте у менеджера Если у вас остались какие либо вопросы звоните нам мы с радостью на них ответим +38 (098) 195 02 36 +38 (097) 248 78 83 +38 (048) 771 17 22 Выбирай удобный для вас способ доставки Новая почта: Бесплатная доставка от 3000 грн либо по договоренности Укр почта: Бесплатная доставка от 3000 грн либо по договоренности Джастин: Бесплатная доставка от 3000 грн либо по договоренности Самовывоз Доставка курьером по Одессе: Бесплатная при заказе от 500 грн Выбирайте удобный для вас способ оплаты Наложенный платеж Приват 24 Оплата картой Visa, Mastercard — LiqPay Оплата картой Visa, Mastercard — WayForPay Наличными Если у вас остались какие либо вопросы звоните нам мы с радостью на них ответим !!! +38 (097) 248 78 83 +38 (098) 195 02 36 +38 (048) 771 17 22 Лучшая ЦЕНА так как все товары на прямую от поставщика !!!! Оптовым покупателям дополнительные скидки !!! Отправка светодиодных люстр по всей Украине
Качественные заводские люстры по лучшей цене !!! На фото люстра коричневого цвета. Цвет данной модели: Цвет основания: Белый Цвет веток: Белый Так же данные модели есть в других цветах: уточняйте у…
Цвет данной модели: Цвет основания: Белый Цвет веток: Белый Так же данные модели есть в других цветах: уточняйте у…
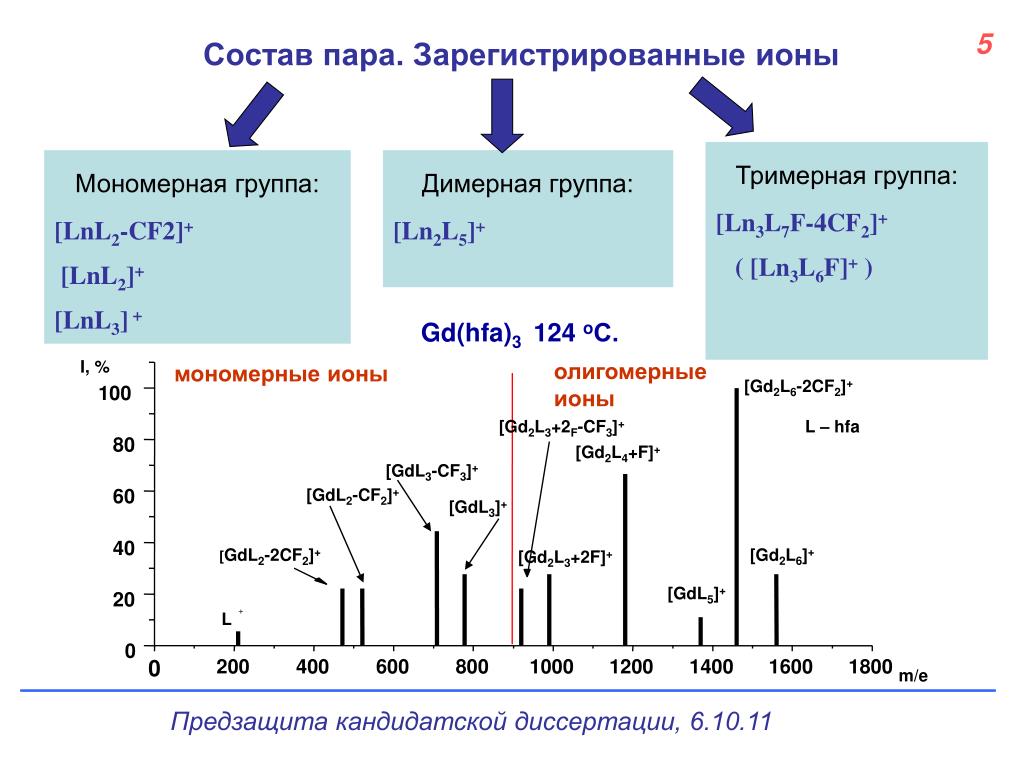
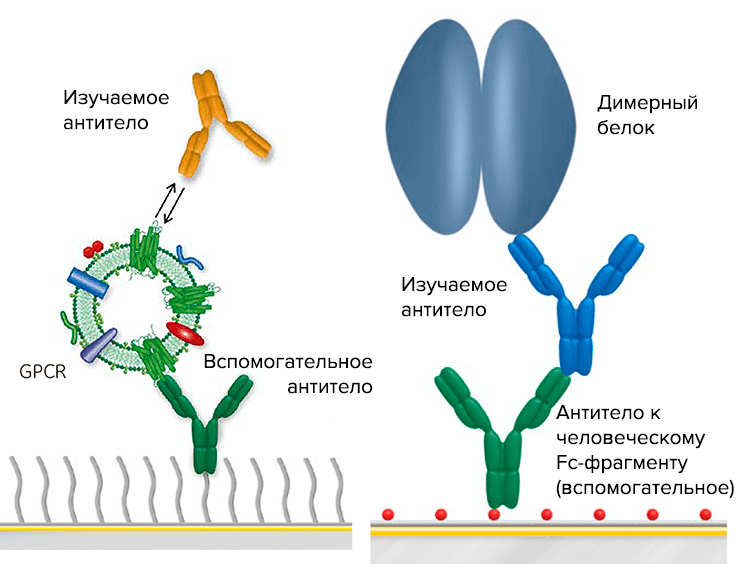
ДИМЕРНАЯ ОККЛЮДАНТНАЯ НАНОСТРУКТУРА, МЕЧЕННАЯ МОЛЕКУЛОЙ, АКТИВНОЙ В ОТНОШЕНИИ РАМАНОВСКОГО РАССЕЯНИЯ, ЛОКАЛИЗОВАННОЙ В МЕЖЧАСТИЧНОМ СОЕДИНЕНИИ, ЕЕ ИСПОЛЬЗОВАНИЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
Область техники
Настоящее изобретение относится к окклюдантной димерной наночастице, меченной молекулой, активной в отношении рамановского рассеяния, в межчастичном соединении. Более конкретно, настоящее изобретение относится к димерной наноструктуре, содержащей две наночастицы с молекулой, активной в отношении рамановского рассеяния, локализованной в соединении между ними, в котором каждая наночастица состоит из золотого или серебряного ядра с олигонуклеотидами, прикрепленными к его поверхности, и золотой или серебряной оболочки, покрывающей ядро. Также настоящее изобретение относится к применению димерной наноструктуры и способу получения димерной наноструктуры.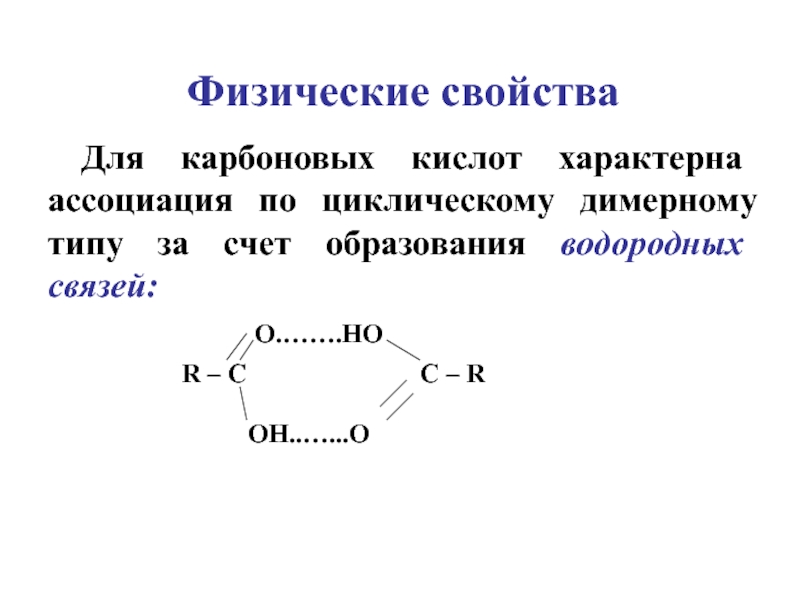
Предшествующий уровень техники
Крайне чувствительное, точное детектирование единичных молекул из биологических и других образцов экстенсивно широко применяется во многих областях, включая медицинскую диагностику, патологию, токсикологию, взятие проб из окружающей среды, химический анализ и т.д.
Не так давно, в связи с этой целью, при исследовании метаболизма, распределения и связывания малых синтетических материалов и биомолекул в биолого-химической области широко применяли специфически меченые наночастицы или химические материалы. Как правило, применяли радиоактивные изотопы, органические флуоресцентные красители и квантовые точки.
Показательные примеры радиоактивных изотопов, обычно применяемых в исследовании, включают 3H, 14C, 32P, 35S и 125I, которые соответственно применяют при замене 1Н, 12C, 31P, 32S и 127I, которые широко распространены в организме. Радиоактивные изотопы долгое время применяли вследствие того, что радиоактивные и нерадиоактивные изотопы имеют почти одинаковые химические свойства и могут быть применены взаимозаменяемо, и вследствие того, что даже небольшое количество радиоактивных изотопов можно детектировать благодаря их относительно высокой энергии эмиссии. Однако с радиоактивными изотопами труднее работать вследствие того, что радиация, которую они излучают, приносит вред организму. Кроме того, хотя их энергия эмиссии высока, некоторые радиоактивные изотопы имеют короткий период полураспада, и их нельзя хранить в течение длительного периода времени, или они не пригодны для использования в длительных экспериментах.
Радиоактивные изотопы долгое время применяли вследствие того, что радиоактивные и нерадиоактивные изотопы имеют почти одинаковые химические свойства и могут быть применены взаимозаменяемо, и вследствие того, что даже небольшое количество радиоактивных изотопов можно детектировать благодаря их относительно высокой энергии эмиссии. Однако с радиоактивными изотопами труднее работать вследствие того, что радиация, которую они излучают, приносит вред организму. Кроме того, хотя их энергия эмиссии высока, некоторые радиоактивные изотопы имеют короткий период полураспада, и их нельзя хранить в течение длительного периода времени, или они не пригодны для использования в длительных экспериментах.
В качестве альтернативы радиоактивным изотопам применяли органическое флуоресцентное вещество. Органическое флуоресцентное вещество поглощает энергию определенной длины волны и излучает свет при другой характерной длине волны. В частности, поскольку способы детектирования все больше упрощаются, радиоактивные вещества сталкиваются с пределами детектирования и, таким образом, требуют длительных периодов времени для детектирования. В противоположность этому органическая флуоресценция теоретически делает возможным детектирование даже единственной молекулы ввиду того, что она может излучать тысячи фотонов на молекулу при надлежащих условиях. Однако в отличие от радиоактивных изотопов, флуорофоры не могут заменять элементы активных лигандов напрямую. Вместо этого они узко предназначены быть связанными с составными группами, которые не оказывают эффекта на их активность, в свете взаимосвязи структуры и активности. Кроме того, флуоресцентные метки претерпевают со временем фотообесцвечивание. Другой проблемой, связанной с флуорофорами, является интерференция между различными флуорофорами вследствие того, что они повторно излучают широкий спектр длин световых волн, тогда как они возбуждаются крайне узким спектром длин волн. Более того, лишь небольшое число флуорофоров является доступным.
В противоположность этому органическая флуоресценция теоретически делает возможным детектирование даже единственной молекулы ввиду того, что она может излучать тысячи фотонов на молекулу при надлежащих условиях. Однако в отличие от радиоактивных изотопов, флуорофоры не могут заменять элементы активных лигандов напрямую. Вместо этого они узко предназначены быть связанными с составными группами, которые не оказывают эффекта на их активность, в свете взаимосвязи структуры и активности. Кроме того, флуоресцентные метки претерпевают со временем фотообесцвечивание. Другой проблемой, связанной с флуорофорами, является интерференция между различными флуорофорами вследствие того, что они повторно излучают широкий спектр длин световых волн, тогда как они возбуждаются крайне узким спектром длин волн. Более того, лишь небольшое число флуорофоров является доступным.
Квантовая точка является полупроводниковым наноматериалом, который составлен, как правило, из CdSe или CdS в качестве ядра и ZnS или ZnSe в качестве оболочки, и может излучать свет различных цветов в зависимости от размера частиц и вида материалов ядра. В сравнении с органическими флуоресцентными красителями квантовые точки могут возбуждаться более широким спектром длины волны возбуждения, излучать свет в более широком спектре длин волн и, таким образом, демонстрируют большее число различных цветов. Таким образом, квантовые точки привлекли большое внимание благодаря их преимуществу над органическими флуоресцентными красителями. Однако недостатком квантовых точек является высокая токсичность и трудности крупномасштабного производства. Кроме того, число доступных квантовых точек, несмотря на теоретическую вариабельность, на практике крайне ограничено.
В сравнении с органическими флуоресцентными красителями квантовые точки могут возбуждаться более широким спектром длины волны возбуждения, излучать свет в более широком спектре длин волн и, таким образом, демонстрируют большее число различных цветов. Таким образом, квантовые точки привлекли большое внимание благодаря их преимуществу над органическими флуоресцентными красителями. Однако недостатком квантовых точек является высокая токсичность и трудности крупномасштабного производства. Кроме того, число доступных квантовых точек, несмотря на теоретическую вариабельность, на практике крайне ограничено.
Для преодоления этих проблем для мечения в последнее время применяли рамановскую спектрометрию и/или поверхностный плазмонный резонанс.
Поверхностно усиленное рамановское рассеяние (SERS) является спектроскопическим способом, который использует явление, в результате которого, когда молекулы абсорбируются на шероховатой поверхности металлической наноструктуры, такой как золотые или серебряные наночастицы, интенсивность рамановского рассеяния резко увеличивается до уровня 106-108 раз по сравнению с нормальными рамановскими сигналами. Когда свет проходит через прозрачную среду, молекулы или атомы среды рассеивают свет. В этом случае небольшая часть фотонов проходит неупругое рассеяние, известное как рамановское рассеяние. Например, часть падающих фотонов взаимодействует с молекулами таким образом, что высвобождается энергия, или электроны возбуждаются до более высоких энергетических уровней, так что рассеянные фотоны обладают частотой, отличной от той, что бывает у падающих фотонов. Вследствие того, что частоты спектра рамановского рассеяния обуславливают химические составы и структурные свойства абсорбирующих свет молекул в образце, рамановскую спектроскопию совместно с нанотехнологией, которая непрерывно развивается в настоящее время, можно дополнительно развивать в направлении высокочувствительного детектирования единичной молекулы. Кроме того, существует серьезное ожидание, что сенсор SERS можно использовать в значительной мере в качестве медицинского датчика. Эффект SERS взаимосвязан с плазмонным резонансом. В этом контексте металлические наночастицы демонстрируют очевидный оптический резонанс в ответ на падающее электромагнитное излучение вследствие коллективного связывания электронов проводимости в металле.
Когда свет проходит через прозрачную среду, молекулы или атомы среды рассеивают свет. В этом случае небольшая часть фотонов проходит неупругое рассеяние, известное как рамановское рассеяние. Например, часть падающих фотонов взаимодействует с молекулами таким образом, что высвобождается энергия, или электроны возбуждаются до более высоких энергетических уровней, так что рассеянные фотоны обладают частотой, отличной от той, что бывает у падающих фотонов. Вследствие того, что частоты спектра рамановского рассеяния обуславливают химические составы и структурные свойства абсорбирующих свет молекул в образце, рамановскую спектроскопию совместно с нанотехнологией, которая непрерывно развивается в настоящее время, можно дополнительно развивать в направлении высокочувствительного детектирования единичной молекулы. Кроме того, существует серьезное ожидание, что сенсор SERS можно использовать в значительной мере в качестве медицинского датчика. Эффект SERS взаимосвязан с плазмонным резонансом. В этом контексте металлические наночастицы демонстрируют очевидный оптический резонанс в ответ на падающее электромагнитное излучение вследствие коллективного связывания электронов проводимости в металле. Таким образом, наночастицы золота, серебра, меди и других конкретных металлов могут быть основой наноразмерной антенны для расширения локализации электромагнитных лучей. Молекулы, локализованные вблизи этих частиц, обнаруживают гораздо большую чувствительность к рамановской спектроскопии.
Таким образом, наночастицы золота, серебра, меди и других конкретных металлов могут быть основой наноразмерной антенны для расширения локализации электромагнитных лучей. Молекулы, локализованные вблизи этих частиц, обнаруживают гораздо большую чувствительность к рамановской спектроскопии.
Таким образом, в дополнение к крайне чувствительному анализу ДНК, проводится много исследований, связанных с применением сенсоров SERS для детектирования биомаркеров, включающих гены и белки, в целях ранней диагностики различных заболеваний. Рамановская спектроскопия обладает различными преимуществами перед другими способами (инфракрасная спектроскопия). Тогда как инфракрасная спектроскопия может детектировать сильные сигналы от молекул, которые имеют дипольный момент, рамановская спектроскопия позволяет детектировать сигналы даже от неполярных молекул, в которых индуцированная поляризуемость снижена. Таким образом, почти все органические молекулы имеют свои собственные смещения частоты при рамановском рассеянии (см-1). Кроме того, будучи свободной от интерференции молекул воды, рамановская спектроскопия пригодна для использования в детектировании биомолекул, включая белки, гены и т.д. Однако вследствие низкой интенсивности сигнала развитие рамановской спектроскопии еще не достигло уровня, при котором его можно было бы практически применять, несмотря на то, что исследования охватывают значительный период времени. После своего открытия поверхностно-усиленное рамановское рассеяние (SERS) постоянно развивалось до такого уровня, который позволяет детектировать сигналы на молекулярном уровне от рандомизированных скоплений наночастиц, абсорбировавших флуоресцентные красители (Science 1997, 275(5303), 1102; Phys rev lett 1997, 78(9), 1667). После этого сообщалось о многих исследованиях оптимизации SERS различными наноструктурами (наночастицы, нанооблочки, нанопровода). Для того чтобы применять SERS в качестве высокочувствительного способа детектирования для биодатчика, Mirkin et al. сообщали о высокочувствительном ДНК анализе с использованием ДНК-модифицированных золотых наночастиц, с пределом детектирования 20 fM (2002, science, 297, 1536).
Кроме того, будучи свободной от интерференции молекул воды, рамановская спектроскопия пригодна для использования в детектировании биомолекул, включая белки, гены и т.д. Однако вследствие низкой интенсивности сигнала развитие рамановской спектроскопии еще не достигло уровня, при котором его можно было бы практически применять, несмотря на то, что исследования охватывают значительный период времени. После своего открытия поверхностно-усиленное рамановское рассеяние (SERS) постоянно развивалось до такого уровня, который позволяет детектировать сигналы на молекулярном уровне от рандомизированных скоплений наночастиц, абсорбировавших флуоресцентные красители (Science 1997, 275(5303), 1102; Phys rev lett 1997, 78(9), 1667). После этого сообщалось о многих исследованиях оптимизации SERS различными наноструктурами (наночастицы, нанооблочки, нанопровода). Для того чтобы применять SERS в качестве высокочувствительного способа детектирования для биодатчика, Mirkin et al. сообщали о высокочувствительном ДНК анализе с использованием ДНК-модифицированных золотых наночастиц, с пределом детектирования 20 fM (2002, science, 297, 1536).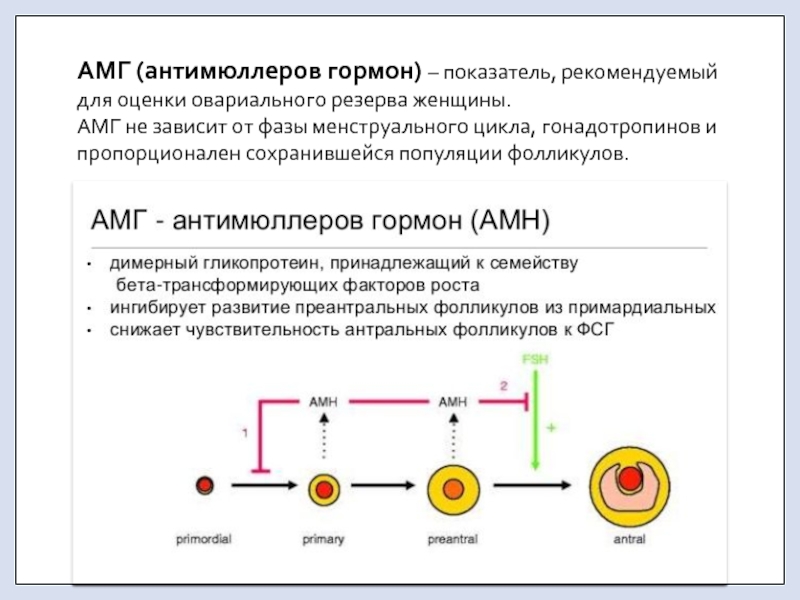 Однако не было почти никаких успехов в приготовлении SERS-активных субстратов из единичных молекул на основе индуцированной солью агрегации серебряных (Ag) наночастиц, несущих молекулы, активные в отношении рамановского рассеяния (например, Родамин 6G) после первого исследования. В одном отчете сообщали, что только одна часть (менее чем 1%) гетерогенно агрегированных коллоидов имеет SERS-активность единичной молекулы (J Phys Chem B 2002, 106(2), 311). Подобно этому, произвольно шероховатые поверхности обеспечивают множество интересных существенных данных, связанных с SERS, но эту стратегию принципиально невозможно воспроизвести, так как даже малое изменение морфологии поверхности ведет к значительному изменению усиления. Недавно Fang et al. сообщили о количественном измерении распределения центров усиления при SERS. Самые горячие SERS-активные центры (EF>109) насчитывали только 63 центра из общего количества 1000000 центров, но составили 24% от общей интенсивности SERS (Science, 2008, 321, 388).
Однако не было почти никаких успехов в приготовлении SERS-активных субстратов из единичных молекул на основе индуцированной солью агрегации серебряных (Ag) наночастиц, несущих молекулы, активные в отношении рамановского рассеяния (например, Родамин 6G) после первого исследования. В одном отчете сообщали, что только одна часть (менее чем 1%) гетерогенно агрегированных коллоидов имеет SERS-активность единичной молекулы (J Phys Chem B 2002, 106(2), 311). Подобно этому, произвольно шероховатые поверхности обеспечивают множество интересных существенных данных, связанных с SERS, но эту стратегию принципиально невозможно воспроизвести, так как даже малое изменение морфологии поверхности ведет к значительному изменению усиления. Недавно Fang et al. сообщили о количественном измерении распределения центров усиления при SERS. Самые горячие SERS-активные центры (EF>109) насчитывали только 63 центра из общего количества 1000000 центров, но составили 24% от общей интенсивности SERS (Science, 2008, 321, 388). В связи с этим объединение SERS-активных наночастиц в хорошо определенные и воспроизводимые горячие SERS наночастицы привело бы к высоконадежному, чувствительному анализу биомолекул и было бы очень полезным для применения в ксенодиагностике и методах визуализации in vivo.
В связи с этим объединение SERS-активных наночастиц в хорошо определенные и воспроизводимые горячие SERS наночастицы привело бы к высоконадежному, чувствительному анализу биомолекул и было бы очень полезным для применения в ксенодиагностике и методах визуализации in vivo.
Однако общепринятые способы детектирования для различных аналитов, как правило, используют коллоидные частицы металлов на субстратах и/или подложках, например, агрегированные наночастицы Ag. Это устройство часто способствует SERS-детектированию с чувствительностью, повышенной до порядка 106-108, но не может быть применено для детектирования единичных молекул малых аналитов, таких как нуклеотиды. Несмотря на достоинства SERS механизмы, стоящие за SERS, еще недостаточно поняты. Дополнительно, детектирование единичных молекул, основанное на SERS, обычно сталкивается со многими проблемами структурной воспроизводимости и надежности вследствие не только трудности в синтезе и контроле хорошо определенных наноструктур, но также и изменений увеличения выхода при длине волны и направлении поляризации излучения возбуждения, применяемого для измерения спектра. Такие проблемы остаются громадной помехой в применении SERS в попытке достичь развития и коммерциализации нанобиосенсоров. Чтобы решить вышеизложенные проблемы, сейчас, более чем когда-либо ранее, необходимы исследования оптических свойств и точные измерения SERS-усиления хорошо определенных наноструктур.
Такие проблемы остаются громадной помехой в применении SERS в попытке достичь развития и коммерциализации нанобиосенсоров. Чтобы решить вышеизложенные проблемы, сейчас, более чем когда-либо ранее, необходимы исследования оптических свойств и точные измерения SERS-усиления хорошо определенных наноструктур.
Исследования SERS-усиления, сообщенные Jeong, Proke, Schneider, и Lee, et. al., и с димером металлических частиц, поддерживают теоретические SERS-исследования по SERS-усилению, где SERS является результатом очень сильного электрического поля (т.е. горячая точка или интерстициальное поле), которое образуется, по меньшей мере, между двумя наночастицами. В соответствии с теоретическими вычислениями, основанными на электромагнитном принципе, в «горячей точке» ожидается усиление SERS в примерно 1012 раз. В силу этого увеличенная чувствительность детектирования рамановского рассеяния, хотя, по-видимому, не являющаяся гомогенной внутри агрегатов коллоидных частиц, варьирует в зависимости от наличия «горячих точек». Однако информация о физической структуре «горячих точек», диапазоне расстояний от наночастиц, где достигается повышенная чувствительность, и увеличивающей чувствительность пространственной взаимосвязи между аналитами и агрегированными наночастицами еще нигде ранее не сообщалась. Кроме того, агрегированные наночастицы являются нестабильными в растворах, таким образом, оказывая противоположный эффект на воспроизводимость детектирования аналитов из единичных частиц.
Однако информация о физической структуре «горячих точек», диапазоне расстояний от наночастиц, где достигается повышенная чувствительность, и увеличивающей чувствительность пространственной взаимосвязи между аналитами и агрегированными наночастицами еще нигде ранее не сообщалась. Кроме того, агрегированные наночастицы являются нестабильными в растворах, таким образом, оказывая противоположный эффект на воспроизводимость детектирования аналитов из единичных частиц.
Кроме того, хотя создавались теоретические имитационные модели и проводили экспериментальную проверку концепции димерных структур золота и серебра, о получении единичной молекулы, локализованной в соединении между наночастицами, еще не сообщалось. Синтез прочных SERS-активных наноструктур золота или серебра до сих пор остается нерешенной проблемой.
Ведущие к настоящему изобретению интенсивные и полные исследования развития наноструктур, способных к детектированию единичной ДНК с высокой чувствительностью и воспроизводимостью, проведенные авторами настоящего изобретения, имели результатом открытие того, что димерная окклюдантная наночастица, меченная молекулой, активной в отношении рамановского рассеяния, локализованной в межчастичном соединении, в котором расстояние между димерными наночастицами подогнано под желаемый диапазон посредством контроля толщины оболочки, показывает очень сильные сигналы поверхностно-усиленного рамановского рассеяния (SERS) с фактором усиления SERS (EF) до ~2,7×1012, и, как доказано, является высоковоспроизводимой частицей — «горячей точкой».
Раскрытие сущности изобретения
Техническая проблема
Таким образом, предмет настоящего изобретения относится к димерной окклюдантной наноструктуре, в которой молекула, активная в отношении рамановского рассеяния, локализована в межчастичном соединении.
Другой предмет настоящего изобретения относится к способу конструирования димерной наноструктуры.
Дополнительно, предмет настоящего изобретения относится к способу детектирования аналита с применением димерной наноструктуры.
Еще один дополнительный предмет настоящего изобретения относится к набору для детектирования аналита, содержащему димерную наноструктуру.
Техническое решение
В соответствии с вышеизложенным аспектом, настоящее изобретение относится к димерной окклюдантной наноструктуре, меченной молекулой, активной в отношении рамановского рассеяния, локализованной в межчастичном соединении.
Более подробно, димерная окклюдантная наноструктура по настоящему изобретению содержит две наночастицы, каждая из которых состоит из ядра (золотого или серебряного) и оболочки (золотой или серебряной), покрывающей ядро, где олигонуклеотиды прикреплены к поверхности каждой наночастицы, и части олигонуклеотидов выходят на внешнюю сторону оболочки, при этом частицы соединены друг с другом посредством прямой или непрямой гибридизации между двумя олигонуклеотидами. В каждой наночастице олигонуклеотид прикреплен одним концом к поверхности ядра, и в то же время частично выходит на наружную сторону оболочки. Экспонированные олигонуклеотидные последовательности двух наночастиц могут быть гибридизированы непосредственно одна с другой, когда они комплементарны одна с другой, или косвенно через олигонуклеотидную последовательность, комплементарную обеим экспонированным олигонуклеотидным последовательностям.
Как его применяют в настоящем документе, термин «ядро» относится к металлической частице, к поверхности которой непосредственно прикреплен олигонуклеотид. Предпочтительно, применяют золотую или серебряную частицу. Термин «оболочка» относится к металлическому, покрывающему ядро слою. Часть олигонуклеотида, прикрепленного к ядру, находится внутри оболочки. Предпочтительно, оболочка изготовлена из золота или серебра.
Предпочтительно, применяют золотую или серебряную частицу. Термин «оболочка» относится к металлическому, покрывающему ядро слою. Часть олигонуклеотида, прикрепленного к ядру, находится внутри оболочки. Предпочтительно, оболочка изготовлена из золота или серебра.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения димерная окклюдантная наноструктура выбрана из группы, состоящей из i) димерной наноструктуры, состоящей из двух наночастиц, каждая из которых состоит из золотого ядра и серебряной оболочки, ii) димерной наноструктуры, состоящей из двух наночастиц, каждая из которых состоит из серебряного ядра и золотой оболочки, iii) димерной наноструктуры, состоящей из двух наночастиц, каждая из которых состоит из золотого ядра и золотой оболочки, и iv) димерной наноструктуры, состоящей из двух наночастиц, каждая из которых состоит из серебряного ядра и серебряной оболочки, и v) димерной наноструктуры, состоящей из двух наночастиц, одна из которых состоит из золотого ядра и серебряной оболочки, и другая частица состоит из серебряного ядра и золотой оболочки. Наиболее предпочтительно, димерная окклюдантная наноструктура по настоящему изобретению состоит из двух наночастиц, каждая из которых состоит из золотого ядра и серебряной оболочки.
Наиболее предпочтительно, димерная окклюдантная наноструктура по настоящему изобретению состоит из двух наночастиц, каждая из которых состоит из золотого ядра и серебряной оболочки.
Окклюдантная наноструктура по настоящему изобретению может быть в форме гомодимера или гетеродимера. Как он применяется в настоящем документе, термин «гомодимер» относится к димерной сруктуре, содержащей две наночастицы, идентичные по размеру и структуре друг другу, а термин «гетеродимер» относится к димерной структуре, содержащей две наночастицы, отличающиеся по размеру и структуре друг от друга.
Диаметр частицы ядра димерной окклюдантной наноструктуры для наномечения посредством поверхностно-усиленного рамановского рассеяния в соответствии с настоящим изобретением составляет предпочтительно порядка от 5 нм до 300 нм. Когда диаметр ядра менее чем 5 нм, получается эффект пониженного SERS-усиления. С другой стороны, диаметр ядра, превышающий 300 нм, накладывал бы много ограничений на биологическое применение наноструктуры. Более предпочтительно, размер диаметра ядра находится в диапазоне от 10 нм до 40 нм. Наночастицы могут быть приблизительно сферическими, но также могут иметь неправильную форму или какой-либо другой вид формы.
Более предпочтительно, размер диаметра ядра находится в диапазоне от 10 нм до 40 нм. Наночастицы могут быть приблизительно сферическими, но также могут иметь неправильную форму или какой-либо другой вид формы.
Нанооболочка наносится на поверхность частицы ядра. Будучи адаптированной к тому, чтобы обеспечивать поверхность частицы ядра эффектом усиленного рамановского рассеяния, нанооболочка облегчает спектроскопический анализ рамановского рассеяния. То есть частица ядра, покрытая нанооболочкой, увеличивает поверхность усиленного рамановского рассеяния, таким образом, гарантируя уравнивание сигналов от каких-либо химических веществ. Предпочтительно, оболочка имеет толщину от 1 нм до 300 нм и более предпочтительно от 1 нм до 20 нм. Кроме того, толщина оболочки может увеличиваться пропорционально диаметру ядра и длине используемой ДНК.
Ядро характеризуется присутствием там, по меньшей мере, одного функционального олигонуклеотида, прикрепленного к его поверхности. Например, ядро A может быть функционализировано защитной олигонуклеотидной последовательностью, модифицированной тиольной группой на 3′-конце и захватывающей мишень олигонуклеотидной последовательностью, модифицированной тиольной группой на 3′-конце. С другой стороны, ядро B может быть функционализировано двумя различными видами олигонуклеотидных последовательностей (защитная последовательность и захватывающая мишень последовательность — обе модифицированные тиольной группой на соответствующих 5′-концах). Кроме того, захватывающие мишень олигонуклеотиды, прикрепленные к ядру A или к ядру B, модифицированы молекулой, активной в отношении рамановского рассеяния. Альтернативно, олигонуклеотиды могут быть прикреплены к 5′-модифицированному концу ядра A в то время как ядро B функционализировано 3′-модифицированными олигонуклеотидами в соответствии с настоящим изобретением.
Например, ядро A может быть функционализировано защитной олигонуклеотидной последовательностью, модифицированной тиольной группой на 3′-конце и захватывающей мишень олигонуклеотидной последовательностью, модифицированной тиольной группой на 3′-конце. С другой стороны, ядро B может быть функционализировано двумя различными видами олигонуклеотидных последовательностей (защитная последовательность и захватывающая мишень последовательность — обе модифицированные тиольной группой на соответствующих 5′-концах). Кроме того, захватывающие мишень олигонуклеотиды, прикрепленные к ядру A или к ядру B, модифицированы молекулой, активной в отношении рамановского рассеяния. Альтернативно, олигонуклеотиды могут быть прикреплены к 5′-модифицированному концу ядра A в то время как ядро B функционализировано 3′-модифицированными олигонуклеотидами в соответствии с настоящим изобретением.
Как он применяется в настоящем документе, термин «защищитный олигонуклеотид» относится к олигонуклеотиду, который прикреплен к поверхности частицы ядра, стабилизируя частицу ядра с целью способствовать захватывающему мишень олигонуклеотиду прикрепляться должным образом к поверхности ядра и защищать его.
Как он применяется в настоящем документе, термин «захватывающий мишень олигонуклеотид» относится к олигонуклеотиду, имеющему последовательность, комплементарную последовательности таргетного олигонуклеотида. Оба соответствующих захватывающих мишень олигонуклеотида для ядра A и ядра B гибридизуются с общим таргетным олигонуклеотидом для образования димерной наноструктуры.
Как он применяется в настоящем документе, термин «таргетный олигонуклеотид» относится к олигонуклеотиду, который содержит последовательность, комплементарную обоим захватывающим мишень олигонуклеотидам для ядер A и B, и, таким образом, пригодную в качестве линкера, с которым эти два захватывающих мишень олигонуклеотида гибридизуются для образования димерной наноструктуры. Следует понимать, что «таргетный олигонуклеотид» не означает конечного таргетного аналита для анализа с использованием димерной наноструктуры.
Как защитный олигонуклеотид, так и захватывающий мишень олигонуклеотид можно модифицировать на их 3′- или 5′-концах поверхностно-связанной функциональной группой, которой они прикреплены к поверхности частицы ядра.
Как он применяется в настоящем документе, термин «поверхностно связанная функциональная группа» относится к соединению, которое связано с 3′- или 5′-концами каждого олигонуклеотида, и которая служит для прикрепления олигонуклеотида к частице ядра. Можно использовать без ограничений любую поверхностно-связанную функциональную группу при условии, что она способствует образованию такого малого агрегата наноструктур, что агрегат не осаждается. Поверхностно-связанную функциональную группу можно использовать для сшивания наноструктур, как описано ранее в данной области (Feldheim, The Electrochemical Society Interface, Fall, 2001, pp. 22-25). Соединение, имеющее поверхностно-связанную функциональную группу, пригодную в настоящем изобретении, содержит на его одном конце поверхностно-связанную функциональную группу, которая связана с поверхностью частицы ядра. Предпочтительно, поверхностно-связанная функциональная группа является серосодержащей группой, такой как тиольная или сульфгидрильная (HS). Таким образом, функциональная группа может быть соединением, представленным RSH, и являющимся производным спирта или фенола, в котором атом серы присутствует вместо атома кислорода. Альтернативно функциональная группа может быть группой тиолового сложного эфира или дитиолового сложного эфира, соответственно представленной как RSSR’ и RSR’, или аминогруппой (-Nh3). Кроме того, соединение, имеющее поверхностно-связанную функциональную группу, можно связать с рядом реакционноспособных групп, например -NH2,-COOH, -CHO, -NCO, и эпоксидной группой, которая может реагировать с биомолекулами, такими как ДНК-зонды, антитела, олигонуклеозиды и аминокислоты. Эти реакционноспособные группы хорошо известны в данной области, и их можно применять к способу и аппаратуре по настоящему изобретению.
Таким образом, функциональная группа может быть соединением, представленным RSH, и являющимся производным спирта или фенола, в котором атом серы присутствует вместо атома кислорода. Альтернативно функциональная группа может быть группой тиолового сложного эфира или дитиолового сложного эфира, соответственно представленной как RSSR’ и RSR’, или аминогруппой (-Nh3). Кроме того, соединение, имеющее поверхностно-связанную функциональную группу, можно связать с рядом реакционноспособных групп, например -NH2,-COOH, -CHO, -NCO, и эпоксидной группой, которая может реагировать с биомолекулами, такими как ДНК-зонды, антитела, олигонуклеозиды и аминокислоты. Эти реакционноспособные группы хорошо известны в данной области, и их можно применять к способу и аппаратуре по настоящему изобретению.
С другой стороны, олигонуклеотид может содержать спейсерную область на конце, противоположном линкерному соединению. Спейсерная область не только предохраняет оболочку, покрывающую ядро, от перекрывания таргетной распознающей последовательности захватывающего мишень олигонуклеотида, но также обеспечивает пространство для подходящей толщины оболочки. Примером спейсерной области является A10-PEG.
Примером спейсерной области является A10-PEG.
Как он применяется в настоящем документе, термин «молекула, активная в отношении рамановского рассеяния», относится к молекуле, которая облегчает детектирование и измерение аналита посредством рамановского детектора, когда димерная наноструктура по настоящему изобретению применяется к одному или нескольким аналитам. Захватывающий мишень олигонуклеотид либо на ядре A, либо на ядре B модифицирован молекулой, активной в отношении рамановского рассеяния. Молекула, активная в отношении рамановского рассеяния, создает специфический рамановский спектр и обладает преимуществом способствовать эффективному анализу последующих биомолекул.
В качестве молекул, активных в отношении рамановского рассеяния, пригодных в рамановской спектроскопии, можно применять органические или неорганические молекулы, атомы, комплексы или синтетические молекулы, красители, натуральные красители (фикоэритрин и т.д.), органические наноструктуры, такие как С60, бакиболы, углеродные нанотрубки, квантовые точки и органические флуоресцентные молекулы. Конкретные примеры молекул, активных в отношении рамановского рассеяния, включают FAM, Dabcyl, TRITC (тетраметил родамин-5-изотиоцианат), MGITC (малахитовый зеленый изотиоцианат), XRITC (X-родамин-5-изотиоцианат), DTDC (3,3-диэтилтиадикарбоцианин иодид), TRIT (тетраметил родамин изотиол), NBD (7-нитробенз-2-1,3-диазол), фталевую кислоту, терефталевую кислоту, изофталевую кислоту, пара-аминобензойную кислоту, эритрозин, биотин, дигоксигенин, 5-карбокси-4′,5′-дихлор-2′,7′-диметокси, флуоресцеин, 5-карбокси-2′,4′,5′,7′-тетрахлорфлуоресцеин, 5-карбоксифлуоресцеин, 5-карбоксиродамин, 6-карбоксиродамин, 6-карбокситетраметил аминофталоцианин, азометин, цианин (Cy3, Cy3,5, Cy5), ксантин, сукцинилфлуоресцеин, аминоакридин, квантовые точки, аллотропы углерода, цианиды, тиол, хлор, бром, метил, фосфор и серу, но не ограниченные этим. Для применения в димерной наноструктуре по настоящему изобретению от молекулы, активной в отношении рамановского рассеяния, требуется продемонстрировать отчетливый спектр рамановского рассеяния, и она должна быть связана различными видами аналитов или иметь сродство с ним.
Конкретные примеры молекул, активных в отношении рамановского рассеяния, включают FAM, Dabcyl, TRITC (тетраметил родамин-5-изотиоцианат), MGITC (малахитовый зеленый изотиоцианат), XRITC (X-родамин-5-изотиоцианат), DTDC (3,3-диэтилтиадикарбоцианин иодид), TRIT (тетраметил родамин изотиол), NBD (7-нитробенз-2-1,3-диазол), фталевую кислоту, терефталевую кислоту, изофталевую кислоту, пара-аминобензойную кислоту, эритрозин, биотин, дигоксигенин, 5-карбокси-4′,5′-дихлор-2′,7′-диметокси, флуоресцеин, 5-карбокси-2′,4′,5′,7′-тетрахлорфлуоресцеин, 5-карбоксифлуоресцеин, 5-карбоксиродамин, 6-карбоксиродамин, 6-карбокситетраметил аминофталоцианин, азометин, цианин (Cy3, Cy3,5, Cy5), ксантин, сукцинилфлуоресцеин, аминоакридин, квантовые точки, аллотропы углерода, цианиды, тиол, хлор, бром, метил, фосфор и серу, но не ограниченные этим. Для применения в димерной наноструктуре по настоящему изобретению от молекулы, активной в отношении рамановского рассеяния, требуется продемонстрировать отчетливый спектр рамановского рассеяния, и она должна быть связана различными видами аналитов или иметь сродство с ним. Предпочтительными являются флуоресцентные красители цианинового типа, такие как Cy3, Cy3,5 и Cy5, или органические флуоресцентные молекулы, такие как FAM, Dabcyl, молекулы родамина и т.д. Эти органические флуоресцентные молекулы обладают преимуществом детектирования более высоких рамановских сигналов, резонируя под действием возбуждения лазерных длин волн, пригодных для рамановского анализа. Молекулы, активные в отношении рамановского рассеяния, могут быть прикреплены к аналитам прямо или через линкерное соединение.
Предпочтительными являются флуоресцентные красители цианинового типа, такие как Cy3, Cy3,5 и Cy5, или органические флуоресцентные молекулы, такие как FAM, Dabcyl, молекулы родамина и т.д. Эти органические флуоресцентные молекулы обладают преимуществом детектирования более высоких рамановских сигналов, резонируя под действием возбуждения лазерных длин волн, пригодных для рамановского анализа. Молекулы, активные в отношении рамановского рассеяния, могут быть прикреплены к аналитам прямо или через линкерное соединение.
В соответствии с аспектом настоящего изобретения, выявлено, что наноструктура может детектировать SERS сигналы, только когда молекула, активная в отношении рамановского рассеяния, локализована на междучастичном стыке. Например, никакие SERS сигналы не могли быть детектированы для окклюдантных мономеров вследствие того, что они не обладали горячими точками, и присутствовала только одна молекула, активная в отношении рамановского рассеяния (фиг.3A-1, 2).
По другому аспекту, настоящее изобретение относится к способу конструирования димерной окклюдантной наноструктуры, меченной молекулой, активной в отношении рамановского рассеяния.
Более подробно, способ конструирования димерной окклюдантной наноструктуры, меченной молекулой, активной в отношении рамановского рассеяния, включает: 1) синтезирование ядра A и ядра B, соответственно, причем ядро A имеет защитный олигонуклеотид и захватывающий мишень олигонуклеотид, которые связаны с его поверхностью, а ядро B имеет защитный олигонуклеотид и захватывающий мишень олигонуклеотид, модифицированные на одном конце молекулой, активной в отношении рамановского рассеяния, которая связана с его поверхностью, 2) гибридизование ядра A и ядра B с таргетным олигонуклеотидом для образования димерной структуры, и 3) нанесение оболочки на ядро A и ядро B.
На первом этапе синтезируют ядро A и ядро B, каждое из которых обладает защитным олигонуклеотидом и захватывающим мишень олигонуклеотидом, связанными с их поверхностью. При синтезе частиц ядра по варианту осуществления настоящего изобретения золотое ядро A функционализировано двумя типами последовательностей ДНК, модифицированных тиольной группой на 3′-концах (защитная олигонуклеотидная последовательность и захватывающая мишень олигонуклеотидная последовательность). Аналогично, золотое ядро B функционализировано двумя типами ДНК-последовательностей, модифицированных тиольной группой на 5′-концах. Молярные отношения этих двух типов последовательностей (защитная последовательность/захватывающая мишень последовательность) составляют 99:1 для ядра A и 199:1 для ядра B. Эти соотношения были приняты такими, чтобы модифицировать один захватывающий мишень олигонуклеотид на зонд с учетом емкости загрузки по ДНК, зависящей от размера наночастиц (фиг.1A). Важно отметить, что Cy3, FAM или краситель Dabcyl, активные в отношении рамановского рассеяния, предварительно конъюгируют с захватывающим мишень олигонуклеотидом, связанным с ядром B.
Чтобы удалить мономер наночастицы, с которым не связаны захватывающие мишень последовательности, ядра, модифицированные олигонуклеотидами, можно очищать посредством процесса магнитного разделения. Тозил-модифицированные магнитные частицы (диаметр 1 мкм, Invitrogen) можно функционализировать аминомодифицированными таргетными олигонуклеотидными последовательностями, комплементарными к захватывающим мишень последовательностям для ядер A и B, соответственно. Только частицы ядра, имеющие захватывающие мишень последовательности, связанные с ними, образуют комплексы с магнитными частицами посредством гибридизации. После реакции гибридизации к реакционному раствору применяется наружное магнитное поле для разделения комплексов ядер и магнитных частиц. Ядра освобождаются от магнитных частиц посредством нагревания комплексов до температуры выше температуры плавления (Tm) гибридизированных двухцепочечных ДНК последовательностей.
На втором этапе ядрам A и B дают возможность образовывать димер посредством гибридизации с таргетной олигонуклеотидной последовательностью. На первом этапе частицы ядра A и B, разделенные и изолированные от магнитных частиц в буфере, например, 0,3M PBS, гибридизуются с достаточным количеством таргетной олигонуклеотидной последовательности для образования желаемой димерной наноструктуры. Таким образом, способ по настоящему изобретению дает возможность производить димер с высоким выходом продукта (70-80%).
На третьем этапе нанесение нанооболочки на частицы ядра можно предпочтительно проводить посредством реакции предшественника золотой частицы ядра с предшественником серебряной наночастицы при 10-100°C в растворителе. Предпочтительно, предшественник серебряной наночастицы выбран из AgNO3 и AgClO4. Любое соединение можно использовать в качестве предшественника золотых частиц ядра при условии, что оно содержит ионы Au. Предпочтительным является HAuCl4. Серебряные ионы или золотые ионы можно превратить в золотые или серебряные наночастицы посредством восстановителя. Примеры восстановителя, пригодного в настоящем изобретении, включают гидрохинон, борогидрид натрия (NaBH4) и аскорбат натрия, но не ограничены ими. Растворитель, пригодный для использования в образовании нанооболочки, является предпочтительно водным раствором (чистая вода или фосфатный буфер). Дополнительно, можно использовать стабилизатор для точного контроля толщины нанооболочки. Реакция при температуре менее чем 10°C занимает слишком много времени на образование серебряных наночастиц. С другой стороны, когда температура реакции превышает 100°C, образуются искривленные серебряные наночастицы. Таким образом, предшественники предпочтительно реагируют в пределах данного диапазона температур. Реакцию можно проводить в течение от 10 до 24 часов в зависимости от температуры реакции.
Димерная окклюдантная наноструктура, меченная молекулой, активной в отношении рамановского рассеяния, в межчастичном соединении, в соответствии с настоящим изобретением является функционализированной на ее поверхности или поверхности ядра молекулой зонда, способного распознавать аналит, так что она может быть применена для детектирования различных биомолекул.
Примерами аналитов являются аминокислоты, пептиды, полипептиды, белки, гликопротеины, липопротеины, нуклеозиды, нуклеотиды, олигонуклеотиды, нуклеиновые кислоты, сахариды, углеводы, олигосахариды, полисахариды, жирные кислоты, липиды, гормоны, метаболиты, цитокины, хемокины, рецепторы, нейромедиаторы, антигены, аллергены, антитела, субстраты, кофакторы, ингибиторы, лекарственные средства, фармацевтические вещества, нутриенты, прионы, токсины, токсические вещества, взрывчатые вещества, пестициды, вещества для химического оружия, биологические вредновоздействующие вещества, радиоактивные изотопы, витамины, гетероциклические ароматические соединения, онкогенные средства, мутагенные факторы, анестетики, амфетамин, барбитурат, галлюциногены, отходы и примеси. Когда аналитами являются нуклеиновые кислоты, они включают гены, вирусную РНК и ДНК, бактериальную ДНК, грибную ДНК, ДНК млекопитающих, кДНК, мРНК, РНК и фрагменты ДНК, олигонуклеотиды, синтетические олигонуклеотиды, модифицированные олигонуклеотиды, одно- и двухцепочечные нуклеиновые кислоты и природные или синтетические нуклеиновые кислоты.
Неограничивающие примеры распознающих аналиты молекул-зондов, связанных с поверхностью димерной наноструктуры, включают антитела, фрагменты антител, антитела, созданные методами генной инженерии, одноцепочечные антитела, белки рецепторов, белки лигандов, ферменты, ингибиторные белки, лектины, белки клеточной адгезии, олигонуклеотиды, полинуклеотиды, нуклеиновые кислоты и аптамеры.
Полную димерную наноструктуру по настоящему изобретению можно покрывать неорганическим веществом. После полного покрытия неорганическим веществом димерная наноструктура по настоящему изобретению может выдерживать более значительные воздействия структурной деформации. Таким образом, полное неорганическое покрытие стабилизирует димерную наноструктуру и является преимущественным для хранения и применения димерной наноструктуры. Можно использовать любое неорганическое вещество при условии, что оно не оказывает влияния на сигналы рамановского рассеяния. Предпочтительным неорганическим веществом является диоксид кремния.
По дополнительному аспекту, настоящее изобретение относится к способу детектирования аналита с применением димерной наноструктуры по настоящему изобретению.
Более подробно, способ включает 1) синтезирование димерной наноструктуры по настоящему изобретению; 2) функционализирование поверхности димерной наноструктуры или ядра молекулой-зондом, способной детектировать аналит; 3) воздействие на димерную наноструктуру образца, содержащего, по меньшей мере, один аналит; и 4) детектирование и идентификацию аналита посредством лазерного возбуждения и рамановской спектроскопии.
Предпочтительно, аналиты детектируются и идентифицируются с применением любой хорошо известной рамановской спектроскопии. Примеры рамановской спектроскопии, пригодной в настоящем изобретении, включают SERS (поверхностно-усиленная рамановская спектроскопия), SERRS (резонансная поверхностно-усиленная рамановская спектроскопия), гиперрамановская и/или CARS (когерентная антистоксовая рамановская спектроскопия).
Термин «поверхностно-усиленная рамановская спектроскопия» (SERS) относится к спектроскопическому способу, который использует явление, при котором, когда молекулы адсорбированы на шероховатой поверхности металлической наноструктуры, такой как золотые или серебряные наночастицы, или присутствуют в пределах расстояния в сотни нанометров от поверхности, интенсивность рамановского рассеяния существенно увеличивается до уровня 106-108 раз по сравнению с нормальными сигналами рамановского рассеяния. Термин «резонансная поверхностно-усиленная рамановская спектроскопия» (SERRS) относится к комбинации SERS и резонансной рамановской спектроскопии, которая использует пространственную близость к поверхности для усиления рамановской интенсивности, и длины волны возбуждения, подходящей для максимальной поглощающей способности анализируемой молекулы. Термин «когерентная антистоксовая рамановская спекроскопия» (CARS) относится к спектроскопическому способу, в котором два лазерных луча — переменный и фиксированный, падают на рамановскую активную среду, генерируя когерентный антистоксовый частотный луч.
В варианте осуществления способ детектирования аналитов в соответствии с настоящим изобретением включает 1) синтезирование димерной наноструктуры по настоящему изобретению; 2) функционализирование поверхности димерной наноструктуры или ядра молекулой зонда, комплементарного детектируемому аналиту нуклеиновой кислоты; 3) изолирование, очистка и амплифицирование аналита нуклеиновой кислоты из образца; 4) гибридизацию димерной окклюдантной наноструктуры со специфической последовательностью амплифицированных нуклеиновых кислот; и 5) детектирование и идентификацию аналита нуклеиновой кислоты, комбинированной с димерной наноструктурой, с применением рамановской спектроскопии. Если он модифицирован подходящим образом для условий аналита, этот способ можно применять при детектировании, по меньшей мере, одного однонуклеотидного полиморфизма (SNP) или других генетических мутаций в образце и дополнительно применять при секвенировании ДНК.
В варианте осуществления, применяемом на практике, субстрат, активный в отношении рамановского рассеяния, можно функционально связать с, по меньшей мере, одним устройством детекции рамановского рассеяния. Способы, основанные на рамановской спектроскопии, детектирующие аналиты, хорошо известны в данной области (например, патенты США № 6002471, 6040191, 6149868, 6174677 и 6313914). При SERS и SERRS интенсивность рамановского рассеяния от молекул, адсорбированных на шероховатой металлической поверхности, такой как серебро, золото, платина, медь или алюминий, усиливается в 106 раз или выше по сравнению с нормальными сигналами рамановского рассеяния.
Неограничивающие примеры устройств детектирования рамановского рассеяния описаны в патенте США № 6002471. Возбуждающее излучение получают или посредством Nd:YAG лазера при длине волны 532 нм или Ti:сапфирового лазера при длине волны 365 нм. Можно применять как импульсные лазерные лучи, так и непрерывные лучи. Сигнал светового возбуждения проходит через конфокальную оптическую систему 6 и объектив микроскопа и фокусируется на субстрате, активном в отношении рамановского рассеяния, содержащем, по меньшей мере, один аналит. Рамановское излучение, испускаемое аналитом, собирается посредством объектива микроскопа и конфокальной оптической системы, и соединяется с монохроматором для спектрального расщепления. Конфокальное оптическое устройство включает комбинацию дихроичных фильтров, барьерных фильтров, конфокальных точечных отверстий, линз объектива и зеркал и служит для уменьшения фонового сигнала. Можно использовать стандартную оптику полного поля, а также конфокальную оптику. Сигналы рамановского излучения детектируются посредством детекторной системы, которая включает лавинный фотодиод, связанный с компьютером для расчета цифрового кодирования сигналов.
Другой пример устройства детекции можно найти в патенте США № 5306403, в котором SERS-измерения можно проводить посредством спектрометра Spex Model 1403 с двумя дифракционными решетками, оснащенного фотоэлектронным умножителем на арсениде галлия (RCA, Model C31034 или Burle Industries Model C3103402), который эксплуатируют в однофотонном режиме работы с расчетом выключки строк. Лазерный генератор является 514,5 нм линейным аргон-ионным лазером (SpectraPhysics, Model 166) и 647,1 нм линейным криптон-ионным лазером (Innova 70, Coherent).
Другие лазеры, доступные для возбуждения, включают азотный лазер (Laser Science Inc.) при 337 нм и гелиево-кадмиевый лазер (Liconox) при 325 нм (патент США № 6174677), фотодиоды, Nd:YLF лазер и/или различные ионные лазеры и/или лазеры на красителе. Лучи спектрально очищают полосно-пропускающим фильтром (Corion) и коллимируют перед фокусированием на субстрат, активный в отношении рамановского рассеяния, с помощью 6X линзы объектива (Newport, Model L6X). Кроме того, линзу объектива применяют как для возбуждения аналита, так и для собирания сигналов рамановского рассеяния. Эта геометрия возбуждения/собирания с торцевым входом стала возможной благодаря использованию голографической светоделительной призмы (Kaiser Optical Systems, Inc., Model HB 647-26N18). Голографический узкополосный режекторный фильтр (Kaiser Optical Systems, Inc., HNPF-647-1,0) можно поместить в луч SERS-сигнала для дальнейшего отклонения рэлеевского рассеянного излучения. Другим детектором рамановского излучения является спектрограф (ISA, ЧАС-320), оснащенный системой детекции на основе усиленного по красному спектру интенсифицированного прибора с зарядовой связью (RE-ICCD) (Princeton Instruments). Можно использовать другие детекторы, такие как Фурье-спектрометр (основанный на интерферометре Майкельсона), прибор с инжекцией заряда (CID), фотодиодные матрицы, InCaAs детекторы, электронно-множительный CCD, высокочувствительный CCD и/или фототранзисторные установки.
Для детектирования аналитов можно использовать любую хорошо известную подходящую форму или модификацию рамановской спектроскопии или связанной с ней спектрометрии. В качестве неограничивающих примеров рамановская спектроскопия включает нормальное рамановское рассеяние, резонансное рамановское рассеяние, поверхностно-усиленное рамановское рассеяние, поверхностно-усиленное резонансное рамановское рассеяние, когерентную антистоксовую рамановскую спектроскопию, стимулированную рамановскую спектроскопию, инверсную рамановскую спектроскопию, спектроскопию комбинационного усиления, гиперкомбинационное рассеяние, молекулярно-оптический лазерный щуп (MOLE), рамановское микрозондирование, рамановскую микроскопию, конфокальный рамановский микроспектрометр, 3-D или сканирующую рамановскую спектроскопию, рамановскую спектроскопию насыщения, резонансное рамановское рассеяние с временной разрешающей способностью, рамановскую диссоциационную спектроскопию и рамановскую спектроскопию с УФ-возбуждением.
По варианту осуществления настоящего изобретения прибор для детектирования рамановского рассеяния может содержать компьютер. На компьютер, используемый в настоящем изобретении, не накладывается никаких ограничений. Показательный компьютер может содержать канал для обмена информацией и процессор для обработки информации. Компьютер может дополнительно содержать RAM или другое динамическое запоминающее устройство, ROM или другое статическое запоминающее устройство и устройство для хранения данных, такое как магнитный диск или оптический диск, вместе с соответствующим драйвером. Также компьютер может содержать периферические устройства, такие как дисплей (например, электронно-лучевая трубка или жидко-кристаллический дисплей), алфавитное устройство ввода данных (например, клавиатура), координатно-указательное устройство (например, мышь, трекбол, или клавиша управления курсором) и устройство связи (например, модем, сетевая интерфейсная карта или локальная компьютерная сеть Ethernet, кольцевая сеть с маркерным доступом или другие устройства, взаимодействующие с сетью).
В варианте осуществления настоящего изобретения прибор для детекции рамановского рассеяния можно оперативно связать с компьютером. Данные от детектирующего прибора можно обрабатывать процессором и хранить в главном устройстве памяти. Данные по профилям эмиссии для стандартных аналитов могут быть сохранены в главном устройстве памяти или ROM. Процессор может идентифицировать аналит в образце посредством сравнения спектров испускания аналита в рамановском активном субстрате. Процессор может анализировать данные от детектирующего прибора для идентификации и количественного определения различных аналитов. Компьютеры, настроенные различным образом, можно использовать для различных целей. Таким образом, структура системы рамановской спектроскопии может различаться от одного варианта осуществления к другому. После сбора данные, как правило, переводят в устройство, где данные анализируют. Для анализа данных, данные от детектора обрабатываются цифровым компьютером, как описано выше. Как правило, компьютер запрограммирован, чтобы получать и хранить данные от детектора, а также анализировать и обрабатывать данные.
В соответствии с еще одним дополнительным аспектом настоящее изобретение относится к набору для детектирования аналита, содержащего димерную наноструктуру по настоящему изобретению.
Например, когда детектируемым аналитом является нуклеиновая кислота, набор может содержать ингредиенты, необходимые для ПЦР-РВ для амплификации нуклеиновой кислоты, содержащейся в образце. Набор для ПЦР-РВ может дополнительно содержать пару праймеров, специфичных для аналита нуклеиновой кислоты, тестовую пробирку или другой подходящий контейнер, рабочий буферный раствор (различные значения pH и концентрации Mg), дезоксинуклеотиды (dNTPs), ферменты, такие как Taq-полимераза и обратная транскриптаза, ингибиторы ДНКазы и РНКазы, DEPC-воду и стерилизованную воду. В предпочтительном варианте осуществления настоящего изобретения набор для детектирования может быть предназначен для осуществления функции ДНК-чипа. Набор ДНК-чипа может содержать субстрат, на котором располагаются гены или кДНК, соответствующие фрагментам генов, и реагенты, составы и ферменты для конструирования флуоресцентных зондов. Также субстрат может дополнительно содержать контрольный ген или кДНК, соответствующие фрагменту гена.
В другом варианте осуществления настоящего изобретения, когда детектируемый аналит является белком, набор может предназначаться для иммунологического детектирования антитела и может содержать субстрат, соответствующий буферный раствор, вторичное антитело, конъюгированное с димерной наноструктурой по настоящему изобретению, и краситель. Субстрат можно подвергать обработке на нитроцеллюлозной мембране, 96-луночном планшете, изготовленном из поливинилового полимера, 96-луночном планшете, изготовленном из полистиролового полимера или предметном стекле.
В действительности, набор для детектирования содержит распространенные инструменты и средства, хорошо известные в данной области. В качестве неограничивающих примеров инструменты/средства включают носитель, вещество для мечения, способное производить детектируемый сигнал, растворяющее средство, моющее средство, буферный раствор и стабилизатор. В случае когда вещество для мечения является ферментом, набор может содержать субстрат для измерения активности ферментов и ограничитель реакции. В качестве неограничивающих примеров носители включают растворимые носители, например хорошо известные физиологически приемлемый буфер, например PBS, нерастворимые носители, например полистирол, полиэтилен, полипропилен, сложный полиэфир, полиакрилонитрил, фторсодержащий полимер, поперечно-сшитый декстран, полисахариды, полимеры, такие как магнитные бусины, в которых латекс покрывают металлом, бумагу, стекло, агарозу или их сочетания.
Для образования комплексов антиген-антитело могут быть применены хорошо известные способы. В качестве неограничивающих примеров способы включают гистохимическое окрашивание, RIA, ELISA, Вестерн-блоттинг, иммунопреципитационный анализ, иммунодиффузионный анализ, анализ связывания комплемента, FACS и белковый чип.
Полезные эффекты
Так как молекула, активная в отношении рамановского рассеяния, локализована в межчастичном соединении, и расстояние между молекулой, активной в отношении рамановского рассеяния, и частицей наноядра точно определяется толщиной серебряной или золотой оболочки, димерная окклюдантная наноструктура по настоящему изобретению способствует получению сильных сигналов поверхносто-усиленного рамановского рассеяния (SERS). Кроме того, несмотря на локализацию только одной молекулы, активной в отношении рамановского рассеяния, сильные рамановские сигналы можно детектировать с использованием димерной окклюдантной наноструктуры. Кроме того, способ конструирования димерной окклюдантной наноструктуры гарантирует производство димера высокой чистоты. В частности, наноструктуру можно сконструировать с высокой степенью чистоты посредством стехиометрического контроля олигонуклеотидов для ядер А и В и посредством использования магнитных частиц при очистке ядер А и В. Кроме того, зазор между двумя наночастицами можно регулировать на наноуровне. Будучи спроектированной для амплификации рамановских сигналов в большой степени, окклюдантная наноструктура по настоящему изобретению находит применение в различных областях, включая детектирование аналитов, таких как ДНК и белки (биомаркеры), связанные с возникновением и прогрессированием специфических заболеваний, анализом крупномасштабных геномных последовательностей, детектированием однонуклеотидного полиморфизма (SNP), секвенированием оснований, генным фингерпринтингом, взаимосвязью между заболеваниями и разработкой лекарственных средств.
Описание рисунков
Фиг.1A и 1B являются схематическими диаграммами, представляющими синтез димеров Au-наночастицы, проходящих через магнитную очистку, ДНК гибридизацию и образование Ag-оболочки. Защитной последовательностью для зонда A является 3′-HS-(CH2)3—A 10-PEG 18-AAACTCTTTGCGCAC-5′, захватывающей мишень последовательностью для зонда A является 3′-HS-(CH2)3—A 10-PEG 18-CTCCCTAATAACAAT-5′, и модифицированной последовательностью для MMP-A является 3′-NH2-(CH2)3—A 10-PEG 18-ATTGTTATTAGGGAG-5′ (Tm=38°С). Защитной последовательностью для зонда B является 5′-HS-(CH2)6-A10-PEG18-AAACTCTTTGCGCAC-3′, захватывающая мишень последовательность для зонда B представлена формулой 5′-HS-(CH2)3—A 10-PEG 18— ATCCTTATCAATATTAAA-Cy3-3′ и модифицированная последовательность для MMP-B представлена формулой 5′-NH2-(CH2)3—A 10-PEG 18-TTTAATATTGATAAGGAT-3′ (Tm=40°C). Подчеркнутые части представляют спейсерные области, сконструированные так, чтобы облегчить образование Ag-оболочки. Последовательность таргетной ДНК представлена 5′-GAGGGATTATTGTTAAATATTGATAAGGAT-3′ (олигонуклеотид сибирской язвы).
На фиг.1C представлена коррелированная с AFM наладка рамановской спектроскопии (лазерный фокальный диаметр 250 нм) для идентификации горячей точки SERS из единичной димерной наноструктуры.
На фиг.2A представлен спектр излучения в УФ- и видимой области до и после образования димера Au-наночастицы и соответствующие TEM и HR-TEM изображения. На фиг.2B представлен спектр излучения в видимой и УФ-области до и после нанесения Ag-оболочки на димер Au-наночастицы и соответствующие TEM и HR-TEM изображения. На фиг.2C представлен плазмонный резонанс (пик при ~400 нм) наноструктуры, которая варьирует в зависимости от толщины серебряной оболочки. Они соответствуют HR-TEM изображениям Au-Ag окклюдантного димера. HR-TEM изображения C.1a и C.1b окклюдантной наноструктуры представляют Au-Ag окклюдантные мономеры с толщиной оболочки 5 нм и 10 нм соответственно. C.2, C.3 и C.4 являются соответственно Au-Ag окклюдантными гетеродимерами с толщиной оболочки ~3 нм, ~5 нм и ~10 нм.
На фиг.3A представлен AFM (атомный силовой микрограф, 1×1 мкм) Au-Ag окклюдантного мономера и гетеродимера. На фиг.3B представлены коррелированные SERS-спектры, взятые от мономерных или димерных Au-Ag окклюдантных наноструктур. На фиг.3C представлены все спектры, полученные 514,5 нм возбуждающим лазером, накопление 1 сек, образец 100 мкВт и фокальный диаметр лазера 250. Спектры рамановского рассеяния получены от Cy3-модифицированных олигонуклеотидов (красная линия) и Cy3-свободных олигонуклеотидов (черная линия) в NaCl-агрегированных серебряных коллоидах.
На фиг.4 представлены SERS сигналы от индивидуальных проанализированных Au-Ag окклюдантных димеров, которые соответствуют единичной молекуле активного Cy3.
На фиг.4A представлены AFM изображения в полуконтактном режиме (5×5 мкм) Au-Ag окклюдантного димера (соответствующего наноструктуре с толщиной Ag-оболочки ~5 нм и пропуску ~1 нм на фиг.2B-2). На фиг.4B представлены SERS-спектры Cy3 от индивидуальной димерной наноструктуры с длиной волны лазера 514,5 нм, мощностью лазера ~80 мкВт, лазерным фокальным диаметром ~250 нм и продолжительностью интегрирования 1 сек.
На фиг.5A и 5B представлены мерцающие SERS-спектры, полученные от наноструктуры с временем аккумуляции 1 сек. На фиг.5C представлен SERS-спектр, полученный от Au-Ag окклюдантных гетеродимеров с различной поляризацией падающего лазерного луча. На фиг.5D представлены полярные диаграммы интегрированных SERS-интенсивностей рамановских полос 1470 и 1580 см-1 в зависимости от ?. Их измеряли лазером с длиной волны 514,5 нм, мощностью лазера ~40 мкВт, фокальным диаметром лазера ~250 нм и временем интеграции 20 сек.
На фиг.6 представлены SERS-спектры от димерных наноструктур, модифицированных олигонуклеотидами, меченными FAM и Dabcyl. На фиг.6A представлены спектры рамановского рассеяния от FAM-меченых олигонуклеотидов (1 нМ) и Dabcyl-меченых олигонуклеотидов (1 нМ) в растворах. На фиг.6B представлены спектры рамановского рассеяния от димерных Au-Ag окклюдантных наноструктур, меченных FAM (Ag-оболочка 5 нм) и Dabcyl (Ag оболочка, 5 нм).
Лучшее понимание настоящего изобретения можно получить с помощью следующих примеров, которые описаны для иллюстрации, но не в качестве ограничивающих примеров настоящего изобретения.
Варианты реализации изобретения
Вышеизложенные и другие объекты, свойства и другие преимущества настоящего изобретения будут более понятны из следующих примеров, но следует понимать, что настоящее изобретение не ограничено следующими примерами ни в коей мере.
ПРИМЕР 1: Получение димерной Au-Ag окклюдантной наноструктуры, меченной молекулой, активной в отношении рамановского рассеяния (Cy3), локализованной в межчастичном соединении
Основанный на ДНК-направленном мостиковом способе синтез рамановского Au-Ag окклюдантного димера проводили с использованием таргетных Au-наночастиц, связанных с олигонуклеотидами с Ag оболочкой, образованной из контролируемого количества Ag предшественника (фиг.1).
Во-первых, высокоочищенные гетеродимеры Au-наночастиц получены путем точного контроля молярного отношения между защищающим олигонуклеотидом и захватывающим мишень олигонуклеотидом с последующей эффективной очисткой. Вследствие того, что максимальное расстояние (расстояние зазора) между поверхностью Au-наночастицы (AuNP) и Cy3 молекулы еще оставалось равным 7,5 нм, его необходимо было уменьшить, чтобы обеспечить увеличенное электромагнитное усиление. Серебряную нанооболочку наносили, потому что серебро усиливает SERS сигналы в несколько раз больше, чем золото.
Подробно, ДНК, связанную с димерами наночастиц, покрывали серебром посредством хорошо известного процесса осаждения серебряной оболочки в наномасштабе (Chem. Comm. 2008, J. Phys. Chem. B 2004, 108, 5882-5888) на поверхности Au-наночастицы, чтобы сократить расстояние между наночастицами, что ведет к усилению SERS-сигналов. В отношении этого 250 мкм раствор димера Au-наночастиц реагировал с различными количествами раствора AgNO3 [10-3M] при комнатной температуре в течение 3 часов в присутствии 100 мкл поливинилпирролидона в качестве стабилизатора и 50 мкл L-аскорбата натрия [10-1M] в качестве восстановителя в 0,3 M растворе PBS. Толщина Ag оболочки Au-Ag окклюдантных наночастиц составляла ~3 нм, ~5 нм и ~10 нм при использовании 30 мкл, 40 мкл, и 70 мкл раствора AgNO3 [10-3M], соответственно. Таким образом, синтезировали таргетные, связанные с олигонуклеотидом Au-Ag окклюдантные гетеродимерные наноструктуры с толщиной оболочки ~3 нм, ~5 нм и ~10 нм.
Золотую наночастицу (15 нм) для зонда A функционализировали двумя видами 3′-тиол-модифицированных олигонуклеотидов таким образом, что одну захватывающую мишень последовательность прикрепляли к поверхности золотой наночастицы. Кроме того, золотую наночастицу (30 нм) для зонда B функционализировали двумя видами 5′-тиол-модифицированных олигонуклеотидов. Молярные отношения этих двух видов последовательностей (защитная последовательность/захватывающая мишень последовательность) были 99:1 для ядра A и 199:1 для ядра B. Эти отношения были приняты для модификации одного захватывающего мишень олигонуклеотида на зонд на основе емкости ДНК, зависящей от размера наночастиц (фиг.1). Важно отметить, что захватывающую мишень последовательность для зонда B помечали на конце посредством Cy3, который служил рамановской меткой. Чтобы устранить мономер наночастицы, к которому не прикреплены никакие захватывающие мишень последовательности, олигонуклеотид-модифицированные зонды A и B очищали посредством процесса магнитного разделения. Тозил-модифицированные магнитные частицы (диаметр 1 мкм, Invitrogen) функционализировали посредством амин-модифицированных таргетных олигонуклеотидных последовательностей, комплементарных к захватывающим мишень последовательностям для ядер A и B соответственно. Только частицы ядер, имеющие захватывающие мишень последовательности, связанные с ними, могли бы быть разделены магнитными частицами. Кроме того, очищенные растворы зондов A и B гибридизовали достаточным количеством таргетной последовательности в 0,3 M PBS.
Кроме того, получали олигонуклеотид-модифицированные димеры Au-Ag окклюдантных наночастиц, меченные молекулой, активной в отношении рамановского рассеяния, FAM или Dabcyl.
ПРИМЕР 2: Спектроскопия в УФ- и видимой области и HR-TEM анализ изображений
Образование димеров Au-наночастиц (в качестве молекулы, активной в отношении рамановского рассеяния, использовали Cy3) верифицировали посредством спектроскопии в УФ- и видимой области и изображений трансмиссионного электронного микроскопа высокого разрешения (HRTEM) (фиг.2). УФ- и видимый спектры демонстрируют очень малое красное смещение после образования димера, что согласуется с ранее сообщенными результатами Oaul Alivisatos, et al. (Angew chem. 1999,38(12), 1808). Фиг.2A представляет стандартные HR-TEM изображения димеров Au-наночастиц. Посредством статистического анализа, по меньшей мере, 200 частиц выявлено, что 25% частиц существовали в качестве мономера и 65% частиц существовали в качестве димера, и менее чем 10% существовали в качестве мультимера (тримера, тетрамера и т.д.). Межчастичное расстояние между золотыми частицами было равно около 2-3 нм по измерению HR-TEM. В растворе (0,3M PBS) межчастичное расстояние было ~15 нм, что, как ожидалось, должно было быть намного длиннее, чем в обезвоженных условиях. Кроме того, серебряные наночастицы вводили в наномасштабе на поверхность димера Au-наночастицы посредством хорошо известного способа (Chem. Comm. 2008, J. Phys. Chem. B 2004, 108, 5882-5888) на поверхности Au-наночастицы, чтобы уменьшить расстояние между наночастицами, что ведет к усилению SERS-сигналов (см. пример 1). Au-Ag окклюдантные мономеры с толщиной Ag-оболочки ~3 нм и ~10 нм (1a и 1b на фиг.2C) также синтезировали из очищенного раствора зонда B (30 нм AuNP) при сходных условиях. Спектры УФ- и видимой области из индивидуальных растворов разделяли на пике плазмонного резонанса -400 нм соответственно толщине оболочки. Фиг.2C представляет HR-TEM изображения, полученные от индивидуальных Au-Ag окклюдантных гетеродимеров с диаметром 26-36 нм (фиг.2C-2), 30-40 нм (фиг.2C-3) и 40-50 нм (фиг.2C-3) для набора двух сфер окклюдантных наночастиц. Фиг.2C-1a и 1b представляют HR-TEM изображения, полученные от индивидуальных Au-Ag окклюдантных мономеров с диаметром 40 нм (толщина оболочки = 5 нм, 2C-1a) и 50 нм (толщина оболочки = 10 нм, 2C-1b).
Кроме того, мономерные и димерные окклюдантные наноструктуры (с использованием Cy3 в качестве молекулы, активной в отношении рамановского рассеяния) измеряли посредством SERS/AFM. В стандартном эксперименте аликвоты (20 мкл) растворов Au-Ag окклюдантного гетеродимера промывали посредством повторного центрифугирования (8,000 об/мин, 20 мин, три раза), наносили посредством центрифугирования на стеклянные подложки, покрытые поли-L-лизином, промывали много раз водой Nanopure и просушивали на воздухе. Сразу же после получения образцы измеряли посредством AFM и SERS. SERS-спектры записывали с использованием AFM-связанного нанорамановского микроскопа, оборудованного инвертированным оптическим микроскопом (Axovert 200, Zeiss), и пьезоэлектрический двухкоординатный сканер (Physik Instrument) применяли с использованием независимого самодельного сканирующего контроллера. Применяли 514,5 нм линейный аргоново-ионный лазер (Melles Griot) в качестве источника возбуждения, объединенного с одномодальным оптическим волокном. Установили дихроичное зеркало (520DCLP, Chroma Technology Corp.), чтобы направить возбуждающий лазерный луч от 50 нВт до 1 мВт в масляную иммерсию объектива микроскопа (x100, 1,6 NA, Zeiss), который фокусировал луч на дифракционно-ограниченную точку (250 нм) на верхней поверхности покровного стекла. AFM (Bioscope, Digital Instruments, Veeco Metrology Group) с контроллером Nanoscope IV установили на микромеханическом столе. Полуконтактный режим модуля AFM на столе оптического микроскопа применяли для корреляции сигнала рамановского рассеяния с топографическим изображением AFM с точностью перекрытия менее 100 нм. Фокальная точка лазера в точности совпадала с центром верхушки для симметричного рассеяния на конце верхушки AFM. Фоновые сигналы рамановского рассеяния собирали на охлажденном жидким азотом (-125°C) CCD (прибор с зарядовой связью). Спектры рассеяния образца были записаны в диапазоне 500-2,000 см-1, при одном захвате, накопление 1 сек и 400 мкВт. Все данные откорректированы посредством вычитания фоновых сигналов из Si.
ПРИМЕР 3: AFM (Атомная силовая микрография) анализ Au-Ag окклюдантных наночастиц
На фиг.3A представлены изображения AFM (1×1 мкм) окклюдантных мономерных и гетеродимерных наноструктур (с использованием Cy3 в качестве молекулы, активной в отношении рамановского рассеяния), которые совпадают по форме и диаметру с изображениями HR-TEM. На фиг.3B представлены коррелированные SERS-спектры от соответствующих единичных частиц, изображенных посредством AFM на фиг.3A. Не было детектировано никаких сигналов рамановского рассеяния для мономерных Au-Ag окклюдантных наночастиц с 5 нм (фиг.3A-1) и 10 нм (фиг.3A-2) серебряными оболочками соответственно, потому что у них нет горячих точек и есть только одна Cy3 молекула на частицу. Гетеродимеры Au-наночастиц без Ag оболочек или с расстоянием зазора менее 1 нм между ними не демонстрирует также никакого SERS-сигнала. Это происходит из-за недостаточного электромагнитного усиления в условиях возбуждения лазером 514,5 нм. При толщине Ag оболочки менее 3 нм (фиг.3A-4) не детектировали никакие сигналы рамановского рассеяния даже после использования повышенной мощности падающего лазерного луча 200 мкВт). Эти результаты указывают на то, что тонкая серебряная оболочка (<3 нм) не могла бы вызвать достаточного электромагнитного возбуждения при SERS.
В противоположность этому, когда толщина Ag оболочки была ~5 нм (фиг.3A-5), наблюдали сильный сигнал SERS от Cy3 метки, расположенной в соединении двух окклюдантных частиц. Характерные пики рамановского рассеяния для красителя Cy3, хотя низкие по интенсивности, наблюдали при 1,470 и 1,580 см-1, характерные для фингерпринт спектров, от 514,5 нм лазерного возбуждения. Низкая интенсивность этих пиков возможно обусловлена присутствием только одной молекулы в пределах области горячего соединения и относительно низкой лазерной мощности (100 мкВт) по сравнению с интенсивностью мощности, применяемой в других SERS-исследованиях единичных молекул (Science 1997. 275(5203), 1102, Phys rev lett 1997, 78(9), 1667, Nano lett 2006, 6(1) 2173, Nano lett DOI: 10,1021/ni803621x). Сигналы получали от различных видов так же, как от олигонуклеотид-модифицированных Au-наночастиц. На фиг.3C представлено сравнение SERS-спектров Cy3-модифицированных олигонуклеотидов (5-HS-(CH2)6-A10-PEG18-ATCCTTATCAATATTAAA-Cy3-3′, 1 нМ, красная линия) с теми олигонуклеотидами, свободными от Cy3 (5-HS-(CH2)6-A10-PEG18-ATCCTTATCAATATTAAA-3′, 1 нМ, черная линия), в агрегированных Ag коллоидах. SERS-спектры на фиг.3C (черная линия) представляют преимущественные адениновые пики (734 см-1, 1320 см-1) над другими базовыми основаниями из-за обогащения адениновым основанием (в качестве спейсерной последовательности применяли А10) (JACS 2008, 130(16), 5523). Важно отметить, что самый низкий предел детектирования для неадениновых ДНК оснований, сообщаемый до сих пор, находится в субмикромолярном диапазоне (JACS, 2006, 128, 15580). Однако относительно сильные сигналы получали при 1,470 см-1 и 1,580 см-1, характерных для молекулы Cy3, как показано на SERS-спектрах на фиг.3С (красная линия) (Anal chem. 2004, 76, 412-417). Известно, что рамановская интенсивность и спектральные позиции молекулы Су3 колеблются со временем, и рамановские спектры отличаются для каждой наблюдаемой наноструктуры (J. Phys. Chem. B 2002, 106, 8096). Таким образом, спектральные паттерны являются сравнимыми, но не полностью сходными с сообщенными ранее. Независимо от толщины оболочки никакие наблюдения от детектируемых SERS сигналов от Au-Ag окклюдантных мономеров в экспериментальных условиях не указывали на то, что только Cy-молекулы, локализованные в межчастичном соединении, могли вызывать SERS-пики при 1,470 и 1,580 см-1. Как показано в рамановских спектрах, полученных от окклюдантных димеров с толщиной оболочки ~10 нм (фиг.3A-6), преимущественные адениновые пики наблюдали при 734 см-1 и 1320 см-1 наряду с Cy3 пиком при 1,480 см-1. Интенсивность рамановского рассеяния от других наночастиц не наблюдали в специфической форме. Толстая Ag оболочка могла компенсировать молекулы Cy3, которые вызывали несоответствующее электромагнитное усиление.
ПРИМЕР 4: Анализ SERS-спектров от димеров Au-Ag окклюдантных наночастиц в соответствии с поляризацией падающего лазерного луча
Большинство димеров окклюдантных наночастиц с толщиной оболочки ~5 нм (с использованием Cy3 в качестве рамановской активной молекулы) продемонстрировало детектируемые SERS-сигналы от единичных молекул, как показано на фиг.4A и 4B. Принимая во внимание, что падающий лазерный луч неточно поляризовался на межчастичных осях димера (панели 1-5 на фиг.4A), детектируемые SERS-сигналы от каждого из перпендикулярно поляризуемых димеров наночастиц наблюдали на той же поверхности. Однако на фиг.5C представлены только малые пики при 1,470 см-1, потому что ориентация димера приблизительно перпендикулярна падающему лучу. В настоящем документе выявлено, что димеры окклюдантных наночастиц с оптимизированной толщиной оболочки могли бы быть структурами горячих точек, весьма подходящих для детектирования единичной молекулы ДНК.
В результате экспериментов известно, что двухпозиционное мерцающее поведение включено-выключено наблюдают при детектировании единичной молекулы (фиг.5A) (J. Phys. Chem. B2002, 106, 8096). Отсутствие рамановской интенсивности продолжается в течение 10 сек, после чего рамановская интенсивность находится в положении ВКЛЮЧЕНО. Это циклическое явление включено-выключено может повторяться несколько минут, в течение которых сигналы окончательно исчезают из интенсивного поля. Флуктуацию SERS-интенсивности наблюдали на второй временной шкале вследствие броуновского движения вокруг горячей точки. Эти явления мерцания и флуктуации соответствовали предыдущим сообщениям.
На фиг.5C и 5D представлена зависимость поляризации падающего лазерного луча от рамановских сигналов для Au-Ag окклюдантного димера. Все спектры получены посредством 514,5 нм возбуждения лазера, накопления 20 сек и мощности лазера 40 мкВт. Максимальные пики Cy3 наблюдали, когда падающий лазерный луч был поляризован параллельно продольной оси гетеродимера. Когда лазерный луч вращали на 20-90° от продольной оси Cy3, сигнал постепенно ослаблялся. Пики рамановского рассеяния исчезали, когда лазерный луч поляризовали перпендикулярно продольной оси (т.е. 90° и 270°). Фактор усиления (EF) при 1,580 см-1 горячей точки в димерной наноструктуре рассчитывали в соответствии со следующим уравнением.
EF= (I sers×N bulk)/(I bulk×N molecule),
где Isers и Ibulk представляют одну и ту же интенсивность полос для SERS и bulk спектров соответственно, Nbulk является числом плотности массы молекул в массе образца, Nmolecule является числом плотности Cy3 в SERS-спектрах (Nmolecule=1). Наиболее сильную полосу спектра прочитывали при областях 1,580 см-1, так что ее применяли при интенсивности для Isers и Ibulk. Таким образом, EF горячей точки по расчетам была 2,7×1012.
С другой стороны, высокочувствительные SERS-спектры были детектированы от димеров наночастиц, модифицированных олигонуклеотидами, меченными FAM и Dabcyl, как описано для Cy3. Таким образом, димерные наноструктуры и способ получения в соответствии с настоящим изобретением применимы к обычным рамановским активным молекулам.
Хотя предпочтительные варианты осуществления настоящего изобретения были описаны для показательных целей, специалисты в данной области оценят, что различные модификации, дополнения и замены возможны без отклонения от объема и сущности изобретения, как описано в прилагаемой формуле изобретения.
Китай Полиизоцианатный сшиватель для полиуретановой системы PU Резина димерная TDI аналог Addoink TT / Thanecure T9 Поставщики, Фабрика — Цена и предложение & Бесплатный образец
ГЛОПУ-ТТ 2,4-диоксо-1,3-диазетидин-1,3-бис (метил-м-фенилен) диизоцианат
CAS: 26747-90-0
Описание
Сшиватель для термоактивированного полиуретанового клея, покрытий, эластомера
Вулканизирующий агент для специальных измельчаемых полиуретановых каучуков
GLOPU-TT представляет собой димерный 2,4-толуолдиизоцианат (TDI) бифункциональный изоцианат при температуре до 130 ° C, это соединение расщепляется на две молекулы TDI при температуре выше 140 ° C или в отсутствие некоторых аминовых катализаторов. Хотя он остается бифункциональным, но с молекулярным весом 174, центральная группа уретдиона расщепляется с образованием мономерного TDI. 10 мкм с анти-слеживающим агентом, имеет задержку при комнатной температуре.
СПЕЦИФИКАЦИЯ
вид | Белый до ярко-желтого порошка |
Содержание мономера (TDI) | Менее 0,1% |
Температура деблокирования | Мин.145 ° C |
Содержание NCO вес / вес | Прибл. 24% |
Размер частиц 98,0% | Максимум. 10 мкм |
Летучие | Максимум. 0,5% |
заявка
Вулканизующий агент для полиуретановых каучуков, таких как Urepan 600, особенно когда требуется высокая твердость. включает в себя промышленные формованные детали, ролики, формы для керамической плитки
Сшиватель для термоактивируемого полиуретанового клея, покрытий или эластомерных систем
Упаковка и хранение
— 10 кг / коробка, волоконный барабан или подгонять
— Хранить в запечатанном виде в оригинальной упаковке в прохладном и сухом месте, срок хранения не должен превышать 6 месяцев.
Для получения дополнительной информации о GLOPU-TT, пожалуйста, оставьте сообщение, и мы получим вам быстрый ответ
Hot Tags: полиизоцианатный сшиватель для полиуретановой системы полиуретановая резина димерный аналог tdi addoink tt / thanecure t9, Китай, поставщики, завод, купить, цена, предложение, бесплатный образец, сделано в Китае
Димерные взаимодействия и образование комплексов с использованием прямых коэволюционных связей
Холмс, К. К., Попп, Д., Гебхард, В. и Кабш, В. Атомная модель актинового филамента. Nature 347, 44–49 (1990).
ADS CAS PubMed Google ученый
Рейслер Э. Молекулярная структура и функция актина. Curr Opin Cell Biol. 5, 41–47 (1993).
CAS PubMed Google ученый
Домингес, Р.И Холмс, К. С. Структура и функции актина. Анну. Rev. Biophys 40, 169–186 (2011).
CAS PubMed PubMed Central Google ученый
Caudron, N., Arnal, I., Buhler, E., Job, D., Valiron, O. Зарождение микротрубочек из стабильных олигомеров тубулина. J. Biol. Chem. 277, 50973–50979 (2002).
CAS PubMed Google ученый
Бермудес, Д., Хинкль, Г. и Маргулис, Л. Содержат ли прокариоты микротрубочки? Microbiol. Ред. 58, 387–400 (1994).
CAS PubMed PubMed Central Google ученый
Bieniossek, C. et al. Молекулярная архитектура металлопротеиназы FtsH. Proc. Natl. Акад. Sci. USA 103, 3066–3071 (2006).
ADS CAS PubMed Google ученый
Лангклотц, С., Baumann, U. & Narberhaus, F. Структура и функция бактериальной протеазы AAA FtsH. Bba-Mol. Клетка. Res. 1823. С. 40–48 (2012).
CAS Google ученый
Ли, К. А. Семейства димерных факторов транскрипции: для танго нужны двое, но кто выбирает партнеров и место встречи? J. Cell. Sci. 103 (Pt 1) , 9–14 (1992).
CAS PubMed Google ученый
Клемм, Дж.Д., Шрайбер, С. Л. и Крэбтри, Г. Р. Димеризация как регуляторный механизм передачи сигнала. Анну. Rev. Immunol. 16. С. 569–592 (1998).
CAS PubMed Google ученый
Али, М. Х. и Империали, Б. Олигомеризация белка: как и почему. Биоорган. Med. Chem. 13, 5013–5020 (2005).
CAS Google ученый
Мэтьюз, Дж. М., Димеризация и олигомеризация белков в биологии (под ред.Мэтьюз, Дж. М.) гл. 1, 1–18 (Springer: New York, 2012).
Google ученый
Исполатов И., Юрьев А., Мазо И. и Маслов С. Связывающие свойства и эволюция гомодимеров в сетях межбелкового взаимодействия. Nucleic Acids Res. 33, 3629–3635 (2005).
CAS PubMed PubMed Central Google ученый
Моркос, Ф., Хва, Т., Онучич, Дж.N. & Weigt, M. Прогнозирование структуры белка, Методы молекулярной биологии, 3-е изд. 1137 (изд. Kihara, D.) Ch. 5, 55–70 (Humana Press, 2014).
Google ученый
Экеберг, М., Ловквист, К., Лан, Й. Х., Вейгт, М. и Аурелл, Э. Улучшенное предсказание контактов в белках: использование псевдодостоверностей для вывода моделей Поттса. Phys. Ред. E 87 (2013).
Камисетти, Х., Овчинников, С. и Бейкер, Д. Оценка полезности основанных на коэволюции прогнозов контакта остатков с остатками в эпоху, когда много последовательностей и структур.Proc. Natl. Акад. Sci. USA 110, 15674–15679 (2013).
ADS CAS PubMed Google ученый
Локлесс, С. В. и Ранганатан, Р. Эволюционно консервативные пути энергетической связи в семействах белков. Science 286, 295–299 (1999).
CAS Google ученый
Лю, З., Чен, Дж. И Тирумалай, Д. О точности вывода энергетической связи между удаленными сайтами в семействах белков из эволюционных отпечатков: Иллюстрации с использованием решетчатой модели.Proteins Struct. Func. Биоинф 77, 823–831 (2009).
CAS Google ученый
Дима Р. и Тирумалай Д. Определение сети остатков, регулирующих аллостерию в семействах белков, с использованием анализа последовательностей. Protein Sci. 15. С. 258–268 (2006).
CAS PubMed PubMed Central Google ученый
Сулковска, Дж. И., Моркос, Ф., Вейгт, М., Хва, Т.И Онучич, Дж. Н. Прогнозирование структуры с помощью геномики. Proc. Natl. Акад. Sci. USA 109, 10340–10345 (2012).
ADS CAS PubMed Google ученый
Marks, D. S. et al. Трехмерная структура белка рассчитана на основе изменения эволюционной последовательности. PLoS ONE 6, e28766 (2011 г.).
ADS CAS PubMed PubMed Central Google ученый
Хопф, Т.A. et al. Трехмерные структуры мембранных белков из геномного секвенирования. Cell 149, 1607–1621 (2012).
CAS PubMed PubMed Central Google ученый
Morcos, F. et al. Анализ прямого связывания при коэволюции остатков фиксирует нативные контакты во многих семействах белков. Proc. Natl. Акад. Sci. USA 108, E1293–1301 (2011).
CAS PubMed Google ученый
Тейлор, В.Р., Джонс, Д. Т. и Садовски, М. I. Топология белка на основе предсказанных контактов остатков. Protein Sci. 21. С. 299–305 (2012).
CAS PubMed Google ученый
Kloczkowski, A. et al. Подход к прогнозированию структуры белков на основе матрицы расстояний. J. Struct. Funct. Геномика 10, 67–81 (2009).
CAS PubMed PubMed Central Google ученый
Ву, Д., Цуй, Ф., Джерниган, Р. и Ву, З. PIDD: база данных для межатомного распределения белков. Nucleic Acids Res. 35, D202–207 (2007).
CAS PubMed Google ученый
Халаби, Н., Ривуар, О., Лейблер, С., Ранганатан, Р. Белковые секторы: эволюционные единицы трехмерной структуры. Cell 138, 774–786 (2009).
CAS PubMed PubMed Central Google ученый
Моркос, Ф., Jana, B., Hwa, T. и Onuchic, J. N. Коэволюционные сигналы в клонах белков помогают улавливать множественные конформации белков. Proc. Natl. Акад. Sci. USA 110, 20533–20538 (2013).
ADS CAS PubMed Google ученый
Weigt, M., White, R.A., Szurmant, H., Hoch, J. A. & Hwa, T. Идентификация прямых контактов остатков в межбелковом взаимодействии посредством передачи сообщений. Proc. Natl. Акад. Sci. США 106, 67–72 (2009).
ADS CAS PubMed Google ученый
Schug, A., Weigt, M., Onuchic, J. N., Hwa, T. & Szurmant, H. Белковые комплексы высокого разрешения на основе интеграции геномной информации с молекулярным моделированием. Proc Natl Acad Sci USA 106, 22124–22129 (2009).
ADS CAS PubMed Google ученый
Procaccini, A., Lunt, B., Szurmant, H., Hwa, T.И Вейгт, М. Анализ специфичности белок-белкового взаимодействия в бактериальной двухкомпонентной передаче сигналов: сироты и перекрестные помехи. PLoS one 6, e19729 (2011).
ADS CAS PubMed PubMed Central Google ученый
Ченг, Р. Р., Моркос, Ф., Левин, Х. и Онучич, Дж. Н. К рациональному изменению конструкции бактериальных двухкомпонентных сигнальных систем с использованием коэволюционной информации. Proc. Natl. Акад. Sci. USA 111, E563–571 (2014).
ADS CAS PubMed Google ученый
Тамир С. и др. Интегрированная стратегия выявляет белковый интерфейс между мишенями рака Bcl-2 и NAF-1. Proc. Natl. Акад. Sci. USA 111, 5177–5182 (2014).
ADS CAS PubMed Google ученый
Яна, Б., Моркос, Ф. и Онучич, Дж. Н. От структуры к функции: конвергенция структурных моделей и коэволюционная информация.Phys. Chem. Chem. Phys. 16. С. 6496–6507 (2014).
CAS PubMed Google ученый
Овчинников, С., Камисетти, Х. и Бейкер, Д. Надежное и точное предсказание остаточных взаимодействий на границах раздела белков с использованием информации об эволюции. Элиф 3, e02030 (2014).
PubMed PubMed Central Google ученый
Пирс, Б., Тонг, В. и Венг, З.M-ZDOCK: основанный на сетке подход для стыковки симметричных мультимеров с Cn. Биоинформатика 21, 1472–1478 (2005).
CAS PubMed Google ученый
де Врис, С. Дж., Ван Дейк, М. и Бонвин, А. М. Веб-сервер HADDOCK для биомолекулярной стыковки, управляемой данными. Nat. Протокол 5, 883–897 (2010).
CAS PubMed Google ученый
Mukherjee, S. & Zhang, Y.Прогнозирование структуры белково-белковых комплексов с помощью многопоточности и матричной рекомбинации. Структура 19, 955–966 (2011).
CAS PubMed PubMed Central Google ученый
Ким, С. К. и Якобсон, К. А. Расчетное прогнозирование гомодимеризации аденозинового рецептора A3. J. Mol. График. Модель 25, 549–561 (2006).
CAS PubMed PubMed Central Google ученый
Ла, Д., Конг, М., Хоффман, В., Чой, Ю. И. и Кихара, Д. Прогнозирование постоянных и временных межбелковых интерфейсов. Proteins 81, 805–818 (2013).
CAS PubMed PubMed Central Google ученый
Эскивель-Родригес, Дж., Филос-Гонсалес, В., Ли, Б. и Кихара, Д. Парный и мультимерный белок-белок стыковка с использованием пакета программ LZerD. Методы Мол. Биол. 1137, 209–234 (2014).
CAS PubMed Google ученый
Чжэн, W., Шафер, Н. П., Давтян, А., Папоян, Г. А., Волинс, П. Г. Прогнозирование энергетических ландшафтов для белковой ассоциации. Proc. Natl. Акад. Sci. USA 109, 19244–19249 (2012).
ADS CAS PubMed Google ученый
Miyashita, N., Straub, J. E., Thirumalai, D. & Sugita, Y. Трансмембранные структуры димера белка-предшественника амилоида, предсказанные с помощью моделирования молекулярной динамики обмена репликами. Варенье. Chem.Soc. 131, 3438–3439 (2009).
CAS PubMed PubMed Central Google ученый
Сгуракис, Н. Г. и Гарсиа, А. Э. Мембранный комплекс трансдуцина и темного родопсина демонстрирует динамику границы раздела с большой амплитудой в субмикросекундной шкале времени: выводы из моделирования МД всех атомов. J. Mol. Биол. 2010. Т. 398. С. 161–173.
CAS PubMed Google ученый
Сгуракис, Н.Дж., Патель, М. М., Гарсия, А. Е., Махатадзе, Г. И. и МакКаллум, С. А. Конформационная динамика и структурная пластичность играют решающую роль в распознавании убиквитина UIM-домена. J Mol Biol 396, 1128–1144 (2010).
CAS PubMed PubMed Central Google ученый
Ламмерт, Х., Шуг, А. и Онучич, Дж. Н. Надежность и обобщение структурных моделей сворачивания и функции белков. Proteins Struct.Func. Биоинф 77, 881–891 (2009).
CAS Google ученый
Моркос, Ф., Шафер, Н. П., Ченг, Р. Р., Онучич, Дж. Н. и Волинс, П. Г. Коэволюционная информация, ландшафты сворачивания белков и термодинамика естественного отбора. Proc. Natl. Акад. Sci. USA 111, 12408–12413 (2014).
ADS CAS PubMed Google ученый
Лауб, М. Т.И Гулиан, М. Специфичность в путях передачи двухкомпонентного сигнала. Анну Рев Жене 41, 121–145 (2007).
CAS PubMed Google ученый
Хох, Дж. А. Двухкомпонентная и фосфорелейная передача сигналов. Curr. Opin. Microbiol. 3. С. 165–170 (2000).
CAS PubMed Google ученый
Фабрет К., Фехер В. А. и Хох Дж. А. Двухкомпонентная передача сигнала в Bacillus subtilis: как один организм видит свой мир.J. Bacteriol. 181. 1975–1983 (1999).
CAS PubMed PubMed Central Google ученый
Баххават, П., Свапна, Г. В., Монтелионе, Г. Т. и Сток, А. М. Механизм активации транскрипционного фактора PhoB, предполагаемый различными способами димеризации в неактивном и активном состояниях. Структура 13, 1353–1363 (2005).
CAS PubMed PubMed Central Google ученый
Кинг-Скотт, Дж.и другие. Структура полноразмерного регулятора ответа Mycobacterium tuberculosis в стабилизированном трехмерном активированном состоянии с заменой домена. J. Biol. Chem. 282, 37717–37729 (2007).
CAS PubMed Google ученый
Sola, M., Gomis-Ruth, F. X., Serrano, L., Gonzalez, A. & Coll, M. Трехмерная кристаллическая структура приемного домена фактора транскрипции PhoB. J. Mol. Биол. 285. С. 675–687 (1999).
CAS PubMed Google ученый
Baumkotter, F. et al. Димеризация белка-предшественника амилоида и синаптогенная функция зависят от связывания меди с доменом, подобным фактору роста. J. Neurosci. 34. С. 11159–11172 (2014).
PubMed PubMed Central Google ученый
Баулак, С., ЛаВой, М. Дж., Стрейл, Дж., Шлосмахер, М. Г. и Ся, В. Димеризация вызывающего болезнь Паркинсона DJ-1 и образование высокомолекулярных комплексов в мозге человека.Мол. Клетка. Neurosci. 27, 236–246 (2004).
CAS PubMed Google ученый
Томпа П., Туснади Г. Э., Фридрих П. и Саймон И. Роль димеризации в репликации прионов. Биофиз. J 82, 1711–1718 (2002).
CAS PubMed PubMed Central Google ученый
Чжэн В., Шафер Н. П. и Волинс П. Г. Ландшафты свободной энергии для инициации и разветвления агрегации белков.Proc. Natl. Акад. Sci. USA 110, 20515–20520 (2013).
ADS CAS PubMed Google ученый
Finn, R.D. et al. База данных семейств белков Pfam. Nucleic Acids Res. 38, D211–222 (2010).
CAS PubMed Google ученый
Финн, Р. Д., Клементс, Дж. И Эдди, С. Р. Веб-сервер HMMER: интерактивный поиск сходства последовательностей. Nucleic Acids Res.39, W29–37 (2011).
CAS PubMed PubMed Central Google ученый
Fraczkiewicz, R. & Braun, W. Точный и эффективный аналитический расчет доступных площадей поверхности и их градиентов для макромолекул. J. Comput. Chem. 19, 319–333 (1998).
CAS Google ученый
Берман, Х. М. и др. Банк данных о белках. Nucleic Acids Res.28. С. 235–242 (2000).
ADS CAS PubMed PubMed Central Google ученый
Бордоли, Л. и Шведе, Т. Автоматическое моделирование структуры белка с помощью SWISS-MODEL Workspace и портала моделей белков. Методы Мол. Биол. 2012. Т. 857. С. 107–136.
CAS PubMed PubMed Central Google ученый
Ноэль, Дж. К., Уитфорд, П. К., Санбонмацу, К.Y. & Onuchic, J. N. SMOG @ ctbp: упрощенное развертывание структурных моделей в GROMACS. Nucleic Acids Res. 38, W657–661 (2010).
CAS PubMed PubMed Central Google ученый
Pronk, S. et al. GROMACS 4.5: высокопроизводительный и высокопараллельный набор инструментов молекулярного моделирования с открытым исходным кодом. Биоинформатика 29, 845–854 (2013).
CAS PubMed PubMed Central Google ученый
Димеризация — обзор | Темы ScienceDirect
7.3 Димеризация и белок-белковые взаимодействия
Димеризация важна для активности цитидиндезаминаз и ADAT, таких как ADAT2 / 3 и TadA. Имеются многочисленные сообщения о роли димеризации в реакциях ADAR [200–202]. Однако вопрос о том, требуется ли димеризация для активности ADAR, все еще обсуждается. Сообщалось, что ADAR димеризуются как РНК-зависимым, так и РНК-независимым образом [154,200,201]. Кроме того, существуют противоречивые сообщения о том, существует ли очищенный человеческий ADAR2 в основном в виде мономера или димера в растворе [121, 202, 203].Хотя данные в литературе ясно подтверждают вывод, что ADARs способны к самоассоциации и формированию олигомерных состояний, не так ясно, важна ли эта олигомеризация для активности редактирования. Например, каталитический домен ADAR2 человека был кристаллизован с субстратами РНК в каталитически релевантной конформации в виде комплекса 1: 1 [121]. Однако мутант с усечением dADAR, который сохраняет способность связывать РНК, но не может образовывать димеры, теряет свою ферментативную активность, предполагая, что димеризация необходима для правильной активности ADAR [200].Возможно, что для активности полноразмерных ADAR требуется димеризация. Однако, учитывая большую поверхность контакта РНК каталитического домена ADAR и относительно короткие субстраты, которые могут реагировать с ADAR полной длины, маловероятно, что, если димеризация необходима, все возможные поверхности контакта РНК (т.е. четыре или шесть dsRBD и два каталитических домена) могут взаимодействовать с субстратом РНК во время реакции.
Сообщалось также, чтоADAR образуют гетеродимеры. ADAR1 и ADAR2 могут образовывать гетеродимеры в клетках человека [204, 205], что может приводить к подавлению активности редактирования.Экспрессия ADAR1 повышена в астроцитах, что ведет к вмешательству в активность ADAR2, вероятно, за счет гетеродимеризации ADAR1-ADAR2 [205]. В Drosophila melanogaster , dADAR гетеродимеризуется с неактивным белком, который ингибирует редактирование [200].
Функция ADAR также регулируется многими другими белками посредством прямого физического взаимодействия. Например, в C. elegans ADR-2-связывающий белок 1 (ADBP-1) физически взаимодействует с ADR-2 и способствует локализации ADR-2 в ядре [206].У мутанта adbp-1 не было обнаружено редактирование РНК A-to-I, что позволяет предположить, что ADBP-1 необходим для активности ADR-2 по редактированию РНК. В другом случае Drosophila fragile X homolog (dFMR1) взаимодействует с dADAR, и потеря или сверхэкспрессия dFMR1 влияет на эффективность редактирования некоторых мишеней dADAR [207]. Более того, регуляция с помощью Jun N-терминальной киназы (JNK) участвует в усиленной глюкозой экспрессии ADAR2 [208]. В недавнем скрининге активирующих ADAR белков было идентифицировано несколько энхансеров редактирования, включая DSS1 / SHFM1, компонент протеасомной субъединицы [161].Однако неизвестно, имеет ли он прямое взаимодействие с ADAR.
Подвижность интерфейса между мономерами в димерной бычьей АТФ-синтазе участвует в ультраструктуре внутренних митохондриальных мембран
Комплексы АТФ-синтазы, встроенные во внутренние мембраны митохондрий (IMM), представляют собой вращающиеся машины, которые заставляют АТФ поддерживать жизнь (1). Энергия дыхания генерирует протонную движущую силу (ПДС) через IMM, и эта ПДС прикладывается непосредственно к встроенному в мембрану секторе ротора АТФ-синтазы через цепочку молекул воды Гроттуса, тем самым создавая вращающий момент для поворота ротора. синтетическое направление вращения (2).У млекопитающих этот мембранный сектор ротора состоит из кольца из восьми c-субъединиц и прикреплен к внемембранному центральному стеблю субъединиц γ, δ и ε, который проникает во внемембранный α 3 β 3 -каталитический домен ок. На расстоянии 90 Å от мембранного домена (2, 3). Три из шести границ раздела между α- и β-субъединицами содержат каталитические сайты фермента, и, когда ротор поворачивается с шагом 120 ° во время цикла вращения, эти сайты претерпевают серию структурных изменений, которые, в свою очередь, связаны со связыванием субстратов, а также образование и высвобождение АТФ из каждого сайта (4).Каталитический домен также прикреплен к мембранному домену через периферический стержень (PS), удлиненный стержень, который достигает ок. 150 Å между каталитическим доменом и поверхностью ИММ (2, 5, 6). Сердцевина стержня представляет собой длинную α-спираль bh4, которая проходит между α 3 β 3 -каталитическим доменом и IMM, а затем проникает и пересекает IMM, чтобы достичь межмембранного пространства (IMS). а затем возвращается в митохондриальный матрикс через второй трансмембранный промежуток. Внешняя часть мембраны bh4 поддерживается и в значительной степени ригидизирована с помощью других α-спиралей в субъединицах d и F 6 и во внешней области мембраны субъединицы ATP8, все связанные приблизительно параллельно внешней области мембраны bh4.Верхняя часть стержня прикрепляется через C-концевую α-спираль субъединицы b, bh5 к C-концевому домену субъединицы OSCP, а N-концевой домен этой субъединицы связывается с N-концевыми областями три α-субъединицы. Два домена OSCP соединены гибким линкером, который обеспечивает PS универсальным соединением. Во время вращающегося каталитического цикла домен α 3 β 3 качается из стороны в сторону, как отмечалось ранее (7⇓⇓ – 10), с небольшим смещением или без смещения перпендикулярно поперечному движению PS к центру. ось ротора (2), и PS компенсирует это качательное движение за счет комбинированного действия универсального шарнира и шарнира в PS вблизи поверхности IMM (2).Связанный с мембраной N-концевой участок субъединицы b свернут в две дополнительные α-спирали, bh2 и bh3, и вместе с трансмембранным доменом bh4 они образуют каркас клиновидной структуры в мембранном домене (2), с bh2, сидящим сверху на матричной стороне IMM, и трансмембранными α-спиралями bh3 и bh4, образующими угол прибл. 45 °. Дополнительные субъединицы e, f и g также вносят свой вклад в структуру клина. Трансмембранные α-спирали eh2 и gh4 субъединиц e и g дополняют α-спираль bh3, а вершина клина на матричной стороне мембраны представлена четырьмя амфипатическими α-спиралями, по две в каждой из субъединиц g и f. , лежащая в области головной группы липидов.Внутренние полости в клине заняты пятью специфически связанными липидами, тремя кардиолипинами (CDL1, CDL2 и CDL3) и двумя менее четко определенными фосфолипидами, предположительно смоделированными как фосфатидилглицерины (LHG4 и LHG5). Эти фосфолипиды повышают стабильность клина (2). Субъединица j связана с клином, а в димерном комплексе две субъединицы j взаимодействуют друг с другом через поверхность раздела мономер-мономер. В IMM димерные комплексы АТФ-синтазы занимают вершины крист, а димеры расположены длинными рядами вдоль вершин крист (11-13).Как димеры удерживаются вместе в высших олигомерах, неясно, но белок-белковые взаимодействия в мембранных доменах димеров могут обеспечивать интердимерные связи (2, 14). Если способность мономерных комплексов образовывать димеры удаляется, например, путем удаления одного из компонентов клина, структура IMM резко изменяется, и трубки крист исчезают (15⇓⇓⇓⇓⇓ – 21). Таким образом, димеризация АТФ-синтазы, по-видимому, является определяющим фактором образования крист. Эти динамические комплексы АТФ-синтазы действуют в постоянно меняющемся структурном контексте самих митохондрий.Органеллы постоянно модифицируются путем деления митохондриальных сетей и слияния везикулярных митохондрий под влиянием, например, клеточных условий, таких как энергетическое состояние, клеточный цикл или проапоптотические факторы или факторы гибели клеток (22). События слияния и деления включают изменения как во внутренней, так и во внешней мембранах, в последнем случае снова влияя на структуру крист и расположение димерных комплексов АТФ-синтазы внутри них. Во время этих динамических событий и в условиях активного клеточного роста IMM должен оставаться связанным с синтезом АТФ.Следовательно, чтобы оставаться активной, димерная АТФ-синтаза должна не только приспосабливаться к изменениям на границе раздела мономер-мономер, которые возникают непосредственно из ее собственной каталитической активности, но также и к другим изменениям, которые происходят из динамики самой органеллы, и не диссипировать pmf за счет утечки протонов через границу раздела мономер-мономер. При томографических реконструкциях крист митохондрий наблюдались зигзагообразные, латеральные изгибы, перпендикулярная кривизна и неоднородная упаковка рядов димеров АТФ-синтазы (12, 17, 23), что свидетельствует о широком диапазоне различных режимов олигомеризации, при которых происходит процесс олигомеризации. Действуют комплексы АТФ-синтазы.
Как показано здесь, взаимодействие между двумя клиньями, связывающими мономеры в димерной АТФ-синтазе, не является постоянной характеристикой. Он изменяется, чтобы приспособиться как к колебательным движениям внешнего каталитического домена мембраны, связанным с катализом, так и к другим движениям, которые не зависят от катализа, наблюдаемого в изолированной димерной АТФ-синтазе. Эти вращательные движения и скользящие трансляции между мономерными комплексами являются внутренними особенностями димерной АТФ-синтазы. Они позволяют ему работать в постоянно меняющейся ультраструктуре IMM, а также вносить свой вклад в их ультраструктуру.
Результаты и обсуждение
Классификация димерных частиц бычьей АТФ-синтазы.
Как описано ранее, были собраны три набора данных о 4267, 2238 и 4096 дозо-фракционированных воздействиях очищенной димерной бычьей АТФ-синтазы, и структуры мономерного фермента были получены с помощью анализа одной частицы с координатами 176 710 частиц (2). Хотя каждый мономер ингибируется мономерной формой белка-ингибитора, IF 1 , ингибитор имеет захваченные димерные состояния, в которых каждый мономерный каталитический домен содержит одни и те же три точки вращения в активном каталитическом цикле.Положение этих трех точек вращения относительно периферической ножки приводит к возникновению трех состояний интактной мономерной АТФ-синтазы, названных s1, s2 и s3. Были построены полные структуры мономерного комплекса (2), и путем объединения состояний s1, s2 и s3 ( SI Приложение , Таблица S1) были построены модели димерных комплексов в диапазоне комбинаций каталитических состояний и подсостояний ( SI Приложение , Схема S1 и Таблица S2). Подсостояния возникают в результате изменений, которые не зависят от катализа в относительном расположении двух мономеров друг к другу ( SI Приложение , Схема S2).Путем иерархической классификации более раннего набора данных ( SI Приложение , схема S1) и последующего уточнения 154 130 частиц были разделены на девять дискретных классов димерной сборки, представляющих вращательные состояния [s1: s1], [s1: s2], [s1: s3], [s2: s1], [s2: s2], [s2: s3], [s3: s1], [s3: s2] и [s3: s3] с разрешением 9.2, 11.9, 9.0, 9.4, 8,5, 10,7, 9,7, 11,4 и 13,1 Å соответственно. Составные модели димеров были созданы путем подгонки твердого тела карт и соответствующих атомных координат (2) в эти огибающие с более низким разрешением.Дальнейшая классификация частиц в каждом каталитическом состоянии ( SI Приложение , схема S2) выявила 59 дополнительных подсостояний димера с разрешением от 13,8 до 23,8 Å. Подсостояния отличаются от дискретных классов димерной сборки в определенных состояниях вращения последовательными буквами и сгруппированы в соответствии с каталитическим состоянием. Например, первое, второе и третье подсостояния димера АТФ-синтазы, в которых правый и левый мономеры находятся в каталитических состояниях 1 и 3, соответственно, называются димерными подсостояниями [s1: s3a], [s1: s3b] , и [s1: s3c].
Изменения границы раздела мономер-мономер во время катализа.
В димерном комплексе граница раздела мономер-мономер в мембранном домене состоит из контактов между двумя субъединицами j, каждая на внешней поверхности клина (Рис. 1 и SI Приложение , Рис. S1 A ). Из остатков 1-20 субъединица j свернута в амфипатическую α-спираль jh2, которая лежит в области головной липидной группы на матричной стороне IMM, где она взаимодействует с C-концевой областью трансмембранной α-спирали A6Lh2 и CDL1. .Отрицательно заряженная головная группа CDL1 связана с jK8, а также с остатками fQ38 и fY42 субъединицы f в клине и остатками aT33 и A6LK27 и A6LK30 ( SI Приложение , фиг. S1 B ). Трансмембранная α-спираль jh3 (с остатками 22–39, образующими трансмембранный промежуток) расположена рядом с A6Lh2 на противоположной стороне от ah2 клина и связана с субъединицей a через взаимодействия между ее N-концевой областью и остатками 107–108, 110 –111 и 114–115 из ah5 ( SI Приложение , рис.S1 A и B ). С-концевой участок jh3 (остатки 40–49) выступает в IMS. Остатки j50–60 не моделировались, так как они не были четко определены в реконструкциях криоэлектронной микроскопии. Предполагается, что они будут иметь расширенную структуру ( SI Приложение , рис. S2), которая взаимодействует с той же областью в соседней субъединице j, на что указывают структуры димеров в различных вращательных состояниях и многих их подсостояниях, где плотность за пределами смоделированных остатков ( SI Приложение , рис.S1 D — F ). Однако взаимодействия между двумя субъединицами j являются мобильными, и наблюдаемый угол между центральными осями центрального стебля или PS мономеров колеблется от прибл. От 75 до 86 ° в девяти вращательных каталитических состояниях (фильмы S1 и S2). Этот диапазон углов возникает из-за того, что твердое тело клина и остальной части мембранного домена поворачивается вокруг точек контакта между амфипатическими α-спиралями jh2 (остатки 1–20), обеспечиваемыми остатками 3, 7, 10, 11 и 14. (Рис.2 и 3 и SI Приложение , рис. S1). Две α-спирали jh2 ориентированы в плоскости IMM на стороне матрицы, поскольку фермент искажается во время цикла вращения (рис. 1 и 2 и Movie S3). Остатки 3, 7, 10, 11 и 14 в jh2 выступают к границе раздела, возможно, взаимодействуя через промежуточный липид. Это вращение уменьшает чистое смещение каталитического домена из стороны в сторону, возникающее из-за вращения асимметричной центральной ножки, и приспосабливает другие изменения в структуре динамических крист митохондрий.
Рис. 1.Структура бычьей АТФ-синтазы и границы раздела мономер-мономер в мембранных доменах димеров. ( A и B ) Структуры и состав субъединиц мономера бычьей АТФ-синтазы во вращательном состоянии 3 (код 6ZQN (2) банка данных белка [PDB]) и димера в состоянии [s1: s1] (PDB ID код 7AJB), соответственно, показаны как молекулярные поверхности без растворителя. Димер s1: s1 был создан стыковкой двух мономеров s1 (код PDB ID 6ZPO) в карту димеров s1: s1 с более низким разрешением.Субъединицы α, β, γ, δ и ε каталитического домена F 1 красного, желтого, синего, индиго и зеленого цвета соответственно с центральным стержнем (субъединицы γ, δ и ε), прикрепленным к c 8 кольцо (темно-серое) в мембранном домене, контактирующем с субъединицей А или АТФ6 (васильковый синий). Субблоки PS OSCP, b, d и F 6 имеют бирюзовый, светло-розовый, оранжевый и пурпурный цвета соответственно, а субъединица A6L — кирпично-красного цвета. В области границы раздела мономер-мономер субъединицы e, f, g, j и k имеют цвет хаки, соломенно-желтый, лесной зеленый, морской пены зеленый и темно-розовый соответственно.Кардиолипин (CDL) и фосфатидилглицерин (LHG) прозрачно-серого цвета. В A мономерный комплекс рассматривается в двух повернутых положениях, чтобы выявить положения всех субъединиц, при этом оси вращения выровнены вертикально. I обозначает остатки 1–60 белка-ингибитора IF 1 . В B димер рассматривается изнутри плоскости IMM. ( C и D ) Растворитель исключал молекулярные поверхности субъединиц в мембранных доменах димерных комплексов, просматриваемых между двумя периферическими ножками.( C ) Комплекс рассматривается со стороны матрицы IMM с границами раздела мономер: мономер, обозначенными белой пунктирной линией. Черная пунктирная линия обозначает границу белка между мономерами, прилегающую к области, занятой неспецифическими липидами и мицеллой детергента (серая заливка). ( D ) Ортологическое изображение в плоскости IMM с границами раздела мономер: мономер, открытыми удалением субъединиц e, g и d. Углы между осями вращения в каждом мономере, указанном ниже, оценивали путем вычисления двух центроидов для остатков 2 и 38 в каждом кольце с 8 крупного рогатого скота.Ось, соединяющая два центроида, приближается к оси вращения c-кольца. Центроиды и соединительные оси были рассчитаны с помощью набора инструментов Structure Measurements в Chimera (35). Угол пересечения измерялся для моделей, выровненных по этим осям, перпендикулярным направлению обзора.
Рис. 2.Поворот мембранных доменов бычьей АТФ-синтазы вокруг матричного контакта между j-субъединицами во время синтеза АТФ. Субъединица j имеет зеленый цвет морской пены внутри черного ящика.Цвета других субъединиц см. В легенде на рис. ( A ) Димер состояния [s3: s1]. Пунктирными линиями обозначена центральная ось амфипатических α-спиралей jh2 (остатки 1–19), лежащих в плоскости листка матрикса мембраны. Во время синтетического вращательного цикла каждый мономер переходит из состояния 1 в состояние 2, в состояние 3 и так далее. ( B ) Вращение мембранного домена вокруг точки контакта в jh2 во время перехода из состояния [s3: s1] в состояние [s1: s2] с сопутствующим смещением субъединиц e, f и g и трансмембранного α -спирали bh3 (остатки 33–47) и bh4 (остатки 55–73), перемещая клин наружу или внутрь, как показано стрелками.Внешние мембранные домены F 1 остаются примерно неподвижными, а раскачивающее движение, связанное с асимметрией центральной ножки, передается в мембранный домен через универсальное соединение между N- и C-концевыми доменами OSCP в PS (2 ). ( C ) Подобное поворотное движение происходит при переходе из состояния [s1: s2] в состояние [s2: s3]. ( D ) Завершение кругового цикла переходом из состояния [s3: s1] в состояние [s1: s2]. Синтетический вращательный цикл продолжается через B , как показано стрелкой справа.Схема была построена с использованием составных атомных моделей мономерной бычьей АТФ-синтазы, которые были жестко подогнаны к консенсусным димерным структурам, полученным в соответствии с SI Приложение , Схема S1. Эта цифра относится к фильму S3. Как на этом рисунке, так и в Movie S3, боковые цепи были удалены, а элементы вторичной структуры были расширены, чтобы получить схематический характер фигуры, который выводится из структур с более низким разрешением интактного димерного комплекса.
Рис.3.Связь между наклонным клином мембраны в домене мономерной мембраны и объединением двух мономеров в димер. Показан димер в состоянии [s2: s2]. Кольцо c 8 серое, а трансмембранные α-спирали bh3 и bh4 субъединицы b (розовые) определяют угол клина (2). Остальная часть конструкции показана силуэтом. ( A ) Вид сбоку, показывающий взаимосвязь между углами осей вращения и углами клина при измерении от одной и той же контрольной точки с обеими осями вращения, выровненными в плоскости.Угол между bh3 и bh4 на этом виде составляет 33 °, примерно половину угла димера. Указана приблизительная граница мембраны; в B, ось вращения выровнена вертикально, и структура поворачивается так, что bh3 и bh4 в клине правого мономера находятся в плоскости бумаги. Угол клина 45 ° является мерой наклона трансмембранной α-спирали bh3 относительно bh4 и оси вращения фермента, необходимой для того, чтобы клин обеспечивал кривизну мембраны в мембранном домене каждого мономера.Для перспективы обозначена приблизительная граница нижнего листочка. ( C и D ) Виды сверху, показывающие различия между плоскостями измерения угла, чтобы объяснить, почему простое удвоение угла клина не дает угла оси вращения. В контексте угловых вариаций, наблюдаемых в консенсусных реконструкциях, угол клина и димер, или ось вращения, угол являются отдельными соображениями. Угол клина не меняет, скорее, способ расположения мембранных доменов относительно друг друга, как показано на рис.2 и Movie S3.
Изменения на границе раздела мономер-мономер, не связанные с катализом.
Другие изменения в движении, происходящие в группах частиц определенного каталитического состояния, являются подсостояниями, не зависящими от катализа. Они делятся на две категории: те, где угол между осями вращения меньше 90 ° (фильм S4), и другие, где угол больше 90 ° (фильмы S5 и S6). Движения в первой категории аналогичны тем, которые происходят во время катализа, в том, что относительное расположение мембранных доменов изменяется поворотным движением вокруг поверхности раздела между j субъединицами, при этом С-концевые выступы IMS остаются в контакте.Гибкость этого стержня является внутренним свойством интерфейса, и у него есть другие роли, помимо описанных выше, по рассеиванию раскачивания каталитического домена в митохондриальных кристах. В частности, он обеспечивает механизм для обеспечения общей текучести мембраны в области кривизны, связанной с димерными АТФ-синтазами и происходящими перестройками. Вторая категория движений между подсостояниями, где угол между осями вращения превышает 90 °, возникает из-за скольжения и скручивания вдоль границы раздела мономер-мономер, представленной субъединицами a и j и мембранным клином, тем самым вызывая сложное вращение одного мономера относительно к другому (рис.4 и фильмы S4 и S5). Например, на рис. 4, где сравниваются структуры димеров АТФ-синтазы в подсостояниях [s2: s2c] и [s2: s2b], позиции выступа субъединицы j в IMS и области петли ( остатки 12-19) в субъединице а значительно различаются в двух структурах (Movies S5 и S6). В подсостоянии [s2: s2c] C-концевые остатки субъединицы j находятся в контакте в IMS, как на фиг. 4 C . Напротив, в подсостоянии [s2: s2b] эти остатки замещены на ca.20 Å, и две петли, состоящие из остатков 12–19 субъединицы a, по-видимому, контактируют друг с другом, как на рис. 4 D . Это сложное твердотельное вращение мономеров значительно изменяет угол между осями вращения, а также перестраивает амфипатические α-спирали, лежащие в створке IMS мембраны (рис. 4 и видеоролики S5 и S6). В IMM это преобразование может быть частью механизма для димеров и олигомерных рядов, чтобы адаптироваться к извилинам крист, с двумя положениями контакта, представляющими простой стерический механизм, который ограничивает вращение до верхних и нижних пределов.В этом механизме широкоугольная конформация (как наблюдается в подсостоянии [s2: s2b]; см. Рис. 4 B , D и F ) находится в положении, где две субъединицы a находятся в контакте, и предотвращено дальнейшее расширение с помощью ah2, а конформация с малым углом (например, подсостояние [s2: s2c] на рис. 4 A , C и E ) лежит в положении, где два j субъединицы находятся в контакте в IMS. Вероятно, между двумя крайностями существует континуум подсостояний.Конформеры с малыми углами между осями вращения ок. От 76 ° до 86 ° были наиболее часто наблюдаемые подсостояния ( SI Приложение , Рис. S3 и Схема S2). Высокая динамическая природа димерного комплекса продемонстрирована компиляцией всех наблюдаемых конформеров в Movie S7.
Рис. 4.Расположение субъединиц a и j на границе раздела мономер-мономер димерной бычьей АТФ-синтазы на самых узких и самых широких концах углов между осями вращения. Субъединицы a, j и k имеют синий, зеленый и розовый цвет соответственно, а кольца c 8 серые.( A и B ) Виды со стороны матрицы IMM на интерфейсы мономер-мономер в мембранных доменах димеров крупного рогатого скота с углами между осями вращения, составляющими прибл. 76 ° и ок. 95 ° соответственно. В A и B , соответственно, показаны димерное подсостояние [s2: s2c] ( SI Приложение , схемы S1 и S2) и димерное подсостояние [s2: s2b] ( SI Приложение , Схема S2). в качестве примеров. Положение субъединиц e, f, g и мембранного домена субъединицы b показано серым силуэтом.Для ясности удалены домены F 1 и все субъединицы PS. ( C — F ) Схематическое изображение границ раздела мономер-мономер, рассматриваемое в C и D , как в A и B , соответственно, и в E и F , ортогональных к плоскость мембраны. В E стрелка указывает взаимодействие между C-концевыми остатками двух субъединиц j. В F стрелка указывает на возможное взаимодействие остатков 12-19 в петле, идущей от αh2 субъединицы α.В C и D изогнутые стрелки указывают приблизительное сложное вращение мембранных доменов, которое происходит при изменении угла оси вращения между подсостояниями димера. Эта цифра относится к фильмам S5 и S6.
Не исключено, что широкоугольные подсостояния с углами оси вращения больше прибл. 95 °, что значительно отличается от консенсусных структур с углами оси вращения прибл. 76–86 °, возникают из-за влияния мицеллы детергента и отсутствия взаимодействий между димерами, которые происходят в нативных мембранах.В изогнутых мембранах расчетное натяжение прибл. 10 мН / м действует на механочувствительные каналы (24, 25), и возможно, что сила митохондриальных липидов на вершинах крист стабилизирует границу раздела димеров, и in situ эта латеральная сила может уменьшить диапазон движения, наблюдаемый в изолированных мономерах. Субтомографические реконструкции димерных АТФ-синтаз из митохондрий млекопитающих, где углы оси вращения ок. Сообщалось, что 80 ° представляют собой средние структуры многих отдельных молекул или субтомограмм в пределах данных (12), аналогично согласованному димеру в SI Приложение , Схема S1.Следовательно, они не исключают возможность больших вариаций угла оси вращения, особенно если эти конформации возникают редко, например, в ультраструктурах крист с резкой отрицательной кривизной, или во время динамических перестроек крист, и действительно, димерные подсостояния с более широкие углы встречаются относительно редко ( SI Приложение , Рис. S3 C и D и Схема S2). Хотя неясно, встречаются ли эти подсостояния с очень широким углом оси вращения в нативных мембранах, поскольку анализ проводился на изолированных димерах, данные убедительно свидетельствуют о том, что границы раздела между мономерами в значительной степени динамичны и что этот динамизм является общим свойством интерфейса. , связанные с движениями фермента, которые зависят и не зависят от катализа.Действительно, этот динамизм, который проявляется как симметрия псевдос2 относительно границы раздела димеров, потребовал определенных стратегий уточнения, чтобы предотвратить вращение ориентации частиц вокруг оси псевдос2, чтобы изолировать и впоследствии поддерживать каталитически однородные подмножества частиц во время дальнейшей перестройки частиц ( SI Приложение , схема S1). Следовательно, во время обработки изображения каждому мономеру было присвоено произвольное обозначение «левый или« правый »по отношению к одному направлению обзора, и, например, димеры состояния [s1: s2] и состояния [s2: s1] различны и не представляют одно и то же молекулярное состояние.
Взаимодействие димеров.
Проблема того, как димерные АТФ-синтазы взаимодействуют друг с другом в длинных рядах, которые формируются вдоль вершин крист в IMM, не может быть решена окончательно с помощью текущего исследования структуры изолированных димеров крупного рогатого скота. Однако структуры и другая информация предполагают, как димерные АТФ-синтазы могут разумно образовывать тетрамеры и высшие олигомеры, вовлекая гомовзаимодействия между двумя копиями каждой из субъединиц g и k.В димерной структуре крупного рогатого скота субъединица g из 102 аминокислотных остатков свернута в три α-спирали, gh2 (остатки 20–36), gh3 (остатки 42–60) и gh4 (остатки 69–93), с трансмембранным gh4 увеличение скелета клина, а также амфипатические gh2 и gh3, связанные с вершиной клина на матричной стороне IMM. В димерном комплексе два gh3 обладают способностью связываться друг с другом через границу раздела димер-димер и связывать димеры вместе, как показано на рис. 5, со слабыми взаимодействиями через границу раздела димер-димер между остатками gQ50, gK53 и gK54 в каждом протомере (см. рис.6), обеспечивая потенциальную молекулярную основу для необходимых элементов скольжения, трансляции и вращения для генерации широкого диапазона структур крист, которые наблюдались в митохондриях. Такой жидкостный интерфейс позволил бы, например, длинным рядам олигомеров АТФ-синтазы следовать кривизне вдоль вершин крист (Рис. динамика крист. Эта текучесть показана на рис.5 B , где димеры АТФ-синтазы следуют кривизне IMM вдоль оси, показанной на фиг. 5 C и D . Текучесть границы раздела димер-димер может позволить либо вращение вокруг фиксированной точки контакта между субъединицами g, либо смещать контакт и перемещать димеры в сторону (Fig. 7 A ). Эти корректировки междимерных контактов и их комбинации могут порождать ряд олигомерных расположений, которые выводятся здесь из геометрических соображений и представления димеров АТФ синтазы в томографических реконструкциях митохондриальных крист.Они включают в себя неоднородную упаковку (рис. 7 B — G ), где вращение вокруг фиксированной точки контакта вызывает боковые изгибы в рядах олигомеров (если смотреть сверху; см. Рис. 7 F и G ), и где контактная дислокация позволяет димерам складываться в компактную структуру (фиг. 7 C и E ) или образовывать шахматные ряды (фиг. 7 D ). Эти структуры геометрически ограничены в кристах сферическими каталитическими доменами фермента.Утончение отпечатка мембранного домена димера, если смотреть сверху или снизу мембраны, в результате изменения угла между осями вращения, как описано в фильмах S5 и S6, помещает соседние каталитические домены ближе друг к другу и, следовательно, ограничивает степень боковой кривизны олигомерного ряда. Такой подвижный контакт также обеспечивает положительную и отрицательную кривизну вдоль рядов крист (рис. 5 C и D ) и, в различных комбинациях с дислокациями, вызывает зигзагообразные, боковые изгибы, перпендикулярную кривизну и неоднородная упаковка.Ряды олигомеров могут также пластически деформироваться, подобно проволоке якоря в модели скульптуры, обеспечивая прочность для поддержания вершины крист на больших расстояниях, одновременно позволяя формироваться различным типам ультраструктуры, таким как боковые и перпендикулярные изгибы. Многие из этих договоренностей наблюдались при томографических реконструкциях крист (12, 17, 23).
Рис. 5.Приспособление димерной АТФ-синтазы к кривизне мембраны в кристах митохондрий вдоль оси олигомеризации через гибкие интердимерные контакты.( A ) Вид, ортогональный плоскости IMM, димера бычьей АТФ-синтазы в состоянии [s1: s1]. Серые треугольники представляют мономеры, движущиеся вперед и назад как твердые тела за счет вращения вокруг точки контакта в j субъединицах; оси вращения обоих мономеров выровнены в одной плоскости, а стрелка указывает диапазон углов между осями вращения. ( B ) Вид сбоку, параллельный плоскости IMM, двух мономеров в тетрамерном расположении двух соседних димеров, образованных через контакты между субъединицами g.Стрелки указывают независимые направления их каталитических доменов при вращении вокруг этой точки. ( C и D ) Вид, аналогичный B , с доменами F 1 в силуэте, показывающими, как изменения на границе раздела между димерами (красный прямоугольник) позволяют изогнутой ультраструктуре развиваться вдоль вершин кристы. Цвета субъединиц указаны в легенде на рис.
Рис. 6.Крупный план границы димер-димер в возможной тетрамерной бычьей АТФ-синтазе.Взаимодействия показаны как молекулярная поверхность между субъединицами g в двух соседних димерах, если смотреть изнутри митохондриального матрикса между осями периферических ножек, как на рис. 7 B — G . Части каталитических доменов, расположенные над плоскостью просмотра, показаны серой прозрачностью. Серая пунктирная линия указывает приблизительную границу раздела тетрамеров, окруженных липидами. ( A ) Вращение димеров относительно друг друга, как показано стрелками, вокруг точки контакта между двумя субъединицами g, выделенными красным кружком.Ключевые отрицательные и положительные полярные остатки обозначены синими и красными точками соответственно. ( B ) Контактное смещение границы раздела между субъединицами g, как показано стрелками. Возможные положения перемещенных областей показаны на прозрачной подложке. Остаток W30 может участвовать в гидрофобном взаимодействии типа «ручки в отверстия» с участками gh2, которые богаты остатками лейцина и изолейцина. Дополнительные полярные остатки в gh2 и gh3 обозначены цветными точками. Субъединицы e, f, g, j и k имеют цвет хаки, соломенно-желтый, лесной зеленый, морской пенистый зеленый и розовый, соответственно.Кольцо c 8 серое.
Рис. 7.Возможные способы ассоциации димерных бычьих АТФ-синтаз в кристах. ( A ) Ряд димеров при осмотре сверху вершин крист. В двух верхних комплексах серые трапеции представляют отдельные димеры, движущиеся как твердые тела; в двух нижних комплексах индивидуальные димеры транслируются, как показано стрелками, через интерфейс димер-димер в синем поле. ( B – G ) Влияние трансляции или вращения димеров на дальний порядок олигомерных рядов.В B ряды димеров, расположенные напротив друг друга, обеспечивают простейшую архитектуру прямых и плоских олигомеров. ( C — E ) Эффекты дислокации взаимодействия g-g на границе раздела между двумя димерами. В C и E компактные ряды димеров, расположенные спиной к лицевой стороне, образуются с диапазоном наклона относительно перпендикулярной оси, или, в D , в виде чередующегося «зигзагообразного» расположения. ( F и G ) Изгиб рядов олигомеров в поперечном направлении путем вращения вокруг фиксированной точки в контакте g-g.Более сложные устройства могут быть предусмотрены комбинацией эффектов в B – G с дополнительной возможностью изгиба мембраны положительно вдоль оси олигомеризации, как на фиг. 5 D . Цвета субъединиц указаны в легенде на рис.
Также возможно, что субъединица k может участвовать в связывании димеров вместе. В процессе сборки близкородственного фермента человека эта субъединица последней включается в комплекс, а в клетках человека, выращенных в гликолитических условиях, субъединица k превращается быстрее, чем другие субъединицы фермента, которые превращаются вместе. медленнее (26).Эти наблюдения привели к предположению, что субъединица k может участвовать в механизме ремоделирования IMM (26). Частичная структура крупного рогатого скота k совместима с этим предложением. В димерном бычьем комплексе остатки 12–47 из 57-остатков субъединицы k были разрешены (2). N-концевая область k-субъединицы свернута в короткую α-спираль, kh2, от остатков 14 до 17 и связана с kh3 петлей (остатки 18–23). За этой областью следует единственная трансмембранная α-спираль, kh3, от остатков с 24 до 44, которая связана с субъединицей a через взаимодействия с ah5 и aH5.С-концевой участок (остатки 45-57) субъединицы k находится в IMS и, как предполагается, будет удлинен. Таким образом, возможно, что в IMM эта расширенная область может контактировать с C-концевой областью субъединицы g через интерфейс димер-димер. Расстояние между k- и g-субъединицами в соседних димерах уменьшается с увеличением угла между осями вращения в димере. Перестройка клиновидных субъединиц вдоль границы раздела димеров, сопровождающаяся изменениями осей вращения, как показано в фильмах S5 и S6, сужает мембранный след димера, тем самым сближая соседние димеры.
Влияние белка-ингибитора IF
1 .Был описан другой способ взаимодействия двух димеров АТФ-синтазы, где два неактивных димера связаны в тетрамеры АТФ-синтаз свиньи (14) и овцы (27) двумя димерными молекулами IF 1 , расположенными между глобулярными F 1 домены через интерфейс между двумя димерными АТФ-синтазами. Однако мембранные домены тетрамера свиньи были неправильно истолкованы (2), но в исправленной структуре (2), а в структуре димерного фермента овцы (27) субъединицы g из соседних димеров контактируют поверх матричная сторона мембраны через gh3 и предыдущую петлю (остатки 39–53), мембранные домены субъединиц е находятся в тесном контакте, а остатки 13 и 14 субъединицы k взаимодействуют с gh2 на матричной стороне мембраны (2 ).Кроме того, его неразрешенный конец C может взаимодействовать с субъединицами g и a на стороне IMS IMM. Эти тетрамерные звенья требуют, чтобы каталитические состояния соседних димеров были [s1: s3] и [s3: s1] или наоборот.
Физиологическое значение этого неактивного тетрамера неясно. Тетрамеры свиней и овец очищали из митохондрий, выделенных из сердец животных. Следовательно, эти эксперименты не предоставляют информации о том, сосуществуют ли активные димеры, описанные здесь, и эти неактивные тетрамеры в одной митохондрии.Сосуществование активных димеров и неактивных димеров в одной митохондрии можно представить в двух случаях. Во-первых, отдельные кристы внутри митохондрии могут иметь разные мембранные потенциалы (28). Следовательно, как синтез АТФ активными димерами, так и гидролиз АТФ с последующим ингибированием IF 1 и образованием тетрамеров могут происходить одновременно в разных кристах одной и той же митохондрии. Во-вторых, если преобладающие физиологические условия привели к активированным димерам IF 1 , но, несмотря на его очевидное изобилие в митохондриях (29), было недостаточно активного IF 1 для ингибирования гидролитического действия димерных АТФ-синтаз, тогда эта ситуация может привести к смеси активных димеров АТФ-синтазы в гидролитическом режиме и ингибировать димеры внутри тетрамеров.
Независимо от этих физиологических соображений, структуры свободных димеров и эквивалентных димеров в тетрамерах существенно различаются, и, например, угол между осями вращения мономеров в каждом димере в тетрамерах составляет 112–116 °, тогда как он составляет ок. 76–95 ° в свободных димерах. Этот более широкий угол между мономерами в димерах внутри тетрамеров сопровождается изгибом наружу каждой оси вращения и значительной перестройкой границы раздела между мономерами в димерах (граница раздела сжимается, чтобы обеспечить тесную ассоциацию каталитических доменов, что в противном случае стерически запрещено. субъединицей g).Мембранный домен тетрамера претерпел структурную перестройку, при которой отдельные мономерные мембранные домены, по-видимому, свернулись внутрь: см. Изменение наклона колец c 8 ( SI Приложение , Fig. S4). Кроме того, связывание соседних каталитических доменов с помощью IF 1 вызывает скручивание в доменах F 1 и PS, наклон осей вращения, сопровождаемый сужением мембранного домена в димерной единице ( SI Приложение , рис.S5). Это изменение в мембранных доменах могло возникнуть из-за эффектов экстракции комплексов из мембраны детергентами и потери эндогенных липидов ( SI Приложение , Рис. S4). Таким образом, возможно, что связывание двух димеров IF 1 с образованием тетрамеров АТФ-синтазы происходит во время этой процедуры экстракции, и что образование тетрамеров является артефактом. Релаксация наклонной геометрии соседних димеров и границы раздела димер-димер в тетрамерах свиньи и овцы невозможна из-за непосредственной близости каталитических доменов, и это предотвращает образование плоских олигомерных рядов.Напротив, модели олигомеризации активных димеров, предложенные здесь, позволяют формировать разнообразные олигомерные структуры, необходимые для создания геометрии IMM. Кроме того, они совместимы с текучестью границы раздела димеров, наблюдаемой в структурах димеров крупного рогатого скота (Fig. 4 and Movies S4-S7). Эти модели олигомеризации активных димеров несовместимы с образованием неактивных тетрамеров ( SI Приложение , рис. S6). Изменения в архитектуре мембранных доменов в тетрамерных структурах создают жесткую кривизну вдоль оси олигомеризации, несовместимую с ультраструктурами IMM, наблюдаемыми с помощью томографии (12, 17, 23), а тетрамерные структуры препятствуют текучести в олигомерные ряды наблюдаются in vivo.Таким образом, эта конформация маловероятна с учетом более широкой пластичности IMM, особенно поскольку ассоциация in silico тетрамерных комплексов ведет к замкнутой петле в пределах шести димерных единиц ( SI Приложение , Fig. S7).
Один из возможных способов связывания димерного IF 1 , который до сих пор не рассматривался в контексте возможного влияния белка-ингибитора на топографию крист, заключается в том, что одна из двух его активных ингибирующих областей может связываться с Комплекс АТФ-синтазы в гидролитическом режиме, оставляя вторую ингибирующую область несвязанной и неспособной вставлять себя в каталитический сайт во второй копии фермента.Действительно, такое состояние может быть довольно распространенным, поскольку ингибитор может связываться со всеми тремя возможными состояниями фермента, s1, s2 и s3, и не ограничиваться перекрестным связыванием соседних состояний s1 и s3. В отличие от сшивания двух димеров, обсужденных выше, такой способ связывания вряд ли будет иметь большое влияние на ультраструктуру крист.
Заключительные замечания.
АТФ-синтазы млекопитающих являются высококонсервативными по составу и последовательностям их субъединиц, и, следовательно, природа ассоциации между мономерами в димерных единицах также будет сохранена.Точно так же состав и структура АТФ-синтаз у дрожжей и грибов во многом напоминают ферменты млекопитающих (30, 31). Напротив, структуры более далеких АТФ-синтаз, описанные недавно (32–34), сильно отличаются от ферментов млекопитающих. Например, их области PS намного сложнее и жестче, чем у млекопитающих, и их кристы, вероятно, будут иметь свойства, сильно отличающиеся от описанных здесь. Выяснение молекулярных основ взаимодействий димеров АТФ-синтаз в митохондриальных кристах млекопитающих, а также у более отдаленных видов требует дальнейших исследований с помощью томографии митохондриальных мембран.
Границы | Структура и взаимодействия димерного варианта sHIP, нового детерминанта вирулентности Streptococcus pyogenes
Введение
Streptococcus pyogenes , также известный как стрептококки группы А (ГАЗ), является важным патогеном человека, который поражает и колонизирует кожу и верхние дыхательные пути, вызывая относительно легкие клинические состояния, такие как импетиго и фарингит. Некоторые инфекции, вызванные инвазивными штаммами, такие как штамм AP1 серотипа M1, могут приводить к тяжелым и потенциально опасным для жизни заболеваниям, таким как некротический фасциит и синдром токсического стрептококкового шока (STSS), тогда как острая ревматическая лихорадка и гломерулонефрит являются последствиями острого заболевания. С.pyogenes инфекции. С . pyogenes вызывает около 700 миллионов случаев легких и неинвазивных инфекций каждый год, из которых ~ 650 000 прогрессируют до тяжелых инвазивных инфекций со смертностью не менее 25% (Carapetis et al., 2005; Ralph and Carapetis, 2013) . S. pyogenes продуцирует ряд белков, которые позволяют бактерии прикрепляться к тканям хозяина, уклоняться от иммунного ответа и распространяться, проникая в слои ткани хозяина. Эти факторы вирулентности представляют собой преимущественно секретируемые или ассоциированные с поверхностью белки, и они включают семейство белков M (Lancefield, 1962; Swanson et al., 1969; Phillips et al., 1981), фибронектин-связывающие белки (Talay et al., 1994; Kreikemeyer et al., 1995; Jaffe et al., 1996; Courtney et al., 1999; Rocha and Fischetti, 1999; Terao et al. ., 2001), суперантигенные экзотоксины (Stevens et al., 1989; Abe et al., 1991; Tomai et al., 1992; Mollick et al., 1993; Norrby-Teglund et al., 1994) и секретируемый стрептококковый ингибитор комплемента, называемый белком SIC (Åkesson et al., 1996; Fernie-King et al., 2002; Frick et al., 2003).
В недавнем исследовании мы количественно проанализировали и сравнили S.pyogenes в среде роста вирулентного для мышей штамма (AP1) с невирулентным штаммом (SF370). Мы обнаружили, что один белок, в частности, присутствовал в значительно более высоких уровнях в стационарной питательной среде вирулентного штамма. Количество sHIP в средней фракции аналогично секретируемому митогенному экзотоксину SmeZ (Kamezawa et al., 1997) и демонстрирует общий профиль содержания, напоминающий профиль, наблюдаемый для поверхностно-ассоциированных белков H и M1 (Lancefield, 1962; Åkesson et al., al., 1990; Wisniewska et al., 2014). Используя масс-спектрометрический анализ аффинности плазмы крови человека, мы смогли продемонстрировать, что новый бактериальный белок взаимодействует с антимикробным человеческим белком, богатым гистидином, гликопротеином (HRG), и имеет название sHIP ( s treptococcal H istidine -богатый гликопротеин I , взаимодействующий с ротином P ) (Wisniewska et al., 2014). HRG представляет собой обильный гликопротеин плазмы с массой примерно 60 кДа, который взаимодействует с несколькими другими белками-лигандами, такими как тропомиозин, гепарин, плазминоген, плазмин, фибриноген и IgG (Jones et al., 2005). Было показано, что HRG обладает широким антимикробным действием (Rydengård et al., 2007), включая активность против S. pyogenes (Shannon et al., 2010). Было показано, что sHIP связывает как интактные HRG, так и производные HRG пептиды (пептиды, содержащие согласованные гепарин-связывающие последовательности) с высокой аффинностью. Более того, антибактериальная активность HRG блокируется белком sHIP, который представляет собой новый механизм, который может способствовать вирулентности бактерий AP1. Кроме того, мы смогли показать, что пациенты с тяжелой формой болезни S.pyogenes , в отличие от пациентов с поверхностными и неосложненными инфекциями, более склонны к выработке антител против sHIP, что предполагает, что sHIP представляет собой новую детерминанту вирулентности (Wisniewska et al., 2014). Более того, определение трехмерной структуры sHIP показало, что он имеет тетрамерную организацию, состоящую из четырех мотивов спираль-петля-спираль. Аналогичную структурную единицу можно найти в факторе адгезии FadA из Fusobacterium nucleatum .Однако эти два белка значительно различаются по своей олигомерной организации. В FadA мотивы спираль-петля-спираль образуют удлиненные волокна, тогда как мономеры sHIP организованы в компактную тетрамерную структуру. Чтобы понять молекулярные предпосылки для наблюдаемого взаимодействия между sHIP и HRG, мы провели обширные испытания по кристаллизации, но не смогли получить какие-либо дифрагирующие кристаллы комплексов между sHIP и HRG или какие-либо пептиды, производные от HRG. Из-за размера тетрамерного sHIP эксперименты с ЯМР в растворе оказались очень сложными и выиграли бы от доступа к варианту sHIP с более низкой молекулярной массой и сохраненной активностью.Ранее мы сделали наблюдение, что тетрамерная структура sHIP также может быть описана как димер димеров, и постулировали, что три остатка на границе раздела димер-димер могут представлять важные детерминанты для стабилизации тетрамерной формы sHIP. В этом исследовании мы мутировали эти три межфазных остатка и тем самым смогли получить стабильный димерный вариант sHIP, который, как было показано, является активным как в экспериментах по биофизическому связыванию, так и в антимикробном анализе.Генерация стабильных димеров позволила дополнительно охарактеризовать взаимодействие между sHIP и пептидом из HRG с помощью экспериментов ЯМР, предоставив первые молекулярные детали взаимодействия с участием этой новой детерминанты вирулентности.
Материалы и методы
Мутагенез
Последовательность ДНК, соответствующая остаткам Lys3-Met98 в белке sHIP S. pyogenes (UniprotID: Q99XU0), была экспрессирована, как описано ранее, и обозначена как sHIPwt (Wisniewska et al., 2014). Вариант белка sHIP, четверной мутант под названием sHIPqp, в котором Leu84, Leu88, Tyr95 были мутированы до аланина, а Cys65 — до серина, был сконструирован с использованием набора для сайт-направленного мутагенеза Quikchange XL (Agilent) в соответствии с инструкциями производителя. Ранее мы наблюдали, что белок дикого типа может образовывать более крупные агрегаты через экспонированный остаток Cys65 в отсутствие восстанавливающего агента. Мутация Cys65Ser была введена для того, чтобы избежать необходимости использования восстанавливающего агента в последующих экспериментах.Как отмечалось ранее, эта мутация не влияет на структуру и функцию sHIP (Wisniewska et al., 2014). Поэтому мы используем мутант Cys65Ser во всех исследованиях с участием как sHIP дикого типа, так и варианта sHIP. Все мутации подтверждены анализом последовательности ДНК. Полученная конструкция экспрессии содержала His-метку и сайт расщепления протеазой TEV, предшествующий интересующей белковой последовательности.
Экспрессия и очистка белка
Белковые варианты sHIPwt и sHIPqp экспрессируются в E.coli штамм Rosetta BL21 (DE3) и очищают в две стадии с использованием стандартной аффинной хроматографии с иммобилизованными ионами металлов (IMAC) с последующим протеолитическим удалением His-метки и обращенно-фазовой хроматографией (RPC), как описано ранее (Wisniewska et al., 2014). Для исследований ЯМР белок получали с использованием минимальной среды для роста клеток, чтобы ввести стабильные изотопы 15 N и 13 C, позволяющие проводить эксперименты с тройным резонансом ЯМР (Neidhardt et al., 1974). His-метка была удалена обработкой протеазой вируса травления табака (TEV), давая следующие аминокислотные последовательности для белка дикого типа sHIP, sHIPwt:
SMKQDQLIVEKMEQTYEAFSPKLANLIEALDAFKEHYEE
YATLRNFYSSDEWFRLANQPWDDIPCGVLSEDLLFDMIG
DHNQLLADILDLAPIMYKHM,
и четверной мутантный белок sHIP, sHIPqp:
SMKQDQLIVEKMEQTYEAFSPKLANLIEALDAFKEHYEE
YATLRNFYSSDEWFRLANQPWDDIPSGVLSEDLLFDMIG
DHNQLAADIADLAPIMAKHM соответственно.
Чистота и монодисперсность рекомбинантных белков были подтверждены электрофорезом в SDS-PAGE и масс-спектрометрией.
Кристаллизация, сбор рентгеновских данных и определение структуры
Кристаллизацию варианта белка sHIP проводили методом диффузии паров из сидящей капли при 18 ° C. Лучшие кристаллы были получены из 20% ПЭГ 6000, 0,2 М хлорида кальция и 0,1 М Трис, pH 8,0. Перед погружным замораживанием кристаллы вымачивали примерно на 30 с в капле резервуарного раствора, содержащего 20% об. Этиленгликоля в качестве криозащитного средства.Кристаллы принадлежали к пространственной группе P22121 и содержали один мономер на асимметричное звено. Набор данных с самым высоким разрешением из 180 кадров (диапазон колебаний 1 °) был получен с орторомбического кристалла на лабораторном канале Max II I911-2, Лунд, Швеция, с использованием детектора MAR CCD. Данные были проиндексированы и интегрированы с использованием iMOSFLM (Battye et al., 2011) и масштабированы с использованием SCALA (Evans, 2006) из набора программ CCP4. Структура была решена путем молекулярной замены с использованием sHIP дикого типа в качестве модели поиска (PDB ID: 4MER) и уточнена с помощью REFMAC (Муршудов и др., 1997). Раунды уточнения были дополнены перестроением вручную с использованием COOT (Emsley et al., 2010). Молекулы воды были автоматически вставлены с помощью Arp / wArp и визуально проверены. Для получения дополнительных сведений об обработке данных и статистике уточнения см. Таблицу 1. Геометрия модели была проанализирована с помощью Molprobity (Chen et al., 2010). Молекулярные графические изображения были созданы с помощью программы Pymol. Координаты атомов и структурные факторы для кристаллической структуры мутанта sHIP (sHIPqp) были депонированы в банке данных белков (PDB ID: 4PZ1).
Таблица 1. Статистика сбора и уточнения кристаллографических данных .
Аналитическое ультрацентрифугирование
Эксперименты по скорости седиментации проводили при 20 ° C и 50000 об / мин с использованием прибора Beckman XL-I. Образцы, содержащие sHIPwt или sHIPqp, находились в 20 мМ буфере MES (2- (N-морфолино) этансульфоновая кислота), pH 5,5. Данные были проанализированы с помощью SEDFIT с использованием непрерывного распределения c (S) (Schuck, 2000). HYDROPRO (Ortega et al., 2011) использовался для расчета теоретического коэффициента седиментации с использованием идентификаторов PDB 4MER (sHIPwt) и 4PZ1 (sHIPqp) соответственно.
Синтетический пептид
Последовательность пептида HRG, используемого в исследовании, называемая HRGsingle, соответствующая одному мотиву связывания гепарина, имеет аминокислотную последовательность GHHPHG. Пептид был синтезирован Biosyntan GmbH (Берлин, Германия), чистота и молекулярная масса подтверждены с помощью MALDI-TOF MS.
Антимикробный анализ
Штамм AP1 (40/58) S. pyogenes был получен из Центра сотрудничества Всемирной организации здравоохранения по справочным материалам и исследованиям стрептококков, Прага, Чешская Республика.Бактерии культивировали в THY (бульон Тодда-Хьюитта (Difco) с добавлением 0,2% дрожжевого экстракта (Oxoid) при 37 ° C и 5% CO 2 до достижения средней логарифмической фазы (OD 620 нм приблизительно 0,4). клетки промывали и ресуспендировали в 10 мМ Трис-HCl, pH 7,5, содержащем 5 мМ глюкозы, до концентрации 2 × 10 9 КОЕ (колониеобразующая единица) / мл. Затем бактерии разбавляли до концентрации 2 × 10 6 КОЕ / мл в 10 мМ буфере MES, pH 5,5, содержащем 5 мМ глюкозы.Пятьдесят микролитров бактериального раствора инкубировали с рекомбинантным His-меченным HRG (Creative Biomart) в концентрации 0,45 мкМ вместе с различными концентрациями белка sHIPwt или белка sHIPqp в течение 40 минут при 37 ° C. Последовательные разведения инкубационных смесей высевали на TH-агар, планшеты инкубировали в течение ночи при 37 ° C и определяли количество КОЕ.
Изотермическая калориметрия титрования (ITC)
экспериментов ITC было выполнено с использованием прибора VP-ITC200 (GE Healthcare).Образцы интенсивно диализовали против 20 мМ буфера MES, pH 5,5. 0,5 мМ одиночного пептида HRG титровали до 0,05 мМ sHIPwt или sHIPqp соответственно. Все эксперименты проводились при 25 ° C и продолжались до достижения насыщения. Данные были подогнаны с использованием модели, описывающей один независимый сайт связывания, с использованием программного обеспечения, предоставленного производителем (Wiseman et al., 1989).
Эксперименты ЯМР
Образцы белка были приготовлены в 20 мМ MES pH 5,5 с 7% (об. / Об.) D2O для блокировки спектрометра и 0.02% (мас. / Об.) NaN 3 для предотвращения роста бактерий в образцах. Все эксперименты ЯМР проводили при 25 ° C. Для исследования комплекса sHIPqp / HRGsingle пептид образец содержал 1,0 мМ дважды меченого ( 15 N, 13 C) белка sHIPqp и 1,1 мМ пептида HRGsingle. Эксперименты по назначению резонанса основной цепи и боковой цепи были выполнены на частоте протонного резонанса 800 МГц, тогда как эксперименты по установлению ограничений расстояния Nuclear Overhauser Enhancement (NOE) были получены на частоте протонного резонанса 900 МГц.Распределение сигналов от sHIPqp и пептида HRGsingle и сбор ограничений NOE выполняли с использованием комбинации стандартных 2D- и 3D-экспериментов с тройным резонансом, включая HNCA (Clore et al., 1990), HNCOCA (Bax and Ikura, 1991). ), HNCACB (Wittekind and Mueller, 1993), CBCACONH (Grzesiek and Bax, 1992), HCCONH (Montelione et al., 1992), CCONH (Montelione et al., 1992), 15 N-NOESY-HSQC (Marion et al., 1989), 13 C-NOESY-HSQC (отдельно для алифатических и ароматических сигналов; Marion et al., 1989), 2D с двойной фильтрацией NOESY (Ikura et al., 1992) и 2D с одной фильтрацией NOESY (Ikura et al., 1992). Кроме того, для пептида HRGsingle были проведены эксперименты 2D NOESY и TOCSY. Спектры обрабатывали с помощью NMRpipe (Delaglio et al., 1995), применяя нулевое заполнение и линейное предсказание в косвенных измерениях, а также фильтр растворителя и полиномиальную коррекцию базовой линии в прямом измерении. CCPNMR (Vranken et al., 2005) использовался для визуализации спектров, анализа резонансной связи и определения ограничений расстояния (NOE).Расчеты структуры были выполнены с использованием итерационной процедуры в рамках набора программ ARIA / CNS (Brunger et al., 1998). Оценка качества структурных моделей, созданных ЯМР, проводилась с использованием пакета проверки структуры белка (PSVS, таблица 3; Bhattacharya et al., 2007). Молекулярные графические изображения были созданы с использованием программы Pymol (Рисунок 5).
Результаты
Мутант sHIPqp образует стабильные димеры двух мотивов спираль-петля-спираль
sHIP дикого типа состоит из тетрамеров, которые можно описать как димер двух димеров, каждый из которых несет два мотива спираль-петля-спираль (рис. 1А).Гипотеза заключалась в том, что три неполярных остатка на границе тетрамера (Leu84, Leu88, Tyr95) представляют собой важные детерминанты для олигомеризации белка (рис. 1B), и поэтому эти остатки были мутированы на аланины в мутантном белке sHIPqp. Орторомбические кристаллы мутанта sHIPqp содержат один мономер в асимметричном звене с содержанием растворителя 36%. Кристаллическая упаковка показывает образование димера с общей площадью скрытой поверхности 6070 Å 2 , как рассчитано сервером PISA (Krissinel and Henrick, 2007).Последняя модель включает остатки 3-98, соответствующие всей молекуле sHIPqp (рис. 1C). Структура очень хорошо определена, со средним B-фактором 12,2 Å 2 (10,8 Å 2 и 13,6 Å 2 для основной цепи и боковых цепей, соответственно). Конечные карты электронной плотности имеют очень высокое качество, включая область петли, которая частично не видна у sHIP дикого типа (рис. 1D). Все неглициновые остатки имеют углы главной цепи в предпочтительных областях графика Рамачандрана, как определено с помощью программы Molprobity (Chen et al., 2010; Таблица 1). Для количественного анализа олигомерных состояний вариантов sHIP использовали аналитическое ультрацентрифугирование на sHIPwt и мутанте sHIPqp. Эти эксперименты ясно показывают, что sHIP дикого типа (sHIPwt) проявляется в виде тетрамеров в растворе, тогда как мутант sHIP (sHIPqp) существует в виде димеров (рис. 2). Наибольшие различия в мотиве мономерная спираль-петля-спираль между двумя вариантами sHIP наблюдаются в области петли, соединяющей две спирали. В мутанте sHIPqp все остатки, включая боковые цепи, очень хорошо определены, в то время как в sHIPwt некоторые остатки не могут быть определены из-за отсутствия интерпретируемых карт электронной плотности в этой области (рис. 1D).
Рисунок 1. Трехмерная структура шИП . (A) Гомотетрамер sHIPwt, образованный цепочкой A (зеленый), цепью B (красный), цепочкой C (пурпурный) и цепочкой D (голубой) с использованием PDB ID 4MER. (B) Молекулярный интерфейс, показывающий остатки в контакте на границе раздела двух димеров тетрамера sHIPwt (PDB ID: 4MER). (C) Димер sHIPqp, образованный цепочкой A (зеленый) и цепью B (красный) (PDB ID: 4PZ1). (D) Трехмерное выравнивание структур мономеров спираль-петля-спираль sHIP дикого типа (синий) и мутанта sHIPqp (желтый).
Рис. 2. Эксперименты по скорости седиментации белка sHIP . Пунктирные линии указывают теоретический коэффициент седиментации для тетрамера и димера, соответственно, рассчитанный с использованием HYDROPRO, и структурные координаты для белка sHIPwt (PDB ID: 4MER) и белка sHIPqp (PDB ID: 4PZ1). SHIPwt дикого типа показан черным, а мутант sHIPqp — красным соответственно.
Мутант sHIPqp ингибирует антибактериальную активность HRG
Известно, что HRG обладает антибактериальной активностью, в том числе против S.pyogenes (Shannon et al., 2010), а при заражении HRG было показано, что sHIP спасает бактерий S. pyogenes (Wisniewska et al., 2014). Чтобы проверить, обладает ли мутант sHIP такой же способностью, мы провели антимикробный анализ, сравнив sHIPwt и sHIPqp. Как показано на фиг. 3, sHIPqp ингибирует бактерицидную активность HRG в той же или даже большей степени, чем sHIP дикого типа, что указывает на то, что димерный мутант sHIPqp сохраняет свою ингибирующую способность.
Рисунок 3.Мутантный белок sHIPqp подавляет бактерицидную активность HRG более эффективно, чем белок sHIP дикого типа . Бактерицидный эффект 0,45 мкМ HRG против бактерий S. pyogenes AP1 (2 × 10 6 КОЕ / мл) подавлялся sHIP дикого типа (♦) и мутантным sHIPqp (■) в указанных концентрациях. Эксперименты повторяли не менее трех раз, и показаны средние значения ± стандартное отклонение.
sHIP связывает одиночный гепарин-связывающий мотив в HRG
В наших предыдущих исследованиях мы показали, что белок sHIP связывается как с HRG, так и с пептидами, производными от HRG, с наномолярным или микромолярным сродством, и что богатая гистидином область важна для взаимодействия (Wisniewska et al., 2014). Чтобы дополнительно проанализировать молекулярные детали взаимодействия, мы исследовали, способны ли варианты sHIP также связываться с одним гепарин-связывающим мотивом (GHHPHG) в HRG (обозначенном как HRGsingle). Эксперименты изотермической калориметрии титрования (ITC) показали, что как sHIPwt, так и sHIPqp связывают HRGsingle с аналогичной микромолярной аффинностью, ясно указывая на то, что мотив связывания гепарина представляет собой важный мотив узнавания в HRG для взаимодействия с белком sHIP (рис. 4, таблица 2). .
Рис. 4. Эксперименты с калориметрическим изотермическим титрованием (ITC), показывающие связывание между sHIP и пептидом HRGsingle. (A) sHIPwt и HRGsingle. (B) sHIPqp и HRGsingle. Исходные данные экспериментов представлены на верхней панели. Площадь под каждым пиком впрыска равна общему количеству тепла, выделяемого для этого впрыска. Когда это интегрированное тепло отображается в зависимости от молярного отношения титранта, добавленного к раствору пептида в ячейке, получается полная изотерма связывания для взаимодействия (нижняя панель).Для соответствия данным использовалась модель для любого из сайтов связывания. Сплошная линия — это расчетная кривая с использованием наиболее подходящих параметров.
Таблица 2. Сводка термодинамических параметров ITC-экспериментов связывания двух вариантов sHIPwt и sHIPqp с пептидом HRGsingle соответственно .
Сайт связывания HRG в sHIP включает оба мотива спираль-петля-спираль димера
Белок sHIP дикого типа представляет собой тетрамерный белок с молекулярной массой 46 кДа, что усложняет эксперименты по ЯМР в растворе из-за широких и перекрывающихся резонансов.Создание мутантной димерной формы sHIP, sHIPqp, и благодаря проверке ее функциональных свойств, теперь у нас есть доступ к меньшей, но биологически релевантной системе с молекулярной массой 23 кДа, которая позволила провести подробные ЯМР-исследования в растворе.
Была создана молекулярная модель с комбинацией структуры sHIPqp (PDB ID: 4PZ1) и ограничений расстояния (NOE), извлеченных из экспериментов ЯМР комплекса между sHIPqp и HRGsingle пептидом. Всего в расчетах структуры использовалось 1714 NOE в качестве ограничений расстояния, из которых 321 — ограничения дальнего действия, а 56 — NOE, обнаруженные между sHIPqp и пептидом HRGsingle (таблица 3).Следует отметить, что эта модель представляет собой предварительное описание комплекса sHIPqp-HRGsingle, который потребует дальнейшего уточнения, прежде чем рассматривать его как окончательную сложную структуру. Однако оценка сгенерированной структуры показывает, что она имеет достаточное качество, чтобы представлять наиболее подходящую описательную модель для комплекса (Таблица 3). Модель показывает, что одинарный пептид HRG связывается в кармане, созданном остатками из обоих мономерных мотивов спираль-петля-спираль, предполагая, что димерная форма представляет собой наименьший достижимый вариант sHIP с сохраненной способностью связывания HRG.Каждый димер sHIP связывает два одиночных пептида HRG в двух идентичных сайтах (рис. 5А). Сайт связывания включает N-концевую часть спирали 1 одного мономера (остатки Asp5-Met12) и концевую область спирали 1 второго мономера (остатки Ala41-Ala56). Для первого мономера три остатка вовлечены в контакты NOE с пептидом HRGsingle с основным вкладом от Ile8. Для второго мономера тринадцать остатков приводят к детектируемым NOE, в котором преобладают контакты с участием Phe46, Glu51 и Arg54.Более того, сайт связывания не включает никаких остатков в непосредственной близости от интерфейса димер-димер, что согласуется с наблюдением, что мутантный sHIPqp сохраняет свою полную ингибирующую способность HRG в антимикробных анализах (рис. 3). Два внешних глициновых остатка одинарного пептида HRG, Gly-1 и Gly-6, не участвуют в каких-либо взаимодействиях с sHIP. Однако основная часть пептида (HHPH) образует множественные контакты со связывающим карманом, созданным остатками из обеих цепей структурного каркаса, созданного димером sHIP.В частности, остатки His-2 и His-5 расположены глубоко в связывающем кармане, что является подтверждением пептидного остова, что стало возможным благодаря уникальным свойствам остова связывающего остатка Pro-4 (рис. 5B).
Таблица 3. Структурные ограничения ЯМР и структурная статистика модели sHIPqp / HRGsingle.
Рисунок 5. Молекулярная модель комплекса между sHIPqp и пептидом HRGsingle. (A) sHIPqp показан на ленте с цепочкой A зеленым и цепью B красным.Пептид HRGsingle показан в виде карандаша. (B) sHIPqp показан с заполнением пробела цепочкой A зеленым цветом и цепью B красным. Пептид HRGsingle показан в виде карандаша.
Обсуждение
Бактериальные инфекции представляют собой серьезную проблему для здоровья человека во всем мире, причем проблема возрастает все более быстрыми темпами из-за тревожного роста устойчивости к антибиотикам. Чтобы лечить бактериальные инфекции в будущем, необходимо разработать новые терапевтические стратегии, которые потребуют лучшего понимания сложного молекулярного взаимодействия между бактериальными патогенами и их человеческим хозяином. S. pyogenes представляет собой один из наиболее значимых бактериальных патогенов в человеческой популяции. Используя протеомику на основе масс-спектрометрии, мы ранее идентифицировали новый белок и фактор вирулентности этой бактерии (Wisniewska et al., 2014). В этом исследовании мы расширили структурные и функциональные характеристики этого белка, чтобы лучше понять взаимодействие между sHIP и человеком-хозяином.
Определение структуры мутанта sHIPqp показало, что складка мутанта sHIP и мономеров sHIP дикого типа по существу идентична, демонстрируя удлиненный мотив спираль-петля-спираль (рис. 1).Однако наиболее существенное различие связано с олигомерными состояниями двух вариантов белка. Для sHIP дикого типа четыре мономера собираются в компактный гомотетрамер, который можно описать как димер димеров из-за взаимодействий на границе димер-димер. Наши предыдущие исследования показали, что этот интерфейс состоит из аминокислот с преимущественно неполярными боковыми цепями, таких как Leu84, Leu88, Tyr95 и Met98, которые могут быть ответственны за олигомеризацию белка. Мутация этих остатков в остатки аланина привела к сдвигу в четвертичной структуре от тетрамеров к димерам, что дополнительно подтверждается экспериментами по скорости седиментации, которые ясно показывают, что мутант sHIPqp существует в виде димеров в растворе (рис. 2).
Чтобы лучше понять взаимодействие между sHIP и HRG, была создана молекулярная модель для комплекса между sHIPqp и одним гепарин-связывающим мотивом HRG (HRGsingle), пептида, который, как было показано, проявляет активность в связывании как с sHIPwt, так и с sHIPqp ( Рисунок 4). Модель показывает, что пептид HRGsingle взаимодействует с обоими мономерами димеров спираль-петля-спираль, и что пролин, расположенный в середине пептидной последовательности, позволяет двум гистидинам, His-2 и His-5, глубоко вступать в связывание. карман, созданный двумя мономерами sHIP (Рисунки 5A, B).Однако, даже если оба мономера вносят вклад в контакты с пептидом HRGsingle, один из мономеров явно доминирует в общем вкладе в связывающий эпитоп для димера sHIP. Будущие исследования должны включать эксперименты по мутагенезу пептидов sHIP и HRG для дальнейшего определения критических детерминант взаимодействия.
Заключительные замечания
Посредством структурной инженерии белка выбранного набора остатков на границе димер-димер sHIP мы смогли создать димерную форму белка с сохраненными функциональными свойствами.Доступ к димерному sHIP дает возможность использовать методы ЯМР для дальнейшего выяснения взаимодействий с участием этого белка. В заключение, с помощью комбинации методов белковой инженерии, биофизики и структурной биологии мы предоставили первые молекулярные детали, описывающие взаимодействие между антимикробным белком HRG и новым фактором вирулентности sHIP.
Авторские взносы
CD и MagW провели ЯМР- и рентгеновский эксперименты соответственно.IF провел антимикробный анализ, WS — эксперименты с AUC, а JM — протеомный анализ MS. LB предоставляла оценку клинических данных. MW (автор-корреспондент) руководил проектом, проводил эксперименты ITC и написал рукопись при участии всех авторов.
Финансирование
Работа поддержана Шведским исследовательским советом (проекты 7480, 2008: 3356 и 621-2012-3559), Шведским фондом стратегических исследований (грант FFL4), Фондом Крафорда (грант 20100892), стипендиатом Валленбергской академии KAW. (2012.0178), стартовый грант Европейского исследовательского совета (ERC-2012-StG-309831), грант Novo Nordisk Foundation NNF14CC0001, Европейская комиссия в рамках Седьмой рамочной программы (FP7) контракт Bio-NMR 261863, обеспечивающий доступ к Шведскому центру ЯМР, Гётеборг, Швеция, и лаборатория MAX в Лунде, Швеция, обеспечивающие доступ к лаборатории MAX (ID 20120014 и 20130189).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить проект SyBIT компании SystemsX.ch за поддержку и обслуживание внутренней вычислительной инфраструктуры лаборатории, команду ITS HPC (Brutus).
Список литературы
Абэ, Дж., Форрестер, Дж., Накахара, Т., Лафферти, Дж. А., Коцин, Б. Л., и Леунг, Д. Ю. (1991). Селективная стимуляция Т-клеток человека стрептококковыми эритрогенными токсинами А и В. J. Immunol. 146, 3747–3750.
PubMed Аннотация | Google Scholar
Окессон, П., Sjöholm, A.G., и Björck, L. (1996). Белок SIC, новый внеклеточный белок Streptococcus pyogenes , нарушающий функцию комплемента. J. Biol. Chem. 271, 1081–1088. DOI: 10.1074 / jbc.271.2.1081
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бэтти, Т. Г., Контогианнис, Л., Джонсон, О., Пауэлл, Х. Р., и Лесли, А. Г. (2011). iMOSFLM: новый графический интерфейс для обработки дифракционных изображений с помощью MOSFLM. Acta Crystallogr.D Biol. Кристаллогр. 67, 271–281. DOI: 10.1107 / S0
48675
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бакс А. и Икура М. (1991). Эффективный метод 3D ЯМР для корреляции резонансов протона и амида основной цепи 15N с альфа-углеродом предыдущего остатка в белках, равномерно обогащенных 15N / 13C. J. Biomol. ЯМР 1, 99–104. DOI: 10.1007 / BF01874573
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхаттачарья, А., Техеро Р. и Монтелионе Г. Т. (2007). Оценка белковых структур, определяемых консорциумами структурной геномики. Белки 66, 778–795. DOI: 10.1002 / prot.21165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brunger, A. T., Adams, P. D., Clore, G. M., DeLano, W. L., Gros, P., Grosse-Kunstleve, R. W., et al. (1998). Система кристаллографии и ЯМР: новый пакет программ для определения структуры макромолекул. Acta Crystallogr. Д 54, 905–921.DOI: 10.1107 / S0
4998003254
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карапетис, Дж. Р., Стир, А. К., Малхолланд, Е. К., и Вебер, М. (2005). Глобальное бремя стрептококковых заболеваний группы А. Lancet Infect. Дис. 5, 685–694. DOI: 10.1016 / S1473-3099 (05) 70267-X
PubMed Аннотация | CrossRef Полный текст
Чен, В. Б., Арендалл, В. Б. III, Хедд, Дж. Дж., Киди, Д. А., Иммормино, Р. М., Капрал, Г. Дж. И др. (2010). MolProbity: проверка структуры всех атомов для кристаллографии макромолекул. Acta Crystallogr. D Biol. Кристаллогр. 66, 12–21. DOI: 10.1107 / S0
490
73
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клор, Г. М., Бакс, А., Дрисколл, П. К., Вингфилд, П. Т., и Гроненборн, А. М. (1990). Отнесение протонного и углеродного резонансов в боковой цепи интерлейкина-1. бета. с использованием двух- и трехрезонансной гетероядерной трехмерной ЯМР-спектроскопии. Биохимия 29, 8172–8184. DOI: 10.1021 / bi00487a027
CrossRef Полный текст | Google Scholar
Кортни, Х.С., Хэсти, Д. Л., Ли, Ю., Чанг, Х. К., Такер, Дж. Л., и Дейл, Дж. Б. (1999). Фактор помутнения сыворотки является основным связывающим фибронектин белком и детерминантой вирулентности M типа 2 Streptococcus pyogenes . Мол. Microbiol. 32, 89–98. DOI: 10.1046 / j.1365-2958.1999.01328.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Delaglio, F., Grzesiek, S., Vuister, G. W., Zhu, G., Pfeifer, J., and Bax, A. (1995). NMRPipe: система многомерной спектральной обработки, основанная на конвейерах UNIX. J. Biomol. 6, 277–293. DOI: 10.1007 / BF00197809
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ферни-Кинг, Б. А., Сейли, Д. Дж., Дэвис, А., и Лахманн, П. Дж. (2002). Стрептококковый ингибитор комплемента подавляет два дополнительных компонента врожденной иммунной системы слизистой оболочки: ингибитор секреторной лейкоцитарной протеиназы и лизоцим. Заражение. Иммун. 70, 4908–4916. DOI: 10.1128 / IAI.70.9.4908-4916.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрик, И.М., Окессон, П., Расмуссен, М., Шмидтхен, А., и Бьорк, Л. (2003). SIC, секретируемый белок Streptococcus pyogenes , который инактивирует антибактериальные пептиды. J. Biol. Chem. 278, 16561–16566. DOI: 10.1074 / jbc.M301995200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Grzesiek, S., and Bax, A. (1992). Корреляция резонансов амида основной цепи и боковой цепи в более крупных белках с помощью многократного ретрансляции тройного резонанса ЯМР. J. Am. Chem.Soc. 114, 6291–6293. DOI: 10.1021 / ja00042a003
CrossRef Полный текст | Google Scholar
Икура, М., Клор, Г. М., Гроненборн, А. М., Чжу, Г., Клее, К. Б., и Бакс, А. (1992). Структура раствора комплекса кальмодулин-целевой пептид методом многомерного ЯМР. Наука 256, 632–638. DOI: 10.1126 / science.1585175
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джаффе, Дж., Натансон-Ярон, С., Капарон, М. Г., и Хански, Э. (1996).Белок F2, новый связывающий фибронектин белок из Streptococcus pyogenes , обладает двумя связывающими доменами. Мол. Microbiol. 21, 373–384. DOI: 10.1046 / j.1365-2958.1996.6331356.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс А. Л., Хьюлетт М. Д. и Пэриш К. Р. (2005). Гликопротеин, богатый гистидином: новый адаптерный белок в плазме, который модулирует иммунную, сосудистую и свертывающую системы. Immunol. Cell Biol. 83, 106–118.DOI: 10.1111 / j.1440-1711.2005.01320.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камезава Ю., Накахара Т., Накано С., Абэ Ю., Нодзаки-Ренар Дж. И Исоно Т. (1997). Стрептококковый митогенный экзотоксин Z, новый кислый суперантигенный токсин, продуцируемый штаммом T1 Streptococcus pyogenes . Заражение. Иммун. 65, 3828–3833.
PubMed Аннотация | Google Scholar
Крайкемейер Б., Талай С. Р. и Чхатвал Г.С. (1995). Характеристика нового поверхностного белка, связывающего фибронектин, у стрептококков группы А. Мол. Microbiol. 17, 137–145. DOI: 10.1111 / j.1365-2958.1995.mmi_17010137.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лэнсфилд, Р. К. (1962). Современные знания о типоспецифических антигенах M стрептококков группы А. J. Immunol. 89, 307–313.
PubMed Аннотация | Google Scholar
Ласковски, Р.А., Макартур, М.У., Мосс, Д. С. и Торнтон, Дж. М. (1993). PROCHECK: программа для проверки стереохимического качества белковых структур. J. Appl. Cryst. 26, 283–291. DOI: 10.1107 / S0021889892009944
CrossRef Полный текст | Google Scholar
Ласковски, Р. А., Руллманн, Дж. А., Макартур, М. В., Каптейн, Р., и Торнтон, Дж. М. (1996). AQUA и PROCHECK-NMR: программы для проверки качества белковых структур, решаемые методом ЯМР. J. Biomol. ЯМР 8, 477–486. DOI: 10.1007 / BF00228148
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мэрион Д., Дрисколл П. К., Кей Л. Е., Вингфилд П. Т., Бакс А., Гроненборн А. М. и др. (1989). Преодоление проблемы перекрытия при назначении спектров ЯМР 1H более крупных белков за счет использования трехмерной гетероядерной множественной квантовой когерентности 1H-15N-Хартмана-Хана и ядерной множественной квантовой когерентной спектроскопии Оверхаузера: применение к интерлейкину 1 бета. Биохимия 28, 6150–6156.DOI: 10.1021 / bi00441a004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моллик, Дж. А., Миллер, Г. Г., Массер, Дж. М., Кук, Р. Г., Гроссман, Д., и Рич, Р. Р. (1993). Новый суперантиген, выделенный из патогенных штаммов Streptococcus pyogenes с аминотерминальной гомологией со стафилококковыми энтеротоксинами B и C. J. Clin. Инвестировать. 92, 710–719. DOI: 10.1172 / JCI116641
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монтелионе, Г.Т., Лайонс, Б.А., Эмерсон, С.Д., и Таширо, М. (1992). Эффективный эксперимент с тройным резонансом с использованием изотропного смешения углерода-13 для определения последовательностей резонансных назначений изотопно-обогащенных белков. J. Am. Chem. Soc. 114, 10974–10975. DOI: 10.1021 / ja00053a051
CrossRef Полный текст | Google Scholar
Муршудов Г. Н., Вагин А. А., Додсон Э. Дж. (1997). Уточнение структуры макромолекул методом максимального правдоподобия. Acta Crystallogr.D Biol. Кристаллогр. 53, 240–255. DOI: 10.1107 / S0
4996012255
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нейдхардт, Ф. К., Блох, П. Л., и Смит, Д. Ф. (1974). Питательная среда для энтеробактерий. J. Bacteriol. 119, 736–747.
PubMed Аннотация | Google Scholar
Норрби-Теглунд, А., Ньютон, Д., Котб, М., Холм, С. Э., и Норгрен, М. (1994). Суперантигенные свойства стрептококкового экзотоксина SpeF (MF) группы А. Заражение. Иммун. 62, 5227–5233.
PubMed Аннотация | Google Scholar
Ортега А., Аморос Д. и Гарсиа де ла Торре Дж. (2011). Прогнозирование гидродинамических и других свойств растворов жестких белков на основе моделей атомарного и остаточного уровней. Biophys. J. 101, 892–898. DOI: 10.1016 / j.bpj.2011.06.046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филипс Г. Н. мл., Фликер П. Ф., Коэн К., Манджула Б. Н. и Фишетти В.А. (1981). Белок Streptococcal M: структура и расположение альфа-спиральной спиральной спирали на поверхности клетки. Proc. Natl. Акад. Sci. США 78, 4689–4693. DOI: 10.1073 / pnas.78.8.4689
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роча, К. Л., Фишетти, В. А. (1999). Идентификация и характеристика нового связывающего фибронектин белка на поверхности стрептококков группы А. Заражение. Иммун. 67, 2720–2728.
PubMed Аннотация | Google Scholar
Rydengård, V., Олссон, А.К., Моргелин, М., и Шмидтхен, А. (2007). Гликопротеин, богатый гистидином, обладает антибактериальной активностью. FEBS J. 274, 377–389. DOI: 10.1111 / j.1742-4658.2006.05586.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шук П. (2000). Анализ распределения макромолекул по размерам с помощью ультрацентрифугирования скорости седиментации и моделирования уравнения Ламма. Biophys. J. 78, 1606–1619. DOI: 10.1016 / S0006-3495 (00) 76713-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шеннон, О., Rydengård, V., Schmidtchen, A., Mörgelin, M., Alm, P., Sørensen, O.E., et al. (2010). Гликопротеин, богатый гистидином, способствует улавливанию бактерий сгустками и снижает смертность на мышиной модели сепсиса. Кровь 116, 2365–2372. DOI: 10.1182 / кровь-2010-02-271858
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стивенс, Д. Л., Таннер, М. Х., Уиншип, Дж., Свартс, Р., Райс, К. М., Шливерт, П. М. и др. (1989). Тяжелые стрептококковые инфекции группы А, связанные с токсическим шоковым синдромом и токсином А скарлатины. N. Engl. J. Med. 321, 1–7. DOI: 10.1056 / NEJM1983210101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Талай С. Р., Валентин-Вейганд П., Тиммис К. Н. и Чхатвал Г. С. (1994). Доменная структура и консервативные эпитопы белка Sfb, фибронектин-связывающего адгезина Streptococcus pyogenes . Мол. Microbiol. 13, 531–539. DOI: 10.1111 / j.1365-2958.1994.tb00448.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Терао, Ю., Кавабата, С., Кунитомо, Э., Мураками, Дж., Накагава, И., и Хамада, С. (2001). Fba, новый связывающий фибронектин белок из Streptococcus pyogenes , способствует проникновению бактерий в эпителиальные клетки, а ген fba положительно транскрибируется под действием регулятора Mga. Мол. Microbiol. 42, 75–86. DOI: 10.1046 / j.1365-2958.2001.02579.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томай, М.А., Шливерт, П.М., и Котб, М. (1992). Четкое использование гена Vβ-рецептора Т-лимфоцитов человеческими Т-лимфоцитами, стимулированными стрептококковыми пирогенными экзотоксинами и белком pep M5. Заражение. Иммун. 60, 701–705.
PubMed Аннотация | Google Scholar
Вранкен, В. Ф., Баучер, В., Стивенс, Т. Дж., Фог, Р. Х., Пайон, А., Ллинас, М., и др. (2005). Модель данных CCPN для ЯМР-спектроскопии: разработка программного обеспечения. Белки 59, 687–696. DOI: 10.1002 / prot.20449
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wiseman, T., Williston, S., Brandts, J., and Lin, L. (1989). Быстрое измерение констант связывания и теплоты связывания с помощью нового калориметра для титрования. Анал. Biochem. 179, 131–137. DOI: 10.1016 / 0003-2697 (89)
-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wisniewska, M., Happonen, L., Kahn, F., Varjosalo, M., Malmström, L., Rosenberger, G., et al. (2014). Функциональные и структурные свойства нового белка и фактора вирулентности (Protein sHIP) в Streptococcus pyogenes . J. Biol. Chem. 289, 18175–18188. DOI: 10.1074 / jbc.M114.565978
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виттекинд, М., и Мюллер, Л. (1993). HNCACB, высокочувствительный 3D-ЯМР-эксперимент для корреляции амид-протонных и азотных резонансов с альфа- и бета-углеродными резонансами в белках. J. Magn. Резон. Сер. В 101, 201–205. DOI: 10.1006 / jmrb.1993.1033
CrossRef Полный текст
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
DimerX I: Рекомбинантный растворимый димерный HLA-A2 человека: слитый белок Ig
Этот слитый белок HLA-A2: Ig был протестирован с помощью иммунофлуоресцентного окрашивания (≤ 2 мкг HLA-A2: Ig / миллион клеток) (см. Рисунок) и проточного цитометрического анализа антигенспецифических Т-клеток для подтверждения специфичности и реактивности.Перед иммунофлуоресцентным окрашиванием Т-клеток необходимо загрузить HLA-A2 части димерного белка соответствующим представляющим интерес пептидом. HLA-A2: комплексы Ig эффективно загружаются путем инкубации с избытком релевантных (специфических) или нерелевантных (контрольных) пептидов (см. Протокол 1). Нагруженный пептидом HLA-A2: Ig можно использовать для иммунофлуоресцентного окрашивания (см. Протокол 2). FITC-конъюгированные mAb BB7.2 (против HLA-A2 человека, каталожный № 551285) можно использовать для определения фенотипа A2 клеток перед окрашиванием слитым белком HLA-A2: Ig.Поскольку варианты применения различаются, каждый исследователь должен определить разведения, подходящие для индивидуального использования.
Протокол 1. Пептидная загрузка HLA-A2: димерный белок Ig
Было описано несколько протоколов пептидной загрузки. Метод, используемый в BD Biosciences Pharmingen, включает пассивную загрузку избытка пептида в раствор с белком HLA-A2: Ig. Мы обнаружили, что пассивная загрузка особенно хорошо работает в случае пептидов с высоким сродством. Для пептидов с более низким сродством увеличение молярного отношения пептида к HLA-A2: Ig может улучшить нагрузку, как определено с помощью проточного цитометрического анализа.Предлагается, чтобы для каждого пептида параметры, такие как доза HLA-A2: Ig на миллион клеток, молярное отношение пептида к HLA-A2: Ig и время нагрузки пептида, определялись исследователем эмпирически. В литературе описаны параметры и минимальные требования для связывания пептида с HLA-A2. Хотя этот продукт DimerX содержит микроглобулин β2, исследователям, которым требуется избыток рекомбинантного человеческого микроглобулина β2, мы рекомендуем BD Biosciences Cat. № 551089.
Приготовление и загрузка пептидов:
1.Необходимо определить молекулярную массу (MW) интересующего пептида. MW пептида можно оценить, умножив его количество (n) аминокислот (AA) на 130 дальтон (d) на аминокислоту:
MW пептида (d) = n (AA) x 130 (d / AA)
2. Можно приготовить запас пептида с концентрацией 20 мг / мл в ДМСО. Разбавьте раствор пептида до 2 мг / мл в стерильном DPBS, pH 7,2 для использования в протоколе загрузки HLA-A2: Ig.
3. Смешайте белок HLA-A2: Ig со специфическим или контрольным пептидом при 40, 160 или 640 молярном (М) избытке.
Можно использовать следующий расчет с использованием пептида из 8 аминокислот (8-мер) в качестве примера:
Dp = молекулярная масса пептида: например, 8 аминокислот x 130 = 1040 дальтон.
DA = молекулярная масса HLA-A2: Ig = 250000 дальтон.
R = желаемое молярное соотношение избытка, например 160.
Mp = микрограммы (мкг) представляющего интерес пептида.
МА = микрограммы (мкг) HLA-A2: Ig в реакции.Типичное количество нагруженного пептидом HLA-A2: Ig для использования для окрашивания проточной цитометрией составляет от 1 до 2 мкг / миллион клеток (тест).
Mp = MA x R x Dp = 4 мкг x 160 x 1040 d = 2,66 мкг
DA 250 000 d
Следовательно, нужно добавить 2,66 мкг пептида и 4 мкг HLA-A2: Ig в растворе для оптимального пептидная нагрузка HLA-A2: Ig.
4. Смешайте пептид и HLA-A2: Ig вместе в PBS, pH 7.2, инкубируйте при 37 ° C в течение ночи. Нагруженный пептидом HLA-A2: Ig можно хранить при 4 ° C до 1 недели.
Протокол 2: Протокол иммунофлуоресцентного окрашивания
1. Ресуспендируйте PBMC или клетки-мишени в буфере для окрашивания FACS [например, буфер для окрашивания BD Pharmingen ™ с BSA, кат. № 554657] в концентрации приблизительно 10e6 клеток на 50 мкл. Добавьте ~ 1x 10e6 клеток в каждую пробирку для окрашивания (например, пробирку 12 x 75 мм, BD Falcon ™ Cat. No. 352008).
2. Приготовьте коктейль для окрашивания нагруженного пептидом белка HLA-A2, смешав 1-2 мкг нагруженного пептидом белка HLA-A2 / тест с 1 — 2 мкг PE-конъюгированных A85-1 mAb (антимышиных IgG1, кат. .No. 550083) / тест в соотношении 1: 1 или 1: 2 димера: A85-1 mAb. Инкубируйте смесь в течение 60 минут при комнатной температуре, защищая от воздействия света.
3. Добавьте 1-2 мкг очищенного контрольного mAb A111-3 изотипа мышиного IgG1 (каталожный № 553485) / тест в смесь для окрашивания (см. Шаг 2 выше). Инкубируйте окрашивающий коктейль в течение 30 минут при комнатной температуре, защищая от воздействия света.
4. Приготовьте очищенный поликлональный человеческий IgG с концентрацией приблизительно 0,2 мг / мл в фосфатно-солевом буфере (PBS), pH 7.2.
5. Добавьте 10 мкл (2 мкг) исходного человеческого IgG в пробирку, чтобы заблокировать неспецифическое связывание DimerX I или реагентов антител с поверхностными рецепторами Fc. Инкубируйте 10 минут при комнатной температуре.
6. Добавьте 50 мкл буфера FACS, содержащего оптимальное количество окрашивающей смеси для каждого теста, плюс любые другие антитела, специфичные для маркеров клеточной поверхности, которые будут использоваться для каждого образца.
7. Промыть клетки 1x 2 мл буфера FACS, центрифугировать в течение 5 минут при 250 x g и аспирировать супернатант.Ресуспендируйте в буфере FACS и проанализируйте с помощью проточной цитометрии. *
* В клеточной популяции частота клеток, которые способны распознавать специфические комплексы пептид-MHC, обычно очень низка, например, <1%. Мы рекомендуем собрать не менее 100 000 лимфоцитов для анализа проточной цитометрией для оптимального выявления этой субпопуляции.
Протокол 3: Альтернатива: Протокол иммунофлуоресцентного окрашивания
1. Ресуспендируйте PBMC или клетки-мишени в буфере для окрашивания FACS [e.g., BD Pharmingen ™ Stain Buffer с BSA, кат. № 554657] в концентрации приблизительно 10e6 клеток на 50 мкл. Добавьте ~ 1x 10e6 клеток в каждую пробирку для окрашивания (например, пробирку 12 x 75 мм, BD Falcon ™ Cat. No. 352008).
2. Приготовьте очищенный поликлональный человеческий IgG с концентрацией приблизительно 0,2 мг / мл в фосфатно-солевом буфере (PBS), pH 7,2.
3. Добавьте 10 мкл (2 мкг) исходного человеческого IgG в пробирку, чтобы заблокировать неспецифическое связывание DimerX I или реагентов антител с поверхностными рецепторами Fc. Инкубируйте 10 минут при комнатной температуре.
4. Добавьте 1-2 мкг белка HLA-A2: Ig, нагруженного пептидами, в каждый образец. Инкубируйте 60 минут при 4 ° C.
5. Промыть клетки 1x 2 мл буфера FACS, центрифугировать в течение 5 минут при 250 x g и аспирировать супернатант.
6. Снова добавьте 10 мкл (2 мкг) очищенного поликлонального человеческого IgG на образец. Инкубируйте 10 минут при комнатной температуре.
7. Добавьте 100 мкл буфера FACS, содержащего соответствующим образом разбавленный флуоресцентный вторичный реагент. Обычно мы используем PE-конъюгированные mAb A85-1 (антимышиный IgG1, кат.№ 550083). Инкубируйте 30 минут при комнатной температуре. **
8. Промойте клетки 1x 2 мл буфера FACS, центрифугируйте в течение 5 минут при 250 x g и аспирируйте супернатант. Ресуспендируйте в буфере FACS и проанализируйте с помощью проточной цитометрии. ***
** Дополнительные антитела, специфичные для маркеров, таких как CD4, CD8 или HLA-A2, могут быть включены на этом этапе путем добавления соответствующим образом разведенных флуоресцентно-конъюгированных антител. ПРИМЕЧАНИЕ. BD ™ Dimerx HLA-A2: Ig — это гибридный белок, содержащий области тяжелой цепи мышиного IgG1.Следовательно, важно выбирать реагенты другого изотипа, чтобы избежать возможного окрашивания вторичным реагентом (анти-IgG1) этими реагентами других антител.
*** В клеточной популяции частота клеток, которые способны распознавать специфические комплексы пептид-MHC, обычно очень низка, например <1%. Мы рекомендуем собрать не менее 100 000 лимфоцитов для анализа проточной цитометрией для оптимального выявления этой субпопуляции.
Институт медицинской информации и исследований штата Делавэр (DIMER) — Служба здравоохранения и социального обеспечения штата Делавэр
Делавэрский институт медицинского образования и исследований (DIMER)
Предоставление возможности жителям Делавэра получить медицинское образование.
Созданная в 1969 году как альтернатива государственной медицинской школе, DIMER предоставляет жителям Делавэра возможность получить качественное медицинское образование.
Через компанию DIMER Делавэр поддерживает отношения с Медицинским колледжем Сиднея Киммела Университета Томаса Джефферсона в Филадельфии, штат Пенсильвания, и Филадельфийский колледж остеопатической медицины (PCOM), в результате чего Медицинский колледж Сидни Киммела и PCOM функционируют как медицинский центр штата Делавэр. школы.Каждый год двадцать (20) приемных мест в Медицинском колледже Сидни Киммела и десять (10) приемных мест в PCOM резервируются для абитуриенты первого года обучения из Делавэра, что повысило шансы приема студентов из Первого штата.
Приемлемые кандидаты должны быть законными резидентами штата Делавэр и соответствовать предварительным медицинским академическим требованиям предпочитаемой медицинский колледж; Медицинский колледж Сидни Киммела или PCOM.