Гальванический элемент в химии с примером
Гальванический элемент (гэ). Напряжение гальванического элементаГальванический элемент — это, прибор, который преобразует химическую энергию окислительно-восстановительной реакции в электрическую энергию.
Схема простейшего ГЭ Даниэля-Якоби представлена на рис. 5.
Гальванический элемент состоит из двух электродов, каждый из которых опущен в сосуд с соответствующим раствором соли: цинковый электрод погружен в раствор соли . Медный электрод погружен в раствор .
Сосуды соединены электролитическим мостиком, заполненным концентрированным раствором электролита (например, или ), который служит ионным проводником между двумя сосудами.
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие
поэтому возникает электродный потенциал меди.
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
1) реакция окисления цинка
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди
Процессы восстановления в электрохимии получили название электродных процессов, а электроды, на которых идут процессы восстановления, назвают катодами;
3) движение электронов во внешней цепи;
4) движение ионов в растворе: через электролитический мостик анионов к аноду, катионов к катоду.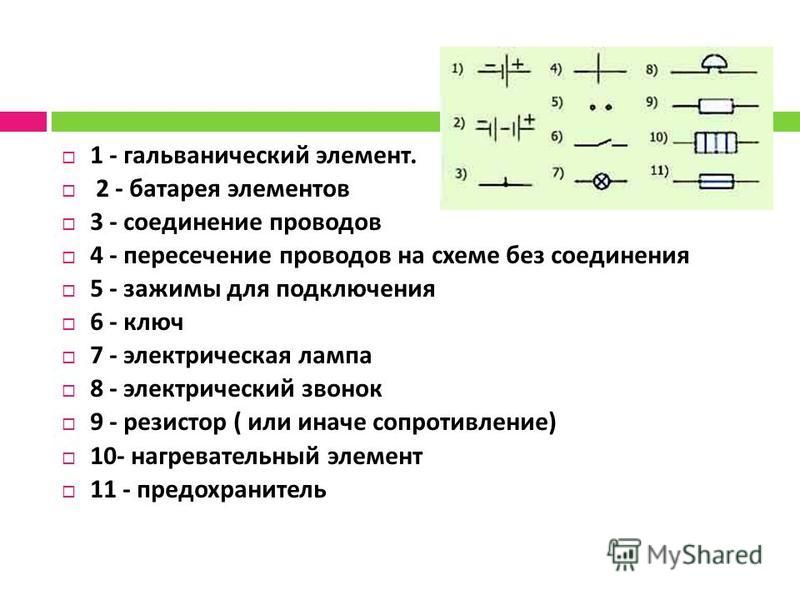 Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем
Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток, поэтому
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода — двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде:
для упрощения в таких схемах обычно опускается внешняя цепь. Как видно, в гальваническом элементе идет химическая реакция, а во внешней цепи элемента протекает электрический ток, т.е. в гальваническом элементе происходит превращение химической энергии в электрическую.
Электродвижущая сила. Напряжение элемента. Электрическая работа равна произведению разности потенциалов электродов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силон (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента.
Напряжение элемента. Электрическая работа равна произведению разности потенциалов электродов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силон (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента.
= Если на электродах испытывает превращение один моль вещества, то по закону Фарадея через систему протекает количество электричества, равное nF, где n — число молей эквивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля вещества равна
где — напряжение гальванического элемента.
В то же время максимальная полезная работа , которую может совершить система при протекании реакции при постоянном давлении, равна энергии Гиббса реакции
Так как , то, приравнивая первые части уравнений получаем
Значения термодинамических характеристик процесса получаются равными .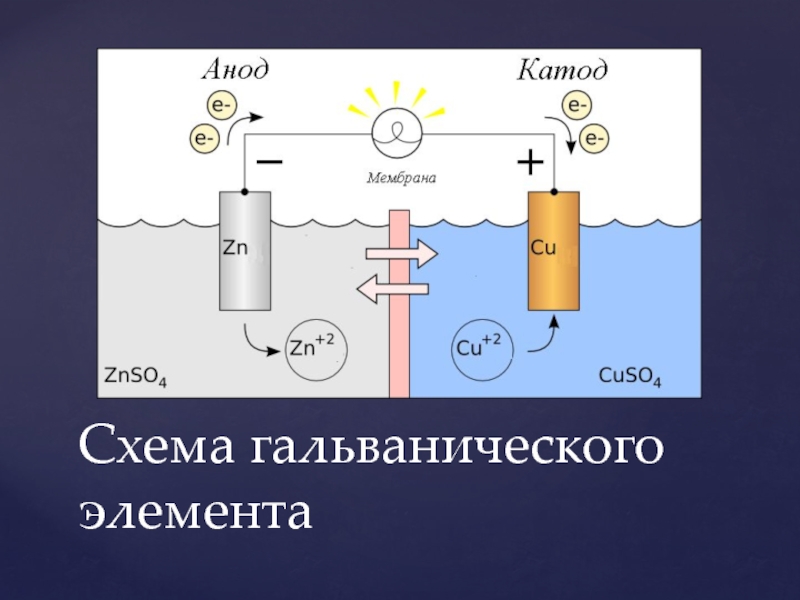 Отсюда =-216800 + 16,1 Т и при температуре 25°С. = -212,3- Вт, г/моль.
Отсюда =-216800 + 16,1 Т и при температуре 25°С. = -212,3- Вт, г/моль.
Согласно уравнения Нернста один и тот же электрод при различных концентрациях ионов имеет различное значение потенциала, поэтому возможны так называемые концентрационные ГЭ. Рассмотрим, например, ГЭ, составленный из двух медных электродов, опущенных в электролиты с разными концентрациями ионов .
Схема такого ГЭ:
Положим, что , тогда
Работа в концентрационном ГЭ совершается не за счет реакции окисления восстановления, а за счет выравнивания концентрации растворов. Если концентрация электролитов отличаются в 10 раз, то напряжение (э.д.с.) ГЭ равна 0,0295 в, а если в 100 раз, то — 0,059 в.
Применяются для определения одной из концентраций .
Концентрационная и химическая поляризация электронов.
На медном катоде в замкнутом элементе происходит восстановление ионов меди. При этом концентрация их при электродном слое снижается и тем сильнее, чем больше сила тока. Это затрудняет протекание реакции восстановления, и скорость катодной реакции определяется скоростью диффузии ионов к электроду. Уменьшение концентрации катионов меди по формуле Нернста приводит к уменьшению величины потенциала меди. Цинковый анод растворяется и тем с большей скоростью, чем больше сила тока. Это приводит к накоплению ионов цинка в приэлектродном слое, в результате чего его потенциал смещается по указанной причине в положительную сторону. Электроды в этом случае поляризуются благодаря изменению концентрации ионов у их поверхности. Такая поляризация носит название концентрационный или диффузионный.
Это затрудняет протекание реакции восстановления, и скорость катодной реакции определяется скоростью диффузии ионов к электроду. Уменьшение концентрации катионов меди по формуле Нернста приводит к уменьшению величины потенциала меди. Цинковый анод растворяется и тем с большей скоростью, чем больше сила тока. Это приводит к накоплению ионов цинка в приэлектродном слое, в результате чего его потенциал смещается по указанной причине в положительную сторону. Электроды в этом случае поляризуются благодаря изменению концентрации ионов у их поверхности. Такая поляризация носит название концентрационный или диффузионный.
В ряде случаев кроме поляризации, при протекании тока имеет место и так называемая химическая поляризация. Для иллюстрации этого явления составим следующую цепь:
В данном случае на платине восстанавливаются не ее ионы, поскольку их нет в растворе, а ионы водорода до атомного водорода, который адсорбируется на платине и частично растворяется в ней, а также превращается в молекулярный водород.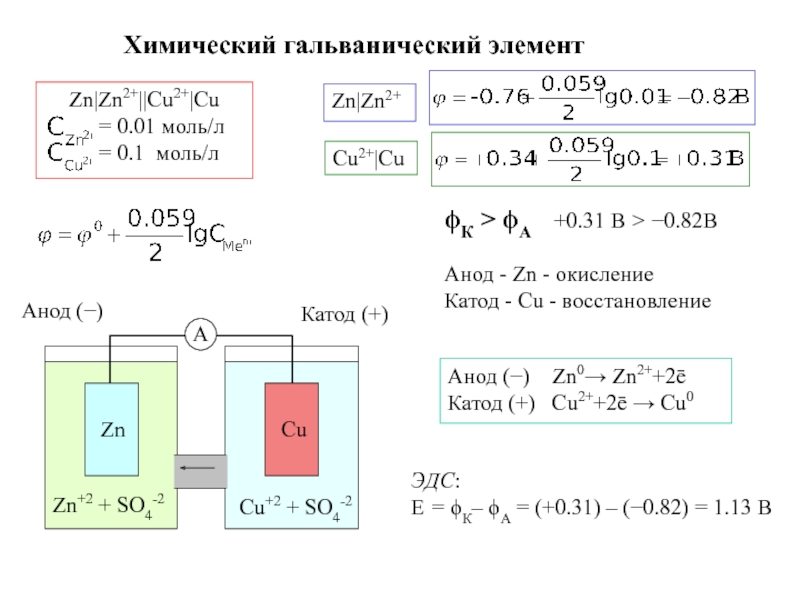
Гальванический элемент состоит из двух электродов: катода (+) и анода (-) и из одного или дух электролитов, разделенных между собой пористой перегородкой, ограничивающей их смешивание. Известны типы гальванических элементов: химические, концентрационные,
окислительно-восстановительные. В гальваническую пару можно сочетать также электроды, принадлежащие к различным видам. При таком сочетании электродов не представляется возможным классифицировать элементы, исходя из природы электродов. Классификация окажется очень громоздкой. Поэтому элементы подразделяют по другим признакам: по особенностям работы, назначению и конструкциям.
Гальванические элементы делят на первичные химические источники тока и вторичные. К первичным относятся вес ранее рассмотренные элементы. Их можно использовать только один раз. После разряда они становятся непригодными к дальнейшей работе.
К вторичным относят аккумуляторы (накопители электричества). Аккумулятор после разряда можно снова зарядить, г.е. превратить продукты реакции путем электролиза в исходные вещества. При этом электрическая энергия превращается в химическую.
Первичные источники тока в свою очередь делят на элементы с жидким электролитом (наливные) и «сухие» (непроливающиеся) элементы с загущенным электролитом. Сухие элементы можно подразделить по признаку катодных деполяризаторов на элементы с твердыми окислителями, воздушной системы и смешанной марганцово-воздушной системы.
Аккумуляторы. Аккумуляторы — обратимые гальванические элементы.
Вещества, из которых изготовляют электроды, и электролиты подобраны в аккумуляторах с таким расчетом, чтобы обратимость химических процессов при электролизе (зарядке) достигалась с минимальной потерей энергии на побочные реакции и в виде теплоты.
Понятно, что медно-цинковый элемент с двумя разделенными пористой перегородкой растворами не пригоден в качестве аккумулятора. Так как происходящие в нем диффузионные процессы необратимы. При этом восстановление ионов цинка до металлического при зарядке будет сопровождаться побочной реакцией восстановления водорода.
Из огромного количества исследованных гальванических элементов удовлетворяют указанным требованиям свинцовый аккумулятор Плантэ, железо-никелевый (кадмиево-никелевый) аккумулятор Эдиссона и серебряно-цинковый аккумулятор Андре.
Свинцовый аккумулятор (рис. 6) был изобретен в результате работ Якоби, Плате и братьев Тюдор. В незаряженном виде он состоит из свинцовых пластин, отлитых в виде решеток. Отверстия отрицательных решеток заполнены пастой из свинцового глета РЬО и воды, а положительных — суриком . Пластины сушат и путем электролиза РЬО превращают губчатый свинец, а — в двуокись свинца . После «формовки током» отрицательные пластины имеют светло-серый цвет, а положительные темно-коричневый. Такие аккумуляторы называют сухозаряженными.
Такие аккумуляторы называют сухозаряженными.
Перед использованием в аккумулятор наливают 30%-ый раствор серной кислоты.
При этом образуется гальваническая цепь:
с напряжением около 2 в (при 18°С в 20%-ый
При разрядке аккумулятора на электродах протекают следующие реакции: на катоде
на аноде
Вещества катода и анода превращаются в сернокислый свинец, а химическая энергия — в электрическую.
При зарядке аккумулятора на электродах протекают следующие реакции:
на катоде
на аноде
Суммируя процессы зарядки и разрядки, получим:
В гальваническом элементе катод заряжен положительно, а анод -отрицательно. При электролизе, наоборот, катод заряжен отрицательно, а анод -положительно. Однако в любом случае на катоде протекает реакция восстановления, а на аноде — окисления. При зарядке и разрядке аккумулятора полярность электродов остается неизменной.
Исходя из равновесных потенциалов и , казалось бы, можно ожидать, что при зарядке свинцового аккумулятора на катоде будет преимущественно восстанавливаться водород, так как равновесный потенциал водородного электрода в сравнении с потенциалом свинца более положителен. В действительности же потенциал восстановления водорода на свинце благодаря его высокому перенапряжению оказывается значительно отрицательнее не только равновесного потенциала водородного электрода, но и потенциала восстановления двухвалентного свинца до металлического. Поэтому на катоде восстанавливается при зарядке только свинец.
В действительности же потенциал восстановления водорода на свинце благодаря его высокому перенапряжению оказывается значительно отрицательнее не только равновесного потенциала водородного электрода, но и потенциала восстановления двухвалентного свинца до металлического. Поэтому на катоде восстанавливается при зарядке только свинец.
После того как на катоде закончится восстановление катионов свинца до металлического свинца, а на аноде — окисление , при дальнейшем электролизе на электродах наблюдается бурное выделение водорода (на катоде) и кислорода (на аноде). При этом напряжение на зажимах повышается до 2,6 в, что указывает на окончание зарядки аккумулятора и начало электролиза воды. Зарядка ведется так, чтобы температура электролита не повышалась более 40°С.
Емкость свинцового аккумулятора около 35вт/ч (20000 кулонов) на 1 кг веса. Последняя возрастает с повышением концентрации кислоты до некоторого предела; максимум емкости соответствует концентрации кислоты около 30% (плотность 1,224).
Свинцовый аккумулятор отдает около 80% подведенной к нему электроэнергии и дает примерно 4 а/ч на 1 дм2 поверхности пластин. Аккумулятор считают практически разряженным, если его напряжение на зажимах упало на 10% (от 2 в).
В щелочном аккумуляторе Эдиссона электродами служат порошкообразное железо и (гидрат окиси никеля, который частично дегидратируется до ), в качестве электролита берут 21%-ный раствор КОН:
К электролиту часто добавляют гидрат окиси лития , который заметно повышает емкость аккумулятора.
Электроды щелочных аккумуляторов изготавливают в виде пакетов из стальной стали с большим числом отверстий для прохода электролита к действующей массе, закладываемой в пакеты. При сборке пластины изолируют одну от другой эбонитовыми стержнями.
При разрядке на электродах протекают следующие процессы:
на катоде
на аноде
Напряжение щелочного аккумулятора равна 1,33 — 1,40 в.
При зарядке на катоде железо из гидрата закиси восстанавливается до металлического; на аноде окисляется до . Водород на железном катоде при зарядке аккумулятора не восстанавливается благодаря чрезвычайно низкой концентрации ионов водорода в растворе щелочи и значительному перенапряжению водорода на железе.
Водород на железном катоде при зарядке аккумулятора не восстанавливается благодаря чрезвычайно низкой концентрации ионов водорода в растворе щелочи и значительному перенапряжению водорода на железе.
Суммарно процесс зарядки и разрядки можно изобразить следующим уравнением:
Максимальное напряжение при зарядке щелочного аккумулятора равно 1,8 в, конечное напряжение при разрядке 1 — 1,1 в. К.п.д. у щелочных аккумуляторов меньше, чем у свинцовых. Преимуществом щелочных аккумуляторов является их малый вес, простота ухода за ними, а также то обстоятельство, что случайные короткие замыкания не приносят такого вреда, как свинцовым аккумуляторам. При большой скорости образования сернокислого свинца он полу рыхлым, в результате чего электроды аккумулятора разрушаются.
Срок службы щелочных аккумуляторов в зависимости от электролита составляет 250-750 циклов.
Эта теория взята со страницы помощи по химии:
Онлайн помощь по химии
Возможно эти страницы вам помогут:
Сборка гальванического элемента и повышающего преобразователя и его использование для изучения электролитической диссоциации растворов электролитов
Описание
Гальванический элемент собирался с целью проверки диссоциации растворов электролитов. Гальванический элемент состоит из двух электродов разных металлов (Al, Cu), погруженных в растворы их сульфатов, соединённых соляным мостиком из раствора KCl.
Гальванический элемент состоит из двух электродов разных металлов (Al, Cu), погруженных в растворы их сульфатов, соединённых соляным мостиком из раствора KCl.
Сразу после сборки ГЭ как недостаток было выявлено низкое выходное напряжение. Для решения этой проблемы был изготовлен повышающий преобразователь, позволивший эффективно увеличить напряжение более чем в два раза.
Цель
Собрать гальванический элемент с повышающим импульсным преобразователям и применить его в качестве источника тока при изучении электролитической диссоциации растворов электролитов.
Результаты
В результате работы над проектом была собрана действующая модель гальванического элемента и импульсного повышающего преобразователя; также была использована конечная установка для изучения электролитической диссоциации растворов электролитов (например, раствора соляной кислоты).
Оснащение и оборудование, использованное при создании работы
Цифровая лаборатория по химии, аквадистиллятор, датчики электрического потенциала, медные и алюминиевые электроды, сульфаты меди и алюминия, стекловата.
Награды/достижения
- Призёр окружного этапа Московского городского конкурса проектов.
- Победитель городской открытой научно-практической конференции «Инженеры будущего 2018».
Перспективы развития результатов работы
В перспективе планируется более глубокое изучение ЭДС, внутреннего сопротивления и КПД гальванического элемента.
Особое мнение
«Мы считаем, что данная конференция является отличной возможностью для обучающихся московских школ представить свои работы на высоком городском уровне и обменяться опытом в различных направлениях естественно-научной сферы, ‒ говорят авторы. ‒ Эта деятельность была нам интересна, т. к. дала возможность расширить знания по физике и химии. А большая и сложная практическая часть позволила освоить новые методы работы с научным оборудованием и электротехническими установками»
Гальванический элемент: устройство, принцип работы, виды
Люди довольно часто сталкиваются с электрохимическими элементами в повседневной жизни: от одноразовых батареек АА в пультах дистанционного управления ТВ до литий-ионных батарей в смартфонах. Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.
Принцип работыГальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (h3SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (h3SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.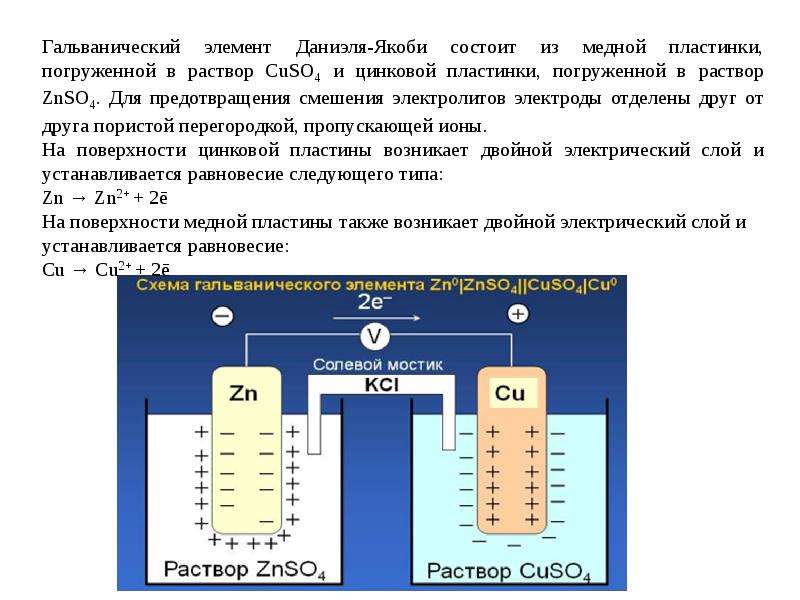
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
Александро ВольтВ 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее.
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Виды
Гальванические элементы классифицируются, как щелочные и нещелочные. Стандартная щелочная сухая батарея имеет цинковый А и К из диоксида марганца. Электролит выполнен в виде некислотной пасты. Обычно электролитом, используемым в щелочных батарейках — есть гидроксид калия. Она выполнена в форме стальной банки, заполненной диоксидом марганца в самой внутренней области К, и заполнена цинком и электролитом в центральной области А. Электролит, окружающий А, запускает химреакцию между ними.
Электролит, окружающий А, запускает химреакцию между ними.
Типичная нещелочная батарея с сухими элементами имеет цинковый А и К из углеродного стержня/ диоксида марганца. Электролит обычно представляет собой кислое пастообразное вещество из смеси хлорида аммония и хлорида цинка. Физически она имеет обратную щелочной батареи конструкцию. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень/ диоксид марганца занимает внутреннюю область в качестве К. Электролит смешивается с К и обеспечивает химическую реакцию между К и А.
Общее мнение специалистов говорит о том, что химически щелочная батарея имеет преимущества по отношению к нещелочной. Хотя последние более надежные и дешевые, тем не менее, щелочные, нужны, когда требуется быстрое, сильнотоковое потребление, например, вспышка на камере с быстрой перезарядкой.
Щелочные батареи
Эта конструкция ячейки получила свое название благодаря использованию щелочных водных растворов в качестве электролитов. Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.
Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.
Цинк в порошкообразной форме увеличивает площадь поверхности анода, что обеспечивает большее взаимодействие частиц. Это снижает внутреннее сопротивление и увеличивает плотность мощности. Катод, MnO2, произведен синтетически из-за его превосходства над природным MnO2, что дает рост плотности энергии. Как и в цинковой в углеродной ячейке, графит добавляется к катоду для увеличения проводимости.
Электролит КОН, обеспечивает высокую ионную проводимость. Оксид цинка часто включают для замедления коррозии цинкового анода. Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
Половинные реакции:
- Zn + 2OH — -> ZnO + h3O + 2 e —
- 2MnO2 + h3O + 2 e — -> Mn2O 3 + 2OH —
Общая реакция:
- Zn + 2MnO2 -> ZnO + Mn2O3 E = 1,5 В
Существуют и другие конструкции ячеек, которые относятся к категории щелочных, в том числе оксиды ртути, серебра и цинка. Ртуть и серебро дают еще более высокую плотность энергии, но стоят намного дороже и постепенно исключаются требованиями международных организаций из-за их высокой токсичности.
Солевые ячейки
Аккумуляторы с сухими элементами — это устройства, в которых используется электролит с очень низким содержанием влаги. Они контрастируют с батареями с мокрыми элементами, такими как свинцово-кислотные, в которых используется жидкий электролит. Электролит, используемый в большинстве устройств с сухими элементами, является пастой, которая, хотя и содержит влагу, тем не менее остается относительно сухой. Наиболее часто используемые формы сухих элементов — это батареи типа «С», «А», 9 вольт батарейки и для электронных часов.
Сухой элементВажно! Сухих элементы вырабатывают электроэнергию путем преобразования химической энергии в электричество. Выходные данные зависят от типа батареи с сухими элементами. Более популярными являются конструкции с использованием цинка и углерода или цинка и диоксида марганца.
Эти материалы помещаются в пасту электролита внутри батареи. Они реагируют друг с другом посредством химического процесса, в котором электролит, диоксид углерода или марганца реагирует с цинком, создавая электричество.
Литиевые аккумуляторы
Литий-ионная технология включает в себя несколько химических процессов: ионы лития хранятся в аноде или отрицательном электроде, и транспортируются во время разряда к катоду или положительному электроду в органическом электролите.
Наиболее популярными материалами являются графит для анода и оксид металла для катода на основе никеля, марганца и кобальта. Все эти материалы обладают хорошими свойствами интеркалирования лития, что позволяет хранить большое количество энергии.
Литий-ионный элементВыбор аккумуляторной технологии зависит от требований эксплуатации по производительности, сроку службы, безопасности и стоимости, причем каждый тип аккумулятора обеспечивает определенные функциональные возможности.
Преимущества литий-ионных аккумуляторов:
- Высокая плотность энергии. Высокая плотность энергии является одним из главных преимуществ технологии литиевых батарей, для того чтобы работать дольше.
- Саморазряд. Одной из проблем многих аккумуляторов является скорость саморазряда. Литий-ионные элементы в том, что скорость их саморазряда намного ниже, чем у Ni-Cad и NiMH. Обычно составляет около 5% в первые 4 часа после зарядки, но затем падает до 1 или 2% в месяц.
- Низкие эксплуатационные расходы, поскольку требуют технического обслуживания для обеспечения их производительности.
- Разнообразие типов: для бытовой электроники, для электроинструментов и электромобилей.
У таких батарей есть один существенный недостаток — им требуется встроенная схема защиты. Кроме того они страдают от старения и могут выдержать 500–1000 циклов зарядки-разрядки.
Устройство гальванического элемента
Гальваническая ячейка представляет собой простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию.
Строение гальванического элемента для литиевых батарей:
- Анод, при разряде отдает электроны во внешнюю цепь и окисляется во время электрохимической реакции. Большинство коммерческих элементов в настоящее время используют электрод на основе углерода/графита, однако можно использовать металл или сплав.
- Катод, на разряде принимает электроны из внешней цепи и восстанавливается во время электрохимической реакции. Обычно это переходный металлический оксид или фосфат.
- Электролит.
Обратите внимание! Строение электролита ионный проводник, при этом электронный изолятор, разделяет два электрода и обеспечивает среду для переноса заряда внутри ячейки между анодом и катодом. Электролитом обычно является неводный неорганический растворитель, содержащий растворенную соль лития, например LiPF6 в пропиленкарбонате.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.
Аккумуляторная батарейкаКлетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
- Реакция восстановления положительного электрода (катода): Li 1 -xCoO 2 + xLi + + xe- → LiCoO2
- Реакция окисления отрицательного электрода (анода): LiC 6 → xLi + + xC6 + e-
- Общая обратимая, окислительно-восстановительная, клеточная реакция: LiC 6 + CoO 2 C6 + LiCoO 2
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
Элемент гальванический, обратимый — Справочник химика 21
Если химическая реакция в гальваническом элементе протекает обратимо, то связь между э.д.с. и изменением энергии Гиббса в окислительно-восстановительном процессе при постоянных температуре и давлении может быть выражена соотношением [c.58]Гальванические элементы делят на обратимые и необратимые. В обратимом элементе все процессы протекают в обратном направлении, когда извне приложена э. д. с. на бесконечно малую величину, отличающуюся от э. д. с. элемента. В обратимом элементе, находящемся в разомкнутом состоянии, химическая реакция ие идет вещества, из которых он составлен, химически не изменяются, В необратимом гальваническом элементе прн приложении внешней э. д. с. обратная реакция не идет. В необратимом элементе, находящемся в разомкнутом состоянии, протекает химическая реакция. [c.125]
Обратимые и необратимые цепи. Общие термодинамические условия обратимости применительно к работе гальванических элементов могут быть сформулированы следующим образом. Гальванический элемент работает обратимо при соблюдении двух условий 1) если его э. д. с. лишь на бесконечно малую величину превышает приложенную к нему извне и противоположно направленную э. д. с. (обратимость условий работы) и 2) если реакция в элементе может быть полностью обращена в противоположном направлении при приложении к нему извне противоположно направленной э. д. с., которая лишь на бесконечно малую величину превышает э. д. с. данного элемента (обратимость самой цепи, т. е. химических реакций, происходящих на электродах). [c.421]
Вторичный элемент — гальванический элемент с обратимой реакцией ячейки. [c.93]
Представим себе, что гальванический элемент, помещенный в калориметр, замкнут накоротко. В этом случае производимая им электрическая энергия полностью превратится в тепло, количество которого равно тепловому эффекту реакции ДЯ, и, следовательно, работа будет равна нулю. Пусть теперь реакция в элементе осуществляется обратимо, например провода от электродов выведены из калориметра и электрический ток производит работу. Тогда, очевидно, часть освобождающейся при реакции энергии превратится в электрическую работу А, а другая часть д останется в виде тепла и будет измерена в калориметре. Согласно первому закону термодинамики [c.159]
Изменение изобарно-изотермического потенциала в результате химической реакции, протекающей в гальваническом элементе (если элемент работает обратимо), связано с э. д. с. уравнением [c.263]
Реакцию можно провести обратимо в топливном гальваническом элементе. В обратимых условиях при Т = 298,15 К и р = 1 атм энтальпия реакции равна —48,64 кДж. Отсюда изменение энтропии реакции равно —48,64/298,15 = = —163,1 Дж/(моль-К). [c.98]
Как указано выше, гальванический элемент работает обратимо лишь в том случае, когда э. д. с. только на бесконечно малую величину превышает противоположно направленную э. д. с., приложенную к нему извне. Следовательно, только в таких условиях производимая им работа будет равна максимальной работе реакции и разность потенциалов на электродах будет наибольшей. Чем больше реальные условия работы отличаются от указанных, тем меньшей будет э. д. с. элемента и тем больше будет различаться фактически получаемая от него работа от максимальной работы реакции. [c.424]
Следует отметить, что гальванический элемент, дающий электрический ток, находится в неравновесном состоянии. С уменьшением силы тока разность потенциалов между электродами возрастает. Если сила тока бесконечно мала и система практически находится в состоянии равновесия, то элемент работает обратимо. Максимальная разность потенциалов, достигаемая при обратимой работе гальванического элемента, называется его электродвижущей силой. [c.121]
Для иллюстрации полученных результатов рассмотрим изобарно-изотермический переход из одного и того же исходного состояния в одно и то же конечное состояние разными способами. Конкретным примером может служить химическая реакция в гальваническом элементе. При обратимом проведении процесса (как будет показано в гл. 5, для этого необходимо приложить к клеммам гальванического элемента противоположно направленную разность потенциалов, меньшую, чем ЭДС гальванического элемента, на бесконечно малую величину) может быть получена работа А гх.р.т. При необратимом проведении преврашения тех же количеств веществ, когда преодолеваются внешние силы (например, путем пропускания электрического тока через обмотку электродвигателя), совершается работа [c.90]
Пусть в гальваническом элементе при обратимом протекании реакции uA+bB- + dD перенесено zF электричества. Подставим (5.60) в уравнение изотермы химической реакцни [c.220]
Термодинамика гальванических элементов. Гальванические влементы широко используются для определения изменения свободной энергии Гиббса электрохимической реакции. Это связано с тем, что многие реакции в гальванических элементах протекают обратимо при постоянных температуре и давлении. Работа, совершаемая элементом в этих условиях, представляет максимальную полезную работу и равна произведению его ЭДС Е на количество прошедшего электричества ПеР, где Р = =96487,0 Кл/моль (число Фарадея), Ле —заряд иона, т. е. [c.252]
Для иллюстрации полученных результатов рассмотрим изобарно-изотермический переход из одного и того же исходного состояния в одно и то же конечное состояние разными способами. Конкретным примером может служить химическая реакция в гальваническом элементе. При обратимом проведении процесса (как будет показано в гл. 5, для этого необходимо приложить к клеммам гальванического элемента противоположно направленную разность потенциалов, меньшую, чем ЭДС гальванического элемента, на бесконечно малую величину), может быть получена работа Лтах.р.г. При необратимом проведении превращения тех же количеств веществ, когда преодолеваются внешние силы (например, путем пропускания электрического тока через обмотку электродвигателя), совершается работа Ар,т. Если же внешних сил нет (например, при коротком замыкании цепи), то никакой полезной работы не совершается. Так как G — функция состояния, ее уменьшение во всех трех случаях одинаково, но работа в первом случае равна —ДО, во втором — меньше —ДО, а в третьем равна нулю. [c.75]
Во втором случае часть этого изменения внутренней энергии — свободная энергия Дгальваническом элементе проводится обратимо, то сопровождающая ее убыль свободной энергии полностью идет на производство электрической работы. [c.154]
Гальванический элемент работает обратимо, если электрохимические процессы, в результате которых возникает ток, обратимы. Это означает, что реакции, происходящие [c.378]
Пример 16. Рассчитать изменение энтальпии ДЯ и количество теплоты д, выделяющееся в гальваническом элементе при обратимом протекании в водном растворе реакции [c.271]
При работе гальванического элемента химическая энергия реакции превращается в электрическую. Если химическая реакция в гальваническом элементе протекает обратимо, то получаемая работа будет максимальной. Это позволяет использовать электродвижущую силу гальванического элемента для определения изменения свободной энергии Гиббса АС проходящей в нем реакции. [c.250]
Все химические источники тока делят на две большие группы — необратимые (гальванические элементы) и обратимые (аккумуляторы). Первые допускают однократное, вторые — многократное использование. [c.260]
Поскольку гальванический элемент дает ток, он может производить электрическую работу А, например вращать электрический мотор. Эта работа будет максимальной, если элемент работает обратимо. Электрическая работа равна произведению разности потенциалов между электродами, т. е. электродвижущей силы Е (э.д.с.), на количество протекшего через цепь электричества. В рассматриваемом элементе, когда в реакцию вступает по 1 моль двухвалентных цинка и меди, через цепь переносится количество электронов, равное удвоенному числу Авогадро — Ма (6,02-102 ), или, другими словами, 2 моль электронов, которые переносят количество электричества, равное 2-96 485 Кл или 2 фарадея (2Е). Поэтому работа А = 2РЕ. В общем случае А = пРЕ, где п —число электронов, которые участвуют в реакции, протекающей в элементе. Так как при обратимых процессах при постоянных р и Г работа равна убыли энергии Гиббса Л = —АО, то [c.105]
При измерении э. д. с. гальванических элементов необходимо, чтобы химическая реакция в гальваническом элементе протекала обратимо, что возможно при небольшом значении силы протекающего тока. Этому требованию удовлетворяет компенсационный метод измерения э. д. с. (метод Поггендорфа), в котором при приближении к компенсации через гальванический элемент проходят токи с силой не более 10 А. [c.554]
Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называет- [c.334]
Задача 8. При работе гальванического элемента в обратимых [c.226]
Работа любого гальванического элемента будет определяться разностью потенциалов (ЭДС) и величиной прошедшего электрического заряда. Определим работу медно-цинкового элемента, полагая, что в раствор перешел 1 моль цинка или выделился на медном электроде 1 моль меди, что эквивалентно. Считаем, что активности растворов электролитов равны единице и что элемент работает обратимо (/=0). [c.235]
Определим работу гальванического элемента при условии, что элемент работает обратимо (1—0), активные концентрации ионов и Zn равны 1, и в раствор перешел грамм-атом Zn, что эквивалентно осаждению из раствора грамм-атома Си. [c.274]
Э. д. с. и реакция в элементе. Уравнение (1.3) выражает соотношение между э. д. с. гальванического элемента и уменьшением свободной энергии, когда реакция в элементе протекает обратимо. Обе эти величины измеряют тенденцию к протеканию реакции в элементе. Уместно рассмотреть далее влияние изменения концентрации или активности индивидуальных реагентов пли продуктов реакции на величину э. д. с. . Для этого напишем реакцию, происходящую в элементе, в общем виде [c.15]
Гальванический элемент работает обратимо, если электрохимические процессы, в результате которых возникает ток, обратимы. Это означает, что реакции, происходящие при приложении к элементу э. д. с. извне (при обратном течении тока), об-ратны тем, которые происходили при прямом течении процесса. [c.425]
Максимальное напря . е гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой Е (5. д. с.) элемента. Если реакция осуществляется в стандартных условиях, т. е если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом э. д. с. называется стандартной электродвижущей силой данного элемента. [c.178]
Но поскольку эта работа зависит от силы тока, то и напряжение между полюсами элемента тоже зависит от силы тока (Р — величина постоянная). В предельном случае, отвечающем обратимому протеканию реакции, напряжение будет максимальным. Максимальное З11ачение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой (э.д.с.) данного элемента. [c.276]
После прохождения через элемент 1 f кулонов электричества (IF) образуется по 1 экв ионов С+ и А и исчезает такое же количество веществ С и А в соответствии с законом Фарадея. Наш гальванический элемент, таким образом, может служить источником электрического тока и, следовательно, совершать электрическую работу, благодаря протеканию к нем химической реакции (IX. 3). Если все процессы в этом элементе происходят обратимо и при Т, р = onst, то электрическая работа, совершаемая элементом при прохождении IF и равная FE, будет максимальной полезной работой процесса и по (1.90) равна убыли энергии Гиббса при образовании 1 экв ионов С+ и А- по реакции (IX. 3) [c.480]
Общие термодинамические условия обратимости применитель- но к работе гальванических элементов могут быть сформулированы следующим образом. Гальванический элемент работает обратимо при соблюдении двух условий I) если его ЭДС лишо на бесконечно малую величину превышает приложенную к нему извне и противоположно направленную ЭДС и 2) если реакция в элементе может быть полностью обращена в противоположном направлении при приложении к нему извне противоположно направленной ЭДС, которая лишь на бесконечно малую величину превышает ЭДС данного элемента. [c.335]
Очевидно, чем ближе протекание реакций в гальваническом элементе к условиям обратимости, тем большая часть АО превращается в работу. Величина Р, которая характеризует связанную энергию, определяет количество тепла, неизбежно выделяющегося (или поглощающегося) в том случае, когда элемент работает обратимо. Так как 1дА0/дТ)р = —А8 и (дАО/дТ)р=—пр( Е/йТ] то [c.211]
Г альванические элементы могут быть обратимыми и необратимыми. Гальванический элемент назьшается обратимым, если токообразующая реакция в элементе может быть обращена в иротивоноложном нанравлении нри ириложении к нему извне ЭДС, превышающей собственную ЭДС элемента на бесконечно ма.лую величину. Естественно, что обратимые гальванические элементы имеют обратимые электроды со строго онределенны-ми равновесными нотенциалами. Все рассмотренные выше электроды и гальванические элементы относятся к обратимым. Нанример, в эле- [c.66]
Проведенное в разделе III обсуждение результатов, полученных методом э.д.с., дает основания считать, что гальванические элементы работали обратимо и к изменению термодинамических функций AG°, АН° и AS°, отвечающих как реакциям суммарных потенциалобра-з ющих процессов элементов, так и реакциям образования трифторидов из элементов, применим 2-й закон термодинамики АС° = АЯ°—7 А5°, где Т — средняя температура исследования элемента. [c.135]
Гальванические элементы — Электростанции
В настоящее время не стоит вопрос о получении с помощью гальванических элементов больших количеств электрической энергии и это вряд ли целесообразно, поскольку потребности современного общества в электроэнергии вполне удовлетворяются за счет сети электропередач. Однако в технике и быту постоянно растет число таких приборов, машин и сигнальных устройств, для которых требуются автономные, малогабаритные легкие и надежные источники тока. Здесь можно назвать аккумуляторы для автомобилей и самолетов, источники тока для электроинструментов, сигнальных устройств, транзисторных приемников, электрических карманных фонариков, наручных часов и т.д. и, конечно же, для искусственных спутников Земли и космических лабораторий. Гальванические элементы находят также применение в различных предохранительных устройствах.
Црактика предъявляет к современным гальваническим элементам весьма разнообразные требования. Вследствие все возрастающего и весьма разнообразного спроса на гальванические элементы в последнее время вновь расширяются научные исследования, направленные на разработку новых и усовершенствование старых типов элементов.
Гальванические элементы как источники электрической энергии обладают существенными преимуществами: они могут быть различных размеров и форм, не имеют макроскопически подвижных, подверженных износу частей, относительно легки и автономны, мало чувствительны к вибрации и колебаниям температуры, работают бесшумно, хорошо регулируются. Их КПД довольно высок (до 90%), так как превращение химической энергии в электрическую совершается в них без промежуточной тепловой стадии, а электродные процессы в некоторых случаях близки к обратимым.
Типы гальванических элементов.
Гальванические элементы, применяемые на практике для получения электрической энергии, делятся на первичные и вторичные.
Первичные элементы не могут быть возвращены в рабочее состояние после того, как их наполнитель (активное вещество) был уже однажды израсходован. В этом случае говорят, что элемент истощен. У таких элементов нельзя или по меньшей мере неэкономично обращать электродный процесс, пропуская ток в обратном направлении. Этот тип обычно называют просто элементом.
Вторичные элементы или аккумуляторы можно регенерировать после истощения, если пропустить через них ток в обратном направлении (зарядить), потому что процессы генерации тока, происходящие на их электродах, с хорошим приближением электрохимически обращаемы. Принципиального же различия между первичными и вторичными элементами нет.
Основными требованиями к гальваническим элементам являются следующие: большой срок службы, высокие плотность тока и напряжение на клеммах. Желательно также, чтобы они обладали высоким КПД, использовали дешевые активные вещества, имели малые размеры и вес, были просты по устройству и долговечны.
Основные параметры гальванических элементов
Рассмотрим основные параметры гальванических элементов.
Электродвижущая сила — разность потенциалов между электродами гальванического элемента* когда между электродами и раствором существует равновесие и через элемент не проходит ток. Значение эдс не зависит ни от размеров элемента, ни от его внутреннего сопротивления, а является лишь функцией состава электродов и концентрации электролита.
Напряжение на клеммах — разность потенциалов между полюсами в процессе прохождения тока, когда полюса соединены между собой через сопротивление. Напряжение на клеммах меньше, чем эдс, причем различие между ними тем меньше, чем меньше внутреннее сопротивление элемента по сравнению с внешним и чем меньше поляризованы электроды.
Внутреннее сопротивление — выраженное в омах сопротивление электродов и находящегося между ними раствора электролита.
Емкость элемента — выраженное в кулонах или ампер-часах количество электричества, которое элемент способен отдать при соответствующих условиях. У аккумуляторов следует отличать разрядную емкость от зарядной. Обычно емкость выражают через электрическую энергию и в большинстве случаев измеряют ватт-часах или киловатт-часах. Емкость элемента данного типа тем больше, чем большее количество электрохимически активных веществ, которые превращают химическую энергию в электрическую, он содержит и чем меньше плотность генерируемого тока.
Мощность элемента — это количество электрической энергии, получаемое за секунду, равное напряжению на клеммах, умноженному на силу тока, которую без ущерба может дать элемент. Максимальная сила тока, которую можно получить от элемента, определяется этой мощностью, деленной на напряжение на клеммах.
Существенным недостатком гальванических элементов является саморазряд — расходование ими электрохимически активных веществ при отсутствии внешнего тока. Причиной этого может быть- например, растворение металла электродов вследствие образования так называемых локальных элементов, или протекание процесса, генерирующего ток, «непосредственным химическим» путем, или же недостаточная изолирующая способность диэлектрических деталей элемента. Саморазряд уменьшает срок службы элемента, последний со временем становится непригодным, даже если он вообще не использовался для получения энергии.
Всего комментариев: 0
Схема гальванического элемента. 145 — 146
Схема кобальто-хромового гальванического элемента
Задача 8.
Составить схему гальванического элемента, в котором электродами являются два металла Co/Cr, опущенные в растворы их солей с концентрацией ионов 1 моль/л. Описать процессы, которые протекают на катоде и аноде, и вычислить ЭДС гальванического элемента.
Решение:
Электродные потенциалы металлов:
E(Cr3+/Cr) = -0,74 B; E(Co2+/Co) = -0,28 B.
Следовательно, в гальваническом элементе, в котором электродами являются два металла Co/Cr, опущенные в растворы их солей с концентрацией ионов 1 моль/л, электроны будут перемещаться от электрода с более положительным значением стандартного потенциала к электроду с более отрицательным значением стандартного потенциала. Так как электродный потенциал собальта (-0,28 B) более электроположителен чем у хрома (-0,74 B), то электроны будут перемещаться от кобальтового электрода к хромовому, т.е. кобальтовый электрод будет катодом, хромовый — анодом.
Тогда схема гальванического элемента будет иметь вид:
(-)Со|Co2+(1M)||Cr3+(1M)|Cr(+)
На катоде протекает реакция восстановления:
Co2+ + 2 = Со0
На аноде будет протекать процесс окисления:
Cr0 — 3 = Cr3+
Если электроды опущены в растворы их солей с концентрацией ионов 1 моль/л, то значения потенциалов их при этой концентрации будут равны их стандартным электродным потенциалам.
Теперь рассчитаем ЭДС, получим:
ЭДС = Е(катод) — Е(анод) = -0,28 — (-0,74) = +0,46 В.
Схема гальванического элемента составленного из кобальта и железа
Задача 146.
Дать схему гальванического элемента составленного из кобальтовой и железной пластинок, опущенных в 1М растворы их сульфатов. Указать направление движения электронов в сети и ионов в растворе. Написать уравнения катодного и анодного процессов во время работы элемента и вычислить ЭДС элемента.
Решение:
Электродные потенциалы металлов:
E(Fe2+/Fe) = -0,44 B; E(Co2+/Co) = -0,28 B.
Следовательно, в гальваническом элементе, в котором электродами являются два металла Co/Fe, опущенные в растворы их сульфатов с концентрацией ионов 1 моль/л, электроны будут перемещаться от электрода с более положительным значением стандартного потенциала к электроду с более отрицательным значением стандартного потенциала. Так как электродный потенциал собальта (-0,28 B) более электроположителен чем у хрома (-0,74 B), то электроны будут перемещаться от кобальтового электрода к железной пластинки, т.е. кобальтовая пластинка будет катодом, железная пластинка — анодом.
Тогда схема гальванического элемента будет иметь вид:
(-)Со|CoSO4(1M)||FeSO4(1M)|Fe(+)
На катоде протекает реакция восстановления:
Co2+ + 2 = Со0
На аноде будет протекать процесс окисления:
Fe0 — 2 = Fe2+
Если электроды опущены в растворы их солей с концентрацией ионов 1 моль/л, то значения потенциалов их при этой концентрации будут равны их стандартным электродным потенциалам. К катоду будут двигаться ионы Со2+ и там разряжаться, а к аноду будут двигаться ион SO42- которые соединяются с ионами Fe2+, образуя FeSO4:
Fe2+ + SO42- = FeSO4.
Теперь рассчитаем ЭДС, получим:
ЭДС = Е(катод) — Е(анод) = -0,28 — (-0,44) = +0,16 В.
Коррозионный гальванический элемент | Всё о красках
При электрохимической коррозии протекают два, процесса — катодный и анодный, которые образуются на различных участках металлической поверхности. При этом катодные и анодные участки пространственно разделены (локализованы). Локализация анодных и катодных участков вызывается неоднородностью: присутствием в металле незначительных примесей, структурных составляющих сплавов; неравномерным распределением собственных ионов металла, ионов водорода, кислорода и др. возле корродирующей поверхности; неравномерным нагревом различных участков поверхности и наложением внешнего электрического поля; неоднородностью поверхности металла, обусловленной дефектами защитных пленок, продуктов коррозии неравномерной деформацией, неравномерностью приложенных внешних нагрузок.
В общем случае локализация процессов происходит на участках отличающихся физическими и химическими свойствами.
Модель коррозионного элемента показана на рис2. Выделяют три основные стадии коррозионного процесса.
1. Анодный процесс — переход ионов металла в раствор и гидратация с образованием некомпенсированных электронов на анодных участках по реакции
Ме + nН2О → Меz+ + nН2О + ze.
2. Процесс электропереноса — перетекание электронов по металлу от анодных участков к катодным и соответствующее перемещение катионов в растворе.
3. Катодный процесс — ассимиляция электронов каким-либо деполяризатором — ионами и молекулами, находящимися в растворе и способными восстанавливаться на катодных участках по реакции
D + z → [D z ].
Рис. 2. Схема электрохимического коррозионного процесса
Если процесс деполяризации происходит за счет восстановления кислорода, то коррозионный процесс идет с кислородной деполяризацией
О2 + 2Н2О + 4 → 4ОН-.
Если деполяризатором служат ионы водорода, то процесс идет с водородной деполяризацией
Н+ + → Н,
Н + Н → Н2 → Н2↑.
Особенности электрохимического процесса коррозии следующие:
- одновременное протекание катодного и анодного процессов;
- зависимость скорости коррозии, обусловленной механизмом электрохимических процессов, от электродного потенциала металла;
- возможность локализации электродных процессов на различных участках поверхности корродирующего металла, где их протекание облегчено;
- реализация материального эффекта коррозии (растворение металла) на анодных участках при локализации электродных процессов.
Контролирующий фактор электрохимической коррозии, определяющий ее скорость, — поляризация электрода — изменение разности потенциалов коррозионного элемента, приводящее к уменьшению силы тока. Поляризация тормозит скорость протекания электрохимической коррозии металлов. Основная причина поляризации — отставание электродных процессов (катодного и анодного) от перетока электронов в металле. Так, если анодный процесс отстает от перетока электронов от анода к катоду, то происходит уменьшение отрицательного заряда на поверхности электрода. Потенциал анода при этом становится положительнее. Катодный процесс отстает от поступления электронов на катод, происходит увеличение отрицательного заряда на поверхности электрода, что приводит соответственно к сдвигу потенциала катода в отрицательную сторону.
При графическом изображении зависимости потенциала электрода от плотности тока с помощью поляризационных кривых наглядно видно, что при катодной поляризации происходит рост потенциала, а при анодной — его снижение (рис. 3). Чем круче поляризационная кривая, тем больше величина поляризационного сопротивления и тем труднее протекает коррозионный процесс. При пологих поляризационных кривых происходит малая поляризация и легче протекает коррозионный процесс. Скорость коррозии уменьшается как вследствие поляризации анода, так и катода.
Рис. 3. Поляризационные кривые:
1 —анодная; 2 — катодная
В общем случае скорость электрохимического коррозионного процесса можно выразить следующим соотношением:
где I — сила коррозионного тока; φко – φао — разность начальных потенциалов катода и анода, являющаяся движущей силой коррозионного процесса, характеризует термодинамическую возможность протекания электрохимической коррозии; R— омическое сопротивлении коррозионного элемента; Рк, Ра- поляризационное сопротивления катодного и анодного процессов соответственно (сопротивление протеканию электродных процессов). Оно имеет смысл для линейной! поляризации (линейной зависимости тока от потенциала).
При нелинейной зависимости тока от потенциала используют понятие поляризуемости
Р’к = Δφк/Δiк; Р’а = Δφа/Δiа.
Эти величины — отношение величины смещения потенциала к плотности или приращению плотности тока. Омическое сопротивление учитывает сопротивление электролита.
Снизить скорость коррозии можно при:
- уменьшении степени термодинамической нестабильности — сближении потенциалов катодного и анодного процессов;
- увеличении катодной поляризуемости Р, приводящем к торможению катодного процесса;
- увеличении анодной поляризуемости Р, приводящем к торможению анодного процесса;
- увеличении омического сопротивления R.
Торможение коррозионного процесса по одному из указанных Путей определяет вид контроля.
Различают коррозию, протекающую с катодным, анодным или омическим контролем. В практике нефтяной промышленности встречаются в основном процессы с катодным контролем.
Электродные процессы, уменьшающие поляризацию на аноде и Катоде, называются процессами деполяризации, а вещества, препятствующие поляризации, — деполяризаторами. На практике встречаются и в основном процессы коррозии с кислородной и водородной деполяризацией.
При коррозии с водородной деполяризацией на катоде протекает реакция разряда ионов гидроксония по схеме
2Н3О+ +2→ 2Н2О + Н + Н → 2Н2О + Н2↑.
Катодный процесс водородной деполяризации состоит из: диффузии ионов гидроксония к катоду с последующим их разрядом и образованием водородных атомов, адсорбирующихся на металле; полязации водородных атомов с образованием молекулярного водорода, который, в свою очередь, диффундирует и переносится конвекцией от катодных участков в раствор. Часть адсорбированных атомом водорода диффундирует в металл, вызывая явление водородного охрупчивания.
Процессы водородной деполяризации характерны в основном для технологических процессов, протекающих в кислых средах.
Коррозия с кислородной деполяризацией — наиболее распространенный процесс, так как по этому механизму корродируют металлы в водных средах, влажной атмосфере, почве. Катодный процесс кислородной деполяризации заключается в ионизации кислорода на катоде. Причем в зависимости от рН среды будут различными конечные продукты ионизации. При рН > 7 ионизация кислорода на катоде протекции по схеме
О2 + 4+ 2Н2О → 4ОН-
, при рН < 7 — по схеме:
О2 + 4+ 4Н+ → 2Н2О.
Катодный процесс коррозии с кислородной деполяризацией имеет последовательные стадии: прохождение кислорода через поверхность раздела воздух—электролит; перенос растворенного молекулярного кислорода в объеме электролита при механическом перемешивании, конвекции и диффузии к катодным участкам поверхности; перенос кислорода в диффузионном слое; ионизация кислорода; диффузия и конвективный перенос ионов ОН= от катодных участков поверхности металла в электролит.
Коррозия зависит от нескольких факторов. Скорость электрохимической коррозии металлов существенно зависит от температуры, с ее повышением скорость растет. При нейтральных значениях рН для процесса коррозии с кислородной деполяризацией зависимость скорости коррозии от температуры носит сложный характер. Это связано с тем, что с повышением температуры уменьшается растворимость кислорода. В открытых аэрируемых системах скорость коррозии железа с ростом температуры в пределах от 293 до 353 К возрастает и далее уменьшается вследствие резкого снижения концентрации кислорода. В закрытой системе, когда кислород не может выделяться из раствора скорость коррозии железа непрерывно растет с повышением температуры.
В минерализованных средах скорость коррозии стали растет с увеличением скорости движения среды из-за усиления подачи кислорода к металлической поверхности. В пресной воде при скорости движения среды до 0,4 м/с скорость коррозии стали заметно возрастает вследствие облегчения диффузии кислорода к металлической поверхности. С ростом скорости движения насыщенной кислородом среды до 0,8—0,9 м/с скорость коррозии снижается в результате образования пассивной пленки на металле при достаточно обильном пoступлении кислорода. При дальнейшем увеличении скорости движения среды происходит разрушение защитной пленки и самого металла в результате коррозионно-эрозионных и кавитационных процессов. Скорость коррозии при этом растет.
Давление в значительной степени ускоряет электрохимическую коррозию металлов из-за повышения растворимости деполяризаторов коррозионного процесса (кислород, сероводород и др.) и появления механических напряжений в металле.
Поляризация корродирующего металла внешним постоянным током влияет на коррозионное разрушение металлов: при анодном поляризации металла (подключении его к положительному полюсу внешнего источника тока) скорость коррозии увеличивается, при катодной поляризации в большинстве случаев наблюдается защитный эффект, т.е. скорость коррозии металла уменьшается.
Скорость коррозии зависит от рН среды, возрастая по мере подкисления среды, если не происходит пассивирования металла. В нейтральных средах скорость коррозии железа слабо зависит от изменения величины рН. При возрастании рН скорость коррозии железа и стали уменьшается.
Наличие в среде микроорганизмов и продуктов их жизнедеятельности оказывает существенное влияние на характер коррозионных разрушений металлов. При микробиологической коррозии коррозионные поражения носят локальный характер, скорость коррозии достигает значительных величин.
Внутренняя электрохимическая коррозия металлов связана с природой металла, его составом, структурой, состоянием поверхности, напряжениями в металле, а также с термодинамической устойчивостью металла и его местом в периодической системе элементов. Так, металл, нестойкий в одних условиях, в других условиях оказывается стойким. Это обусловлено тем, что протекание термодинамически возможного процесса бывает заторможено образующимися пассивными пленками, труднорастворимыми продуктами коррозии.
Термодинамическая устойчивость выше у металлов с более положительным равновесным потенциалом. Для оценки коррозионного процесса необходимо знать кинетику катодного и анодного процессов. Скорость и характер коррозии металлов в электролитах зависят структуры, состояния исходной поверхности металла, различных и воздействия механического фактора.
Тщательно отполированная поверхность металла придает ему коррозионную устойчивость в агрессивных средах, так как облегчается образование более совершенных и однородных защитных пленок, в том числе не и пассивных.
На процесс коррозии металлов оказывают влияние кристаллическая структура металлов и наличие различных структурных дефектов. Установлено, что скорость коррозии увеличивается при низкой плотности упаковки атомов и кристаллографической плоскости, неупорядоченности атомов кристаллической решетки, дефектах ее структуры. Структурная гетерогенность сплава во многом предопределяет развитие электрохимической коррозии. В отличие от однородных сплавов гетерогенной структуры менее стойки к коррозии. Скорость коррозии уменьшается, если анодная фаза гетерогенной структуры способна пассивироваться. После растворения анодной фазы в поверхностном слое сплав приобретает практически однофазную структуру. Если заметно коррозирует и катодный компонент сплава, то возможно вторичное (контактное, т.е. без тока внешней поляризации) выделение благородного компонента на поверхности сплава в виде несплошного пористого покрытия. Коррозия при этом усиливается. Величина зерна в некоторой степени влияет на скорость коррозии. При утолщении и загрязнении границ его примесями увеличивается микроэлектрохимическая гетерогенность и может начаться процесс межкристаллитной коррозии.
Значительное число металлических изделий эксплуатируется в условиях одновременного воздействия коррозионной среды и механических напряжений. Опасность коррозионно-механического воздействия заключается в том, что при значительной скорости общей коррозии происходит полное разрушение металлического изделия. Под влиянием коррозионной среды и деформации металла возможны образование коррозионно-механических трещин, понижение предела коррозионной усталости, разрушение металла вследствие механического воздействия агрессивной среды, коррозионная кавитация и другие процессы.
17.2: Гальванические элементы — Chemistry LibreTexts
Цели обучения
- Использовать обозначение ячеек для описания гальванических элементов
- Описать основные компоненты гальванических элементов
Гальванические элементы, также известные как гальванические элементы, представляют собой электрохимические элементы, в которых спонтанные реакции окисления-восстановления производят электрическую энергию. При написании уравнений часто бывает удобно разделить окислительно-восстановительные реакции на полуреакции, чтобы облегчить балансировку общего уравнения и подчеркнуть фактические химические превращения.
Рассмотрим, что происходит, когда чистый кусок металлической меди помещают в раствор нитрата серебра (рис. 2 +} (водн.)
\ end {align} \]
Уравнение для полуреакции восстановления необходимо было удвоить, чтобы количество электронов, «приобретенных» в полуреакции восстановления, равнялось количеству электронов, «потерянных» в полуреакции окисления.
Рисунок \ (\ PageIndex {1} \): Когда чистый кусок металлической меди помещают в прозрачный раствор нитрата серебра (а), происходит реакция окисления-восстановления, которая приводит к замене Cu 2+ на Ag + ионов в растворе. По мере протекания реакции (b) раствор становится синим (c) из-за присутствующих ионов меди, и металлическое серебро осаждается на медной полосе по мере удаления ионов серебра из раствора. (кредит: модификация работы Марка Отта)Гальванические или гальванические элементы включают спонтанные электрохимические реакции, в которых половинные реакции разделяются (рисунок \ (\ PageIndex {2} \)), так что ток может течь через внешний провод.Стакан в левой части рисунка называется полуячейкой и содержит 1 M раствор нитрата меди (II) [Cu (NO 3 ) 2 ] с частично погруженным куском металлической меди. в растворе. Металлическая медь — это электрод. Медь окисляется; следовательно, медный электрод является анодом. Анод подключен к вольтметру с помощью провода, а другой вывод вольтметра подключен к серебряному электроду с помощью провода. Серебро сокращается; следовательно, серебряный электрод является катодом.Полуячейка в правой части рисунка состоит из серебряного электрода в 1 M растворе нитрата серебра (AgNO 3 ). В этот момент ток не течет, то есть не происходит значительного движения электронов по проводу, потому что цепь разомкнута. Цепь замыкается с помощью солевого мостика, передающего ток с движущимися ионами. Солевой мостик состоит из концентрированного инертного раствора электролита, такого как раствор нитрата натрия (NaNO 3 ), использованный в этом примере.Поскольку электроны проходят слева направо через электрод и провод, ионы нитрата (анионы) проходят через пористую пробку слева в раствор нитрата меди (II). Это сохраняет левый стакан электрически нейтральным за счет нейтрализации заряда ионов меди (II), которые образуются в растворе при окислении металлической меди. При этом ионы нитрата движутся влево, ионы (катионы) натрия движутся вправо, через пористую пробку, в раствор нитрата серебра справа.Эти добавленные катионы «заменяют» ионы серебра, которые удаляются из раствора по мере их восстановления до металлического серебра, сохраняя электрический стакан справа. Без солевого мостика отсеки не оставались бы электрически нейтральными, и значительный ток не протекал бы. Однако, если два отсека находятся в прямом контакте, солевой мостик не нужен. В момент замыкания цепи вольтметр показывает +0,46 В, это называется потенциалом ячейки. Потенциал ячейки создается при соединении двух разнородных металлов и является мерой энергии на единицу заряда, доступной в результате реакции окисления-восстановления.Вольт — это производная единица СИ для электрического потенциала
.\ [\ mathrm {volt = \ mathit {V} = \ dfrac {J} {C}} \]
В этом уравнении A — это ток в амперах, а C — заряд в кулонах. Обратите внимание, что вольт необходимо умножить на заряд в кулонах (C), чтобы получить энергию в джоулях (Дж).
Рисунок \ (\ PageIndex {2} \): В этом стандартном гальваническом элементе полуэлементы разделены; электроны могут течь по внешнему проводу и становиться доступными для выполнения электрических работ.Когда электрохимическая ячейка сконструирована таким образом, положительный потенциал ячейки указывает на самопроизвольную реакцию и , когда электроны текут слева направо.На рисунке \ (\ PageIndex {2} \) много всего происходит, поэтому полезно подвести итог для этой системы:
- Электроны текут от анода к катоду: слева направо в стандартной гальванической ячейке на рисунке.
- Электрод в левой полуячейке является анодом, потому что здесь происходит окисление. Название относится к потоку анионов в солевом мостике к нему.
- Электрод в правой полуячейке является катодом, потому что здесь происходит восстановление. Название относится к потоку катионов в солевом мостике к нему.
- Окисление происходит на аноде (левая полуячейка на рисунке).
- Восстановление происходит на катоде (правая полуячейка на рисунке).
- Потенциал ячейки, +0,46 В, в этом случае является результатом внутренних различий в природе материалов, используемых для изготовления двух полуячейков.
- Должен присутствовать солевой мостик, чтобы замкнуть (завершить) цепь, и для протекания тока должны происходить как окисление, так и восстановление.
Существует много возможных гальванических элементов, поэтому для их описания обычно используются сокращенные обозначения.Обозначение клеток (иногда называемое диаграммой клеток) предоставляет информацию о различных видах, участвующих в реакции. Это обозначение также работает для других типов ячеек. Вертикальная линия обозначает фазовую границу, а двойная линия ‖ — солевой мостик. Информация об аноде записывается слева, за ней следует раствор анода, затем солевой мостик (если он есть), затем раствор катода и, наконец, информация о катоде справа. Обозначение ячейки для гальванической ячейки на рисунке \ (\ PageIndex {2} \) тогда
\ [\ ce {Cu} (s) │ \ ce {Cu ^ 2 +} (aq, \: 1 \: M) ║ \ ce {Ag +} (aq, \: 1 \: M) │ \ ce { Ag} (s) \]
Обратите внимание, что ионы-зрители не включены и что использовалась простейшая форма каждой полуреакции.Когда они известны, обычно включаются начальные концентрации различных ионов.
Одна из самых простых ячеек — ячейка Даниэля. Можно построить эту батарею, поместив медный электрод на дно банки и покрыв металл раствором сульфата меди. Раствор сульфата цинка плавает поверх раствора сульфата меди; затем цинковый электрод помещают в раствор сульфата цинка. Подключение медного электрода к цинковому электроду позволяет протекать электрическому току.Это пример ячейки без солевого мостика, и ионы могут проходить через границу раздела между двумя растворами.
В некоторых окислительно-восстановительных реакциях участвуют частицы, которые плохо проводят электричество, поэтому используется электрод, который не участвует в реакциях. Часто электродом является платина, золото или графит, которые инертны ко многим химическим реакциям. Одна такая система показана на рисунке \ (\ PageIndex {3} \). Магний подвергается окислению на аноде слева на рисунке, а ионы водорода восстанавливаются на катоде справа.2 +} (aq) ║ \ ce {H +} (aq) │ \ ce {h3} (g) │ \ ce {Pt} (s) \]
Магниевый электрод является активным электродом, поскольку он участвует в окислительно-восстановительной реакции. Инертные электроды, такие как платиновый электрод на рисунке \ (\ PageIndex {3} \), не участвуют в окислительно-восстановительной реакции и присутствуют, так что ток может течь через элемент. Из платины или золота обычно получаются хорошие инертные электроды, потому что они химически неактивны.
Рисунок \ (\ PageIndex {2} \): Окисление магния до иона магния происходит в стакане с левой стороны этого устройства; восстановление ионов водорода до водорода происходит в стакане справа.3 +} (водн.) + \ Ce {3Cu} (s) \]Запишите полуреакции окисления и восстановления и запишите реакцию в обозначениях ячеек. Какая реакция происходит на аноде? Катод?
Решение
При осмотре Cr окисляется, когда три электрона теряются с образованием Cr 3+ , а Cu 2+ восстанавливается, поскольку он получает два электрона с образованием Cu. 2 +} (водн.) + \ ce {4h3O} (l)
\ end {align} \]
использует простейшую форму каждого из уравнений и начинается с реакции на аноде.2 +} (aq) │ \ ce {Cu} (s) \ nonumber. \]
Сводка
Электрохимические ячейки обычно состоят из двух полуэлементов. Полуячейки отделяют полуреакцию окисления от полуреакции восстановления и позволяют току проходить через внешний провод. Одна полуячейка, обычно изображенная на левой стороне рисунка, содержит анод. Окисление происходит на аноде. Анод соединен с катодом в другой полуячейке, что часто показано на рисунке справа.Восстановление происходит на катоде. Добавление солевого мостика завершает цепь, позволяя току течь. Анионы в солевом мостике текут к аноду, а катионы в солевом мостике — к катоду. Движение этих ионов замыкает цепь и сохраняет электрическую нейтральность каждой полуячейки. Электрохимические ячейки можно описать с помощью обозначений ячеек. В этих обозначениях информация о реакции на аноде отображается слева, а информация о реакции на катоде — справа.Соляной мост изображен двойной линией ‖. Твердая, жидкая или водная фазы в полуячейке разделены одной линией. Фаза и концентрация различных видов указаны после названия вида. Электроды, участвующие в окислительно-восстановительной реакции, называются активными электродами. Электроды, которые не участвуют в реакции окисления-восстановления, но предназначены для протекания тока, являются инертными электродами. Инертные электроды часто делают из платины или золота, которые не меняются в результате многих химических реакций.
Глоссарий
- активный электрод
- электрод, участвующий в окислительно-восстановительной реакции электрохимической ячейки; масса активного электрода изменяется в процессе окислительно-восстановительной реакции
- анод
- электрод в электрохимической ячейке, на котором происходит окисление; информация об аноде записана на левой стороне солевого мостика в обозначении ячейки
- катод
- электрод в электрохимической ячейке, при котором происходит восстановление; информация о катоде записана на правой стороне солевого мостика в обозначении ячейки
- обозначение ячейки
- сокращенный способ представления реакций в электрохимической ячейке
- потенциал ячейки
- разность электрических потенциалов, возникающая при соединении разнородных металлов; Движущая сила для протекания заряда (тока) в окислительно-восстановительных реакциях
- гальванический элемент
- электрохимический элемент, в котором протекает спонтанная реакция окисления-восстановления; электрохимические ячейки с положительными потенциалами ячеек; также называется гальванический элемент
- инертный электрод Электрод
- , который пропускает ток, но не участвует в окислительно-восстановительной реакции в электрохимической ячейке; масса инертного электрода не изменяется в процессе окислительно-восстановительной реакции; инертные электроды часто делают из платины или золота, потому что эти металлы химически неактивны.
- гальванический элемент
- другое название гальванического элемента
Авторы и авторство
Гальванический элемент— обзор
Для гальванического элемента
(122) M (Hg) | MX (cin S) | AgX (s) | Ag (s),
, который включает химическую реакцию
(123 ) M (Hg) + AgX (s) ⇆MX (solv) + Ag (s),
ЭДС определяется соотношением
(124) −nFE = ∑β = 1v∑i = 1kωi (β) μi ( β).
В уравнениях. (122) и (123), M (Hg) представляет собой электрод из амальгамы щелочного металла, MX — сольватированный галогенид щелочного металла M с концентрацией c в растворителе S, а AgX (s) / Ag (s) — серебро. галогенидно-серебряный электрод.Уравнение (124) представляет собой общее выражение для электродвижущей силы E гальванического элемента без жидкостного перехода, в котором произвольная реакция ячейки ω1Y1 + ω2Y2 +… ⇆ωiYi +… ,, имеет место между k компонентами в ν-фазах. В формуле. (124) n — число молей электронов, перенесенных во время этого процесса от анода к катоду через внешнюю цепь, F число Фарадея и μ (β) i химический потенциал компонента Y и в фазе β.Ячейки с жидкостными переходами требуют электродвижущей силы E в формуле. (124) следует заменить на величину E — E D , где E D — диффузионный потенциал, обусловленный жидкостным переходом. Стандартный потенциал E ° для ячейки, исследованной по формуле. (122) определяется соотношением
(125) FE ° = — [μAg * + μMX∞ − μAgX * −μM (Hg) sat].
То есть E ° было бы измеренной ЭДС, если бы все компоненты находились в своих стандартных состояниях.Следовательно, для данного примера, уравнение. (124) можно записать как
(126) E = E ° -RTFlnaMXaM (Hg) = E ′ ° −2RTFln (acy ′ ±)
, если концентрация металла в амальгаме остается постоянной для серии измерений.
Уравнение (126) снова относится к типу, заданному формулой. (98). Анализ данных по разбавленным растворам вместе с уравнениями (99) и (100) дает E ‘° и K A в качестве желаемой информации. Константа ассоциации K A , полученная таким образом, согласуется с таковыми из измерений теплот разбавления или проводимости.
Согласно формуле. (126) эталонный потенциал E ′ ° при активности a M (Hg) определяется соотношением
(127) E ′ ° = E ° + RTFlnaM (Hg)
и дает стандартный потенциал E °, когда известна активность a M (Hg) . Следовательно, энергия Гиббса перехода электролита MX из чистого в бесконечно разбавленное состояние в растворителе S доступна:
(128) μMX∞ − μMX * = ΔsolGMX∞ = −FE ° + μAgX * −μMX *.
Измерения ЭДС как функции температурного выхода Δ sol H ∞ MX в соответствии с калориметрическими данными.
Измерения ЭДС также широко используются для расчета коэффициентов активности при концентрациях, превышающих предел достоверности модельных расчетов. Для этого уравнение. (126) используется для определения y ± , y ± = α y ′ ± , после предыдущего определения E ′ ° из данных разбавленного раствора.
Гальванические элементы | Протокол
Электрохимия
Электрохимия — это раздел химии, изучающий взаимосвязь между электрической энергией и химическими изменениями. Эти химические реакции включают перемещение электронов от одного вида к другому. Это движение либо генерирует ток, либо управляется приложенным током.
Ключевой реакцией в электрохимии является окислительно-восстановительная или окислительно-восстановительная реакция. Окислительно-восстановительная реакция состоит из двух полуреакций; реакция окисления, при которой вещество теряет электроны, и реакция восстановления, при которой вещество приобретает электроны.Эта химическая реакция приводит к изменению степени окисления каждого вещества.
Атом или молекула, которая теряет электроны или окисляется, является восстановителем. Атом или молекула, которая принимает электроны или восстанавливается, является окислителем. Один из способов запомнить эти отношения — использовать фразу «нефтяная вышка», которая означает « o xidation i s l osing — r eduction i s g aining».
Ячейки электрохимическиеЭлектрохимическая ячейка — это устройство, которое генерирует электрический ток из энергии, выделяемой в результате окислительно-восстановительной реакции.Электрохимическая ячейка состоит из реакционной камеры или камер и двух проводящих электродов: анода и катода. Анод и катод электрически соединены, а реакционная камера заполнена электролитом. Между двумя камерами находится солевой мостик, замыкающий цепь и позволяющий ионам перемещаться между электродами.
Восстановление происходит на катоде, а окисление происходит на аноде. Это можно легко запомнить, используя мнемоническое «рыжий кот», что означает, что действие red происходит в точке cat hode.
Есть два типа электрохимических ячеек. Один из них — это электролитическая ячейка, которая использует электрическую энергию для запуска несамопроизвольной реакции. В этом типе ячейки электрическая энергия подается от внешнего источника питания. Другой тип элемента — это гальванический элемент, который использует самопроизвольную реакцию для выработки электроэнергии. Батареи являются примером гальванических элементов.
Гальванические элементыГальванические элементы, также известные как гальванические элементы, состоят из двух полуэлементов.Каждая полуячейка содержит металлический электрод, погруженный в электролит. Внешняя цепь соединяет два электрода, а солевой мостик соединяет два раствора электролита. Электроны текут от анода к катоду. На аноде протекает полуреакция окисления, а на катоде — полуреакция восстановления. Например, в гальваническом элементе между медью и магнием на катоде происходит следующая полуреакция:
Cu 2+ + 2e — → Cu
А на аноде происходит следующая полуреакция:
мг → мг 2+ + 2e —
Поскольку электроны теряются во время окисления на аноде, они проходят через внешнюю цепь, чтобы уменьшить катод, генерируя ток.
По мере окисления анода концентрация катионов в электролите увеличивается. Точно так же, когда катод уменьшается, концентрация анионов в электролите увеличивается. Чтобы поддерживать электрическую нейтральность, ионы перемещаются через солевой мостик. Когда катионы образуются на аноде, анионы перемещаются из раствора на анодной стороне, используя солевой мостик. На катодной стороне создаются анионы, побуждая катионы перемещаться от солевого мостика к раствору на катодной стороне.Важно помнить, что электроны проходят через провода внешней цепи, а ионы проходят через солевой мостик и растворы.
Редукционный потенциалНекоторые металлы имеют большую тенденцию терять электроны, чем другие. Следовательно, величина электрического тока, производимого гальваническим элементом, зависит от типов металлических электродов. Стандартный электродный потенциал (E o ) вещества является мерой склонности вещества терять электроны.Если используются два металла с почти равными электродными потенциалами, то величина возникающего тока будет небольшой. Если используются два металла с очень разными потенциалами электродов, величина тока будет большой. Чем выше потенциал восстановления, тем больше вероятность того, что металл будет восстанавливаться и действовать как окислитель.
Возвращаясь к медно-магниевому гальваническому элементу, стандартный электродный потенциал меди составляет 0,337 вольт, в то время как стандартный электродный потенциал магния равен -2.370 вольт. В этом примере катодом является медь, а анодом — магний.
При проведении эксперимента с гальваническим элементом разность потенциалов между двумя электродами отслеживается с помощью мультиметра. Измеренное напряжение равно разнице потенциалов между двумя полуреакциями.
ΔEº = Eº катод — Eº анод
Стандартный потенциал электрода предполагает, что обе полуэлементы находятся в стандартных условиях: 1 М, 1 бар и 298.15 К (25 ° С). Напряжение зависит от концентрации растворов электролитов, которую можно определить с помощью уравнения Нернста.
Здесь E соответствует разности потенциалов или измеренному напряжению, E o — стандартный восстановительный потенциал, R — универсальная газовая постоянная (8,314462618 Дж / моль · К), T — измеренная температура в Кельвинах, F — температура Фарадея. константа (96 485,33212 C⋅mol -1 ), n — число электронов, перенесенных в реакции, и Q h — коэффициент реакции.Коэффициент реакции является электрохимическим эквивалентом константы равновесия.
Список литературы- Коц, Дж. К., Трейхель-младший, П. М., Таунсенд, Дж. Р. (2012). Химия и химическая реакционная способность. Белмонт, Калифорния: Брукс / Коул, Cengage Learning.
- Сильдерберг, М. (2009). Химия: молекулярная природа материи и изменений . Бостон, Массачусетс: Макгроу Хилл.
- Харрис, округ Колумбия (2015). Количественный химический анализ. Шестое издание.Нью-Йорк, штат Нью-Йорк: W.H. Фримен и компания.
Гальванические и электролитические элементы
Гальванические и электролитические элементы
В нашем отделении по мониторингу диабета внедрены электрохимия и электрохимические ячейки. Вы можете просмотреть эту страницу здесь. Электрохимические ячейки находятся в цепи , которая позволяет переносить электроны через нее. Ячейка включает:
- и анод , электрод, на котором происходит окисление
- a катод , электрод, на котором происходит восстановление
- электролит , чтобы обеспечить проводимость ионов внутри раствора в каждой половине ячейки
- a солевой мостик или полупроницаемая мембрана , для обеспечения проводимости ионов между половинными ячейками
- внешняя цепь , которая соединяет два электрода, включает провода, нагрузку и счетчики
Гальванические элементы
Электрохимический элемент, выделяющий энергию, называется гальваническим элементом .Электрохимическая реакция имеет отрицательное значение свободной энергии Гиббса и положительную разность потенциалов ячейки.Ниже представлена гальваническая ячейка, в которой реакция между A + и B является экзотермической с G, равным -10 кДж / моль при стандартных условиях и значением E 0 , равным 0,10 В.
Водородный электрод и полуреакции
У нас есть таблицы, которые показывают полуреакции восстановления. Как их получить?Электрохимическая реакция в электрохимической ячейке требует как полуреакции восстановления, так и полуреакции окисления.Вольтметр в цепи показывает полное напряжение ячейки ( E до = E красный + E ox ). Мы можем определить потенциалы половины ячейки, измерив напряжение ячейки, которая включает эту половину ячейки вместе со стандартной полуячейкой с известным потенциалом.
Принятый стандартный электрод — водородный электрод. Он состоит из полуячейки с инертным металлическим электродом, H 2 (г) при давлении 1 атмосфера, и 1 М водного раствора кислоты.
В режиме восстановления:
- 2H + + 2e — H 2
E красный = 0,00 В
В режиме окисления:
- H 2 2H + + 2e —
E красный = 0,00 В
Здесь вы можете видеть, что потенциал полуэлемента, в котором Cu +2 восстанавливается до Cu, составляет 0,34 В.
| восстановление | Cu +2 + 2e — Cu | E красный = x | ||
| окисление | H 2 2H + + 2e — | E вол = 0.00 В | ||
| нетто | Cu +2 + H 2 Cu + 2H + | E до = 0,34 В |
Ячейки электролитические
В электролитической ячейке протекает эндотермическая химическая реакция. Реакция не является спонтанной, поэтому требуется источник энергии. Энергия хранится в электрохимической ячейке. Эта энергия может быть высвобождена, когда элементу разрешено работать в гальваническом режиме.Справа вверху — гальванический элемент, который мы видели ранее. Молекулы A и B + образуются, и выделяется энергия. Электрод на левой стороне ячейки является катодом, потому что A + уменьшается до A на этом электроде.
Вверху слева такая же ячейка в электролитическом режиме. Источник энергии заставляет реакцию идти в направлении, противоположном спонтанному направлению. Сейчас производятся A + и B. Электрод справа является катодом, потому что здесь B + уменьшено до B.
Назад Компас Таблицы Показатель Вступление Следующий17.2 Гальванические элементы — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Опишите функцию гальванического элемента и его компонентов
- Используйте обозначения ячеек для обозначения состава и конструкции гальванических элементов
В качестве демонстрации спонтанного химического изменения на рис. 17.2 показан результат погружения спиральной медной проволоки в водный раствор нитрата серебра.Спонтанно происходит постепенное, но визуально впечатляющее изменение, когда первоначально бесцветный раствор становится все более синим, а изначально гладкая медная проволока покрывается пористым серым твердым веществом.
Фигура 17,2 Медная проволока и водный раствор нитрата серебра (слева) контактируют (в центре), и происходит самопроизвольный перенос электронов, образуя синий Cu 2+ ( водн. ) и серый Ag ( s ) (справа ).
Эти наблюдения согласуются с (i) окислением элементарной меди с образованием ионов меди (II), Cu 2+ (водн.) , которые придают раствору синий цвет, и (ii) восстановлением серебра (I) ионы с образованием элементарного серебра, которое осаждается в виде пушистого твердого вещества на поверхности медной проволоки.Итак, прямой перенос электронов от медной проволоки к водным ионам серебра является спонтанным, при используемых условиях. Краткое изложение этой окислительно-восстановительной системы представлено следующими уравнениями:
общая реакция: Cu (s) + 2Ag + (водный) ⟶Cu2 + (водный) + 2Ag (s) полуреакция окисления: Cu (s) ⟶Cu2 + (водный раствор) + 2e — полуреакция восстановления: 2Ag + (водный раствор) + 2e -⟶2Ag (s) общая реакция: Cu (s) + 2Ag + (водн.) ⟶Cu2 + (водн.) + 2Ag (s) полуреакция окисления: Cu (s) ⟶Cu2 + (водн.) + 2e — полуреакция восстановления: 2Ag + (вод) + 2e − ⟶2Ag (т)Рассмотрим конструкцию устройства, которое содержит все реагенты и продукты окислительно-восстановительной системы, как здесь, но предотвращает физический контакт между реагентами.Таким образом, предотвращается прямой перенос электронов; передача, напротив, происходит косвенно через внешнюю цепь, которая контактирует с разделенными реагентами. Устройства такого типа обычно называются электрохимическими ячейками , а те, в которых происходит спонтанная окислительно-восстановительная реакция, называются гальваническими ячейками (или гальваническими ячейками).
Гальванический элемент, основанный на спонтанной реакции между медью и серебром (I), изображен на рисунке 17.3. Ячейка состоит из двух полуячеек, каждая из которых содержит пару окислительно-восстановительных конъюгатов («пару») одного реагента.Показанная слева полуячейка содержит пару Cu (0) / Cu (II) в виде твердой медной фольги и водного раствора нитрата меди. Правая полуячейка содержит пару Ag (I) / Ag (0) в виде твердой серебряной фольги и водного раствора нитрата серебра. Внешняя цепь подключена к каждой полуячейке на ее твердой фольге, что означает, что каждая фольга из Cu и Ag функционирует как электрод . По определению, анод электрохимической ячейки — это электрод, на котором происходит окисление (в данном случае медная фольга), а катод — это электрод, на котором происходит восстановление (серебряная фольга).Окислительно-восстановительные реакции в гальваническом элементе происходят только на границе раздела между реакционной смесью каждого полуэлемента и его электродом. Для разделения реагентов при сохранении баланса заряда два раствора полуячейки соединены трубкой, заполненной инертным раствором электролита, называемым солевым мостиком. Спонтанная реакция в этой ячейке производит катионы Cu 2+ в анодной полуячейке и потребляет ионы Ag + в катодной полуячейке, что приводит к компенсирующему потоку инертных ионов из солевого мостика, который поддерживает баланс заряда.Возрастающие концентрации Cu 2+ в анодной полуячейке уравновешиваются притоком NO 3 — из солевого мостика, в то время как поток Na + в катодную полуячейку компенсирует уменьшение Концентрация Ag + .
Фигура 17,3 Гальванический элемент, основанный на спонтанной реакции между ионами меди и серебра (I).
Обозначение ячеек
Сокращенный символизм обычно используется для обозначения гальванического элемента, предоставляя важную информацию о его составе и структуре.Эти символические представления называются обозначениями ячеек или схемами ячеек, и они записываются в соответствии с несколькими рекомендациями:
- Соответствующие компоненты каждой полуячейки представлены их химическими формулами или символами элементов
- Все границы раздела фаз компонентов представлены вертикальными параллельными линиями; если два или более компонента присутствуют в одной фазе, их формулы разделяются запятыми
- По соглашению, схема начинается с анода и продолжается слева направо, идентифицируя фазы и интерфейсы, встречающиеся в ячейке, и заканчивается катодом .
Словесное описание ячейки с точки зрения анода-катода часто является полезным первым шагом при написании ее схемы.Например, гальванический элемент, показанный на рисунке 17.3, состоит из твердого медного анода, погруженного в водный раствор нитрата меди (II), который через солевой мостик соединен с водным раствором нитрата серебра (I), в который погружен твердый продукт. серебряный катод. Преобразование этого утверждения в символику в соответствии с приведенными выше рекомендациями приводит к схеме ячейки:
Cu (т) │1MCu (NO3) 2 (водн.) ║1MAgNO3 (водн.) │Ag (т.) Cu (т.Рассмотрим другой гальванический элемент (см. Рисунок 17.4) на основе спонтанной реакции между твердыми ионами магния и водными ионами железа (III):
чистая реакция клетки: Mg (s) + 2Fe3 + (aq) ⟶Mg2 + (aq) + 2Fe2 + (aq) полуреакция окисления: Mg (s) ⟶Mg2 + (aq) + 2e — полуреакция восстановления: 2Fe3 + (aq) + 2e − ⟶2Fe2 + (aq) чистая реакция клетки: Mg (s) + 2Fe3 + (aq) ⟶Mg2 + (aq) + 2Fe2 + (aq) полуреакция окисления: Mg (s) ⟶Mg2 + (aq) + 2e − полуреакция восстановления реакция: 2Fe3 + (aq) + 2e − ⟶2Fe2 + (aq)В этой ячейке твердый магниевый анод погружен в водный раствор хлорида магния, который соединен солевым мостиком с водным раствором, содержащим смесь хлорида железа (III) и хлорида железа (II), в который погружен платиновый катод.Схема ячейки записывается как
Mg (тв) │0,1MMgCl2 (водн.) ║0,2MFeCl3 (водн.), 0,3MFeCl2 (водн.) │Pt (т) Mg (т) │0,1MMgCl2 (водн.) ║0,2MFeCl3 (водн.), 0,3MFeCl2 (водн.) │ Pt (s)Обратите внимание, что катодная полуячейка отличается от других рассмотренных до сих пор тем, что ее электрод состоит из вещества (Pt), которое не является ни реагентом, ни продуктом реакции в ячейке. Это требуется, когда ни один из членов окислительно-восстановительной пары полуэлемента не может разумно функционировать как электрод, который должен быть электрически проводящим и находиться в фазе, отдельной от раствора полуэлемента.В этом случае оба члена окислительно-восстановительной пары представляют собой растворенные вещества, и поэтому Pt используется в качестве инертного электрода, который может просто обеспечивать или принимать электроны окислительно-восстановительным компонентам в растворе. Электроды, изготовленные из элемента окислительно-восстановительной пары, такого как анод из магния в этой ячейке, называются активными электродами.
Фигура 17,4 Гальванический элемент, основанный на спонтанной реакции между ионами магния и железа (III).
Пример 17,3
Написание схемы гальванических элементов
Гальванический элемент изготавливается путем соединения двух полуэлементов соляным мостиком, в одном из которых хромовая проволока погружена в 1 M раствор CrCl 3 , а в другом медная проволока погружена в 1 M CuCl 2 .Предполагая, что хромовая проволока функционирует как анод, напишите схему этой ячейки вместе с уравнениями для анодной полуреакции, катодной полуреакции и общей реакции ячейки.Решение
Поскольку хромовая проволока должна быть анодом, схема начинается с нее и продолжается слева направо, символизируя другие компоненты ячейки, пока не кончится катодом из медной проволоки: Cr (s) │1MCrCl3 (водный) ║1MCuCl2 (водный) │Cu (s) Cr (s) │1MCrCl3 (водный) ║1MCuCl2 (водный) │Cu (s)Полуреакции для этой ячейки
анод (окисление): Cr (т. −катод (восстановление): Cu2 + (aq) + 2e − ⟶Cu (s)Умножение, чтобы сделать количество электронов, потерянных Cr и приобретенных Cu 2+ , равным, дает
анод (окисление): 2Cr (т. −катод (восстановление): 3Cu2 + (aq) + 6e − ⟶3Cu (s)Сложение уравнений полуреакции и упрощение дает уравнение для реакции в ячейке:
2Cr (s) + 3Cu2 + (водный раствор) ⟶2Cr3 + (водный раствор) + 3Cu (s) 2Cr (s) + 3Cu2 + (водный раствор) ⟶2Cr3 + (водный раствор) + 3Cu (s)Проверьте свои знания
Опуская концентрации растворенных веществ и идентификаторы ионов-наблюдателей, напишите схему гальванической ячейки, итоговая реакция которой показана ниже.Sn4 + (водный) + Zn (s) ⟶Sn2 + (водный) + Zn2 + (водный) Sn4 + (водный) + Zn (s) ⟶Sn2 + (водный) + Zn2 + (водный)Отвечать:
Zn (т) │Zn2 + (водн.) ║Sn4 + (водн.), Sn2 + (водн.) │Pt (s) Zn (s) │Zn2 + (водн.) ║Sn4 + (водн.), Sn2 + (водн.) │Pt (s)
гальванических элементов | Блестящая вики по математике и науке
Первичные элементы одноразовые. Реакция в электроде необратима.
Сухой элемент — наиболее распространенный тип батарей, используемых для питания небольших бытовых устройств, таких как фонарики, радиоприемники и калькуляторы.Несмотря на свое название, эти ячейки состоят из пасты на водной основе, содержащей MnO2MnO_ {2} MnO2 и ZnZnZn. Химические реакции, используемые в сухом элементе, могут быть изменены для работы в кислых или щелочных растворах. Щелочные батареи чаще доступны в продаже.
Ртутные элементы обычно меньше по размеру и построены на основе другой химической реакции, чем сухие батареи. Эти батарейки используются в фотоаппаратах, слуховых аппаратах и подобных устройствах, для которых требуются небольшие и надежные батарейки.Батареи с ртутными элементами часто дороже, чем щелочные батареи, и, поскольку они содержат тяжелые металлы, они могут представлять опасность для окружающей среды при вскрытии или неправильной утилизации.
Общая реакция для ртутного элемента выглядит следующим образом: Zn (s) + HgO (s) → Hg (l) + ZnO (s) Zn (s) + HgO (s) \ to Hg (l) + ZnO (s) Zn (s) + HgO (s) → Hg (л) + ZnO (т)
Какова катодная полуреакция для этого элемента?
Совет: подумайте о добавлении жидкой воды, электронов, протонов или гидроксида, чтобы сбалансировать ваши окислительно-восстановительные полуреакции.{-} (водн.) HgO (s) + h3 O (l) + 2e− → Hg (l) + 2OH− (водн.)
Вторичные элементы перезаряжаемые. Реакцию в электроде можно обратить вспять, приложив к ячейке электрический потенциал. В процессе перезарядки гальванический элемент временно преобразуется в электролитический элемент. Примеры включают никель-кадмиевые батареи в перезаряжаемых электроинструментах и свинцовые аккумуляторные батареи в автомобилях.
Гальванические или гальванические элементы — Электрохимия
Гальванические элементы, также известные как гальванические элементы , представляют собой электрохимические элементы, в которых спонтанные реакции окисления-восстановления производят электрическую энергию.
Электрохимические ячейки имеют два проводящих электрода , называемых анодом и катодом. Электроды могут быть изготовлены из любых достаточно проводящих материалов, таких как металлы, полупроводники, графит и даже проводящие полимеры. Между этими электродами находится электролит , содержащий ионы, которые могут свободно перемещаться.
Поток электронов наблюдается как на аноде, так и на катоде: анод , подвергнется окислению (потеря электронов), тогда как катод , подвергнется восстановлению (усиление избирательности).
— Металл анода окислится, переходя от степени окисления 0 (в твердой форме) к положительной степени окисления, и станет ионом.
— На катоде ион металла в растворе будет принимать один или несколько электронов от катода, и степень окисления иона снизится до 0. При этом образуется твердый металл, который осаждается на катоде.
Направление потока электронов
Два электрода должны быть электрически соединены друг с другом, чтобы обеспечить поток электронов, который покидает металл анода и проходит через это соединение к ионам на поверхности катода.
Этот поток электронов представляет собой электрический ток, который можно использовать для выполнения работы, например, для поворота двигателя или включения света. Батарея — это набор гальванических элементов, соединенных параллельно. Например, свинцово-кислотная батарея имеет элементы с анодами из свинца и катодами из диоксида свинца.
Полууравнения
Принцип действия гальванического элемента — это одновременная реакция окисления и восстановления, называемая окислительно-восстановительной реакцией. Эта окислительно-восстановительная реакция состоит из двух полуреакций.В типичном гальваническом элементе окислительно-восстановительная пара — это медь и цинк, представленные в следующих полуэлементных реакциях:
— Цинковый электрод (анод): Zn (s) → Zn2 + (водный) + 2 e–
— Медный электрод (катод): Cu2 + (водный раствор) + 2 e– → Cu (s)
Потенциал ячейки
Стандартный Потенциалы ячеек (разность двух электродов) можно рассчитать на основе потенциалов полуреакций:
Потенциал клетки = потенциал восстановления + потенциал окисления
При решении стандартного клеточного потенциала необходимо идентифицировать окисленные и восстановленные виды.Это можно сделать с помощью серии занятий. Таблица стандартных восстановительных потенциалов отображает восстановительные потенциалы в порядке убывания. Виды наверху имеют большую вероятность восстановления, в то время как те, что внизу, имеют большую вероятность окисления. Следовательно, когда разновидность наверху соединяется с разновидностью внизу, та, которая находится наверху, становится восстановленной, а та, что внизу, окисляется. Положительный потенциал клетки указывает на то, что реакция протекает самопроизвольно в том направлении, в котором она написана.Потенциал элемента для всех гальванических / гальванических элементов положительный, потому что гальванический элемент генерирует потенциал.
Практические вопросыАкадемия Хана
Изучение метаболизма с помощью гальванических элементов
Официальная подготовка MCAT (AAMC)
Chemistry online Flashcards Вопрос 17
Пакет вопросов по химии Отрывок 19, вопрос 111
Практический экзамен 2 Раздел C / P Отрывок 6 Вопрос 29
Ключевые точки
• Электрохимический элемент, также называемый гальваническим или гальваническим элементом, представляет собой устройство, которое вырабатывает электрический ток из энергии, выделяемой в результате спонтанной окислительно-восстановительной реакции в двух полуячейках.
• Анод подвергнется окислению (потеря электронов) и восстановление (усиление избирательности) на катоде.
• Электроны покидают металл анода и проходят через соединительный провод к ионам на поверхности катода.
• Потенциал клетки = потенциал восстановления + потенциал окисления.
Ключевые термины
Электроды : электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Электролит : вещество, содержащее свободные ионы, переносящие электрический ток.
Активный электрод: электрод, участвующий в окислительно-восстановительной реакции электрохимической ячейки; масса активного электрода изменяется в процессе окислительно-восстановительной реакции
Анод: электрод в электрохимической ячейке, на котором происходит окисление; информация об аноде записана на левой стороне солевого мостика в обозначении ячейки
Катод: электрод в электрохимической ячейке, на котором происходит восстановление; информация о катоде записана на правой стороне солевого мостика в обозначении ячейки
Обозначение ячейки: сокращенный способ представления реакций в электрохимической ячейке
Потенциал ячейки : разность электрических потенциалов, возникающая при соединении разнородных металлов; движущая сила для протекания заряда (тока) в окислительно-восстановительных реакциях
Гальванический элемент : электрохимический элемент, в котором протекает спонтанная реакция окисления-восстановления; электрохимические ячейки с положительными потенциалами ячеек; также называется гальванический элемент
Инертный электрод : электрод, который пропускает ток, но не участвует в реакции окисления-восстановления в электрохимической ячейке; масса инертного электрода не изменяется в процессе окислительно-восстановительной реакции; инертные электроды часто делают из платины или золота, потому что эти металлы химически неактивны.