§ 16. Алюминий —
1. Почему в алюминиевой посуде нельзя хранить щелочные или кислые растворы?2. Какое соединение алюминия могло послужить материалом для гиперболоида инженера Гарина в романе А. Толстого?
Так как оксид алюминия Al2O3 имеет высокую температуру плавления 2044С, то именно он мог послужить материалом для гиперблоида.
3. Какую химическую реакцию положил в основу рассказа «Бенгальские огни» его автор Н. Носов?
4. На каких физических и химических свойствах основано применение в технике алюминия и его сплавов?
Применение алюминия в технике основано на следующих свойствах: легкость, пластичность, большая электропроводность и теплопроводность. С другими металлами алюминий образует прочные сплавы.
5. Напишите в ионном виде уравнения реакций между растворами сульфата алюминия и гидроксида калия при недостатке и избытке последнего.
6. Напишите уравнения реакций следующих превращений:
Реакции, идущие с участием электролитов, запишите в ионной форме. Первую реакцию рассмотрите как окислительно- восстановительный процесс.

7. Вычислите объем водорода (н.у.), который может быть получен при растворении в едком натре 270 мг сплава алюминия, содержащего 5% меди. Выход водорода примите равным 85% от теоретически возможного.

8. Напишите сочинение на тему «Художественный образ вещества или химического процесса», используя свои знания по химии алюминия.

gdz-himiya.ru
§16. Алюминий (Страницы 107,108,109,110,111,112,113,114,115) — Учебник по химии Габриелян 9 класс
Главная › 9 класс › Химия › Учебник по химии Габриелян 9 класс 1. Почему в алюминиевой посуде нельзя хранить щелочные или кислые растворы?2. Какое соединение алюминия могло послужить материалом для гиперболоида инженера Гарина в романе А. Толстого?
Так как оксид алюминия Al2O3 имеет высокую температуру плавления 2044С, то именно он мог послужить материалом для гиперблоида.
3. Какую химическую реакцию положил в основу рассказа «Бенгальские огни» его автор Н. Носов?
4. На каких физических и химических свойствах основано применение в технике алюминия и его сплавов?
Применение алюминия в технике основано на следующих свойствах: легкость, пластичность, большая электропроводность и теплопроводность. С другими металлами алюминий образует прочные сплавы.
5. Напишите в ионном виде уравнения реакций между растворами сульфата алюминия и гидроксида калия при недостатке и избытке последнего.
6. Напишите уравнения реакций следующих превращений:
Реакции, идущие с участием электролитов, запишите в ионной форме. Первую реакцию рассмотрите как окислительно- восстановительный процесс.

7. Вычислите объем водорода (н.у.), который может быть получен при растворении в едком натре 270 мг сплава алюминия, содержащего 5% меди. Выход водорода примите равным 85% от теоретически возможного.

8. Напишите сочинение на тему «Художественный образ вещества или химического процесса», используя свои знания по химии алюминия.

§15. Бериллий, магний и щёлочноземельные металлы — стр. 96-107§17. Железо — стр. 116-124
Сохраните или поделитесь с одноклассниками:
dourokov.ru
Алюминий — Википедия
| Алюминий | |
|---|---|
| ← Магний | Кремний → | |
| мягкий, лёгкий и пластичный металл серебристо-белого цвета. | |
 Алюминий | |
| Название, символ, номер | Алюминий / Aluminium (Al), 13 |
| Группа, период, блок | 13, 3, |
| Атомная масса (молярная масса) | 26,9815386(8)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p1 |
| Электроны по оболочкам | 2, 8, 3 |
| Радиус атома | 143 пм |
| Ковалентный радиус | 121 ± 4 пм |
| Радиус Ван-дер-Ваальса | 184 пм |
| Радиус иона | 51 (+3e) пм |
| Электроотрицательность | 1,61 (шкала Полинга) |
| Электродный потенциал | −1,66 В |
| Степени окисления | 0; +3 |
| Энергия ионизации | 1‑я: 577,5 (5,984) кДж/моль (эВ) 2‑я: 1816,7 (18,828) кДж/моль (эВ) |
| Термодинамическая фаза | Твёрдое вещество |
| Плотность (при н. у.) | 2,6989 г/см³ |
| Температура плавления | 660 °C, 933,5 K |
| Температура кипения | 2518,82 °C, 2792 K |
| Уд. теплота плавления | 10,75 кДж/моль |
| Уд. теплота испарения | 284,1 кДж/моль |
| Молярная теплоёмкость | 24,35[2] 24,2[3] Дж/(K·моль) |
| Молярный объём | 10,0 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,050 Å |
| Температура Дебая | 394 K |
| Теплопроводность | (300 K) 237 Вт/(м·К) |
| Скорость звука | 5200 м/с |
| Номер CAS | 7429-90-5 |
| 13 | Алюминий |
| 3s23p1 | |
Алюми́ний (Al, лат. aluminium) — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий — лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Название элемента образовалось от лат. alumen — квасцы[4].
Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году. Он восстановил хлорид этого элемента амальгамой калия при нагревании и выделил металл. Позже способ Эрстеда был улучшен Фридрихом Вёлером, он использовал для восстановления хлорида алюминия до металла чистый металлический калий и он же описал химические свойства алюминия.
Впервые полупромышленным способом алюминий получил в 1854 г. Сент-Клер Девиль по методу Вёлера, заменив калий на более безопасный натрий. Год спустя на Парижской выставке 1855 г. он продемонстрировал слиток металла, а в 1856 г. получил алюминий электролизом расплава двойной соли хлорида алюминия-натрия.
До развития широкомасштабного промышленного электролитического способа получения алюминия из глинозема этот металл был дороже золота. В 1889 году британцы, желая почтить богатым подарком русского химика Д. И. Менделеева, подарили ему аналитические весы, у которых чашки были изготовлены из золота и алюминия
В России алюминий назвали в то время «серебром из глины», так как главной составной частью глины является глинозём Al2O3. Промышленный способ получения металла электролизом расплава Al2O3 в криолите разработали независимо друг от друга Ч. Холл и П. Эру в 1886 г.
Соединения алюминия, например, двойная соль алюминия и калия — квасцы KAl(SO4)2 • 12H2O — известны и использовались с глубокой древности.
Распространённость[править | править код]
По распространённости в земной коре занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14 %
Природные соединения алюминия[править | править код]
В природе алюминий, в связи с высокой химической активностью, встречается почти исключительно в виде соединений. Некоторые из природных минералов алюминия:
- Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
- Нефелины — KNa3[AlSiO4]4
- Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
- Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд (сапфир, рубин, наждак) — Al2O3
- Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
- Каолинит — Al2O3·2SiO2 · 2H2O
- Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
- Хризоберилл (александрит) — BeAl2O4.
Тем не менее, в некоторых специфических восстановительных условиях (жерла вулканов) найдены ничтожные количества самородного металлического алюминия[8].
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в водоёмах России колеблются от 0,001 до 10 мг/л. В морской воде его концентрация 0,01 мг/л[9].
Изотопы алюминия[править | править код]
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al с ничтожными следами 26Al, наиболее долгоживущего радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при расщеплении ядер аргона 40Ar протонами космических лучей с высокими энергиями.
Алюминий образует прочную химическую связь с кислородом. По сравнению с другими металлами, восстановление алюминия до металла из природных оксидов и алюмосиликатов более сложно в связи с его высокой реакционной способностью и с высокой температурой плавления всех его руд, например таких, как бокситы, корунды.
Обычное восстановление до металла обжигом оксида с углеродом (как например, в металлургических процессах восстановления железа) — невозможно, так как сродство к кислороду у алюминия выше, чем у углерода.
Возможно получение алюминия посредством неполного восстановления алюминия с образованием промежуточного продукта — карбида алюминия Al4C3, который далее подвергается разложению при 1900—2000 °С с образованием металлического алюминия. Этот способ производства алюминия изучается, предполагается, что он более выгоден, чем классический электролитический способ производства алюминия процесс Холла — Эру[en], так как требует меньших энергозатрат и приводит к образованию меньшего количества CO2[10].
Современный метод получения,
ru.wikipedia.org
Как правильно соединить провода алюминий и медь
Практически все уже знают, что алюминиевая проводка это наследие прошлого века, и ее обязательно нужно менять при ремонте квартиры. Мало кто проводит капремонт и забывает об этом.
Однако случаются ситуации, когда ремонт проводится частично, и возникает крайняя необходимость соединить алюминиевый провод с медным или просто их нарастить, добавив несколько лишних сантиметров жилы.
Электрохимическая коррозия
 При этом алюминий и медь не совместимы гальванически. Если вы их соедините напрямую, это будет что-то вроде мини батарейки.
При этом алюминий и медь не совместимы гальванически. Если вы их соедините напрямую, это будет что-то вроде мини батарейки.
При прохождении тока через такое соединение, даже при минимальной влажности, происходит электролизная химическая реакция. Проблемы обязательно рано или поздно себя проявят.
Окисление, ослабление контакта, его дальнейший нагрев с оплавлением изоляции. Переход в короткое замыкание, либо отгорание жилы.
К чему может в итоге привести такой контакт, смотрите на фото.
Как же сделать такое соединение грамотно и надежно, чтобы избежать проблем в будущем.
Вот несколько распространенных способов, которые применяют электрики. Правда не все они удобны для работы в монтажных коробках.
Рассмотрим подробнее каждый из них и выберем наиболее надежный, не требующий последующего обслуживания и ревизий.
Соединение через болт и стальные шайбы
 Здесь для соединения используется стальная шайба и болт. Это один из наиболее проверенных и простых методов. Правда получается очень габаритная конструкция.
Здесь для соединения используется стальная шайба и болт. Это один из наиболее проверенных и простых методов. Правда получается очень габаритная конструкция.
Для монтажа, закручиваете кончики проводов колечками. Далее подбираете шайбы.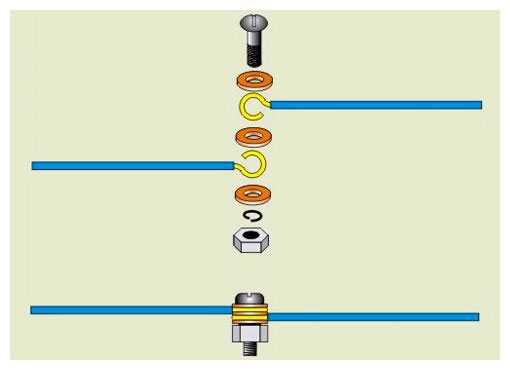
Они должны быть такого диаметра, чтобы все ушко провода спряталось за ними и не могло контактировать с другим проводником.
Самое главное, как расположить колечко. Его нужно одевать так, чтобы во время закручивания гайки, ушко не разворачивалось, а наоборот стягивалось во внутрь.
Стальные шайбы между проводниками из разных материалов препятствуют процессам окисления. При этом не забывайте про установку гравера или пружинной шайбы.
Без нее контакт со временем ослабнет.
Особо нужно отметить, что не рекомендуется использовать оцинкованные болты или шайбы.
Дело в том, что безопасно соединять между собой можно металлы, у которых электрохимический потенциал соединения не превышает 0,6мВ.
Вот таблица таких потенциалов.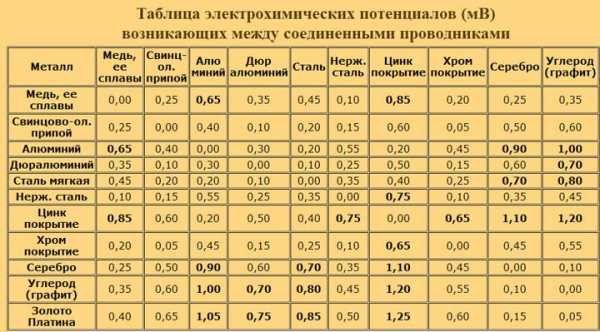
Как видите у меди и цинка здесь целых 0,85мВ! Такое подключение даже хуже чем прямой контакт алюминиевых и медных жил (0,65мВ). А значит, соединение будет не надежным.
Однако, несмотря на простоту резьбовой сборки, в итоге получается большая, неудобная конструкция, формой похожая на улей.
И запихнуть все это дело в не глубокий подрозетник, не всегда есть возможность. Более того, даже в такой простой конструкции многие умудряются напортачить.
Последствия себя не заставят ждать через очень короткое время.
 Еще один способ — это применение соединительного сжима типа орех.
Еще один способ — это применение соединительного сжима типа орех.
Он часто используется для ответвления от питающего кабеля гораздо большего сечения, чем отпайка.
Причем здесь даже не требуется разрезание магистрального провода. Достаточно снять с него верхний слой изоляции. Некоторые нашли ему применение для подключения вводного кабеля к СИПу.
Однако делать этого не стоит. Почему, читайте в статье ниже.
Но опять же, для распаечных коробок орехи не подходят. Более того, и такие зажимы бывает, выгорают. Вот реальный отзыв от пользователя на одном из форумов:
 Есть серия специальных зажимов, которыми можно стыковать медь с алюминием.
Есть серия специальных зажимов, которыми можно стыковать медь с алюминием.
Внутри таких клемм находится противоокислительная паста.
Однако споры о 100% надежности таких зажимов, тем более для розеточных, а не осветительных групп, не утихают до сих пор. При определенной укладке в ограниченном пространстве, контакт может ослабнуть, что неминуемо приведет к выгоранию.
Причем произойти это может даже при нагрузке ниже минимальной на которую рассчитаны Ваго. Почему и когда это происходит?
Дело в том, что когда сжимаются соединяемые проводники, между прижимной пластиной и местом контакта появляется небольшой зазор. Отсюда и все проблемы с нагревом.
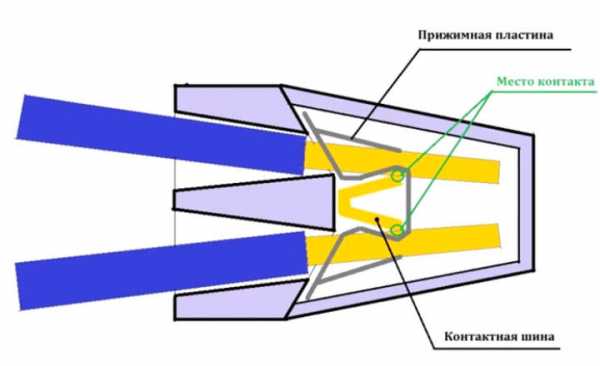
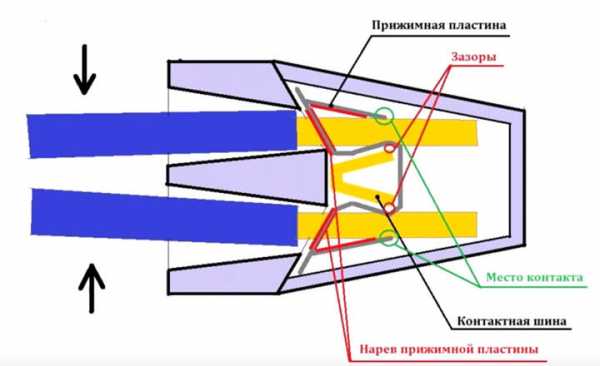
Вот очень наглядное видео, без лишних слов объясняющее данную проблему.
Клеммная колодка
 Данный способ имеет один существенный минус. Большинство продаваемых колодок очень низкого качества.
Данный способ имеет один существенный минус. Большинство продаваемых колодок очень низкого качества.
Некоторые исхитряются и чтобы избежать прямого контакта меди и алюминия, медную жилку припаивают сбоку такого зажима, а не вставляют во внутрь.
Правда клемму для этого придется разобрать. Кроме того, надежный контакт алюминия под винтом без ревизии, не живет очень долго.
Винтики каждые полгода-год нужно будет подтягивать. Частота ревизионных работ будет напрямую зависеть от нагрузки и ее колебаний в периоды максимума и минимума.
Забудете подтянуть и ждите беды. А если все это соединение запрятано глубоко в подрозетнике, то лезть туда каждый раз, не совсем удобное занятие.
Поэтому остается самый надежный из доступных способов – опрессовка. Здесь не будем рассматривать применение специализированных медно-алюминиевых гильз ГАМ, так как они начинаются от сечений 16мм2.
Для домашней же проводки, как правило наращивать нужно провода 1,5-2,5мм2 не более.
Соединение меди с алюминием опрессовкой
Рассмотрим наиболее распространенный случай, который встречается в панельных домах. Допустим, вам нужно запитать одну или несколько дополнительных розеток от уже существующего алюминиевого вывода в сквозной нише.
Для наращивания берете ГИБКИЙ медный провод сечением 2,5мм2. Это уменьшит механическое воздействие на алюминиевою жилу, когда вы будете укладывать провода в подрозетник.
Зачищаете концы медного провода. Далее, для такого соединения их нужно обязательно пропаять. Это исключит непосредственный контакт в гильзе меди и алюминия.
При этом перед пайкой флюсом снимите с жилы оксидный слой.
Сам процесс лужения заключается в окунании провода в специальное отверстие в паяльнике, заполненное оловом.
После остывания жилы остатки флюса удаляются растворителем.
Далее переходите к алюминиевым проводам, торчащим из стены. Аккуратно зачищаете их концы и также удаляете слой окиси.
Для этого можно воспользоваться оксидной токопроводящей пастой. Такая же паста используется при монтаже модульных штыревых систем заземления.
Она рассчитана на работу в любых условиях и исключает дальнейшее появление окиси на поверхности провода. Имейте в виду, что оксидная пленка может в последствии иметь сопротивление в несколько раз большее, чем сам алюминий.
И не удалив ее, вся ваша дальнейшая работа пойдет насмарку. Более того, температура плавления такой пленки достигает 2000 градусов (против примерно 600С у Al).

У некоторых возникнет логичный вопрос, а не продавится ли при опрессовке слой припоя на жиле? Тогда получается что все манипуляции по лужению будут напрасны.
Главное здесь правильно подобрать по сечению гильзу и матрицы инструмента для обжатия.
В этом случае мягкий припой как бы загерметизирует контактное пятно медноалюминиевого соединения. А без отсутствия доступа кислорода к этой точке, эрозии контакта наблюдаться не будет.
Будьте внимательны, при работе с алюминиевыми проводниками нужно действовать крайне осторожно, так как это очень ломкий материал. Одно неосторожное движение и облом жилы вам обеспечен.
После опрессовки необходимо заизолировать данное соединение клеевой термоусадкой.
Именно клеевой тип обеспечит 100% герметичность и предотвратит поступление кислорода к контактным местам. Чтобы не рисковать и не прожечь изоляцию, нагревать термоусадку лучше строительным феном, а не зажигалкой или портативной горелкой.
Полученный пучок проводов укладывать в подрозетник нужно с большой осторожностью, так как алюминий не любит резких перегибов.
Так как наращенные медные жили гибкие, то на концы этих проводников одеваете изолированные наконечники НШВИ.
Только после этого их можно смело заводить в клеммные колодки розеток и затягивать винты.
Безусловно, это не единственный способ наращивания алюминиевых проводов, но он является одним из самых простых (в отличии от сварки или пайки) и надежных (в отличии от скрутки). Подробнее
Подробнее
Если же у вас есть малейшая возможность сменить целиком алюминиевую проводку, делайте это обязательно, не экономьте на своей безопасности.
Статьи по теме
domikelectrica.ru
План-конспект урока по химии (9 класс) на тему: Соединения алюминия
9 класс.
Тема урока: Соединения алюминия.
Цель урока:
Ознакомление учащихся с соединениями алюминия, их свойствами, практическим использованием в жизни человека;
Формирование научного мировоззрения;
Развитие познавательного интереса к предмету.
Задачи урока:
Повторить свойства алюминия с точки зрения окислительно-восстановительных процессов; продолжить формирование понятия об амфотерности его соединений; показать практическое применении знаний в жизни;
Развивать умение учащихся логически мыслить, устанавливать причинно-следственные связи, обобщать и анализировать предложенные факты. Развивать навыки лабораторной техники.
Воспитывать ответственное отношение к выполнению дела, самостоятельность, аккуратность и трудолюбие.
Тип урока: урок формирования новых знаний у учащихся.
Вид урока: эвристическая беседа.
Методы и методические приемы:
Диалог учителя с учащимися.
Использование элементов занимательности – детективное расследование.
Выполнение лабораторных опытов.
Программа курса химии для 8 -11 классов общеобразовательных учреждений.
Учебник: Габриелян О.С. «Неорганическая химия» 9 класс.
Литература для учителя и учащихся:
1. Габриелян О.С, Остроумов Е.Г, «Настольная книга учителя»,
Москва, «Дрофа», 2005г.
2. Егоров А.С., Иванчиков Н.М., Шацкая К.Т.
«Химия внутри нас. Введение в бионеорганическую и биоорганическую химию»,
Ростов-на-Дону, «Феникс», 2004г.
3. «Химия на досуге: учение с развлечением», библиотека журнала «Химия в школе»,
Москва, «Центрум-пресс», 2006г.
Оборудование для учащихся:
Штативы с пробирками, держатель для пробирок, спиртовка, фарфоровые чашки.
Реактивы для учащихся:
Растворы гидроксида калия, соляной кислоты, сульфата алюминия, алюминиевые гранулы.
Оборудование для учителя:
Коллекции «Минералы и горные породы», «Алюминий и его сплавы».
Ход урока:
I этап – организационно-психологический.
II этап – Актуализация знаний учащихся.
(Проходит в виде театрализованного представления, заранее подготовленного учащимися).
Учитель: Однажды обнаружили, что в городе Элементарске, по улице Периодической из дома № 3 исчез один жилец. Дворник, наводивший порядок рано утром, заметил на песке следы: большие блестящие капли тяжелой жидкости. Он незамедлительно сообщил об этом следователю.
Следователь: Я вызвал на беседу ближайших соседей и взял у них показания.
Магний: Я – сосед по периоду. Ночью просыпаюсь и слышу: в квартире справа шум, возня, крики! Я прислушался, но ничего не мог понять.
Следователь: Вы не поспешили на помощь?
Магний: Что вы? Как можно?! Там было так жарко, а я легко воспламеняюсь и горю ослепительным пламенем.
Галлий: И я слышал шум в квартире этажом выше. Схватка, видимо, была горячая? Но я тоже не выношу таких условий. Ведь я легко плавлюсь. Уже при температуре 28º С я превращаюсь в жидкость, которая легко переохлаждается. Недаром меня применяют в термометрах.
Кремний: Да, температура, температура…У всех она вызывает разные изменения. Я лично работаю полупроводником. И если меня нагреть, моя проводимость сразу увеличится.
Следователь: А вы что, уважаемый, можете сказать по существу дела?
Кремний: Какого дела?
Следователь: Ну, как же? Ваш сосед слева сегодня ночью был похищен.
Кремний: Я об этом ничего не знаю.
Бор: Зато я знаю. Просыпаюсь среди ночи, слышу снизу шум, крики, удары. Мне показалась, что земля ходуном ходит. Я – элемент любопытный. С моим соседом снизу образую массу соединений неопределенного состава. Интересно стало, что происходит в его квартире. Разобрал паркет, проделал дыру и заглянул вниз. Знаете, что я там увидел? Квартира сплошь выложена плитками из драгоценных камней: сапфиров, рубинов, корундов. Зрелище изумительное.
Следователь: А сосед, что с соседом?
Бор: Сосед? Я его не видел. Когда дыру проделал, шум к этому времени стих, все успокоилось.
Следователь: Так вы не видели, кто похитил вашего соседа?
Бор: Нет. Правда, я видел на полу разлитую жидкость, также круглые капли. Так и перекатываются.
Следователь: Опять капли…Итак, что мы знаем? Преступник оставляет после себя капли тяжелой жидкости. О похищении неизвестно ничего, кроме того, что в квартире похищенного много драгоценных камней.
Зато известны соседи. Сосед слева горит ослепительным пламенем… Сосед справа – полупроводник. Сосед снизу – металл с низкой температурой плавления и применяется в термометрах. (Показывает указкой по таблице периодической системы).
Четвертый сосед ничего о себе не сообщил.
Так кого же похитили, ребята? И кто похититель?
Учащиеся отвечают: Алюминий.
Учитель: название похитителя мы узнаем в конце урока.
А теперь рассекретим этот металл.
Ш этап – повторение материала, изученного на предыдущем уроке.
Вопросы учащимся:
- Положение элемента в периодической системе, строение атома.
- Физические свойства.
- Химические свойства.
Запись уравнений на доске с указанием электронного баланса и признаков данных реакций (4 ученика).
4. Применение алюминия.
IV. Изучение нового материала
1.Лабораторные опыты:
1) Получение гидроксида алюминия реакцией обмена сульфата алюминия с гидроксидом калия. Разделение осадка на две пробирки.
2) Взаимодействие с кислотой.
3) Взаимодействие со щелочью.
Делается вывод об амфотерности гидроксида алюминия и записываются уравнения реакций в ионной форме на доске.
Уравнение реакций со щелочью объясняется учителем:
Объясняется название: тетрагидроксоалюминат калия.
Метаалюминат калия
4. Взаимодействие алюминия с щелочью при нагревании.
Отмечается, что алюминий покрыт оксидной пленкой:
2. Работа с учебником, таблицами и коллекцией «Соединения алюминия в
природе»
Результатом этой работы являются выводы, записываемые в тетради.
Алюмосиликаты:
Полевой шпат, ортоклаз.
Белая глина (фаянс, фарфор)
Боксит, для получения алюминия.
драгоценные камни – корунд, рубин, сапфир. T пл = 2050ºС
Мелкозернистый наждак.
Рубин применяется для изготовления деталей часов и других точных приборов,
в лазерах, ювелирных украшениях.
3. Заслушиваются сообщения учащихся о биологической роли алюминия
и применении его соединений в медицине.
Биологическая роль алюминия изучена мало. В организме человека он является примесным микроэлементом (% от массы тела).
Оксид алюминия – составная часть зубоврачебных цементов — «цемента для фиксации несъемных протезов», силикатного цемента «силицин», применяемого для пломбирования зубов и т.д. В стоматологической практике используется так же белая глина (каолин).
Препараты, содержащие гидроксид алюминия, используются при повышенной кислотности желудочного сока (алмагель, фосфалюгель). В желудке гидроксид алюминия образует гель, нейтрализующий катионы водорода, точнее гидроксония.
Перешедшие в раствор катионы алюминия образуют малорастворимый фосфат алюминия:
, который выводится из организма.
Алюмокалиевые квасцы.
Катионы алюминия образуют с белками достаточно прочные комплексы, выпадающие в виде гелей. Это приводит к гибели клеток микроорганизмов и снижает воспалительные реакции. Квасцы применяются для полосканий, промываний и примочек при воспалительных заболеваниях слизистых оболочек и кожи. Входят в состав кровеостанавливающих карандашей.
8 % раствор ацетата алюминия используется как вяжущее средство
V.Закрепление
Химический диктант: записать только первую букву ответа.
В результате мы получим название элемента – похитителя алюминия.
- Какой минерал, содержащий алюминий используется для получения фарфоровых и фаянсовых изделий?
(глина)
- Элемент подгруппы алюминия, при замене окончания которого получается название страны.
Заменишь букву «й» на «я» —
Увидишь дивные поля,
Узнаешь чудную страну.
Скажите элемент мне, ну?!
(индий)
3. В виде какого сплава чаще всего используется алюминий?
(дюралюминий)
4. Какой драгоценный камень используется в часах и лазерах?
(рубин)
5. Проявление двойственных свойств элементом?
(амфотерность)
6. Кремлевские звезды
Над нами горят.
Повсюду дежурит их свет.
Хорошая Родина есть у ребят.
И лучше той Родины нет!
Какое отношение к уроку имеют эти известные с детства строки?
(звезды – рубиновые).
7. Какая реакция алюминия позволяет использовать его для изготовления бенгальских огней и фейерверков?
(горение).
8. Вид связи в оксиде алюминия?
(ионная, вернее, приближающаяся к ионной)
9. Какое соединение алюминия могло бы послужить материалом для гиперболоида инженера Гарина из романа А.Толстого?
(рубин)
10. На что оканчиваются латинские названия многих химических элементов, в том числе и алюминия?
(на «ум»)
11. Название вещества, формула которого ?
(метаалюминат)
Какое слово получилось — гидраргирум — ртуть.
Похититель алюминия – ртуть, она обладает способностью растворять многие металлы, образуя амальгамы.
VI. Подведение итогов.
Итак, ребята, мы справились с поставленными задачами: повторили свойства химического элемента алюминия, познакомились с его соединениями, доказали амфотерные свойства гидроксида и оксида алюминия, узнали некоторые интересные факты, связанные с этим металлом.
Все учащиеся работали успешно, подготовились добросовестно.
Всем спасибо!
nsportal.ru
Тема 17. Соединения алюминия. | 9 класс
Часть I
1. В земной коре алюминий занимает 3 место по содержанию среди всех элементов и 1 – среди металлов.
Массовая доля его в земной коре составляет 9%.
2. Заполните таблицу «Природные соединения алюминия».
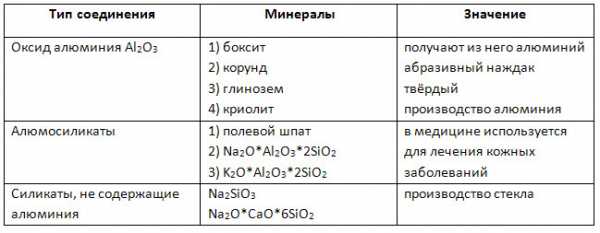
3. Оксид алюминия Al2O3 имеет атомную кристаллическую решётку и построен за счёт ионной химической связи.
Поэтому характеризуется следующими физическими свойствами: белое вещество с очень высокой температурой плавления.
Получение:
Имеет амфотерный характер, поэтому взаимодействует и с кислотами, и с щелочами (напишите уравнение возможных реакций в молекулярной, полной и сокращённой ионной формах).
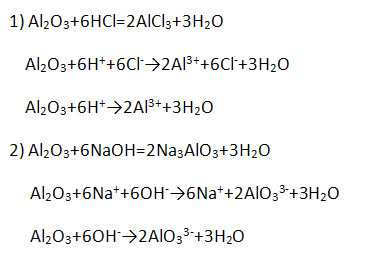
4. Гидроксид алюминия Al(OH)3 является амфотерным соединением и проявляет как основные, так и кислотные свойства (напишите уравнение возможных реакций в молекулярной, полной и сокращённой ионной формах).
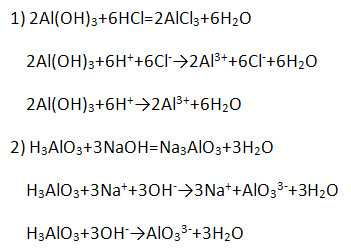
Получают при взаимодействии солей алюминия (изб.) с щелочами, например:
Часть II
1. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
2. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
3. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
4. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Первую реакцию рассмотрите с позиций окисления-восстановления, остальные – в свете ТЭД.
5. Составьте кроссворд (около 10 слов) в особой тетради на тему «Соединения алюминия в ювелирном деле», используя Интернет.
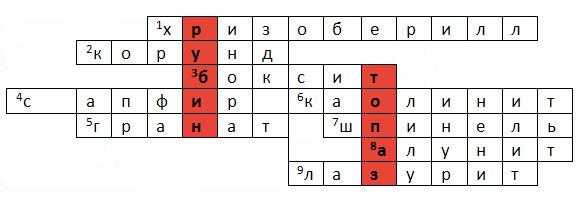
Составив кроссворд, вы получите в выделенных ячейках названия 2-х драгоценных камней, в составе которых есть алюминий.
1. Минерал, алюминат бериллия; зеленовато-желтый, реже бесцветный, красивый и долговечный в огранке.
2. Оксид алюминия, очень богатый алюминием минерал.
3. Основное сырье для получения алюминия; глиноподобная, часто каменистая порода, в качестве примесей в которой обычно присутствуют оксиды кремния, титана, железа и ряд других соединений.
4. Синий драгоценный камень; одна из разновидностей минерала корунда.
5. Ценный минерал, цветом и формой он часто напоминает ягоды крыжовника.
6. Водный алюмосиликат, являющейся основной составной частью каолинов и глин.
7. Ценный камень, желтого, оранжевого, красного, фиолетового, синего, голубого, зеленого или черного цвета массой не более 10 карат.
8. Продукт воздействия на алюмосиликаты природных кислых вод, представляет собой алюминиевые квасцы.
9. Камень с вкраплениями золотистого пирита, напоминающий звездное небо; благодаря своему необычному цвету и возможности полировки до зеркального блеска, он широко применяется в наши дни (краска, фрески, бусы, вазочки, украшения и др.).
6. Напишите сочинение «Художественный образ вещества или процесса» по химии алюминия.
superhimik.ru