Из-за чего металлы ржавеют
Ржавчина — итог окисления металла, также общий термин для определения оксидов железа.
Что есть общего между ржавым гвоздем, проржавевшим мостом или прохудившимся железным забором? Отчего вообще ржавеют железные конструкции и изделия из железа? Что такое ржавчина как таковая? На эти вопросы постараемся дать ответы в нашей статье. Рассмотрим причины ржавления металлов и способы защиты от этого вредного для нас природного явления.
Причины ржавления
Все начинается с добычи металла. Не только железо, но и, например, алюминий, и магний — добывают изначально в виде руды. Алюминиевая, марганцевая, железная, магниевая руды содержат в себе не чистые металлы, а их химические соединения: карбонаты, оксиды, сульфиды, гидроксиды.
Это химические соединения металлов с углеродом, кислородом, серой, водой и т. д. Чистых металлов в природе раз, два и обчелся — платина, золото, серебро — благородные металлы — они встречаются в форме металлов в свободном состоянии, и не сильно стремятся к образованию химических соединений.
Однако большинство металлов в природных условиях все же не являются свободными, и чтобы высвободить их из исходных соединений, необходимо руды плавить, восстанавливать таким образом чистые металлы.
Но выплавляя металлсодержащую руду, мы хоть и получаем металл в чистом виде, это все же состояние неустойчивое, далекое от естественного природного. По этой причине чистый металл в обычных условиях окружающей среды стремится вернуться назад в исходное состояние, то есть окислиться, а это и есть коррозия металла.
Таким образом, коррозия является естественным для металлов процессом разрушения, происходящим в условиях их взаимодействия с окружающей средой. В частности ржавление — это процесс образования гидроксида железа Fe(ОН)3, который протекает в присутствии воды.
Но на руку людям играет тот естественный факт, что окислительная реакция протекает в привычной нам атмосфере не особо стремительно, она идет с очень небольшой скоростью, поэтому мосты и самолеты не разрушаются мгновенно, а кастрюли не рассыпаются на глазах в рыжий порошок. К тому же коррозию в принципе можно замедлить, прибегнув к некоторым традиционным хитростям.
К тому же коррозию в принципе можно замедлить, прибегнув к некоторым традиционным хитростям.
Например, нержавеющая сталь не ржавеет, хотя и состоит из железа, склонного к окислению, она тем не менее не покрывается рыжим гидроксидом. А дело здесь в том, что нержавеющая сталь — это не чистое железо, нержавеющая сталь — это сплав железа и другого металла, главным образом — хрома.
Кроме хрома в состав стали могут входить никель, молибден, титан, ниобий, сера, фосфор и т. д. Добавление в сплавы дополнительных элементов, ответственных за определенные свойства получаемых сплавов, называется легированием.
Пути защиты от коррозии
Как мы отметили выше, главным легирующим элементом, добавляемым к обычной стали для придания ей антикоррозийных свойств, является хром. Хром окисляется быстрее железа, то есть принимает удар на себя. На поверхности нержавеющей стали, таким образом, появляется сначала защитная пленка из оксида хрома, которая имеет темный цвет, и не такая рыхлая как обычная железная ржавчина.
Оксид хрома не пропускает через себя вредные для железа агрессивные ионы из окружающей среды, и металл оказывается защищенным от коррозии, словно прочным герметичным защитным костюмом. То есть оксидная пленка в данном случае несет защитную функцию.
Количество хрома в нержавеющей стали, как правило, не ниже 13%, чуть меньше в нержавеющей стали содержится никеля, и в гораздо меньших количествах имеются другие легирующие добавки.
Именно благодаря защитным пленкам, принимающим на себя воздействие окружающей среды первыми, многие металлы получаются стойкими к коррозии в различных средах. Например, ложка, тарелка или кастрюля, изготовленные из алюминия, никогда особо не блестят, они, если присмотреться, имеют белесый оттенок. Это как раз оксид алюминия, который образуется при контакте чистого алюминия с воздухом, и защищает затем металл от коррозии.
Пленка оксида возникает сама, и если зачистить алюминиевую кастрюлю наждачной бумагой, то через несколько секунд блеска поверхность снова станет белесой — алюминий на зачищенной поверхности вновь окислится под действием кислорода воздуха.
Поскольку пленка оксида алюминия образуется на нем сама, без особых технологических ухищрений, она называется пассивной пленкой. Такие металлы, на которых оксидная пленка образуется естественным образом, называются пассивирующимися. В частности алюминий — пассивирующийся металл.
Некоторые металлы принудительно переводят в пассивное состояние, например высший оксид железа — Fe2О3 способен защитить железо и его сплавы на воздухе при высоких температурах и даже в воде, чем не может похвастаться ни рыжий гидроксид, ни низшие оксиды все того же железа.
Есть в явлении пассивации и нюансы. Например, в крепкой серной кислоте мгновенно пассивированная сталь оказывается устойчивой к коррозии, а в слабом растворе серной кислоты тут же начнется коррозия.
Почему так происходит? Разгадка кажущегося парадокса состоит в том, что в крепкой кислоте на поверхности нержавеющей стали мгновенно образуется пассивирующая пленка, поскольку кислота большей концентрации обладает ярко выраженными окислительными свойствами.
В то же время слабая кислота не окисляет сталь достаточно быстро, и защитная пленка не формируется, начинается просто коррозия. В таких случаях, когда окисляющая среда не достаточно агрессивна, для достижения эффекта пассивации прибегают к специальным химическим добавкам (ингибиторам, замедлителям коррозии), помогающим образованию пассивной пленки на поверхности металла.
Так как не все металлы склонны к образованию на их поверхности пассивных пленок, даже принудительно, то добавление замедлителей в окисляющую среду попросту приводит к превентивному удержанию металла в условиях восстановления, когда окисление энергетически подавляется, то есть в условиях присутствия в агрессивной среде добавки оказывается энергетически невыгодным.
Есть и другой путь удержания металла в условиях восстановления, если нет возможности использовать ингибитор, — применить более активное покрытие: оцинкованное ведро не ржавеет, поскольку цинк покрытия корродирует при контакте с окружающей средой вперед железа, то есть принимает удар на себя, являясь более активным металлом, цинк охотнее вступает в химическую реакцию.
Днище корабля часто защищено аналогичным образом: к нему крепят кусок протектора, и тогда протектор разрушается, а днище остается невредимым.
Электрохимическая антикоррозийная защита подземных коммуникаций — также весьма распространенный путь борьбы с образованием на них ржавчины. Условия восстановления создаются подачей отрицательного катодного потенциала на металл, и в таком режиме процесс окисления металла уже не сможет протекать просто энергетически.
Кто-то может спросить, почему подверженные риску коррозии поверхности просто не красят краской, почему бы просто не покрывать каждый раз эмалью уязвимую к коррозии деталь? Для чего нужны именно разные способы?
Ответ прост. Эмаль может повредиться, например автомобильная краска может в неприметном месте отколоться, и кузов начнет постепенно но непрерывно ржаветь, поскольку сернистые соединения, соли, вода, кислород воздуха, — станут поступать к этому месту, и в итоге кузов будет разрушаться.
Чтобы такое развитие событий предотвратить, прибегают к дополнительной антикоррозийной обработке кузова.
Текущее положение дел
Несмотря на кажущуюся изученность и проработанность явления коррозии, несмотря на применяемые разносторонние методы защит, коррозия по сей день представляет определенную опасность. Трубопроводы разрушаются и это приводит к выбросам нефти и газа, падают самолеты, терпят крушение поезда. Природа более сложна, чем может показаться на первый взгляд, и человечеству предстоит изучить еще многие стороны коррозии.
Так, даже коррозиестойкие сплавы оказываются стойкими лишь в некоторых предсказуемых условиях, для работы в которых они изначально предназначены. Например, нержавеющие стали не терпят хлоридов, и поражаются ими — возникает язвенная, точечная и межкристальная коррозия.
Внешне без намека на ржавчину конструкция может внезапно рухнуть, если внутри образовались мелкие, но очень глубокие поражения. Микротрещины, пронизывающие толщу металла незаметны снаружи.
Даже сплав не подверженный коррозии может внезапно растрескаться, будучи под длительной механической нагрузкой — просто огромная трещина внезапно разрушит конструкцию. Такое уже случалось по всему миру с металлическими строительными конструкциями, механизмами, и даже с самолетами и вертолетами.
Ранее ЭлектроВести писали, что немецкий исследовательский институт Фраунхофера по переработке материалов и ресурсным стратегиям (Fraunhofer IWKS) создал экологически устойчивый «Центр демонтажа и переработки в области электрической мобильности» (нем. — Zentrum für Demontage und Recycling — Elektromobilität ZDR-EMIL). Он разместился в городе Ханау (Hanau) в Федеральной земле Гессен при поддержке регионального министерства науки и искусств.
По материалам: electrik.info.
Почему ржавеет гвоздь? | Наука и жизнь
Ржавый гвоздь, ржавый мост, ржавый забор, ржавый корабль. Почему всё железное ржавеет и что же такое ржавчина?Алюминиевая руда — боксит — состоит из гидроксидов алюминия, оксидов железа и кремния. Внешне она совершенно не похожа на алюминий
Внешне она совершенно не похожа на алюминий
Фото Натальи Домриной.
Коррозия в сочетании с ошибками в конструкции привели к разрушению моста через реку Миссисипи в штате Миннесота (США) в августе 2007 года.
Даже к такому простому делу, как мытьё раковины, надо подходить с умом. Обширная питтинговая и язвенная коррозия кухонной мойки из нержавеющей стали вызвана неправильным подбором чистящих средств, которые содержат соединения хлора.
Коррозионное растрескивание нижней части корпуса стало причиной крушения самолёта «Боинг-737» компании «Элоу Эйрлайн» в апреле 1988 года.
‹
›
Давайте вспомним, откуда берётся железо или, например, алюминий. Правильно, их выплавляют из руды — железной, марганцевой, магниевой, алюминиевой и др. Металлы в рудах содержатся в основном в виде оксидов, гидроксидов, карбонатов, сульфидов, то есть в виде химических соединений с кислородом, водой, серой и пр.
В природе в металлическом, или свободном, состоянии в основном можно встретить лишь золото, платину, иногда серебро. Эти металлы устойчивы, то есть не стремятся (или слабо стремятся) образовывать химические соединения. Наверное, по этой причине они получили название благородных.
Эти металлы устойчивы, то есть не стремятся (или слабо стремятся) образовывать химические соединения. Наверное, по этой причине они получили название благородных.
Что же до подавляющего большинства металлов, то, чтобы они находились в свободном состоянии, их надо восстановить из природных рудных соединений, то есть выплавить. Выходит, выплавляя металл, мы переводим его из устойчивого состояния в неустойчивое. Вот он и стремится вернуться в исходное состояние — окислиться. Это и есть коррозия — естественный для металлов процесс разрушения при взаимодействии с окружающей средой. Частный случай коррозии — ржавление — образование на железе гидроксида железа Fe(ОН)3. Этот процесс может протекать только в присутствии влаги (воды или водяных паров).
Но почему же тогда не рушатся в одночасье мосты, не рассыпаются мгновенно самолёты и автомобили? Да и кастрюльки со сковородками не превращаются на наших глазах в рыжий, чёрный или серый порошок. К счастью, реакции окисления металлов протекают не столь стремительно. Как и любой процесс, они идут с определённой скоростью, порою очень небольшой. Более того, есть много способов замедлить коррозию.
Как и любой процесс, они идут с определённой скоростью, порою очень небольшой. Более того, есть много способов замедлить коррозию.
Плечо друга
Вы замечали, что на нержавеющей стали не бывает ржавчины, хотя её основу составляет то же самое железо, которое при окислении (в присутствии воды или водяного пара) превращается в рыжий мохнатый гидроксид. Тут есть одна хитрость: нержавеющая сталь — это сплав железа с другими металлами. Введение в металлические сплавы элементов для придания им тех или иных свойств называется легированием.
Основной легирующий элемент, который добавляют к обычной (углеродистой) стали, чтобы получить нержавеющую, — хром. Этот металл тоже стремится окислиться, что он с успехом и делает гораздо охотнее и быстрее, чем само железо. При этом на поверхности нержавеющей стали быстро образуется плёнка из оксида хрома. В отличие от рыхлой ржавчины компактный тёмный оксид хрома не даёт агрессивным ионам окружающей среды проникать к поверхности металла, то есть оксид попросту прикрывает собой металл, и процесс коррозии прекращается. Такие оксидные плёнки называются защитными. В нержавеющих сталях хрома должно быть строго определённое количество, но не менее 13%. Кроме хрома в нержавеющие стали часто добавляют никель, молибден, ниобий и титан.
Такие оксидные плёнки называются защитными. В нержавеющих сталях хрома должно быть строго определённое количество, но не менее 13%. Кроме хрома в нержавеющие стали часто добавляют никель, молибден, ниобий и титан.
Благодаря защитным плёнкам многие металлы неплохо выдерживают воздействие различных сред. Возьмём, к примеру, алюминиевую кастрюльку, в какой кипятят молоко или варят манную кашу. Обычно такая кастрюлька не блестит, подобно хрому или нержавеющей стали, и имеет слегка белёсый цвет. Дело в том, что на алюминии, как и на других металлах, на воздухе всегда образуется белёсая оксидная плёнка (оксид алюминия), которая отлично защищает металл от коррозии. Такие плёнки называются пассивными, а металлы, на которых они самопроизвольно образуются, — пассивирующимися. Если же алюминиевую кастрюльку почистить металлической щёткой, налёт исчезнет и появится металлический блеск. Но очень быстро поверхность вновь покроется плёнкой оксида алюминия и станет белёсой.
Укрощение активных
Перевести металл в пассивное состояние можно принудительным образом. Например, железо помимо незащитных гидроксида железа или же низших оксидов (закиси и закиси-окиси) при определённых условиях образует высший оксид — окись железа (Fe2О3). Этот оксид неплохо защищает металл и его сплавы при высоких температурах на воздухе, он же (одна из его форм) «ответственен», как считают специалисты, за пассивное состояние железных сплавов во многих водных средах.
Например, железо помимо незащитных гидроксида железа или же низших оксидов (закиси и закиси-окиси) при определённых условиях образует высший оксид — окись железа (Fe2О3). Этот оксид неплохо защищает металл и его сплавы при высоких температурах на воздухе, он же (одна из его форм) «ответственен», как считают специалисты, за пассивное состояние железных сплавов во многих водных средах.
Устойчивость нержавеющей стали в крепкой серной кислоте связана именно с пассивированием стали в этой весьма агрессивной среде. Если же поместить нержавейку в слабый раствор серной кислоты, сталь начнёт корродировать. Парадокс объясняется просто: крепкая серная кислота обладает сильными окислительными свойствами, благодаря чему на поверхности нержавеющей стали образуется пассивирующая плёнка, а в слабой кислоте не образуется.
В случаях, когда агрессивная среда недостаточно «окислительная», используют специальные химические добавки, помогающие образованию на поверхности металла пассивной плёнки. Такие добавки называют ингибиторами или замедлителями коррозии.
Такие добавки называют ингибиторами или замедлителями коррозии.
Не все металлы способны образовывать пассивные плёнки, даже принудительно. В этом случае добавление в агрессивную среду ингибитора, напротив, удерживает металл в «восстановительных» условиях, в которых его окисление подавляется (оно энергетически невыгодно).
Жертвоприношение
Искусственно поддерживать металл в «восстановительных» условиях можно и иным способом, ведь не всегда есть возможность добавить ингибитор. Возьмём, к примеру, обычное оцинкованное ведро. Оно сделано из углеродистой стали, а сверху покрыто слоем цинка. Цинк — более активный металл, чем железо, значит, он охотнее вступает в химические реакции. Поэтому цинк не просто механически изолирует стальное ведро от окружающей среды, но и «принимает огонь на себя», то есть корродирует вместо железа.
Похожим способом нередко защищают днища кораблей. Только их не покрывают сплошным слоем цинка, марганца или алюминия — это было бы очень дорого да и сложно, а прикрепляют к днищу солидный кусок более активного металла (протектора). В итоге протектор разрушается, а днище корабля остаётся целым и невредимым.
В итоге протектор разрушается, а днище корабля остаётся целым и невредимым.
Для подземных коммуникаций «восстановительные» условия создают с помощью электрохимической защиты: накладывают на защищаемый металл отрицательный (катодный) потенциал от внешнего источника тока, так что на металле прекращается процесс окисления.
Однако зачем нужно столько разных сложных способов защиты металлов? Разве нельзя просто покрасить металл или нанести на него эмаль?
Во-первых, всё покрасить невозможно. А во-вторых… Возьмём для примера эмалированную кастрюлю или автомобиль. Если кастрюля, вырвавшись из рук, с грохотом упадёт на пол и отшибёт себе эмалированный бочок, то под отколовшейся эмалью будет зиять «чёрный глаз», края которого постепенно окрасятся в предательский рыжий цвет — скол покроется ржавчиной. Не лучшая судьба ждёт и автомобиль, если вдруг в его лаковом боку (а чаще на стыке с днищем) образуется небольшая дырочка в слое лака. Этот канал поступления к корпусу агрессивных агентов — воды, кислорода воздуха, сернистых соединений, соли — немедленно заработает, и корпус начнёт ржаветь. Вот и приходится владельцам автомобилей делать дополнительную антикоррозионную обработку.
Вот и приходится владельцам автомобилей делать дополнительную антикоррозионную обработку.
Невидимый злодей
Так, может, проблема коррозии металлов решена? Увы, не всё так просто. Любые коррозиестойкие сплавы устойчивы только в определённых средах и условиях, для которых они разработаны. Например, большинство нержавеющих сталей отлично выдерживают кислоты, щёлочи и очень «не любят» хлориды, в которых они часто подвергаются местным видам коррозии — язвенной, точечной и межкристаллитной. Это очень коварные коррозионные разрушения. Конструкция из красивого, блестящего металла без намёка на ржавление может однажды рухнуть или рассыпаться. Всё дело в мельчайших точечных, но очень глубоких поражениях. Или же в микротрещинах, не видимых глазом на поверхности, но пронизывающих буквально всю толщу металла. Не менее опасно для многих сплавов, не подверженных общей коррозии, так называемое коррозионное растрескивание, когда внезапно конструкцию пронизывает огромная трещина. Такое случается с металлами, испытывающими длительные механические нагрузки — в самолётах и вертолётах, в различных механизмах и строительных конструкциях.
Такое случается с металлами, испытывающими длительные механические нагрузки — в самолётах и вертолётах, в различных механизмах и строительных конструкциях.
Крушение поездов, падение самолётов, разрушение мостов, выбросы газа и разливы нефти из трубопроводов — причиной подобных катастроф нередко становится коррозия. Чтобы её укротить, предстоит ещё много узнать о сложнейших природных процессах, происходящих вокруг нас.
Как заржавить металл
1. Убедитесь, что металл, с которым вы работаете, ржавеет. Ржавеют только металлы, содержащие железо, а некоторые сплавы железа ржавеют медленно или вовсе не ржавеют. Нержавеющую сталь, сплав железа и хрома очень трудно заржавить. Чугун или кованое железо ржавеют лучше.
2. Налейте немного хлористоводородной кислоты в пластиковую бутылку. Раствор хлороводородной кислоты в низких концентрациях широкодоступен в хозяйственных магазинах и обычно называется соляной кислотой. Осторожно налейте около 60 мл кислоты в прочный пластиковый флакон. При этом необходимо использовать резиновые перчатки и защитные очки.
При этом необходимо использовать резиновые перчатки и защитные очки.
3. Растворите небольшое количество меди в соляной кислоте. Растворив медь в кислоте, вы получите раствор, который ускорит процесс ржавления. Легче всего растворить медь в кислоте, свернув короткий отрезок медного провода в катушку и погрузив его в кислоту на период около одной недели.
Когда вы погрузили медь в кислоту, не закрывайте бутылку плотно. Газы, выделяемые в ходе химической реакции, создают давление внутри бутылки. Кроме того, убедитесь, что четко обозначили бутылку и храните ее в недоступном для детей и домашних животных месте.
Также можно использовать медные монеты. Убедитесь, что монета содержит медь в достаточном количестве. Например, монеты США, выпущенные после 1982 года, содержат только 2,5 процента меди. Однако, пенни, сделанные до 1982 года, состоят из меди на 95 процентов.
4. Разведите раствор кислоты и меди с водой. После того, как немного меди растворилось в кислоте, используя защитные перчатки, осторожно удалите медь из раствора. Когда вы достали медь из раствора, можете ее выбросить. Разведите кислоту с водой в соотношении примерно 1 часть кислоты к 50 частям воды. Если вы использовали 60 мл соляной кислоты, вы должны разбавить ее с 3,8 л воды.
Когда вы достали медь из раствора, можете ее выбросить. Разведите кислоту с водой в соотношении примерно 1 часть кислоты к 50 частям воды. Если вы использовали 60 мл соляной кислоты, вы должны разбавить ее с 3,8 л воды.
5. Тщательно очистите сталь или железо. Раствор кислоты и меди лучше работает, если металл будет очень чистым. Существуют доступные на рынке продукты, предназначенные для очистки метала от окалины или коррозии, однако, как правило, вполне достаточно вымыть металл водой с мылом.
6. Нанесите раствор кислоты. Нанесите тонкий слой раствора на поверхность металла и дайте ему высохнуть на воздухе. Кислоту можно наносить распылителем или кистью для краски, однако она быстро разъест любые металлические части распылителя. Используйте защитные перчатки и защитные очки при применении раствора кислоты и работайте в хорошо проветриваемом помещении, предпочтительно на открытом воздухе.
7. Дайте металлу заржаветь. В течение часа вы должны увидеть на металле заметную ржавчину.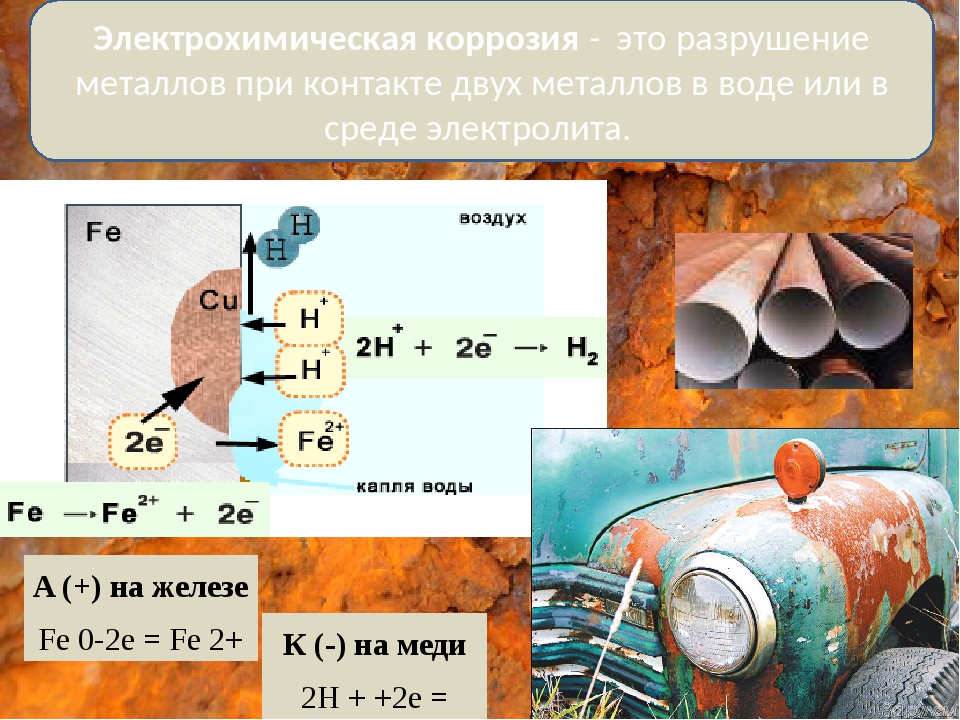 Не нужно вытирать или смывать раствор кислоты, он выветрится естественным путем. Если вы хотите получить более толстый слой ржавчины, нанесите раствор кислоты еще один раз.
Не нужно вытирать или смывать раствор кислоты, он выветрится естественным путем. Если вы хотите получить более толстый слой ржавчины, нанесите раствор кислоты еще один раз.
8. Готово.
Метод 2 из 4: Уксус и отбеливатель
1. Убедитесь, что ваш металл непокрыт грунтовкой или герметиком. Этот метод лучше всего работает для оловянных или железных изделий. После того как вы осмотрели изделие, смешайте в большой пластиковый емкости одну часть уксуса с двумя частями хлорной извести. Количество ингредиентов, которые вы используете, зависит от размера предмета, который вы собираетесь заржавить.
2. Поместите металл в емкость. Убедитесь, что он полностью погружен, если не хотите чтобы заржавела только часть металла. Держите его в растворе около тридцати минут. За это время на металле должен появиться потрескавшийся слой ржавчины.
3. Высушите предмет с помощью бумажного полотенца. Можно воспользоваться и обычным полотенцем, если не боитесь его окрасить. Кстати, если использовать для вытирания бумажные полотенца, то в конце получатся очень симпатичные полотенца с ржавым оттенком. Утилизируйте раствор уксуса и отбеливателя, вылив его в слив.
Кстати, если использовать для вытирания бумажные полотенца, то в конце получатся очень симпатичные полотенца с ржавым оттенком. Утилизируйте раствор уксуса и отбеливателя, вылив его в слив.
4. Дождитесь, пока предмет полностью высохнет, прежде чем делать с ним что-либо. Убедитесь, что метал полностью сухой, перед тем, как дотрагиваться до него, чтобы не подвергать вашу кожу контакту с большим количеством хлорки. Когда предмет высохнет, сотрите ржавчину до необходимой степени. Некоторые люди предпочитают толстый слой ржавчины, в то время как другим нравится легкая коррозия на металле.
5. Используйте грунтовку в аэрозоле, чтобы закрепить ржавчину на предмете. Обычно для этого хорошо подходит матовый спрей герметик. Вы можете приобрести такие спреи в местном хозяйственном магазине.
Метод 3 из 4: Перекись и соль
1. Выберите для работы хорошо проветриваемое помещение. Использование перекиси может быть опасным, если слишком много ее вдыхать. Выберите металл. Этот метод подойдет как для железа, так и для олова.
Этот метод подойдет как для железа, так и для олова.
2. Налейте перекись в бутылку с распылителем. С помощью распылителя намного проще нанести перекись на металл. Опрыскайте металл значительным количеством пероксида. Применение большего количества перекиси ускорит процесс ржавления.
3. Посыпьте металл солью. Нужно делать это в то время, когда перекись еще влажная. Процесс ржавления начнется почти сразу же и будет легко заметен. Вы можете использовать больше или меньше соли, в зависимости от того, насколько толстый слой ржавчины хотите получить.
4. Дайте металлу высохнуть на свежем воздухе. В отличие от использования раствора отбеливателя и уксуса, металл должен высохнуть естественным образом на воздухе. Если вы протрете соль, когда перекись еще влажная, то нарушите процесс ржавления, и ржавчина образует неравномерные пятна на металле. После высыхания сотрите соль и полюбуйтесь вашей работой.
5. Экспериментируйте с этим методом. Только что вы прочитали основы того, как использовать перекись и соль, чтобы заржавить металл, однако при использовании этого метода нет предела совершенству. Сотрите соль, а затем снова распылите перекись на металл. Пробуйте наносить разное количество соли или окунуть металл в воду, как только он высохнет. Вода придаст ржавчине более гладкую структуру.
Сотрите соль, а затем снова распылите перекись на металл. Пробуйте наносить разное количество соли или окунуть металл в воду, как только он высохнет. Вода придаст ржавчине более гладкую структуру.
Метод 4 из 4: Уксус и перекись
1 Защитите рабочую поверхность, если это необходимо.
2 Разложите металлические предметы.
3 Распылите перекись водорода на металл.
4 Сразу же распылите белый уксус на металлические предметы.
5 Дайте металлу заржаветь до конца дня.
Предупреждения
При работе с соляной кислотой, отбеливателем или перекисью всегда соблюдайте осторожность. Даже в низких концентрациях эти химические вещества могут вызвать раздражение кожи или слизистой оболочки.
Что вам понадобится
Раствор кислоты и меди
Железо или его сплав
Резиновые перчатки
Защитные очки
Соляная кислота
Мерная ложка
Пластиковая бутылка
Медный провод
Канистра
Вода
Мыло
Ткань
Распылитель или кисть
Раствор отбеливателя и уксуса
Бытовой отбеливатель
Уксус
Пластиковая емкость для смешивания
Бумажные полотенца
Раствор перекиси и соли
Перекись водорода
Поваренная соль
Распылитель
Что следует знать о ржавчине.

Все мы с вами знаем что такое ржавчина и каковы причины её появления. Причем такая “известность” не мешает ржавчине обладать уникальными свойствами, знание которых, достаточно необходимо для удаления и предотвращения ржавчины во многих приложениях клининга.
Изображение выше, на самом деле могло бы висеть на стене музея, как произведение искусства. Я даже не прочь увидеть это в рамке на стене в своей комнате (жена возможно сможет рассказывать подругам что это Поллок). Однако, когда ржавчина встречается в процессах клининга, она приносит куда меньшее эстетическое наслождение, чем любые предметы искуства, даже если отбросить предстоящие хлопоты по ее удалению.
В формальном мире все довольно просто, ржавчина — это окисление железа. Интересно, между тем, что только лишь контакт железа с кислородом (например, из воздуха) не будет приводить к образованию ржавчины. Для этого необходимо присутствие влаги, которая, как заведено, почти всегда присутствует в воздухе вокруг нас. Следовательно коррозия металла, может происходить без заметного присутствия воды. Также интересно, что железо подвергшееся воздействию только лишь чистой воды не будет ржаветь.
Следовательно коррозия металла, может происходить без заметного присутствия воды. Также интересно, что железо подвергшееся воздействию только лишь чистой воды не будет ржаветь.
Есть много забавных вещей, которые происходят, когда железо или его сплав ржавеет, слишком много, чтобы описать их в этом блоге, к тому же я не химик. Думаю, будет лучше, если мы доверим эти многие интересные вещи тем, кто знает много больше о химии, чем я. Правда мы ни за что не оставим без внимания некоторые из тех свойств ржавчины, которые распространены в мире промышленной уборки.
- Коррозия железа — это процесс необратимый! Когда что-то ржавеет, железо потребляется в процессе окисления на производство оксида и навсегда покидает ржавую поверхность. Ни один известный мне химический процесс, не может востановить заржавевшее железо в исходное состояние.
- Объем ржавчины, полученной в процессе коррозии, во много раз больше объема потребляемого металла. Толстые слои ржавчины не обязательно говорят нам о том, что металл под ними полностью исчез.
 Металл конечно может быть поглощен процессом ржавения абсолютно весь, но это занимает очень много времени. Зачастую, даже очень жирный слоина ржавчины на детали, не говорит о том, что металла осталось критически мало для того чтобы она выдержала положенные ей нагрузки.
Металл конечно может быть поглощен процессом ржавения абсолютно весь, но это занимает очень много времени. Зачастую, даже очень жирный слоина ржавчины на детали, не говорит о том, что металла осталось критически мало для того чтобы она выдержала положенные ей нагрузки. - Коррозия железа, в отличие от многих других форм окисления металлов, не является самоограниченым процессом. Окисление других металлов, включая медь и некоторых сплавов железа, содержащих материалы, называемые в сумме “нержавеющая сталь” защищены от дальнейшего окисления, как только образуется непроницаемый оксидный слой. Коррозия железа, будет продолжаться пока все железо не будет истребленно без остатка.
Всякий раз, когда мы говорим о чистке деталей из железа или железного сплава, которые так любят ржаветь, всегда есть опасения по поводу коррозии в процессе очистки, или после неё. Это происходит потому, что металл подвергается воздействию тех самых элементов (вода и кислород), которые включают ржавчине зеленый сигнал. До того как началась борьба за чистоту окружаеющей среды (в остальном мире), особых проблем с очисткой металлических деталей не было. Металл мыли (наверняка продолжают мыть где-то) с использованием растворителей, купаний в кипящем масле и обезжиривающих паров, ржавчина не считалась такого рода проблемой, как сегодня. Растворитель, всегда оставлял немного масла на детали после очистки, да чего там, даже обезжиривающий пар всегда оставлял следы углеводородов, не говоря уже о масле… Были времена, можно было спать спокойно и не вздрагивать при первой мысли об отсутствии антикоррозийного слоя. Теперь приходится впоминать про смазку сразу же после кибербластинга. ( Кстати именно о струйной очистке сухим льдом пойдет речь в следующей статье. Да, у нас такое тоже есть.)
До того как началась борьба за чистоту окружаеющей среды (в остальном мире), особых проблем с очисткой металлических деталей не было. Металл мыли (наверняка продолжают мыть где-то) с использованием растворителей, купаний в кипящем масле и обезжиривающих паров, ржавчина не считалась такого рода проблемой, как сегодня. Растворитель, всегда оставлял немного масла на детали после очистки, да чего там, даже обезжиривающий пар всегда оставлял следы углеводородов, не говоря уже о масле… Были времена, можно было спать спокойно и не вздрагивать при первой мысли об отсутствии антикоррозийного слоя. Теперь приходится впоминать про смазку сразу же после кибербластинга. ( Кстати именно о струйной очистке сухим льдом пойдет речь в следующей статье. Да, у нас такое тоже есть.)
Современные процессы очистки подразумевают химическое предотвращение или замедление (ингибирование) коррозии очищаемых поверхностей, как во время, так и после их очистки. Если поверхность ржавеет, то результатом может стать металлолом. Как я уже писал, в будущем мы еще вернемся к вопросу предотвращения коррозии, и возможно, попробуем удалить тонкие слои ржавчины с использованием действительно современных технологий для очистки.
Как я уже писал, в будущем мы еще вернемся к вопросу предотвращения коррозии, и возможно, попробуем удалить тонкие слои ржавчины с использованием действительно современных технологий для очистки.
Что такое ржавчина и как ее удалить с поверхности металла?
По статистике, потери от ржавчины (коррозии) составляют до 12% от всего производимого металла. Условия эксплуатации металлических изделий и конструкций постоянно ужесточаются, в том числе и из-за загрязнения атмосферы. Так, выбросы оксидов серы или азота приводят к образованию микрокапель серной или азотной кислот, при этом скорость образования ржавчины увеличивается в несколько раз.
Ржавчина — химические основы процесса
Железо – химически активный металл, который в присутствии воды и кислорода легко окисляется, образуя несколько соединений – оксидов, гидроксидов и их гидратов. Как ни странно, но точной формулы ржавчины не существует: в зависимости от условий окружающей среды продукт окисления железа имеет переменный состав: nFe(OH)3*mFe(OH)2*ph3O. Поражение ржавчиной происходит по всей поверхности металла, но наиболее уязвимыми местами являются сварные швы, внутренние углы конструкций, отверстия для резьбовых соединений. По своей структуре ржавчина очень рыхлая, сцепление с металлом практически отсутствует. Из-за высокой пористости слой ржавчины легко задерживает атмосферную влагу, создавая благоприятные условия для дальнейшего разрушения металла.
Поражение ржавчиной происходит по всей поверхности металла, но наиболее уязвимыми местами являются сварные швы, внутренние углы конструкций, отверстия для резьбовых соединений. По своей структуре ржавчина очень рыхлая, сцепление с металлом практически отсутствует. Из-за высокой пористости слой ржавчины легко задерживает атмосферную влагу, создавая благоприятные условия для дальнейшего разрушения металла.
Опасность процесса в том, что визуально оценить степень поражения металлической конструкции не представляется возможным: под красно-бурым слоем ржавчины металл может быть полностью разрушен. Если своевременно не принять меры, результат может оказаться плачевным, вплоть до полного разрушения изделия. Одно дело, если это – ржавый гвоздь в стене дачного домика, и совсем другое – если ржавчина поразила опору ЛЭП или корпус морского судна.
Способы удаления ржавчины
Народная мудрость гласит, что любую проблему проще предотвратить, чем потом прикладывать героические усилия для устранения ее последствий. Ржавчина – не исключение. За последние 20-30 лет химики и физики предложили немало способов предотвращения коррозии – от защитных покрытий до сложных инженерных сооружений – станций электрохимической защиты.
Ржавчина – не исключение. За последние 20-30 лет химики и физики предложили немало способов предотвращения коррозии – от защитных покрытий до сложных инженерных сооружений – станций электрохимической защиты.
Если ржавчина все-таки появилась – это не повод опускать руки: есть немало эффективных способов ее удаления, и чем раньше предприняты активные меры, тем большим будет эффект от их применения. Итак, обо всем по порядку.
Механическое удаление ржавчины
Продукты коррозии обладают малой адгезией и поэтому легко удаляются с поверхности металла при механическом воздействии – например, при обработке металлической щеткой. Снять ржавый налет с крупных изделий можно с помощью шлифовального станка, соблюдая при этом простое правило: начинать нужно с крупного зерна, а для финишной обработки использовать самое мелкое. Участки металла, с которых удалена ржавчина, оказываются совершенно беззащитными перед атмосферным воздействием. Если их не обработать антикоррозионными составами, предотвращающими контакт с водой и кислородом, процесс ржавления только ускорится.
Если их не обработать антикоррозионными составами, предотвращающими контакт с водой и кислородом, процесс ржавления только ускорится.
Химические способы удаления ржавчины
Зная природу и химический состав ржавчины, логично предположить, что удалить ее можно с помощью кислот. Из школьного курса химии известно, что оксиды и гидроксиды металлов легко взаимодействуют с кислотами, при этом образуются соли железа и соответствующей кислоты, и вода.
Например, при действии соляной кислоты происходят следующие реакции:
- 2Fe (OH)3 + 6HCL → 2FeCl3 + 6h3O
- Fe (OH)2 + 2HCL → FeCl2 +2h3O
Образующийся хлорид железа – водорастворимая соль, которую необходимо удалить с поверхности обрабатываемого изделия простым ополаскиванием в воде, а затем насухо вытереть поверхность. Не надо ждать, пока ржавчина начнет образовываться снова, очищенные участки следует обработать защитными составами.
При обработке кислотами существует опасность растворения металла, поскольку железо в электрохимическом ряду напряжений стоит до водорода, оно активно реагирует со многими разбавленными кислотами:
- Fe + 2HCl → FeCl2 + h3↑
По этой причине прежде, чем заняться химическими экспериментами в домашних условиях, необходимо почитать соответствующую литературу. Устранить побочный эффект поможет ингибитор коррозии – уротропин, при добавлении всего 1-2 г на литр раствора соляной кислоты реакция с железом не протекает.
Преобразователи ржавчины
Жидкие составы на основе ортофосфорной кислоты являются отличным способом предотвратить дальнейшее образование ржавчины на поверхности стальных и железных изделий. При таком способе обработки предварительно удаляются лишь те участки ржавчины, которые слабо держатся на основе. Образующийся в процессе реакции ортофосфат железа создает прочную защитную пленку, через которую не проникает влага и кислород, благодаря чему предотвращается дальнейшая коррозия металла. Для ускорения процесса высыхания на литр 25%-ого раствора ортофосфорной кислоты можно добавить 30-40 мл изобутилового спирта или 15 граммов винной кислоты.
Для ускорения процесса высыхания на литр 25%-ого раствора ортофосфорной кислоты можно добавить 30-40 мл изобутилового спирта или 15 граммов винной кислоты.
Современное оборудование для удаления ржавчины
Механические способы очистки поверхности от ржавчины с помощью подручных средств применимы далеко не всегда, если изделие имеет сложную форму, то обработать все участки не представляется возможным. Химические способы тоже имеют свои недостатки, при несоблюдении элементарных правил техники безопасности можно получить химический ожог или отравление. Определенную проблему представляет и утилизация отработанных растворов.
Оптимальным способом удаления ржавчины, особенно с поверхности изделий сложной геометрической формы, является мягкий бластинг. Суть метода состоит в следующем, на металлическое изделие направляется струя сжатого воздуха, содержащая особые абразивные гранулы. Меняя давление, можно регулировать глубину слоя, снимаемого с поверхности – таким образом удаляется только слой ржавчины или окалины, а металл остается нетронутым. Гранулы ARMEX, используемые в аппарате для мягкого бластинга Nordblast NB 28-2, состоят из мельчайших частиц соды и мела. Попадая под большим давлением на поверхность, они легко удаляют не только ржавчину, но и лакокрасочные материалы.
Гранулы ARMEX, используемые в аппарате для мягкого бластинга Nordblast NB 28-2, состоят из мельчайших частиц соды и мела. Попадая под большим давлением на поверхность, они легко удаляют не только ржавчину, но и лакокрасочные материалы.
Отличительной особенностью метода является абсолютная экологическая безопасность: применяемые компоненты химически инертны. Многочисленные исследования доказали, что на поверхности металла практически не образуются царапины и иные микроскопические дефекты, которые последствии могут стать центрами повторного образования ржавчины. Щелочная природа гранул способствует образованию пассивной пленки на изделиях из железа или стали, предохраняя основной объем металла от коррозионного разрушения.
Наилучшие результаты применения аппарата мягкого бластинга Nordblast NB 28-2 получены при обработке деталей машин или яхт. Процесс чистки от ржавчины зависит от степени коррозии, обычно на полную обработку автомобиля уходит 1 день, яхты – 2 дня.
Чем раньше обнаружена проблема, тем проще бороться с ржавчиной. Какой способ наиболее предпочтителен – каждый решает самостоятельно, но не стоит пользоваться дедовскими методами, если есть оборудование, удаляющее ржавчину со 100%-ой эффективностью!
Ржавчина
Ржавчина — продукт взаимодействия внешней окислительной атмосферы с железом. Процесс ее образования называется ржавлением ( коррозия ). Термин «ржавчина» присущ только продуктам коррозии железа и его сплавов. Любые другие металлы могут корродировать, но не ржаветь!
Ржавчина — это гидратированная окись железа (гидроксид железа). Химическая формула ржавчины — Fe2O3•H2О (иногда пишут просто Fe2O3). На поверхности образуется в виде шероховатого налета, который имеет рыхлую структуру. Цвет ржавчины — от оранжевого до красно-коричневого.
Железо при рН среды > 5,5 образует труднорастворимый гидрат закиси железа, имеющий белый цвет:
Fe2+mH2O + 2OH— = mH2O + Fe(OH)2↓
При взаимодействии гидрата закиси железа с растворенным кислородом в воде, образуются еще более труднорастворимое соединение — гидрат окиси железа (бурый цвет):
2Fe(OH)2 + 1/2 O2 + H2О = 2Fe(OH)3↓
Вторичные продукты коррозии (Fe(OH)2 и Fe(OH)3) могут и дальше превращаться, с образованием гидратированных окислов FeO•Fe2O3•nH2О — ржавчины. FeO — нестабильное соединение, поэтому в формуле ржавчины его часто просто не записывают.
FeO — нестабильное соединение, поэтому в формуле ржавчины его часто просто не записывают.
Реакции образования ржавчины:
2e + 2H+ — H2;
4e +O2 + 4H+ — 2H2O;
2e + Fe(OH)2 + 2H+ — Fe + 2H2O;
2e + Fe2+ — Fe;
2e + Fe(OH)3— + 3H+ — Fe + 3H2O;
e + Fe(OH)3 + H+ — Fe(OH)2 + h3O;
e + Fe(OH)3 + 3H+ — Fe2+ + 3H2O;
Fe(OH)3- + H+ — Fe(OH)2 + H2O;
e + Fe(OH)3 — Fe(OH)3-;
Fe3+ + 3H2O — Fe(OH)3 + 3H+;
Fe2+ + 2H2O — Fe(OH)2 + 2H+;
e + Fe3+ — Fe2+;
Fe2+ + H2O — FeOH + H+;
FeOH+ + H2O > Fe(OH)2 + H+;
Fe(OH)2 + H2O — Fe(OH)3- + H+;
Fe3+ + H2O — FeOH2+ + H+;
FeOH2+ + H2O — Fe(OH)3 + H+;
FeOH2+ + H+ — Fe2+ + H2O;
e + FeOH2+ + 2H+ — Fe2+ +2H2O;
e + Fe(OH)3 + H+ — Fe(OH)2 + H2O;
e + Fe(OH)3 + 2H+ — FeOH+ + 2H2O;
e + Fe(OH)3 + 3H+ — Fe2+ + 3H2O.
Ржавчина может существовать в двух формах: магнитной (γ- Fe2O3) и немагнитной (α-Fe2O3). Гидратированная окись железа в α форме (гематит) -более стабильное соединение. Раствор, насыщенный ржавчиной, почти нейтральный. γ- Fe2O3 обычно между гидратированными оксидами Fe2O3 и FeO образует черный промежуточный слой. Поэтому можно сказать, что ржавчина состоит из трех слоев оксидов железа разной степени окисления.
Процесс ржавления металла начинается только при наличии в воздухе влаги. При попадании на поверхность изделия из железа капли воды, спустя некоторое время, можно заметить изменение ее цвета. Капля становится мутной и постепенно окрашивается в бурый цвет. Это свидетельствует о появлении, в месте контакта воды с поверхностью, продуктов коррозии железа.
Если ржавчина уже образовалась — остановить процесс коррозии крайне трудно и не всегда удается. Лучше его предупреждать и заранее защищать металл!
Почему ржавеет железо?. Все обо всем. Том 1
Почему ржавеет железо?. Все обо всем. Том 1ВикиЧтение
Все обо всем. Том 1Ликум Аркадий
Почему ржавеет железо?
Если оставить какой-то железный предмет в сыром и влажном месте на несколько дней, он покроется ржавчиной, как если бы его покрасили красноватой краской.
Что такое ржавчина? Почему она образуется на железных и стальных предметах? Ржавчина — это окись железа. Она образуется в результате «сгорания» железа при соединении с кислородом, растворенным в воде.
Это значит, что при отсутствии в воздухе влаги и воды вообще отсутствует растворенный в воде кислород и ржавчина не образуется.
Если капля дождя попадает на блестящую железную поверхность, она остается прозрачной в течение короткого периода времени. Железо и кислород, находящийся в воде, начинают взаимодействовать и образуют окись, то есть ржавчину, внутри капли. Вода становится красноватой, и ржавчина плавает в воде в виде мелких частиц. Когда капля испарится, остается ржавчина, образуя красноватый слой на поверхности железа.
Если уж ржавчина появилась, она будет расти и в сухом воздухе. Это происходит потому, что пористое пятно ржавчины поглощает влагу, содержащуюся в воздухе, — она притягивает и удерживает ее. Вот почему легче предупредить ржавчину, чем остановить ее, когда она появилась. Проблема предупреждения ржавчины очень важна, так как изделия из железа и стали должны долго храниться. Иногда их покрывают слоем краски или пластмассы. А что бы ты сделал, чтобы предохранить от ржавчины боевые корабли, когда они не используются? Эта проблема решена с помощью поглотителей влажности. Такие механизмы заменяют влажный воздух в отсеках на сухой. Ржавчина в таких условиях появиться не может!
Читайте также
14. ЖЕЛЕЗО
14. ЖЕЛЕЗО Свободное самородное железо в земной коре, в отличие от меди, почти не встречается. Но оно входит в состав многих минералов и распространено гораздо шире цветных металлов. В древности его можно было добывать буквально повсюду — из озерных, болотистых, луговых и
Железо
Железо Главным врагом изделий из железа считается окисление, которое проступает на поверхности в виде ржавчины. В конечном итоге этот процесс приводит к распаду металла. Но есть и секреты сохранения железа на долгое время. Как раз знание этих способов, а также временное
Почему железо называют главным металлом?
Почему железо называют главным металлом? Это легко понять, если представить себе, что железо вдруг разом исчезло с Земли. Но лучше такого не представлять, потому что вместе с железом может исчезнуть и сама Земля: ведь по предположениям ученых ядро нашей планеты состоит из
Железо сыворотки
Железо сыворотки Норма: 50–175 (70–170) мкг % (9–31,3 мкмоль/л).Содержание железа в крови измеряют натощак, так как уровень железа колеблется в течение суток и бывает максимальным по утрам. Этот уровень зависит от таких факторов, как всасывание железа в кишечнике, накопление его в
Железо
Железо Железо (Fe) – это химический элемент 8 группы периодической системы Д.И. Менделеева, атомный номер 26, атомная масса 55, 847, валентность 2, 3, плотность 7874 кг/м3, температура плавления 1812 К, температура кипения 3013 К, твердость по Бринеллю 350 – 450 Мн/м2.Железо известно человеку
Что вызывает коррозию?
Что такое коррозия?
Коррозия — это естественный процесс, связанный с износом металлических компонентов. Согласно NACE International , коррозия — это «разрушение вещества (обычно металла) или его свойств из-за реакции с окружающей средой». Это в конечном итоге приводит к потенциально серьезным повреждениям вашего здания или приложения и может стать очень дорогостоящим для ремонта .
Как возникает коррозия
Коррозия — это электрохимическая реакция, которая проявляется в нескольких формах, таких как химическая коррозия и атмосферная коррозия, последняя из которых является наиболее распространенной формой.Когда кислотные вещества (включая воду) вступают в контакт с металлами, такими как железо и / или сталь, начинает образовываться ржавчина. Ржавчина является результатом коррозии стали после того, как частицы железа (Fe) подверглись воздействию кислорода и влаги (например, влажности, пара, погружения). Когда сталь подвергается воздействию воды, частицы железа теряются с кислотными электролитами воды. Затем частицы железа окисляются, что приводит к образованию Fe2. Когда образуется Fe⁺⁺, два электрона высвобождаются и проходят через сталь в другую область стали, известную как катодная область.
Кислород заставляет эти электроны подниматься вверх и образовывать ионы гидроксила (ОН). Ионы гидроксила реагируют с FE⁺⁺ с образованием водного оксида железа (FeOH), более известного как ржавчина. Там, где были затронутые частицы железа, теперь образовалась коррозионная яма, а то место, где они сейчас находятся, называется продуктом коррозии (ржавчиной).
Коррозия может произойти в любом случае, в зависимости от окружающей среды, в которой находится металл. Однако, поскольку атмосферная коррозия широко распространена, рекомендуется принять эффективные меры предосторожности, когда речь идет о предотвращении коррозии.
Это ржавый резервуар.Удаление и обработка ржавчины
В зависимости от ситуации и применения вы можете обработать заржавевший участок. Если пораженный участок небольшой и поддается лечению, вам могут потребоваться некоторые инструменты и средства для его удаления. Начните с удаления ржавчины с металла с помощью таких инструментов, как шлифовальный круг или игольчатый пистолет. Будьте осторожны, чтобы не повредить металл.
Для больших участков, подверженных коррозии, вам может потребоваться постоянное защитное покрытие, такое как антикоррозионное защитное покрытие SI-COAT компании CSL. Вы также можете потратить это время на то, чтобы посмотреть на приложение в целом на предмет других преждевременных признаков коррозии.
Как предотвратить коррозию?
Одним из лучших способов предотвращения коррозии является нанесение антикоррозионного защитного покрытия . Защитное покрытие защищает субстрат, предотвращая контакт субстрата с агрессивными средами (атмосферными, химическими и т. Д.).). Здесь, в CSL Silicones Inc, мы предлагаем два вида антикоррозионных защитных покрытий (один — экологически безопасный вариант с низким содержанием летучих органических соединений!), Которые легко наносятся одним слоем. Защитное покрытие Si-COAT® 579 AC является экономичным и обеспечивает долговременную защиту практически любой подложки.
Покрытия экологически безопасны, обладают превосходной термостойкостью (выдерживают температуры от -76 ° F до 392 ° F), не выгорают и не выгорают, имеют слабую пленку, требуют нанесения только одного слоя и обладают отличным качеством. Устойчивость к ультрафиолетовому излучению.Эластичность 180% делает покрытие очень гибким, что допускает тепловое расширение и сжатие основы, на которую оно наносится.
| Слева: резервуар, подверженный коррозии. | Справа: Тот же резервуар после нанесения антикоррозионного защитного покрытия Si-COAT 579. |
Si-COAT Anti-Corrosion Protective Coatings может применяться в широком диапазоне применений, таких как конструкционная сталь, мосты, машины и оборудование, области с сильной коррозией, внешние поверхности резервуаров, металлические крыши, облицовка и многое другое.
Защитные покрытия Si-COAT ACидеально подходят для нанесения там, где требуется необходимое покрытие и максимальная защита, адгезия, эластичность и долговечность.
Если вас интересует защита от коррозии, посетите нашу страницу Антикоррозийные защитные покрытия, стр. , для получения дополнительной информации.
Почему железо ржавеет (и как это предотвратить)
Железо, возможно, является одним из важнейших металлов в мире. Он относительно прочный, легкий и податливый, что делает его эффективным материалом для изготовления бесчисленных продуктов.Однако в естественном состоянии железо очень подвержено коррозии. Со временем универсальный металл подвергнется коррозии, что приведет к образованию оксида железа, который более известен как ржавчина.
Наука за ржавчиной
Железо, как и его сплавы, ржавеет из-за химической реакции, известной как окисление. Когда железо подвергается воздействию влаги или кислорода, происходит окисление. Во время этой химической реакции железо превращается в оксид железа. Оксид железа обычно имеет красноватый шелушащийся вид, который со временем становится все хуже.Если оставить без внимания, оксид железа будет распространяться, тем самым ставя под угрозу физическую целостность железа.
Железо может ржаветь как на воздухе, так и под воздействием влаги. И кислород, и влага являются катализаторами ржавления. Когда железо подвергается воздействию воздуха или влаги, окисление превращает его в оксид железа.
Антикоррозийные средства для обработки железа
Металлообрабатывающие и производственные предприятия могут защитить свои металлические изделия от ржавчины.Например, цинкование — это распространенный процесс антикоррозийной обработки железа. Он предполагает нанесение защитного покрытия на поверхность металлической заготовки. При гальванике цинк наносится на поверхность железа. Слой цинка действует как барьер между железом и окружающей средой. В результате утюг не контактирует с воздухом или влагой. Если предположить, что слой цинка не поврежден, оцинкованное железо не должно ржаветь.
Другой распространенной антикоррозийной обработкой железа является металлизация поверхности.Гальваника поверхности включает нанесение никеля или хрома. Поскольку никель и хром не содержат железа, они не подвержены коррозии. Покрытие поверхности — это более сложная антикоррозионная обработка, но она очень эффективна для защиты железа от ржавчины.
Что-нибудь простое, например, покраска поверхности железа, может защитить ее от ржавчины. Как и в случае гальванизации, окраска создает барьер на поверхности железа. Наличие краски создает барьер между утюгом и окружающей средой.Однако недостатком окраски железа является то, что она не держится так долго, как другие виды обработки поверхности.
Использование кованого железа вместо чистого железа также может защитить от ржавчины. Кованое железо имеет более высокое содержание углерода, чем чистое железо, и с большим содержанием углерода, естественно, лучше защищено от ржавчины. С учетом сказанного, чистое железо, кованое железо и чугун могут ржаветь под воздействием влаги или воздуха.
Почему некоторые вещи ржавеют?
Вы когда-нибудь видели очень старую машину? Как насчет старого металлического ключа или набора инструментов? Может быть, вы видели валяющийся старый велосипед.Если какие-то из этих вещей были заброшены и оставлены без присмотра в течение нескольких лет, они, вероятно, в плохом состоянии. На самом деле они, вероятно, приобрели красновато-коричневый цвет. Они могут даже отслаиваться во многих местах.
Что это за красновато-коричневый материал? Это пятна, на которых металл подвергся коррозии, и их называют ржавчиной. Когда металлические предметы ржавеют, они подвергаются опасности. Если в ближайшее время о них не позаботиться должным образом, они никому не пригодятся.
Но что такое ржавчина? Ржавчина — очень распространенное соединение.Его научное название — оксид железа (Fe2O3). Ржавчина образуется, когда железо и кислород вступают в реакцию в присутствии воды или влаги в воздухе.
Но знаете ли вы, что ржавчина не всегда бывает красновато-коричневого цвета? Вы бы поверили, что иногда он зеленый? Это правда! Когда железо вступает в реакцию с хлоридом в подводной среде, появляется зеленая ржавчина. Иногда это можно увидеть на стали, используемой в подводных столбах.
Ржавчина возникает при коррозии железа или его сплавов, например стали. В присутствии кислорода и воды поверхность куска железа сначала подвергнется коррозии.Через некоторое время любой кусок железа полностью превратится в ржавчину и распадется.
Процесс ржавления — это реакция горения, похожая на огонь. При контакте с кислородом железо вступает в реакцию с кислородом с образованием ржавчины. Однако, в отличие от огня, реакция намного медленнее и не вызывает пламени.
Есть определенные факторы, которые могут ускорить процесс ржавления. Например, вода ускоряет реакцию. Другие вещества, например соль, также могут увеличить скорость процесса ржавления.
Для предотвращения ржавчины железо можно покрыть покрытием. Это предотвращает его реакцию с кислородом и водой. Один из таких процессов называется гальванизацией. Обычно это включает покрытие железного предмета слоем цинка. Цинк препятствует реакции железа с кислородом и водой с образованием ржавчины.
Другой метод предотвращения ржавчины намного проще и распространен. Что это? Покрасить! Верно. Простой слой краски может предотвратить реакцию железа с кислородом и водой в окружающей среде.
У вас дома есть ржавые предметы? Как защитить их от коррозии? Действуй быстро! Они могут не подлежать ремонту, прежде чем вы об этом узнаете.
Стандарты: CCRA.L.3, CCRA.L.6, CCRA.R.1, CCRA.R.2, CCRA.R.4, CCRA.R.10, CCRA.SL.1, NGSS.PS1.B,
| Я не могу заставить себя написать длинный
трактат на эту тему.Это слишком больно и слишком сложно. У меня также есть
рассмотрены части этого в другом месте, так что давайте будем краткими. Я просто задам (и отвечу) на несколько основных вопросов. | ||||||
| 1. Железо и сталь
ржавеет. Почему? Ответ, сначала для простоты, только для чистого железа , прост: железо ржавеет, то есть окисляется, потому что атомы железа любят быть окруженными атомами кислорода (или серы атомов или…) гораздо больше, чем быть окруженным братскими атомами железа. Существование окисленное ближе к нирване, чем чистое. Вот почему мы находим только железную руду а не чистый металл в природе. | ||||||
| Хороший ответ, совершенно правильный, но не является удовлетворительным. Если вы не понимаете почему, посмотрите мой следующий вопрос | ||||||
| 2. Почему
алюминий, кремний и многие другие чистые элементарные кристаллы не ржавеют или не корродируют ? Теперь мы являемся самой сутью проблемы.Ответ выше относится ко всем этим элементы так же хорошо, как и гладить — но они не подвержены коррозии! По крайней мере, намного медленнее чем железо. | ||||||
И снова у нас есть два основных ингредиента.
в двух словах о материаловедении и инженерии:
| ||||||
Тогда ответ на вопрос: Кремний
алюминий и многие другие материалы действительно окисляются. Образовавшийся оксидный слой
на поверхности этих материалов, однако, есть два
важные свойства:
Теперь очевиден следующий вопрос: | ||||||
| 3. Почему
слой оксида железа не самовосстанавливающийся , в
в отличие от слоев оксида кремния или алюминия? Это непростой вопрос. Фактически, качество слоев оксида железа как ржавчины протекторы различаются совсем немного. Если сделать правильный оксид осторожно, он защищать, или, если использовать правильное слово, passivate поверхность красиво.Именно это и делает процесс «воронения». Право оксид — магнетит (Fe 3 O 4 ), черный оксид железа. Гематит (Fe 2 O 3 ), красный оксид — это плохо. Реагирует с водой на какой-то гидроксид (например, FeO (OH)), который вызывает большое изменение объема с неизбежное растрескивание, образование пузырей и отслаивание, которое не прекращается до тех пор, пока есть железо, которое нужно потреблять. Вы это видели. Это называется ржавчиной. | ||||||
| Если хотите, корень всего этого зла приходит
из того прискорбного факта, что существует несколько оксидов и гидроксидов железа, которые
может образовываться в нормальной, богатой кислородом и влажной атмосфере.Они соревнуются с каждым
другие и и превращаются друг в друга, в зависимости от условий, разрываясь на части
защитный слой всякий раз, когда это происходит. Напротив, кремний производят только
чрезвычайно прочный и стабильный диоксид кремния (SiO 2 ) и алюминий
вполне доволен своим очень твердым и очень стабильным только оксидом
(Al 2 O 3 ), материал для изготовления
драгоценные камни. Но продолжим: | ||||||
| ||||||
| 4.Собственно, чистый
железо даже не сильно ржавеет — в отличие от углеродистой стали . Почему? В принципе просто. Не все так просто, если разобраться в деталях. Легкая часть состоит в том, что как как только вы «посмотрите» (в микроскоп) на поверхность углерода стали, вы видите (слегка окисленные) феррит и цементит. Вот картинки для что. Цементит нельзя покрыть оксидом. Если бы вы могли его окислить, газ CO 2 будет производиться без твердого слоя.По краям, где железо и его оксид отвечает цементиту, механическим и «химическим» нагрузкам производится, предлагая точки атаки для молекул кислорода и воды из воздух. | ||||||
| Самое трудное возникает, если учесть, что Коррозия — это часть электрохимии. Как только два материала или фазы будут прямой контакт и некоторый контакт с жидкость, у вас есть аккумулятор со встроенным напряжением, который может управлять химическим в остальном процессы не наблюдаются.Сталь, любая сталь по определению состоит как минимум из двух фаз, как правило, из многих. Некоторая электрохимия обязательно произойдет во влажной среде, и коррозия — это скорее правило, чем исключение. | ||||||
| 5. Как же так?
что у нас есть что-то вроде нержавеющей стали, которая не ржавеет? Ответ на этот вопрос состоит из двух частей. Первый и простой — нержавеющая сталь. Типичный нержавеющая сталь должна иметь достаточно легированного хрома (не менее 11%) для образования закрытый слой оксида хрома на поверхности.Поскольку оксид хрома (Cr 2 O 3 ) соответствует обоим требованиям сверху, сталь поверхность теперь пассивирована и противостоит коррозии. Вторая и более сложная часть ответа касается Кортеновская сталь. Это специальная сталь с необычными легированными элементами, позволяющая производить стабильную и довольно густой оксид. Он такой толстый, что на самом деле сталь выглядит очень ржавой. Но ржавление не продолжается после первоначального образования оксида. | ||||||
| 6. Все остальное
нужно знать о коррозии железа и стали? Вы должны сами ответить на этот вопрос. Лучше всего выйти за рамки того, что я тебе дал чтением хороших книг, которому, возможно, предшествуют несколько лет изучения необходимые основы химии, материаловедения и физики. | ||||||
Почему металл ржавеет? — Сделать из металла
Ржавчина редко когда-либо считается хорошей вещью.Абсолютно больно восстанавливать все, что начало разлагаться и гнить от ржавчины. Стоимость восстановления тоже может быть довольно безумной.
Так почему ржавеет металл? Любой металл, содержащий железо, под воздействием кислорода в присутствии воды начинает ржаветь. Эти же металлы также ржавеют при воздействии хлоридов и воды. Хлорид чаще всего содержится в соли.
В этом посте я расскажу о некоторых научных данных, благодаря которым это происходит, о том, какие металлы не ржавеют и как предотвратить ржавление металлов.
Почему металл ржавеет
Во-первых, ржаветь будет только металл, содержащий железо. Наиболее часто используемый металл, содержащий железо, — это сталь. Металлы, не содержащие железа, такие как алюминий и титан, будут ржаветь , а не (хотя они окисляются).
Ржавчина — это электрохимический процесс, который восстанавливает железосодержащие металлы до их естественного, неочищенного состояния. Этот процесс можно ускорить, добавив тепла, некоторых минералов и химикатов.
Думайте об этом как о естественном способе бросить наш хлам обратно в землю.
Ржавчина — это разновидность окисления. Окисление — это причудливое слово, которое описывает потерю электрона в результате реакции с молекулой, атомом или ионом.
Железо и кислород имеют противоположные заряды, поэтому они притягиваются друг к другу (как магниты). Когда они контактируют друг с другом в присутствии воды, они объединяются. Атом железа теряет три электрона, а атом кислорода получает два атома. Это та потеря электрона, о которой мы говорили. Железо слишком податливо.
Он образует молекулу Fe2O3, которая в науке известна как оксид железа.Остальные из нас просто используют красивое и простое слово «ржавчина».
Окисление не обязательно означает, что виноват кислород, хотя термин возник именно отсюда. Еще во времена динозавров (или около того) кислород был единственным известным окислителем. Современное определение «окисления» может включать другие окислители, такие как перекись водорода и галогены.
Сверхбыстрая ржавчина
Не вся ржавчина образуется кислородом. Также существует ржавчина, образованная хлоридом.
Обычным источником хлоридов является соль. Вообще-то причудливое название соли — хлорид натрия. Ион хлорида будет очень сильно реагировать с железом, когда рядом вода. Если кислорода нет, только этот ион вызовет образование зеленой ржавчины, как на затонувших кораблях.
Вот почему металл так быстро ржавеет в океане. Соленый влажный воздух заметно ускорит этот процесс. Вы даже можете заметить образование ржавчины на голом металле в течение одного дня!
Еще одно обычное место, где соль наносит ущерб металлу, — это холодные районы, где соль используется в качестве антиобледенителя на дорогах.Обычно автомобили ржавеют и гниют значительно быстрее, если не обрабатывать металл и быстро смывать соль.
На самом деле существует несколько видов оксида железа (ржавчины), кроме простого красного вещества из кислорода и зеленого вещества из хлорида, но в среднем их довольно редко можно увидеть.
Как защитить металл от ржавчины
Существует множество способов предотвратить образование ржавчины на металлах, содержащих железо. Хорошо, что все эти методы состоят из создания барьера, который предотвратит контакт железа и кислорода.
Краска
Это наиболее распространенное и обычно самое дешевое решение. Если вы покроете сталь слоем краски, вы создадите простой и легкий барьер, блокирующий молекулы кислорода.
Для того, чтобы это работало правильно, вам понадобится краска, которая будет прочно держаться за металл. Если он сколется или отслоится, он больше не защитит металл. Существуют специально разработанные краски для металла, а также порошковые покрытия для пластика и эмаль, которые, по сути, делают одно и то же.
Покрытие
Это процесс, при котором вы покрываете железо или сталь другим металлом, который не ржавеет. Это можно сделать электрохимическим способом или осаждением из паровой фазы.
Другой распространенный способ нанесения металла — это погружение, как при цинковании. Горячее цинкование — это процесс, при котором сталь погружают в ванну с расплавленным цинком, которая защищает металл от ржавчины.
По сути, вы используете другой металл, чтобы создать барьер между железом и кислородом или хлоридом.
Однако для некоторых металлических покрытий (например, цинка) вы также используете металл для поглощения лишних электронов, вызывающих ржавчину. В конце концов цинк разъедет, но пока он не исчезнет, сталь под ним будет ржаветь гораздо медленнее. Этот процесс называется катодной защитой.
Прочие защитные барьеры
Помимо перечисленных выше, есть еще несколько вариантов, которые можно использовать. Однако обычно это временные решения, например, для доставки на лодке, или они требуют регулярного обслуживания.
Например, многие мелкие металлические детали погружаются в воск, когда они подвергаются воздействию соленого воздуха во время транспортировки. Для больших кусков металла можно использовать воск в спрее.
Многие детали машины покрыты маслом или смазкой. Поскольку масло отталкивает воду, это отличный способ предотвратить ржавчину. Обратной стороной этого является то, что масло должно оставаться на металле. Если его очистить и не наносить повторно, металл заржавеет. Это означает, что машина будет нуждаться в регулярном обслуживании.
Сплавы и нержавеющие стали
Для металлических компонентов, которые нельзя покрасить или покрыть, иногда решением является использование металлического сплава вместо обычной стали.
Нержавеющая сталь предотвращает ржавчину, поскольку она легирована другими металлами и элементами, которые окисляются и образуют тонкий барьер, предотвращающий ржавление. Существует несколько различных видов нержавеющих сталей, большинство из которых в той или иной степени подвержены ржавчине, поскольку они действительно содержат железо. Но тонкий оксидный слой, образованный этими легирующими элементами, предотвратит распространение ржавчины очень далеко.
Общие примеры легирующих элементов для нержавеющих сталей включают хром (наиболее распространенный элемент в этом металле, предотвращающий коррозию), а также никель и молибден.
Нержавеющая сталь с меньшим содержанием хрома будет более подвержена ржавчине, тогда как высокое содержание хрома значительно повысит коррозионную стойкость. Это элемент №1, добавленный для того, чтобы нержавеющая сталь… не оставляла пятен.
Удаление ржавчины
Это обычно полная боль. Однако если вы пытаетесь восстановить что-то заржавевшее, у вас есть несколько вариантов в зависимости от того, насколько глубоко ржавчина заходит.
- Преобразователи ржавчины — отличный способ «нейтрализовать» легкую ржавчину. Они могут действовать как грунтовка и могут быть окрашены непосредственно. Это хорошее решение, если вы просто пытаетесь уберечь что-то от распада и не слишком заботитесь о косметике.
- Лазеры позволяют добиться аналогичного результата. Есть специально разработанные станки, которые удаляют ржавчину, оставляя лежащий под ней металл относительно неповрежденным. Но они не из дешевых. Большинство единиц стоят несколько десятков тысяч долларов.
- Небольшие металлические детали со средним количеством ржавчины можно смочить в кислоте, которая разъедает ржавчину. Обычный домашний подход — замачивать инструменты в уксусе на день.
- Электролиз — отличный способ ускорить кислотное удаление ржавчины. Добавив электричество в кислотную ванну, можно очень тщательно удалить ржавчину.
- Для больших панелей, таких как автомобили, нанесение небольшого количества смазки для локтей является наиболее распространенным способом избавиться от ржавчины. Вы можете использовать проволочный круг или абразивную подушку с угловой шлифовальной машиной, чтобы удалить ржавчину до оголенного металла.После этого специалист по кузовам будет использовать затвердевающую шпатлевку, чтобы сгладить поверхность металла перед перекрашиванием панели.
В любом случае, это основной ответ на вопрос, почему металлы ржавеют. Если вы хотите узнать больше о металлах, которые не содержат железо и окисляются другим способом, вот статья, которую стоит проверить:
Ржавеют ли титан, алюминий и другие цветные металлы?
Или, если вы хотите узнать больше о стали, это может быть для вас более интересно:
Легированная стальи углеродистая сталь — в чем разница?
Что такое RUST… Обширная техническая информация, которая поможет вам принять правильное решение
Ржавчина встречается повсюду и является обычным явлением.
Ржавчина — это общий термин для обозначения различных форм оксида железа.
Они образуются в результате химической реакции между железом и кислородом в присутствии воды. Кислород содержится в воздухе, которым мы дышим, а воду можно найти во влажном воздухе или в жидкостях, которые обычно находятся вокруг нас.
Ржавчина на самом деле представляет собой Fe 2 O 3 , красноватую форму оксида железа.Железо имеет другой оксид Fe 3 O 4 , который иногда называют черной оксидной пленкой или черной ржавчиной. Красная ржавчина встречается в богатых кислородом средах, а черная ржавчина — в бедных кислородом средах, например под водой. Черная окись — хорошая защита для стали. Как и оксид алюминия, молекулы черного оксида имеют тот же размер, что и молекулы железа, поэтому черный оксид не растет и не отслаивается. Черный оксид — это настоящая ружейная воронка и оксид, встречающийся на некоторых сверлах. Черная окись также видна на чугуне и стали, подвергнутой горячей обработке.
Ржавчина начинается с появления легкой пыли на куске незащищенной стали или сплава. По мере развития ржавчины частица ржавчины начинает расти, а в случае красной ржавчины — отслаиваться от основного металла. Ржавчина фактически удаляет железо, с которым реагируют кислород и вода, оставляя основной металл «изъеденным». точечная коррозия не заметна, если ржавчина достаточно легкая, и может вызывать нежелательные последствия, если возникает сильная или сильная ржавчина.
Ржавчина широко известна как коррозия железа и его сплавов, таких как сталь или чугун.Другие металлы подвергаются аналогичной коррозии, хотя образующиеся оксиды обычно не называют ржавчиной.
По прошествии некоторого времени кислород, вода и любая масса железа в конечном итоге полностью превращается в ржавчину и в конечном итоге распадается. Коррозия алюминия происходит чрезвычайно медленно, поскольку образующийся оксид алюминия образует полузащитный барьер или покрытие, которое защищает оставшийся алюминий. Защитный барьер — это процесс, известный как пассивация.
Многие материалы реагируют с кислородом с образованием химического соединения, которое представляет собой комбинацию этого материала и кислорода.Когда железо соединяется с кислородом, оно образует оксид железа или ржавчину. Оксид железа — более крупная молекула, чем железо, поэтому, если железо окисляется, оно часто вздувается и может даже отслаиваться. Это потому, что ржавчина требует больше физического пространства, чем оригинальное железо.
При расширении или вздутии ржавчины образуются трещины и пустоты, из-за которых в окружающую среду попадает больше оголенного металла. Таким образом, ржавление железа может прогрессировать и ограничивается только разрушением всего твердого железа. Другие металлы окисляются, но оксиды некоторых других металлов не больше самого металла, поэтому они не вздуваются и не отслаиваются.Например, алюминий не вздувается при окислении. Это помогает сделать оксид алюминия хорошим защитным покрытием, а не началом быстрой дегенерации.
От некоторых вещей сталь или железо ржавеют быстрее, чем от других. Вода вызовет ржавление железа и стали. Разные металлы ржавеют быстрее, чем отдельные металлы из-за электрохимических реакций, поэтому сталь ржавеет быстрее, чем железо, а стыки между разнородными металлами ржавеют очень быстро. Соленая вода вызывает ржавчину быстрее, чем вода, потому что соленая вода является лучшим проводником электричества.Как и большинство химических реакций, тепло ускоряет ржавчину.
Условия, влияющие на RUST
Для запуска и ускорения коррозии требуется кислород, вода и железо. Следовательно, удаление одного из этих предметов приведет к прекращению реакции. Следующие источники воды увеличивают эту реакцию и обсуждаются ниже.
Влажность: Количество воды в воздухе, которым мы дышим. Уровень влажности зависит от температуры и источника воды, например, большого водоема.Мы можем наблюдать наибольшую влажность в жаркие влажные дни. В эти дни ржавление может значительно ускориться по сравнению с холодными засушливыми зимними днями. Осушение может значительно уменьшить количество воды в горячем влажном воздухе.
Вода: Вода окружает нас повсюду, ее можно найти в воздухе, дожде и других источниках. увеличение количества воды вокруг железных деталей увеличивает скорость их ржавления.
Соленая вода: Соленая вода особенно разъедает железо или сталь.Корабли, пристани для яхт, береговые линии и другие подобные места сильно подвержены коррозии ржавчины. Зимы на севере являются причиной преждевременного ржавления автомобилей из-за «засоления» дорог для тяги.
Как защитить металлы от РОЖДЕНИЯ
Окраска: Окраска надежно защищает металлы от коррозии. Главное в покраске — закрашивать металл без загрязнений. На металле не должно быть масел / смазок, ржавчины / углерода. даже если вы удалите все загрязнения, кроме ржавчины, ржавчина будет продолжать ржаветь под краской и преждевременно отслаиваться от лакокрасочного покрытия.
Средства защиты от ржавчины: Средства защиты не обеспечивают защиты красок. Это покрытие обеспечивает защиту от ржавчины, если покрытие не смыть, не оставить снаружи или что-то подобное. Обычно используется между процессами или в защищенных средах.
Ингибиторы ржавчины: Ингибиторы используются только на короткое время, чтобы предотвратить быстрое ржавление деталей и легко удалить.
Материалы с VCI: Ингибиторы паровой коррозии. Некоторые химические вещества выделяют пар, который препятствует попаданию влаги из воздуха на поверхность черных металлов, тем самым препятствуя образованию оксидов.Обычно используется в закрытых контейнерах или обернутых предметах.
Катодная защита: Используется в автомобилях для замедления процесса ржавления. Работает по принципу катода и анода.
КАК УДАЛИТЬ РЖАВЧИНУ?
Нагрев: Нагрейте деталь сильным нагревом с помощью ацетиленовой горелки или аналогичного предмета. Это удалит большую часть ржавчины, и этому можно помочь, ударив молотком.
Кислоты: Кислоты обычно использовались в прошлом. Они работают хорошо, но опасны для сотрудников и вашего здоровья.Требуются средства защиты и меры безопасности. Кислоты необходимо несколько раз тщательно промыть чистой водой, чтобы удалить все кислоты. Утилизация может быть дорогостоящей и обязательной.
Электролитический: Использует электрический ток для создания анодной и катодной реакции с оксидом железа. Удаление ржавчины может занять до недели. Также углы, острые кромки и т. Д. Не очищаются должным образом от ржавчины из-за эффектов Фарадея.
Chelation: Новая технология, использующая неопасные химические соединения для удаления ржавчины.Chelant произносится как «key-lant».
Всегда лучше защитить металл тем или иным способом.
17.6 Коррозия — химия
Цели обучения
К концу этого раздела вы сможете:
- Определить коррозию
- Перечислите некоторые методы, используемые для предотвращения или замедления коррозии
Коррозия обычно определяется как разложение металлов в результате электрохимического процесса.Образование ржавчины на железе, потускнение серебра и сине-зеленая патина на меди — все это примеры коррозии. Общие затраты на коррозию в Соединенных Штатах значительны и оцениваются более чем в полтриллиона долларов в год.
Статуя Свободы: меняя цвета
Статуя Свободы — достопримечательность, которую признает каждый американец. Статую Свободы легко узнать по ее высоте, положению и уникальному сине-зеленому цвету (рис. 1). Когда эта статуя впервые была доставлена из Франции, она не имела зеленого цвета.Оно было коричневым, цвета его медной «кожи». Так как же Статуя Свободы изменила цвет? Изменение внешнего вида было прямым результатом коррозии. Медь, которая является основным компонентом статуи, медленно подвергалась окислению на воздухе. Окислительно-восстановительные реакции металлической меди в окружающей среде протекают в несколько стадий. Металлическая медь окисляется до оксида меди (I) (Cu 2 O), который имеет красный цвет, а затем до оксида меди (II), который имеет черный цвет
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} ll} 2 \ text {Cu} (s) \; + \; \ frac {1} {2} \ text {O} _2 (g) & \ text {Cu} _2 \ text {O} (s) & (\ text {red}) \\ [0.5em] \ text {Cu} _2 \ text {O} (s) \; + \; \ frac {1} {2} \ text {O} _2 (g) & 2 \ text {CuO} (s) & ( \ text {черный}) \ end {array} [/ latex]
Уголь, часто содержащий большое количество серы, активно сжигался в начале прошлого века. В результате триоксид серы, диоксид углерода и вода прореагировали с CuO
.[латекс] \ begin {array} {r @ {{} = {}} ll} 2 \ text {CuO} (s) \; + \; \ text {CO} _2 (g) \; + \; \ текст {H} _2 \ text {O} (l) & \ text {Cu} _2 \ text {CO} _3 (\ text {OH}) _ 2 (s) & (\ text {зеленый}) \\ [0.5em ] 3 \ text {CuO} (s) \; + \; 2 \ text {CO} _2 (g) \; + \; \ text {H} _2 \ text {O} (l) & \ text {Cu} _2 (\ text {CO} _3) _2 (\ text {OH}) _ 2 (s) & (\ text {blue}) \\ [0.5em] 4 \ text {CuO} (s) \; + \; \ text {SO} _3 (g) \; + \; 3 \ text {H} _2 \ text {O} (l) & \ text {Cu } _4 \ text {SO} _4 (\ text {OH}) _ 6 (s) & (\ text {green}) \ end {array} [/ latex]
Эти три соединения ответственны за характерную сине-зеленую патину, наблюдаемую сегодня. К счастью, патина создала защитный слой на поверхности, предотвращающий дальнейшую коррозию медной пленки. {\ circ} = -0.{+} (водн.) [/ латекс]
Количество молекул воды варьируется, поэтому оно представлено как x . В отличие от патины на меди, образование ржавчины не создает защитного слоя, поэтому коррозия железа продолжается, поскольку ржавчина отслаивается и подвергает свежее железо воздействию атмосферы.
Рис. 2. Когда краска поцарапана на окрашенной железной поверхности, возникает коррозия и начинает образовываться ржавчина. Скорость самопроизвольной реакции увеличивается в присутствии электролитов, таких как хлорид натрия, используемый на дорогах для таяния льда и снега или в соленой воде.Один из способов уберечь железо от коррозии — это держать его в краске. Слой краски предотвращает попадание воды и кислорода, необходимых для образования ржавчины, на утюг. Пока краска остается неповрежденной, утюг защищен от коррозии.
Другие стратегии включают сплавление железа с другими металлами. Например, нержавеющая сталь — это в основном железо с небольшим содержанием хрома. Хром имеет тенденцию собираться у поверхности, где он образует оксидный слой, защищающий железо.
Оцинкованное железо или оцинкованное железо использует другую стратегию. Цинк окисляется легче, чем железо, потому что цинк имеет более низкий восстановительный потенциал. Поскольку цинк имеет более низкий восстановительный потенциал, это более активный металл. Таким образом, даже если цинковое покрытие поцарапано, цинк все равно будет окисляться раньше железа. Это говорит о том, что этот подход должен работать с другими активными металлами.
Еще один важный способ защиты металла — это сделать его катодом в гальваническом элементе.Это катодная защита и может использоваться не только для железа, но и для других металлов. Например, ржавление подземных резервуаров для хранения железа и труб можно предотвратить или значительно уменьшить, подключив их к более активному металлу, такому как цинк или магний (рис. 3). Это также используется для защиты металлических частей водонагревателей. Более активные металлы (более низкий потенциал восстановления) называются расходуемыми анодами , потому что по мере их использования они коррозируют (окисляются) на аноде.Защищаемый металл служит катодом и поэтому не окисляется (не корродирует). Когда аноды подвергаются надлежащему контролю и периодически заменяются, полезный срок службы резервуара для хранения железа может быть значительно увеличен.
Рис. 3. Одним из способов защиты подземного резервуара для хранения железа является катодная защита. Использование в качестве анода активного металла, такого как цинк или магний, эффективно превращает резервуар для хранения в катод, предотвращая его коррозию (окисление).Коррозия — это разрушение металла, вызванное электрохимическим процессом.Ежегодно тратятся большие суммы денег на устранение последствий или предотвращение коррозии. Некоторые металлы, такие как алюминий и медь, образуют защитный слой при коррозии на воздухе. Тонкий слой, который образуется на поверхности металла, предотвращает контакт кислорода с большим количеством атомов металла и, таким образом, «защищает» оставшийся металл от дальнейшей коррозии. Железо разъедает (образует ржавчину) под воздействием воды и кислорода. Ржавчина, образующаяся на металлическом железе, отслаивается, обнажая свежий металл, который также подвергается коррозии.Один из способов предотвратить или замедлить коррозию — нанести на металл покрытие. Покрытие предотвращает контакт воды и кислорода с металлом. Краска или другие покрытия замедляют коррозию, но они неэффективны после царапин. Оцинкованное или оцинкованное железо использует тот факт, что цинк более склонен к окислению, чем железо. Пока покрытие остается, даже если оно поцарапано, цинк будет окисляться раньше железа. Еще один метод защиты металлов — катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (расходуемый анод), электрически соединяется с металлом, который необходимо защищать.Более активный металл — это расходуемый анод, который является анодом в гальванической ячейке. «Защищенный» металл — это катод, и он остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Химия: упражнения в конце главы
- Какой элемент каждой пары металлов с большей вероятностью подвержен коррозии (окислению)?
(а) Mg или Ca
(б) Au или Hg
(c) Fe или Zn
(d) Ag или Pt
- Рассмотрим следующие металлы: Ag, Au, Mg, Ni и Zn.{\ circ} = -0,477 \; \ text {V}) [/ latex], и все же, когда оба подвергаются воздействию окружающей среды, необработанный алюминий имеет очень хорошую коррозионную стойкость, в то время как коррозионная стойкость необработанного железа оставляет желать лучшего. Объясните это наблюдение.
- Если образец железа и образец цинка соприкасаются, цинк разъедает, а железо — нет. Если образец железа соприкасается с образцом меди, железо разъедает, а медь — нет. Объясните этот феномен.
- Предположим, у вас есть три разных металла: A, B и C.{\ circ} = -3.04 \; \ text {V} [/ latex], который, кажется, может защитить все другие металлы, перечисленные в стандартной таблице восстановительного потенциала?
Глоссарий
- катодная защита
- способ защиты металла с помощью расходуемого анода и эффективного получения металла, который нуждается в защите катода, предотвращая его окисление
- коррозия
- Разложение металла в результате электрохимического процесса
- оцинкованное железо
- способ защиты железа путем покрытия его цинком, который окисляется раньше железа; оцинкованное железо
- расходуемый анод
- более активный и недорогой металл, используемый в качестве анода в катодной защите; часто из магния или цинка
Решения
Ответы на упражнения в конце главы по химии
2.Mg и Zn
4. Оба примера включают катодную защиту. (Жертвенный) анод — это металл, который коррозирует (окисляется или вступает в реакцию). В случае железа (-0,447 В) и цинка (-0,7618 В) цинк имеет более отрицательный стандартный восстановительный потенциал и поэтому служит анодом. В случае железа и меди (0,34 В) железо имеет меньший стандартный восстановительный потенциал и поэтому подвергается коррозии (служит анодом).
6. Хотя восстановительный потенциал лития делает его способным защищать другие металлы, этот высокий потенциал также указывает на то, насколько литий реакционноспособен; он будет иметь спонтанную реакцию с большинством веществ.Это означает, что литий будет быстро реагировать с другими веществами, даже с теми, которые не окисляют металл, который он пытается защитить. Такая реактивность означает, что расходуемый анод будет быстро истощаться и его нужно будет часто заменять. (Необязательная дополнительная причина: опасность возгорания в присутствии воды.)
. Металл конечно может быть поглощен процессом ржавения абсолютно весь, но это занимает очень много времени. Зачастую, даже очень жирный слоина ржавчины на детали, не говорит о том, что металла осталось критически мало для того чтобы она выдержала положенные ей нагрузки.
Металл конечно может быть поглощен процессом ржавения абсолютно весь, но это занимает очень много времени. Зачастую, даже очень жирный слоина ржавчины на детали, не говорит о том, что металла осталось критически мало для того чтобы она выдержала положенные ей нагрузки.