Гальванические пары металлов
Табл. 1 Совместимость металлов и сплавов
С — совместимые
Н — несовместимые
П — совместимые при пайке, но несовместимые при непосредственном соприкосновении, так как образуют гальваническую пару
ПОС — припой оловянно-свинцовый
Сталь — нелегированная
Пример нежелательных гальванических пар:
1 ПАРА: алюминий и все сплавы на его основе не рекомендуется и недопустимо сочетать:
— с медью и ее сплавами
— с серебром
— с золотом
— с платиной
— с палладием
— с родием
— с оловом
— с никелем
— с хромом
2 ПАРА: алюминий и все сплавы на его основе не рекомендуется и недопустимо сочетать:
— с титаном и с его сплавами
3 ПАРА: магниево-алюминиевые сплавы не рекомендуется и недопустимо сочетать:
— с хромом
— со свинцом
— со сталью легированной и нелегированной
— с медью
— с серебром
— с золотом
— с платиной
— с палладием
— с родием
— с оловом
— с никелем
4 ПАРА: цинк и его сплавы не рекомендуется и недопустимо сочетать:
— с медью и ее сплавами
— с серебром
— с золотом
— с платиной
— с палладием
— с родием
5 ПАРА: никель и хром не рекомендуется и недопустимо сочетать:
— с медью и ее сплавами
— с серебром
— с золотом
— с платиной
— с палладием
— с родием
6 ПАРА: сталь нелегированная, олово, свинец, кадмий не рекомендуется и недопустимо сочетать:
— с серебром
— с золотом
— с платиной
— с палладием
— с родием
Гальваническая коррозия более активного металла начинается в тот момент, когда две или более детали из разнородных металлов, имеющие взаимный контакт (благодаря обычному соприкосновению, или же посредством проводника) помещаются в электролит (любую жидкость, проводящую электричество). Электролитом может быть что угодно, за исключением химически чистой воды. Не только соленая морская, но и обычная вода из-под крана благодаря наличию минеральных веществ является превосходным электролитом, и с ростом температуры электропроводность ее только растет.
Катод — электрод, на котором происходит процесс восстановления, а анод — это электрод, где протекают окислительные процессы.
Ряд активности металлов (электрохимический ряд напряжений металлов)
1 — Активные металлы
2 — Металлы средней активности
3 — Неактивные металлы
Химическая коррозия — металлы защищают себя оксидной пленкой на своей поверхности, является ли она самовосстанавливающейся, вот вопрос, как в случае алюминия, нержавеющей стали, цветных металлов или же как у стали отделяется.
prof-il.ru
Гальванические пары металлов — Zygar
Гальваническая пара, погруженная в кислотный (или щелочной) раствор, будет корродировать (разрушаться под действием коррозии). Этот процесс называется гальванической коррозией. Как правило, соединения разных металлов всегда подвержены коррозии (если не электролитической, так атмосферной). Но некоторые пары металлов корродируют намного сильнее. Ниже приведён список металлов, которые не рекомендуется применять в паре.
Недопустимые гальванические пары:
первая пара:
алюминий и все сплавы на его основе;
медь и её сплавы, серебро, золото, платина, палладий, родий, олово, никель, хром, нелегированная сталь;
вторая пара:
магниево-алюминиевые сплавы;
сталь легированная и нелегированная, хром, никель, медь, свинец, олово, золото, серебро, платина, палладий, родий;
третья пара:
цинк и его сплавы;
медь и её сплавы, серебро, золото, платина, палладий, родий;
четвёртая пара:
сталь нелегированная, олово, свинец, кадмий;
медь, серебро, золото, платина, палладий, родий;
пятая пара:
никель, хром;
серебро, золото, платина, палладий, родий;
шестая пара:
титан и его сплавы;
алюминий и его сплавы.
Необходимо избегать механического соединения деталей, изготовленных из металлов с заметно разными электрохимическими потенциалами. Например, недопустимо соединять латунные детали алюминиевой заклёпкой. Для выбора материалов в этих случаях можно руководствоваться таблицей электрохимических потенциалов (или так называемым электрохимическим рядом).
Таблица 2 совместимости металлов и сплавов (оценка риска гальванической коррозии).
Легенда:
- «Совм» — совместимые
- «Не совм»—
- «Пайка» — совместимые при тщательной пайке, но несовместимые при непосредственном соприкосновении, так как образуют гальваническую пару
- Таблица двигается по горизонтали, в самом низу таблицы ползунок.
| Материал | Алюминий | Бронза | Дюраль | Латунь | Медь | Никель | Олово | Оловянно-свинцовый сплав (припой ПОС) | Сталь нелегированная (углеродистая) / чугун | Хром | Цинк |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Алюминий | Совм | Не совм | Совм | Не совм | Не совм | Не совм | Не совм | Не совм | Совм | Не совм | Совм |
| Бронза | Не совм | Совм | Не совм | Совм | Совм | Совм | Пайка | Пайка | Не совм | Совм | Не совм |
| Дюралюминий | Совм | Не совм | Совм | Не совм | Не совм | Не совм | Не совм | Не совм | Совм | Не совм | Совм |
| Латунь | Не совм | Совм | Не совм | Совм | Совм | Совм | Пайка | Пайка | Не совм | Совм | Не совм |
| Медь | Не совм | Совм | Не совм | Совм | Совм | Совм | Пайка | Пайка | Не совм | Совм | Не совм |
| Никель | Не совм | Совм | Не совм | Совм | Совм | Совм | Пайка | Пайка | Совм | нет данных | Совм |
| Олово | Не совм | Пайка | Не совм | Пайка | Пайка | II | Совм | Совм | Совм | нет данных | Совм |
| Оловянно-свинцовый сплав припой ПОС | Не совм | Пайка | Не совм | Пайка | Пайка | Пайка | Совм | Совм | Совм | нет данных | Совм |
| Сталь нелегированная (углеродистая)/ чугун | Совм | Не совм | Совм | Не совм | Не совм | Совм | Совм | Совм | Совм | Совм | Совм |
| Хром | Не совм | Совм | Не совм | Совм | Совм | нет данных | нет данных | нет данных | Совм | Совм | Совм |
| Цинк | Совм | Не совм | Совм | Не совм | Не совм | Совм | Совм | Совм | Совм | Совм | Совм |
zygar.ru
Гальваническая пара — Карта знаний
- Гальваническая пара (англ. galvanic couple, voltaic couple), гальванопара — пара проводников, изготовленных из разных материалов (обычно, из разных металлов) и соединённых друг с другом с целью обеспечения электрического контакта. Названа в честь Луиджи Гальвани (Galvani).
Гальвани случайно наткнулся на явление, получившее название «опыт Гальвани», и не смог правильно его объяснить, поскольку исходил из ложной гипотезы о существовании некоего «животного» электричества. Результаты исследований он изложил в «Трактате о силах электричества при мышечном движении».
Гальваническую пару также исследовал Жан-Жак Зульцер (по другим источникам — немецкийфилософ Иоган Георг Зульцер), который писал:
Если два куска металла, один оловянный, другой серебряный, соединить таким образом, чтобы оба края их были на одной плоскости, и если приложить их к языку, то в последнем будет ощущаться некоторый вкус, довольно похожий на вкус железного купороса, в то же время каждый кусок металла в отдельности не даёт и следа этого вкуса
Опыты Зульцера повторил и расширил Алессандро Вольта.
Гальваническая пара, погруженная в кислотный (или щелочной) раствор, будет корродировать (разрушаться под действием коррозии). Этот процесс называется гальванической коррозией. Как правило, соединения разных металлов всегда подвержены коррозии (если не электролитической, так атмосферной). Но некоторые пары металлов корродируют намного сильнее. Ниже приведён список металлов, которые не рекомендуется применять в паре.
Недопустимые гальванические пары:
* первая пара:
* алюминий и все сплавы на его основе;
* медь и её сплавы, серебро, золото, платина, палладий, родий, олово, никель, хром, нелегированная сталь;
* вторая пара:
* магниево-алюминиевые сплавы;
* сталь легированная и нелегированная, хром, никель, медь, свинец, олово, золото, серебро, платина, палладий, родий;
* третья пара:
* цинк и его сплавы;
* медь и её сплавы, серебро, золото, платина, палладий, родий;
* четвёртая пара:
* сталь нелегированная, олово, свинец, кадмий;
* медь, серебро, золото, платина, палладий, родий;
* пятая пара:
* никель, хром;
* серебро, золото, платина, палладий, родий;
* шестая пара:
* титан и его сплавы;
алюминий и его сплавы.Необходимо избегать механического соединения деталей, изготовленных из металлов с заметно разными электрохимическими потенциалами. Например, недопустимо соединять латунные детали алюминиевой заклёпкой. Для выбора материалов в этих случаях можно руководствоваться таблицей электрохимических потенциалов (или так называемым электрохимическим рядом).
Источник: Википедия
Связанные понятия
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах. Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с молекулы на молекулу в электрохимии не рассматривается… Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. Стекло́ — вещество и материал, один из самых древних и, благодаря разнообразию своих свойств, — универсальный в практике человека. Структурно-аморфно, изотропно; все виды стёкол при формировании преобразуются в агрегатном состоянии — от чрезвычайной вязкости жидкого до так называемого стеклообразного — в процессе остывания со скоростью, достаточной для предотвращения кристаллизации расплавов, получаемых плавлением сырья (шихты). Температура варки стёкол, от +300 до +2500 °C, определяется компонентами… Постоя́нный магни́т — изделие из магнитотвёрдого материала с высокой остаточной магнитной индукцией, сохраняющее состояние намагниченности в течение длительного времени. Постоянные магниты изготавливаются различной формы и применяются в качестве автономных (не потребляющих энергии) источников магнитного поля. Алмазоподобное покрытие (DLC) — это технология плазменного импульсного распыления графита в вакуумной камере и осаждение ионов углерода с достаточно большой энергией на изделия.Существует в семи различных формах. Все семь содержат значительное количество sp3 гибридизированных атомов углерода. Наиболее распространенные формы имеют атомы углерода, расположенные в кубической решетке, в то время как менее распространенные (типа «лонсдейлит») имеют гексагональную решетку. При смешивании этих политипов… Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию. Рту́тно-ци́нковый элеме́нт («тип РЦ») — гальванический элемент в котором анодом является цинк, катодом — оксид ртути, электролит — 45 % раствор гидроксида калия на адсорбенте. Дуговая сварка неплавящимся электродом в защитной атмосфере инертного газа — метод дуговой сварки, который используется для сварки алюминия, магния и их сплавов, нержавеющей стали, никеля, меди, бронзы, титана, циркония и других неферромагнитных металлов. Техника сварки похожа на газовую (автогенную) сварку, следовательно, требует высокой квалификации сварщика. Применением данного технологического процесса можно получить сварные швы высокого качества. Однако показатели производительности при использовании… Нитинол (англ. nitinol, от англ. nickel — никель, англ. titanium — титан, англ. Naval ordnance laboratory, сокр. NOL — Лаборатория морской артиллерии США, где был разработан материал) — сплав титана и никеля, обладающий высокой коррозионной и эрозионной стойкостью. Процентное содержание титана — 45 %, никеля — 55 %, что соответствует формуле TiNi, то есть количества атомов равны. Необычно то, что данный сплав обладает свойством памяти формы. Если деталь сложной формы подвергнуть нагреву до красного… Ржа́вчина является общим термином для определения окислов железа. В разговорной речи это слово применяется к красным окислам, образующимся в ходе реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в ходе реакции железа с хлором при отсутствии кислорода. Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его зелёной ржавчиной. Несколько видов коррозии различимы зрительно… Эффект памяти формы — явление возврата к первоначальной форме при нагреве, которое наблюдается у некоторых материалов после предварительной деформации. Мангани́н — прецизионный сплав на основе меди (Cu) (около 85 %) с добавкой марганца (Mn) (11,5—13,5 %) и никеля (Ni) (2,5—3,5 %). Гальванический анод является основным компонентом системы гальванической катодной защиты, используемой для защиты подземных или подводных металлических конструкций от коррозии . Электри́чество — совокупность явлений, обусловленных существованием, взаимодействием и движением электрических зарядов. Термин введён английским естествоиспытателем Уильямом Гилбертом в его сочинении «О магните, магнитных телах и о большом магните — Земле» (1600 год), в котором объясняется действие магнитного компаса и описываются некоторые опыты с наэлектризованными телами. Он установил, что свойством наэлектризовываться обладают и другие вещества. Гальваноте́хника — раздел прикладной электрохимии, описывающий физические и электрохимические процессы, происходящие при осаждении катионов металла на каком-либо виде катода. Элетрошлаковое литьё (ЭШЛ) — вид электрошлакового процесса (ЭШП), литейная технология с защитой металлической ванны от взаимодействия с воздухом находящейся сверху шлаковой ванной, подогреваемой проходящим через неё электрическим током. Используется, например, при изготовлении биметаллических прокатных валков. Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me… Эльбо́р (Ленинград + бор), боразо́н (от бор + азот), кубони́т, кингсонгит, киборит — торговые марки сверхтвердых материалов на основе кубической β-модификации (сфалеритной) нитрида бора, или кубического нитрида бора (советская аббревиатура — КНБ, зарубежная — cBN). По твёрдости и другим свойствам приближается к алмазу (10 по шкале Мооса). 16 декабря 1947 года физик-экспериментатор Уолтер Браттейн, работавший с теоретиком Джоном Бардином, собрал первый работоспособный точечный транзистор. Спустя полгода, но до обнародования работ Бардина и Браттейна, немецкие физики Герберт Матаре и Генрих Велькер представили разработанный во Франции точечный транзистор («транзистрон»). Так из безуспешных попыток создать сначала твердотельный аналог вакуумного триода, а затем полевой транзистор, родился первый несовершенный точечный биполярный транзистор…Подробнее: Изобретение транзистора
Вакуумно-дуговое нанесение покрытий (катодно-дуговое осаждение) — это физический метод нанесения покрытий (тонких плёнок) в вакууме, путём конденсации на подложку (изделие, деталь) материала из плазменных потоков, генерируемых на катоде-мишени в катодном пятне вакуумной дуги сильноточного низковольтного разряда, развивающегося исключительно в парах материала электрода. Коге́рер в современном понимании — это резистор, сопротивление которого по командам управления принимает только крайние значения. Такой элемент в электронике называется ключом. В отличие от обычного ключа с одним входом управления, для смены состояния когерера используются два входа управления с сигналами разной физической природы: для выполнения команды «ВКЛ» нужно подать электрический импульс напряжения на выводы когерера, а для выполнения команды «ВЫКЛ» нужен механический удар по его корпусу… Батарея на расплавах солей (в том числе – батареи на жидких металлах) – тип батарей, использующих в качестве электролитов расплавы солей, и предлагающие одновременно высокую плотность энергии и удельную мощность. Традиционные «однократные» тепловые батареи могут долгое время храниться в твердом состоянии при комнатной температуре, прежде чем они будут активированы за счет нагревания. Перезаряжаемые батареи на жидких металлах используются для электромобилей, также их могут использовать для накопления… Технически чистое железо (ТЧЖ) или АРМКО-железо (от аббр. ARMCO — сокращённого названия американской фирмы American Rolling Mill Corporation) — название низкоуглеродистой нелегированной стали, в которой суммарное содержание других элементов — до 0,08-0,1 %, в том числе углерода — до 0,02 %. Большое содержание основного элемента (до 99,92% Fe) позволяют считать такой сплав железом, загрязненным примесями. Технически чистое железо устойчиво к коррозии, обладает повышенной электропроводностью и очень… Щелочной элемент питания — марганцево-цинковый гальванический элемент питания, в котором в качестве катода используется диоксид марганца, анода — порошкообразный цинк, а в качестве электролита — раствор щёлочи, обычно гидроксида калия. Мю-металл (англ. mu-metal) — магнито-мягкий сплав никеля (77%), железа (16%), меди (5%) и молибдена или хрома (2%). Обладает исключительно большой магнитной проницаемостью при небольшом внешнем магнитном поле (максимальная относительная магнитная проницаемость μ≈100 000…300 000). Сплав с незначительными вариациями выпускается за рубежом под марками MuMETAL, Mumetall, Mumetal2. В России мю-металл относится к классу пермаллоев. Трибоэлектрический эффект — появление электрических зарядов в материале из-за трения. Является типом контактной электризации, в которой некоторые материалы становятся электрически заряженными после того, как они входят в фрикционный контакт с другим материалом. Ранние эксперименты с электричеством эпохи античности, такие, как опыты Фалеса с янтарными палочками, были связаны с трибоэлектрическим эффектом… Желе́зная коло́нна в Де́ли — железная колонна высотой семь метров и весом в шесть с половиной тонн, входящая в состав архитектурного ансамбля Кутб-Минара (откуда второе название — Кутубова колонна), расположенного примерно в 20 километрах южнее Старого Дели. Широкую известность колонна приобрела тем, что за 1600 лет своего существования практически избежала коррозии. Синтетические алмазы или искусственные алмазы (также известные как алмазы, созданные в лаборатории или лабораторно выращенные алмазы) — это алмазы, получаемые в результате искусственного процесса, в отличие от натуральных алмазов, создаваемых в результате геологических процессов. Металлическая микрорешётка — синтетический пористый металлический материал, сверхлёгкая форма пенометалла, имеющий малую плотность вплоть до 0,9 мг/см3, разработанный командой учёных из HRL Laboratories в сотрудничестве с исследователями Калифорнийского университета в Ирвайне и Калифорнийского технологического института. Холодный катод (автоэмиссионный или острийный катод) — эмиттер свободных электронов, работающий на основе явления автоэлектронной эмиссии, функциональный элемент многих приборов в микроэлектронике. Название исходит из того, что предварительно катод специально не нагревается (но всё же во время работы лампы такой катод может нагреваться до таких же температур, что и нагреваемый). Физика полимеров — раздел физики, изучающий строение и физические свойства полимеров, термодинамику последних и их растворов, макромолекул и полимерных сеток, релаксационные явления (механическая, электрическая и магнитная релаксация). Наиболее доступным и компактным оборудованием для экспериментов in situ (с лат. — «на месте»), заключающихся в исследовании вещества, непосредственно находящегося при заданных температуре и давлении, является ячейка с алмазными наковальнями (англ. diamond anvil cell, DAC). Конструкция такой ячейки предполагает наличие двух алмазов конической формы, передающих сжимающее усилие на рабочие площадки диаметром менее миллиметра. Благодаря исключительной твёрдости алмаза таким образом могут быть достигнуты…Подробнее: Ячейка с алмазными наковальнями
Магнитогидродинамический генератор, МГД-генератор — энергетическая установка, в которой энергия рабочего тела (жидкой или газообразной электропроводящей среды), движущегося в магнитном поле, преобразуется непосредственно в электрическую энергию. Алюми́ний (Al, лат. aluminium) — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Катодная защита — это электрохимическая защита от коррозии, основанная на наложении отрицательного потенциала на защищаемую деталь. Катодную защиту, как правило, совмещают с нанесением защитных покрытий. Политетрафторэтиле́н, или фторопла́ст-4 (-C2F4-)n, также известный как тефлон — полимер тетрафторэтилена (ПТФЭ), пластмасса, обладающая редкими физическими и химическими свойствами и широко применяемая в технике и в быту. Атомно-абсорбционная спектрометрия (ААС) — распространённый в аналитической химии инструментальный метод количественного элементного анализа (современные методики атомно-абсорбционного определения позволяют определить содержание почти 70 элементов Периодической системы) по атомным спектрам поглощения (абсорбции) для определения содержания металлов в растворах их солей: в природных и сточных водах, в растворах-минерализатах, технологических и прочих растворах. Омический контакт — контакт между металлом и полупроводником или двумя полупроводниками, характеризующийся линейной симметричной вольт-амперной характеристикой (ВАХ). Если ВАХ асимметрична и нелинейна, то контакт является выпрямляющим (например, является контактом с барьером Шоттки, на основе которого создан диод Шоттки). В модели барьера Шоттки, выпрямление зависит от разницы между работой выхода металла и электронного сродства полупроводника. Искусственные источники света — технические устройства различной конструкции и с различными способами преобразования энергии, основным назначением которых является получение светового излучения (как видимого, так и с различной длиной волны, например, инфракрасного). В источниках света используется в основном электроэнергия, но также иногда применяется химическая энергия и другие способы генерации света (например, триболюминесценция, радиолюминесценция и др.). Багда́дская батаре́йка (также Селевкийские вазы) — месопотамский артефакт парфянского или сасанидского периодов, который вслед за его первооткрывателем — немецким археологом Вильгельмом Кёнигом, директором Национального музея Ирака, — иногда считают древним гальваническим элементом, созданным за 2000 лет до рождения Алессандро Вольта. Аморфные металлы (металлические стёкла) — класс металлических твердых тел с аморфной структурой, характеризующейся отсутствием дальнего порядка и наличием ближнего порядка в расположении атомов. В отличие от металлов с кристаллической структурой, аморфные металлы характеризуются фазовой однородностью, их атомная структура аналогична атомной структуре переохлаждённых расплавов. Металлу́ргия и металлурги́я (от др.-греч. μεταλλουργέω — добываю руду, обрабатываю металлы) — область науки и техники, охватывающая процессы получения металлов из руд или других видов сырья, а также процессы, связанные с изменением химического состава, структуры и свойств металлических сплавов и производством разнообразных металлических изделий из них. В первоначальном, узком значении — искусство извлечения металлов из руд. В настоящее время металлургия является также отраслью промышленности. Жи́дкие криста́ллы (сокращённо ЖК; англ. liquid crystals, LC) — это фазовое состояние, в которое переходят некоторые вещества при определённых условиях (температура, давление, концентрация в растворе). Жидкие кристаллы обладают одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия). По структуре ЖК представляют собой вязкие жидкости, состоящие из молекул вытянутой или дискообразной формы, определённым образом упорядоченных во всём объёме этой жидкости. Наиболее характерным… Була́т (от авестийского «palawad», ср.-перс. «pulad» — «сталь») — сталь, благодаря особой технологии изготовления отличающаяся своеобразной внутренней структурой и видом («узором») поверхности, высокой твёрдостью и упругостью. Лантано́иды (лантани́ды) — семейство, состоящее из 15 химических элементов III группы 6-го периода периодической таблицы — металлов, с атомными номерами 57—71 (от лантана до лютеция). Все представители семейства имеют стабильные изотопы, кроме прометия. Плавление (плавка, выплавка) — это тепловая обработка руды для выделения из неё металла. Является формой добывающей металлургии. Процесс плавления используется для извлечения многих металлов из их руд, в том числе серебра, железа, меди и других неблагородных металлов. В ходе плавления используется тепло и химический восстановитель для разложения руды, удаления других элементов в виде газов или шлака, в результате чего остаётся металлическая основа. Восстановителем обычно является источник углерода… Элинва́р (от др.-греч. elastos — эластичный, упругий и лат. invariabilis — неизменный) — общее название группы сплавов на железоникелевой основе, упругие свойства которых мало зависят от температуры. Оловянный крик — характерный звук, получаемый при сгибании химически чистого оловянного прутка при комнатной температуре. В различных описаниях звук может называться «треск», «скрип» или «крик». Источником звука является процесс образования кристаллических двойников олова при пластической деформации прутка. Издаваемый звук сравнительно негромок, несмотря на название «крик».kartaslov.ru
Гальваническая коррозия
МЕТАЛЛЫ В МОРСКОЙ СРЕДЕ
Крепеж
Когда речь заходит про крепеж, в дело вступают дополнительные факторы. Он должен, естественно, обладать прочностью и желательно при этом иметь разумную стоимость, поскольку количество его даже для самой миниатюрной лодки исчисляется сотнями. Но, пожалуй, самым важным для него является то, что, будучи установлен, он не должен ни корродировать сам, ни вызывать коррозию того, что он крепит — по крайней мере в течение достаточно длительного времени. В данном контексте имеются два вида коррозии, о которых следует помнить: гальваническая и химическая.
Гальваническая коррозия
Первый ее вид — гальваническая коррозия, которая возникает в тех случаях, когда два разных металла находятся в контакте друг с другом в присутствии электролита. Морская вода является (увы!) отличным электролитом и проникает на лодке повсюду. Гальваническая шкала ниже демонстрирует электрические потенциалы металлов, обычно применяемых в малом судостроении. Постараемся не слишком не углубляться в химические дебри, а заострим ваше внимание на трех основных моментах, чтобы понять ее практический смысл:
- Когда два металла находятся в контакте, находящийся левее будет корродировать.
- Разность потенциалов в 0.1 В является безопасной, 0.2 — приемлемой в зависимости от следующего условия.
- Темпы коррозии зависят помимо всего прочего от площадей поверхностей открытых металлов. Если крепеж менее инертен, чем деталь, он корродирует довольно скоро. Если же он из более благородного металла, срок его службы будет достаточен.

Каков практический смысл этой диаграммы?
- Из диаграммы понятно, почему элементы крепежа обычно делаются из материалов правой ее части. С алюминием у вас будут проблемы, поэтому позаботьтесь, чтобы вытяжные заклепки были из монеля (алюминиевые широко используются в автомобильной промышленности).
(Монель — сплав Ni с 23-27% Cu, 2-3% Fe, 1-2% Mn) - Вы сами можете решить, какой крепеж использовать для каких деталей (см. таблицу далее). Оцинкованного крепежа следует, естественно, избегать на нержавейке и алюминии. Менее явно то, что латунные винты представляют собой неудовлетворительный, а скорее даже опасный выбор для крепления бронзовых деталей.
- Существуют сплавы, сами по себе способные являться гальваническими парами. Самым ярким примером является латунь, у которой в присутствии электролита одна из «фаз» начинает корродировать. Явление именуется «децинкификация». Латунный элемент, подверженный этому явлению, представляет собой неприятное зрелище и теряет свою прочность.
|
Крепеж |
||
|
Материал детали |
Допустимо |
Недопустимо |
|
Оцинкованная сталь |
Оцинкованный или нерж. |
Латунь и бронза |
|
Алюминий |
Нержавеющий |
Оцинкованный, латунь |
|
Латунь |
Латунь или бронза |
Нержавеющий |
|
Бронза |
Бронза или нерж. |
Латунь |
|
Нерж. сталь |
Нерж. или монель |
Оцинк. или латунь |
Химическая коррозия
Второй вид коррозии, о котором не стоит забывать, является следствием воздействия различных химических веществ. Как правило, металлы защищают сами себя оксидной пленкой на поверхности и главное тут, является ли она самовосстанавливающейся, как в случае нержавеющей стали, алюминия и цветных металлов или же отваливается хлопьями, как у стали. Последствия этого могут быть разными — от чисто косметических в случае коррозии бронзового или оцинкованного палубного оборудования, до весьма серьезных — в случае коррозии гвоздей обшивки. Последнее в основном вызывается образованием в древесине кислот по мере ее пропитывания, дуб в этой ситуации является наихудшим вариантом. Всем хорошо известно, что может ожидать стальной крепеж, а стало быть килевые болты и гвозди. Гораздо чаще забывают, что нержавеющая сталь тоже уязвима.
Нержавеющая сталь
Поскольку существует огромное количество ложных представлений о нержавеющей стали (впрочем, само это название вводит в заблуждение), стоит провести небольшой ликбез по этой части. Помимо железа и углерода, нержавеющая сталь содержит ряд легирующих добавок. Из них самой важной является хром (Cr). Если сталь содержит его более 12%, вся поверхность покрывается пленкой из оксида хрома. Эта пленка «пассивна», стойка к большинству воздействий и самовосстанавливается в присутствии кислорода. Нержавеющая сталь, содержащая один только хром, довольно хрупкая и поэтому в нее добавляют в два раза меньшее хрома количество никеля (Ni). 304-я нержавейка (она же A2), одна из самых распространенных, содержит 18% Cr и 10% Ni. Мойка или выхлопная труба скорее всего сделаны именно из 304-й и если вы пробовали чистить раковину мойки или релинг, то могли обратить внимание, что они в некоторой степени подвержены воздействию органических кислот, образующихся в пищевых продуктах, отпечатков пальцев и прочих загрязнений.
Химическая и пищевая промышленность снижают остроту этой проблемы путем добавления в сталь небольшого количества молибдена (Mo). Таким образом 316-я нержавейка (она же А4) обычно содержит 17% Cr, 11% Ni, 2 % Mo и широко используется для хранения и транспортировки агрессивных жидкостей. Из этого напрашивается вывод, что она представляет собой идеальный материал для крепежа древесины (или к ней) и с точки зрения воздействия одних только химических веществ вы скорее всего будете правы. Но надо еще принимать во внимание и ту среду, в которой предстоит работать крепежному элементу. Представим себе болт, гвоздь или шуруп, крепящий доску обшивки к шпангоуту ниже ватерлинии. Его шляпка, находящаяся на поверхности или вблизи нее будет иметь достаточный приток кислорода для поддержания оксидной пленки. Само же тело, находящееся внутри конструкции, скорее всего будет испытывать его недостаток, при этом находясь в окружении разных кислот и хлоридов. При подобных обстоятельствах пассивная пленка может разрушиться, сделав таким образом нержавейку «активной». Последствий у этого может быть два. Во-первых, взгляните на гальваническую диаграмму, и вы увидите, что разность активных и пассивных потенциалов у 304-й нержавейки (у 316-й в меньшей степени) вполне достаточна, чтобы вызвать гальваническую коррозию. Подобно латуни, она способна сама собой образовывать гальваническую пару. Во-вторых, лишенная защитной пленки, нержавейка корродирует такими же темпами, как и самая обычная сталь. В результате этого нержавеющий крепеж ниже ватерлинии, независимо от его марки, может не иметь никаких преимуществ по сравнению с простой низкоуглеродистой сталью. Выше ватерлинии (где больше кислорода и меньше электролита) такой крепеж ведет себя превосходно.
В заключение хотелось бы еще указать на неразумность пескоструйной обработки оборудования из нержавеющей стали с целью придания ему вида оцинкованного. Способность пассивной пленки к самовосстановлению выше, если поверхность отполирована. При образовании на поверхности миллионов маленьких «пиков» вы значительно снижаете такую способность, в результате чего деталь покрывается ржавчиной. Если вам надо, чтобы деталь выглядела как оцинкованная, лучше такую и взять.
Сталь и оцинковка
Низкоуглеродистой стали без защитного покрытия нет места на борту лодки по причине ее склонности к коррозии, но при наличии покрытия — это вполне пригодный материал. Обычно этого достигают, нанося на нее слой цинка, получая при этом два плюса. Во-первых, цинк хорошо сопротивляется химической коррозии, а во-вторых, в присутствии электролита он корродирует прежде стали. Существует ряд способов нанесения слоя цинка, основная разница между ними заключается в толщине формируемого слоя. Чтобы получить приемлемый срок службы в морской среде, слой должен иметь толщину порядка 100 мкм. Этого можно достичь лужением (до 125 мкм при горячем погружении), окраской (около 40 мкм на слой), но только не электрогальваникой, где толщина обычно ограничивается 20 мкм. Поэтому тот блестящий оцинкованный крепеж, что продается в магазинах хозтоваров, годится для строительства теплицы, на лодке же жизнь его будет недолгой. «Морской» крепеж должен быть луженый.
Медь
Медные гвозди с шайбами широко применяется в классической деревянной конструкции. Для такого рода сравнительно гибких конструкций медные гвозди представляют идеальный материал: легко крепятся, коррозионно-устойчивы, достаточно эластичны, чтобы позволить подвижку элементов. С выходом на сцену клееных конструкций и тем более стеклопластиковых корпусов, довольно удивительно, что медные корабельные гвозди до сих пор имеются в продаже. Однако их выбор постепенно сужается. К примеру, 5-6 мм шайбы более не выпускаются, поэтому строителям каноэ приходится теперь расклепывать гвозди. Также исчезают и нестандартные размеры, полезные при ремонте обшивки, когда выбор гвоздей на размер выше поможет решить проблему течи.
Латунь
Латунь чаще всего выступает в роли шурупов. Помня о проблемах децинкификации, латунный крепеж следует использовать только в защищенных местах — во внутренней обстройке или в тех местах, где от него не зависит ваша жизнь.
Бронза
Стандартным материалом для крепежа является кремниевая бронза. Помимо использования ее в виде болтов и гвоздей, она является одним из немногих материалов, из которого делают гигантского размера шурупы (вплоть до №30). Она достаточно коррозионно-устойчива и служит очень долго — от тридцати до пятидесяти лет. Поэтому, несмотря на свою стоимость, бронзовый крепеж конкурентоспособен.
|
Виды медных сплавов и химический состав |
||||
|
Наименование |
Обозначение |
Состав |
Применение |
|
|
Латуни |
Обычная латунь |
CZ108 |
Zn 37% |
Внутреннее оборудование |
|
Морская латунь |
CZ112 |
Zn 37% Sn1% |
Оборудование довоенных лодок |
|
|
Высокопрочная латунь |
CZ114 |
Zn 37% Mn 2% Al 1.5% Fe 1% Pb 1.5% Sn 0.8% |
Такелажные скобы, гребные винты, лебедки |
|
|
Коррозионностойкая латунь |
CZ132 |
Zn 36% Pb 2.8% As 0.1% |
Водозапорная и трубная арматура |
|
|
Бронзы |
Алюминиевая бронза |
CA104 |
Al 10% Ni5% Fe5% |
Высокопрочное оборудование |
|
Фосфористая бронза |
PB102 |
Sn 5% P 0.2% |
Сборное и кованое оборудование |
|
|
Кремнистая бронза |
CS101 |
Si 3% Mn1% |
Крепеж |
|
|
Оружейная бронза |
LG2 |
Sn 5% Pb5% Zn5% |
Литье |
|
|
Алюминиевая бронза для литья |
AB2 |
Al 10% Ni5% Fe3% |
Леерное и мачтовое оборудование |
|
|
Al — алюминий, As — мышьяк, Fe — железо, Mn — марганец, Ni — никель |
||||
metalvis-yug.ru
Гальваническая пара — это… Что такое Гальваническая пара? 💯 ✅
Коррозия между двумя типами сталиПара не являющихся одинаковыми проводников (разные материалы), обычно металлов, в электрическом контакте.
Названа в честь Луиджи Гальвани. На явление, получившее название «опыт Гальвани», он наткнулся случайно и не смог правильно объяснить, поскольку исходил из ложной гипотезы о существовании некоего животного электричества. Результаты исследований он изложил в «Трактате о силах электричества при мышечном движении»
Гальваническую пару также исследовал Жан-Жак Зульцер (по другим источникам шведский философ Иоган Георг Зульцер) [1], который писал:
«Если два куска металла, один оловянный, другой серебряный, соединить таким образом, чтобы оба края их были на одной плоскости, и если приложить их к языку, то в последнем будет ощущаться некоторый вкус, довольно похожий на вкус железного купороса, в то же время каждый кусок металла в отдельности не дает и следа этого вкуса…»
Опыты Зульцера повторил и расширил Алессандро Вольта
Гальваническая пара, погруженная в кислотный (щелочной) раствор, будет корродировать (разрушаться под действием коррозии). Этот процесс называется гальваническая коррозия. Как правило, соединения разных металлов всегда подвержены коррозии (если не электролитической, так атмосферной). Но некоторые пары металлов корродируют намного сильнее, ниже список металлов, которые не рекомендуется применять в паре.
Недопустимые гальванические пары:
1 пара:
1) Алюминий и все сплавы на его основе
2) Медь и её сплавы, серебро, золото, платина, палладий, родий, олово, никель, хром
2 пара:
1) Магниево-алюминиевые сплавы
2) Сталь легированная и нелегированная, хром, никель, медь, свинец, олово, золото, серебро, платина, палладий, родий
3 пара:
1) Цинк и его сплавы
2) Медь и её сплавы, серебро, золото, платина, палладий, родий
4 пара:
1) Сталь нелегированная, олово, свинец, кадмий
2) Медь, серебро, золото, платина, палладий, родий
5 пара:
1) Никель, хром
2) Серебро, золото, платина, палладий, родий
6 пара:
1) Титан и его сплавы
2) Алюминий и его сплавы
Необходимо избегать механического соединения деталей, изготовленных из металлов с заметно разными электрохимическими потенциалами. Например, недопустимо соединять латунные детали алюминиевой заклепкой. Для выбора материалов в этих случаях можно руководствоваться таблицей электрохимических потенциалов (так называемый электрохимический ряд).
Примечания
Ссылки
dic.academic.ru
Предотвращение коррозии алюминия
Алюминий и, в разной степени, его сплавы обладают высокой стойкостью к коррозии даже без какого-либо специального защитного покрытия.
Естественное оксидное покрытие
Естественная поверхность алюминия, которая возникает в ходе изготовления алюминиевого изделия, например, прессованием, прокаткой или литьем, имеет высокое сопротивление коррозии в большинстве типов окружающей среды. Это происходит потому, что свежая поверхность алюминия спонтанно и мгновенно образует тонкий, но очень эффективный оксидный слой, который предотвращает дальнейшее окисление металла.
Эта оксидная пленка является непроницаемой и, в отличие от оксидных пленок других металлов, например, железа, очень прочно «прикрепляется» к основному металлу. При каком-либо механическом повреждении эта пленка мгновенно восстанавливается, залечивается.
Естественный оксидный слой и является главной причиной хорошего сопротивления алюминия к коррозии. Это покрытие является стойким в средах с кислотностью – водородным показателем рН – от 4 до 9.
Три главных вида коррозии алюминия
Наиболее частыми видами коррозии алюминия являются:
- гальваническая (контактная) коррозия;
- язвенная (точечная) коррозия;
- щелевая коррозия.
Коррозия под напряжением, которая ведет к образованию трещин, является более специфическим видом коррозии. Она случается в основном в высокопрочных алюминиевых сплавах, например, сплавах AlZnMg, когда они подвергаются длительным растягивающим напряжениям в присутствии коррозионной среды. Этот тип коррозии обычно не происходит в сплавах серии 6ххх, то есть сплавах AlMgSi.
Гальваническая коррозия алюминия
Гальваническая коррозия может случаться тогда, когда два различных металла находятся в непосредственном контакте и между ними образовался электролитический мост. Менее благородный металл в этой комбинации становится анодом и корродирует. Более благородный металл становиться катодом и находится под защитой от коррозии.
В большинстве комбинаций с другими металлами алюминий является менее благородным металлом. Поэтому алюминий подвержен более высокому риску гальванической коррозии, чем другие строительные материалы. Однако, этот риск меньше, чем это обычно считается.
Необходимые условия: контакт и влага
Гальваническая коррозия алюминия происходит только тогда, когда одновременно:
- есть контакт с более благородным металлом (или другим электрическим проводником с более высоким химическим потенциалом, чем у алюминия, например, графитом;
- между двумя металлами находится электролит с хорошей проводимостью, чаще всего, вода с растворенными солями.
Гальваническая коррозия не происходит в сухой воздушной атмосфере, например, внутри нормального жилого помещения. Нет большого риска гальванической коррозии и чистой сельской атмосфере. Вместе с тем, риск гальванической коррозии необходимо всегда принимать в расчет в атмосферах с высоким содержанием хлоридов, например, в районах вблизи морей и океанов.
Алюминий и оцинкованная сталь
Могут быть проблемы с гальванической коррозией и в паре алюминия с оцинкованной сталью. Цинковое покрытие оцинкованной стали будет сначала защищать алюминий от коррозии. Однако, эта защита снижается, когда поверхность стали начинает обнажаться по мере расходования цинка. Горячее цинкование стали дает большую толщину цинкового покрытия, чем электрохимическое цинкование и обеспечивает более длительную защиту алюминия. Поэтому в агрессивной атмосфере в контакте с алюминием применяют только оцинкованную сталь горячего цинкования.
Электрическая изоляция
Там, где различные металлы применяются в контакте, гальванической коррозии можно избежать путем электрической изоляции одного металла от другого. Пример такого решения для болтового соединения между алюминиевым и стальным листом приведен на рисунке 1. Между головкой болта и поверхностью алюминия может возникнуть электролит, но электроизолирующая шайба не даст возможности протекать гальваническому электрическому току и коррозии не произойдет. С другой стороны в контакте алюминиевого и стального листа отсутствует возможность попадания влаги, электролит не образуется и коррозия не происходит.
 Рисунок 1 – Электрическая изоляция алюминия от стали
Рисунок 1 – Электрическая изоляция алюминия от стали
Разрыв электролитической цепи
В больших конструкциях, там, где применение электроизоляции затруднительно, применяют альтернативное решение – предотвращение электролитического мостика между двумя металлами. Окраска поверхности – это один из путей сделать это. Чаще всего лучшим вариантом является окраска поверхности катода, то есть более благородного металла.
Катодная защита
Катодная защита от коррозии может достигаться двумя путями. Чаще всего – это установка анода из менее благородного металла в прямом металлическом контакте с алюминием. Этот менее благородный металл «жертвует» собой, то есть корродирует вместо алюминия. Поэтому его называют жертвенным анодом.
Чтобы такой жертвенный анод работал, он должен быть в жидком контакте с защищаемой алюминиевой поверхностью. Для защиты алюминия в качестве жертвенных анодов чаще всего применяют цинк и магний. Пример катодной защиты показан на рисунке 2.
Другим путем получения катодной защиты является подсоединение алюминиевого объекта к отрицательному полюсу выпрямителя тока.
 Рисунок 2 – Катодная защита алюминиевого винта судна
Рисунок 2 – Катодная защита алюминиевого винта судна
Язвенная коррозия алюминия
Для алюминия именно язвенная коррозия является наиболее частым видом коррозии. Она также случается только в присутствии электролита (воды или влаги), который содержит растворенные соли, обычно хлориды.
Эта коррозия обычно выглядит как очень маленькие ямки, которые на открытом воздухе достигают максимальной глубины незначительной части толщины металла. Глубина этих ямок может быть больше в воде и почве.
Предотвращение язвенной коррозии
Язвенная коррозия является в основном вопросом эстетическим, потому что, в практическом смысле, никогда не снижает прочности алюминиевых изделий.
Проявление язвенной коррозии, конечно, бывает более серьезным на алюминии с естественной поверхностью, то есть поверхностью без какой-либо защитной обработки. Защитная обработка поверхности алюминия (анодирование, окраска или другие методы нанесения покрытий) успешно защищает его от язвенной коррозии.
Для предотвращения язвенной коррозии применяют также катодную защиту (см. выше).
Конструирование дренажа
Очень важно проектировать алюминиевые профили и другие алюминиевые изделия так, что они имели возможность дренажа осадков и быстрого высыхания поверхности. Профили, которые могут подвергаться воздействию влаги, не должны иметь углов или карманов, в которых скапливается вода. Каждый профиль, в котором может скапливаться вода, должен иметь дренажные отверстия (рисунок 3).
 Рисунок 3 – Конструктивный дренаж в алюминиевых профилях
Рисунок 3 – Конструктивный дренаж в алюминиевых профилях
Эффективный дренаж (рисунок 4) и вентилирование «мокрых» алюминиевых профилей значительно снижает риск появления на них язвенной коррозии.
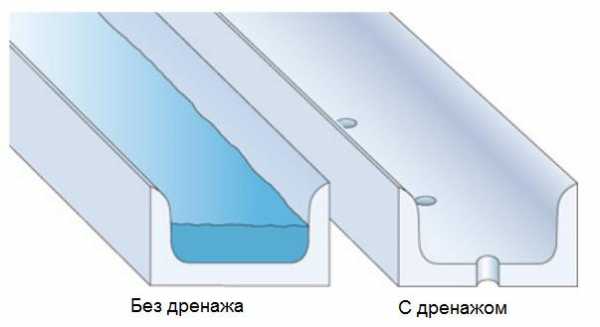 Рисунок 4 – Дренажные отверстия в алюминиевом профиле
Рисунок 4 – Дренажные отверстия в алюминиевом профиле
Щелевая коррозия алюминия
Сущность щелевой коррозии
Щелевая коррозия может возникать в узких, наполненных жидкостью щелях. Возникновение такой коррозии в алюминиевых профилях маловероятно. Однако, значительная щелевая коррозия может возникать в морской атмосфере или на наружной поверхности кузовов транспортных средств. В ходе транспортирования и хранения алюминиевых профилей иногда может собираться вода в щелях между смежными алюминиевыми поверхностями, которая вызывает поверхностную коррозию в виде «водяных пятен» (рисунок 4).
 Рисунок 5 – Сущность щелевой коррозии
Рисунок 5 – Сущность щелевой коррозии
Источником этой воды является дождь или конденсация влаги. Эта вода по капиллярному механизму буквально засасывается в пространство между двумя металлическими поверхностями. Конденсация влаги может возникать тогда, когда холодный материал помещают в теплое помещение. Разность между ночной и дневной температурами может также вызывать конденсацию, когда алюминий хранится снаружи под плотным тентом, который препятствует вентиляции.
Предотвращение щелевой коррозии
На соединяемые поверхности наносят герметики или двухсторонний скотч. Это предотвращает попадание в зазор между ними воды и предотвращает возникновение щелевой коррозии.
В некоторых случаях вместо соединения на заклепках и винтах применяют клеевое соединение. Это также противодействует образованию щелевой коррозии.
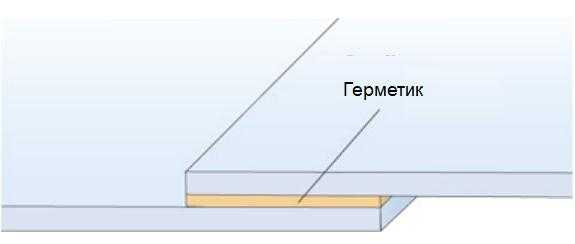 Рисунок 6 – Герметизация соединения предотвращает щелевую коррозию
Рисунок 6 – Герметизация соединения предотвращает щелевую коррозию
Источник: Материалы корпорации SAPA
См. продолжение: Когда и как защищать алюминий от коррозии
aluminium-guide.ru
Алюминий гальванических пар — Справочник химика 21
Рассчитайте ЭДС и АС% гальванического элемента, работающего в стандартных условиях, образующегося при погружении алюминия, спаянного медью, в кислую среду. [c.153]Наиболее распространена защита алюминия и его сплавов от коррозии электрохимическим оксидированием, при котором окисление достигается действием электрического тока (см. работу 5 этого раздела). Алюминиевые изделия помещают в электролит в качестве анода, поэтому метод обработки носит название — анодное окисление, или анодирование. При анодировании на алюминии и его сплавах получают пленки толщиной 5—20 мк, а в специальных случаях до 200—300 мк. Анодирование применяется не только для защиты от коррозии и улучшения адгезии (сцепления) с лакокрасочными покрытиями, но и для декоративной отделки поверхности металла, получения на ней фотоизображений, повышения стойкости против истирания, получения поверхностного электро- и теплоизоляционного слоя и слоя высокой твердости. Твердость анодной окисной пленки на чистом алюминии 1500 кг/мм , т. е. выше, чем твердость закаленной инструментальной стали. С помощью анодных пленок алюминия изготовляют алюминиевые выпрямители и конденсаторы. В последнее время анодная окисная пленка используется как подслой для лучшего сцепления алюминия с гальваническими покрытиями (хромом, никелем, серебром и др.). [c.146]
Вычислите э. д. с. алюминий-платинового гальванического элемента ири стандартных условиях. [c.183]
Следовательно, железо, имеющее в морской воде коррозионный потенциал около —0,4 В, непригодно для использования в качестве протектора для катодно защищаемого алюминия, в отличие от цинка, который имеет более подходящий коррозионный потенциал, близкий —0,8 В. Для нержавеющей стали 18-8 критический потенциал в 3 % растворе Na l равен 0,21 В, для никеля — около 0,23 В. Следовательно, контакт этих металлов с имеющими соответствующую площадь электродами из железа или цинка может обеспечить им в морской воде эффективную катодную защиту, предупреждающую питтинговую коррозию. Элементы создаваемых конструкций (например, кораблей и шельфовых нефтедобывающих платформ) иногда специально проектируют таким образом, чтобы можно было успешно использовать гальванические пары такого рода. [c.227]
Пример 2. Определите массу металла, подвергшегося коррозии в кислой среде при нарушении целостности медного покрытия на алюминии, если в течение 1 мин выделился водород объемом 0,09 л, измеренным при нормальных условиях. Какова максимальная сила тока, даваемая таким гальваническим элементом [c.152]
Металлический алюминий служит в основном для производства сплавов. Сплавы алюминия менее устойчивы к коррозии из-за возникновения гальванических микроэлементов в местах включений примесей. Алюминий идет на производство кабелей, фольги, зеркал, серебристой краски. Способность алюминия восстанавливать металлы из оксидов при высоких температурах послужила основой метода алюмотермии, т. е. восстановления тугоплавких металлов, например хрома или марганца, из их оксидов [c.152]
Наряду с научным интересом гальванические элементы имеют чрезвычайно большое техническое значение. Они служат, с одной стороны, как источники тока (например, аккумуляторы), с другой стороны, для проведения химических реакций, которые осуществляются трудно или в других условиях вообще не осуществляются. Известными примерами таких процессов, которые технически проводят в большом масштабе, является электролиз хлоридов щелочных металлов, электролитическое производство алюминия и электролитическое осаждение металлов в виде поверхностных слоев (гальванические покрытия). [c.272]
Применение цинка очень разнообразно. Значительная часть его идет для нанесения покрытий на железные и стальные изделии, предназначенные для работы в атмосферных условиях или в воде. При этом цинковые покрытия в течение миогих лет хорошо защищают основной металл от коррозии. Однако в условиях высокой влажности воздуха при значительных колебаниях температуры, а также в морской воде цинковые покрытия неэффективны. Широкое промышленное использование имеют сплавы цинка с алюминием, медью и магнием. С медью цинк образует важную группу сплавов — латуни (см. стр. 571). Значительное количество цинка расходуется для изготовления гальванических элементов. [c.621]
ЖЕРТВЕННЫЕ АНОДЫ. Если вспомогательный анод изготовлен из металла более активного (в соответствии с электрохимическим рядом напряжений), чем защищаемый, то в гальваническом элементе протекает ток — от электрода к защищаемому объекту. Источник приложенного тока (выпрямитель) можно не использовать, а электрод в этом случае называют протектором (рис. 12.2). В качестве протекторов для катодной защиты используют сплавы на основе магния или алюминия, реже — цинка. Протекторы, по существу, служат портативными источниками электроэнергии. Они особенно полезны, когда имеются трудности с подачей электроэнергии или когда сооружать специальную линию электропередачи нецелесообразно или неэкономично. Разность потенциалов разомкнутой цепи магния и стали составляет примерно 1 В (в морской воде магний имеет Е = —1,3 В), так что одним анодом может быть защищен только ограниченный участок трубопровода, особенно в грунтах с высоким удельным сопротивлением. Столь небольшая разность потенциалов иногда [c.218]
При покрытии металлов, более активных, чем медь (железо, алюминий), они способны непосредственно вытеснять медь из растворов ее солей без электролиза — контактным путем. Образующиеся при этом осадки меди, несплошные и слабо сцепленные с металлической основой, препятствуют образованию собственно гальванических покрытий. Поэтому состав электролита для меднения имеет особенно большое значение. [c.185]
Магний и алюминий — активные металлы. Будет ли у гальванического элемента из этих днух металлов высокий потенциал Почему да или почему нет [c.537]
Большое значение для скорости коррозии алюминий и его сплавов имеет также контактная коррозия. При наличии в конструкции контакта разнородных металлов и коррозионной среды возникает гальваническая макропара. Алюминий и его сплавы в таких макропарах в большинстве случаев служат анодом и подвергаются усиленной коррозии. Лишь в том случае, когда потенциал алюминия, находящийся в контакте с каким-либо металлом, отвечает пассивной области, контакт не влияет на стойкость алюминия. Так, анодирование дюралюминия с последующим наполнением сильно облагораживает потенциал сплава и делает его катодным по отношению к большинству контактирующих металлов. Даже такой электроположительный сплав, как латунь Л62, в контакте с анодированным и пропитанным хромпиком дюралюминием становится анодом. [c.59]
Многие металлы, в том числе и алюминий, не могут быть осаждены гальваническим способом из водных растворов своих солей вследствие высокого отрицательного [c.81]
Алюминий склонен к образованию питтинга в водах, содержащих ионы С1 . Это особенно сильно проявляется в щелях
www.chem21.info