Гальванические элементы
Гальваническим элементом называется электрохимическая система, производящая электрическую энергию за счет протекания в ней окислительно-восстановительной реакции. Наиболее распространенными являются гальванические элементы, состоящие из двух электродов с различными потенциалами. Рассмотрим реакцию:
Zn + CuSO4 = ZnSO4 + Cu
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn, Fe, Cu, Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции:
Zn – 2e = Zn2+
Cu2+ + 2e = Cu
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
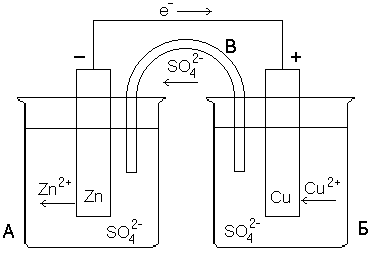
Рисунок 1 – Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби)
Сосуд
А заполнен раствором ZnSO4,
сосуд Б – раствором CuSO4.
В первый из них опущена цинковая
пластинка, во второй – медная. Растворы
либо разделены пористой полупроницаемой
перегородкой (пропускает только ионы),
либо соединяются солевым мостиком B,
который представляет собой стеклянную
трубку, заполненную раствором сильного
электролита (обычно KCl
или NH
В данном случае электродные процессы являются гетерогенными, т.к. окисленная и восстановленная формы находятся в разных фазах. В более общем виде гетерогенный электродный процесс можно записать в виде:
Me
(ВФ, тв. фаза) – ne–  Men+ (aq) (ОФ, раствор)
Men+ (aq) (ОФ, раствор)
Гальванические элементы принято изображать в виде
Анод─ Zn|ZnSO4||CuSO4|Cu +Kатод .
В ионной форме схематическое изображение гальванического элемента: Анод─ Zn|Zn2+||Cu2+|Cu +Kатод .
На границе раздела фаз возникает двойной электрический слой, состоящий из катионов Men+ (в растворе) и электронов (в металле), что приводит к появлению потенциала
Поскольку
самопроизвольно электроны могут
переходить только от электрода с большей
концентрацией электронов к электроду
с меньшей концентрацией, то в процессе
действия рассматриваемого гальванического
элемента электроны во внешней цепи
движутся от цинка к меди. На цинковом
электроде происходит процесс окисления,
так как значение стандартного электродного
потенциала Еº(Zn
Медь в данном процессе играет роль инертного электрода, который передает электроны, поступившие от цинка, ионам Cu2+, находящимся в растворе CuSO4.Таким образом, на медном электроде происходит восстановление катионов меди. Указанные окислительно-восстановительные процесы отображены в схеме гальванического элемента.
Во внутренней цепи ионы SO42-, оказавшиеся в избытке в катодном пространстве, переходят через пористую перегородку или через солевой мостик в анодное пространство, где компенсируют заряды образовавшихся при окислении ионов цинка.
Элемент будет работать до тех пор, пока цинковый анод полностью не растворится или не восстановится вся медь из раствора CuSO4. При описании работы гальванического элемента выделяют процессы, происходящие на электродах, и суммарную окислительно-восстановительную реакцию, указывают направление движения электронов во внешней цепи и ионов в растворе электролита. Для медно-цинкового гальванического элемента:
Zn ‑ 2ē = Zn2 + — процесс окисления на аноде;
Cu2+ + 2ē = Cu – процесс восстановления на катоде;
Zn + Cu 2+= Zn2+ + Cu – суммарная реакция в гальваническом элементе.
Направление
движения электронов – от цинкового
электрода к медному. Ионы SO
Если гальванический элемент находится в условиях, отличных от стандартных, то для расчета ЭДС сначала необходимо найти значения потенциалов электродов в данных условиях по уравнению Нернста, а затем вычислять ЭДС элемента. Поскольку электродвижущая сила гальванического элемента всегда положительная величина, при ее определении вычитают из величины более положительного потенциала величину менее положительного:
ПРИМЕР 1. Вычислить ЭДС гальванического элемента, составленного из стандартных цинкового и оловянного электродов, опущенных в растворы сульфатов цинка и олова.
РЕШЕНИЕ. Запишем уравнения электродных равновесий, устанавливающихся на цинковом и оловянном электродах, и выпишем из таблицы значения их стандартных электродных потенциалов:
Zn2+ + 2ē = Zn; Еº = -0,76B;
Sn2+ + 2ē = Sn; Еº = -0,14B.
Электродный потенциал цинкового электрода имеет более низкое значение, следовательно, цинковый электрод будет анодом, на нем будет происходить процесс окисления. На оловянном электроде с бóльшим значением Еº будет происходить восстановление:
Zn — 2ē = Zn2+ -процесс на аноде;
Sn2+ + 2ē = Sn — процесс на катоде;
Zn
+ Sn2+ = Zn
Электроны по внешней цепи переходят от цинка к олову. Ионы SO42- будут переходить по солевому мостику из катодного пространства в анодное.
ЭДС = E(Sn2+/Sn) — Е(Zn2+/Zn) = -0,14 – (-0,76) = 0,62(В).
ПРИМЕР 2. Гальванический элемент образован электродом Fe2+/Fe с концентрацией ионов Fe2+ = 0,1 моль/л и серебряным электродом Ag+/Ag с концентрацией ионов Ag+ =0,01 моль/л. Написать уравнения электродных процессов, составить схему гальванического элемента, вычислить его ЭДС.
РЕШЕНИЕ.
В таблице находим значения стандартных
электродных потенциалов
окислительно-восстановительных систем:
Eº(Fe
Е (Fe2+/Fe) = -0,44 + 0,059/2lg10-1 = -0,47B;
Е (Ag+/Ag) = +0,8 + 0,059/1lg10-2 = +0,682B.
Поскольку Е(Fe2+/Fe) < E(Ag+/Ag), то на железном электроде будет происходить окисление. т.е. он будет анодом, а на серебряном электроде будет происходить восстановление, т.е. этот электрод будет анодом.:
Fe — 2ē = Fe2+ -процесс на аноде;
Ag+ + ē = Ag — процесс на катоде;
Fe + Ag+ = Fe2+ + Ag — суммарная реакция в гальваническом элементе.
Схема гальванического элемента :
Анод─ Fe|FeSO4||Ag2SO4|Ag +Kатод
Или Анод─ Fe|Fe2+||Ag+|Ag +Kатод.
ЭДС = E(Ag+/Ag) — Е(Fe2+/Fe) = 0,682 – (-0,47) = 1,152(В).
Гальванический элемент может быть составлен не только из различных электродов, но и из одинаковых электродов, погруженных в раствор одного и того же электролита различной концентрации. Такой гальванический элемент называется концентрационным. Он будет действовать до тех пор, пока не произойдет выравнивание концентраций ионов у обоих электродов.
Гальванический элемент. Схема гальванического элемента. Токообразующая реакция. Эдс гальванического элемента
Самопроизвольно идущий окислительно-восстановительный процесс в определенных условиях может создавать электрическую энергию. Процессы превращения химической энергии в электрическую можно использовать для создания химических источников тока (ХИТ), простейший из которых гальванический элемент.
Гальванический элемент состоит из двух электродов, погруженных в электролиты, которые замыкаются электролитическим ключом.
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
Металлический электрод — это металл, погруженный в раствор собственной соли, не является инертным, а участвует в электродной реакции. Cхематично такой электрод записывают в виде Ме|Меn+, где вертикальная черта обозначает границу между металлом и раствором. Уравнение Нернста для металлических электродов имеет вид
,(4)
где — концентрация ионов металла в растворе, моль/л.
Окислительно-восстановительный (редокс-) электрод – это инертный металл (токоподвод), погруженный в электролит, содержащий одновременно окисленную и восстановленную формы потенциалопределяющих частиц. В качестве инертного металла чаще всего используют платину Pt. Схематично такой электрод можно записать в виде Pt│Men+, Mem+. На поверхности инертного металла протекает окислительно-восстановительная реакция. Например, для окислительно-восстановительного электрода Pt│Sn4+, Sn2+ такими реакциями могут быть: Sn2+ — 2 ē → Sn4+; Sn4+ + 2 ē → Sn2+
Уравнение Нернста для редокс- систем включает концентрацию обоих катионов и имеет вид
(5)
где [окисл], [восст] – концентрации окисленной и восстановленной форм потенциалопределяющих частиц в полуреакции.
19
Газовые электроды состоят из инертного металла, который находится в одновременном контакте с газом и раствором, содержащим ионы этого газа. Представителями газовых электродов являются водородный, кислородный, хлорный и другие электроды.
Водородный электрод состоит из платиновой пластинки, покрытой слоем мелкодисперсной платины («платиновой черни») и погруженной в раствор кислоты, содержащий ионы водорода. Через раствор непрерывно пропускается поток водорода, водород адсорбируется на поверхности платины, и на границе электрод/раствор устанавливается равновесие:
H+(раствор) + ē ↔ ½ H2(г) .
При давлении водорода, равном 101,3 кПа (1 атм), активности (концентрации) ионов водорода 1 моль/л и Т=298К водородный электрод называется стандартным водородным электродом. Потенциал такого электрода принимается за ноль.
Уравнение Нернста для водородного электрода имеет вид
, (6)
где — стандартный электродный потенциал,
— концентрация ионов водорода в растворе, моль/л
-парциальное давление водорода над раствором, атм. равно 1 атм.
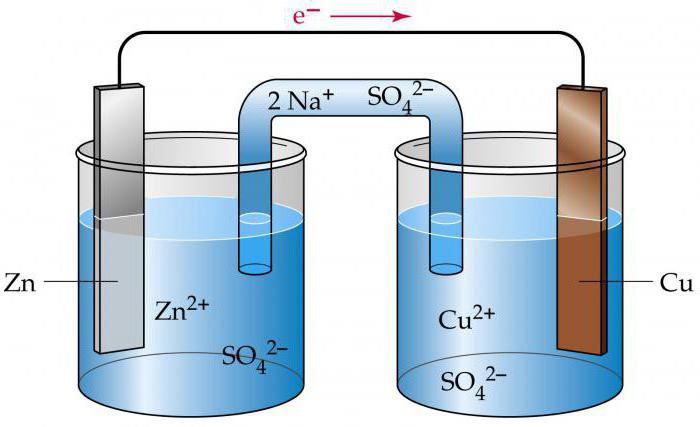
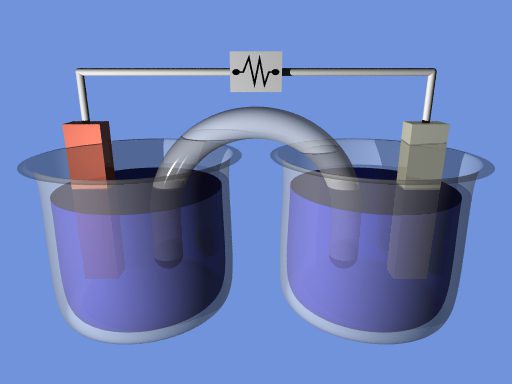
Рассмотрим работу гальванического элемента на примере элемента Даниэля-Якоби. Он представляет собой два сосуда с 1М растворами CuSO4 и ZnSO4, в которые погружены соответственно медная и цинковая пластинки, соединенные проводом. Сосуды соединены между собой трубкой, которая называется солевым мостиком, заполненной раствором электролита (например, KCl). Солевой мостик является электролитическим ключом.
Электрод с меньшим значением потенциала заряжается отрицательно, является анодом. Электрод с большим значением потенциала заряжается положительно, является катодом. На аноде протекает процесс окисления
(отдача электронов), на катоде – процесс восстановления (присоединение электронов).
20
Гальванические элементы принято записывать в виде схем. Анод со знаком (-) записывают слева, катод со знаком (+) записывают справа. Например, схема медно-цинкового гальванического элемента Даниэля-Якоби может быть представлена таким образом:
ē ē
(-) Zn|ZnSO4||CuSO4|Cu (+) или (-) Zn|Zn2+||Cu2+|Cu (+)
Одна вертикальная черта на схеме обозначает границу между металлом и раствором электролита, две черты – границу между растворами (солевой мостик).
При замыкании цепи электроны по внешней цепи пойдут от анода к катоду – от цинка к меди. При этом на электродах протекают следующие реакции:
(-) Анод: Zn – 2 ē → Zn2+ реакция окисления
(+) Катод: Cu2+ + 2 ē →Cu реакция восстановления
Суммируя процессы на катоде и аноде, получаем уравнение окислительно-восстановительной реакции, за счет которой в гальваническом элементе возникает электрический ток:
Zn + Cu2+ = Zn2+ + Cu
Такое уравнение называется уравнением токообразующей реакции.
ЭДС гальванического элемента рассчитывают как разность потенциалов катода и анода: Е = Ек – Еа.
Если концентрация ионов в растворе составляет 1 моль/л, то ЭДС называется стандартной. Стандартная ЭДС медно-цинкового элемента при—
Пример 7. Рассчитайте ЭДС свинцово-цинкового гальванического элемента при Т = 298К, в котором [Zn2+]=0,1моль/л и [Pb2+]=0,01моль/л. Укажите знаки полюсов, напишите уравнения электродных процессов, составьте схему гальванического элемента. Укажите направление движения электронов при замыкании цепи.
Решение: ЭДС гальванического элемента рассчитывают как разность
21
равновесных потенциалов катода и анода: Е= Ек – Еа.
Поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л, рассчитаем по уравнению Нернста (ур. 4) значения электродных потенциалов цинка и свинца:
Электрод с меньшим значением потенциала является анодом (цинковый электрод). На нем протекает реакция окисления:
(-) А: Zn – 2 ē → Zn2+
Электрод с большим значением потенциала является катодом (свинцовый электрод), на нем протекает реакция восстановления:
(+) К: Pb2+ + 2 ē → Pb
Уравнение токообразующей реакции: Zn + Pb2+ → Zn2+ + Pb.
Схема гальванического элемента: (-) Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb (+).
Рассчитываем ЭДС гальванического элемента:
Е= Ек – Еа =
При замыкании цепи, электроны во внешней цепи пойдут от отрицательно заряженного электрода к положительно заряженному электроду, то есть — от цинка к свинцу.
Пример 8. Для гальванического элемента
Pt│Cr3+ (0,1 моль/л), Cr2+(0,01 моль/л)║Н+(рН=2)│Н2, Pt
рассчитать ЭДС, написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать знаки полюсов. Определить направление движения электронов во внешней цепи.
Решение: данный гальванический элемент составлен из окислительно-
восстановительного и водородного электродов.
Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста:
22
Стандартный потенциал пары Сr3+/Cr2+. Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода:
.
Второй электрод данного гальванического элемента является водородным электродом. Потенциал его, согласно уравнению Нернста:
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). После замыкания цепи на первом электроде будет протекать анодный процесс окисления, на втором – катодный процесс восстановления:
(-) А : Cr2+ — ē → Cr3+ 2
(+) К: 2 Н+ + 2 ē → Н2
Суммарная токообразующая реакция описывается уравнением
2 Cr2+ + 2 Н+ → 2 Cr3+ + Н2
Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному: от хромового окислительно-восстановительного электрода к водородному.
ЭДС данного элемента
Пример 9. Какие процессы протекают на электродах в концентрационном гальваническом элементе, имеющем цинковые электроды, если у одного из электродов концентрация ионов цинка Zn2+ равна 1 моль/л, а у другого –
0,0001 моль/л? Какова ЭДС этого элемента? Напишите схему данного ГЭ.
Решение: Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация ионов цинка
23
у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода: .
Потенциал второго электрода рассчитаем по уравнению Нернста:
Первый электрод является катодом, на нем после замыкания цепи протекает реакция восстановления (+) К: Zn2+ + 2 ē →Zn
Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: (-) А: Zn — 2 ē →Zn2+
Токообразующая реакция в гальваническом элементе будет иметь вид:
Zn + Zn2+→ Zn + Zn2+
Рассчитываем ЭДС элемента: Е = Ек — Еа = — 0,763 –(-0,881) = 0,122 В.
Данный гальванический элемент можно отобразить схемой:
(-) Zn│Zn2+(0,0001 моль/л)║Zn2+(1 моль/л)│Zn (+)
studfile.net
Гальванический элемент: схема, принцип работы, применение
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.

Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие катода и анода. Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
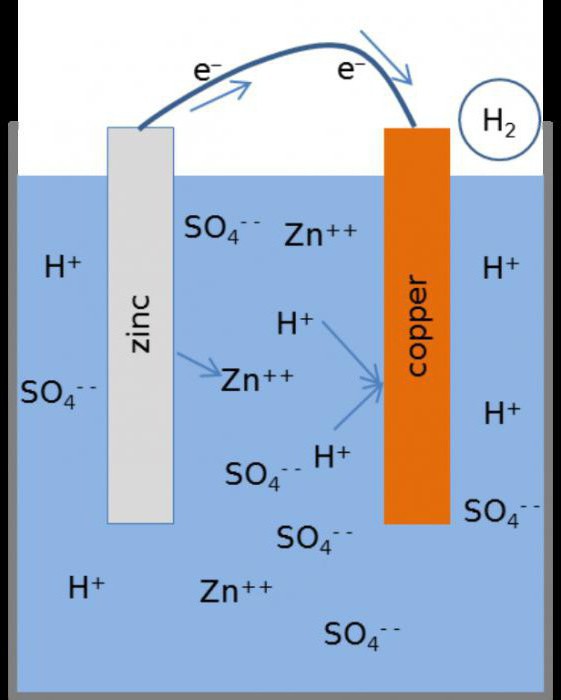
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде. В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения. В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
fb.ru
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Показать решение »
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg0 -2e— = Mg2+
К: Cu2+ +2e— = Cu
Mg0 + Cu2+ = Mg2+ + Cu
Mg + CuSO4 = MgSO4 + Cu
Вычислим ЭДС гальванического элемента:
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Mg2+/Mg
E0Cu2+/Cu = +0,337 В
E0Mg2+/Mg = -2,37 В
ЭДС =0,337 + 2,37 = 2,71 В
Определим энергию химической реакции:
ΔG0298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Показать решение »
Решение.
E02H+/h3 = 0,00 В
E0Pb2+/Pb = -0,126 В
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb0 -2e— = Pb2+
К: 2H+ +2e— = H2
Pb0 + 2H+= Pb2+ + H2
Определим электродный потенциал свинца:
E = E° + (0,059/n)lgC
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = E0кат — E0ан = E02H+/h3 — E0Pb2+/Pb
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Ni2+/Ni и E0Cu2+/Cu
E0Ni2+/Ni = -0,250 В
E0Cu2+/Cu = +0,337 В
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni0 -2e— = Ni2+
К: Cu2+ +2e— = Cu0
Ni0 + Cu2+ = Ni2+ + Cu0
Ni0 + CuSO4 = NiSO4 + Cu0
Составим схему гальванического элемента:
(-) Ni0|NiSO4 || CuSO4|Cu0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Ni2+/Ni
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg2+] = 0,001 моль/л, [Pb2+] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Mg2+/Mg и E0Pb2+/Pb
E0Mg2+/Mg = -2,37 В
E0Pb2+/Pb = -0,126 В
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg0 -2e— = Mg2+
К: Pb2+ +2e— = Pb0
Mg0 + Pb2+ = Mg2+ + Pb0
Составим схему гальванического элемента:
(-) Mg0|Mg2+ || Pb2+|Pb0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
E = E° + (0,059/n)lgC
EMg2+/Mg = -2,37 + (0,059/2)lg0,001 = -2,46 В
EPb2+/Pb = -0,126 + (0,059/2)lg1 = -0,126 В
Рассчитаем стандартную ЭДС реакции
ЭДС = Eкат — Eан = EPb2+/Pb — EMg2+/Mg
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Mg2+/Mg, E0Co2+/Co, E0Fe2+/Fe, E0Ag+/Ag
E0Mg2+/Mg = -2,37 В
E0Fe2+/Fe = -0,440 B
E0Co2+/Co = -0,277 B
E0Ag+/Ag = +0,799 B
Протекание реакции возможно при условии, когда E0восст < E0ок.
В нашем случае восстановителем является кобальт и условие E0восст < E0ок соблюдается только для пары
Co – Ag.
Co0 + Ag+ = Co2+ + Ag0
Молекулярное уравнение, например:
Co0 + 2AgNO3 = Co(NO3)2 + 2Ag0
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Co) = 1∙59 = 59 г
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Показать решение »
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
E0Ni2+/Ni = -0,250 В
E0Cu2+/Cu = +0,337 В
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni0 -2e— = Ni2+
К: Cu2+ +2e— = Cu0
Ni0 + Cu2+ = Ni2+ + Cu0
Ni0 + CuSO4 = NiSO4 + Cu0
Составим схему гальванического элемента:
(-) Ni0|NiSO4 || CuSO4|Cu0 (+)
Рассчитаем стандартную ЭДС реакции
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Ni2+/Ni
ЭДС = 0,337 – (- 0,250) = 0,587 В
zadachi-po-khimii.ru
1.4 Гальванические элементы
В рассмотренных выше окислительно-восстановительных реакциях переход электронов от восстановителя – атома активного металла – к окислителю – ионам неактивного металла – происходит непосредственно, поскольку восстановитель соприкасается с окислителем. Обе стадии реакции – окисление активного металла и восстановление неактивного металла пространственно не разделены, т. е. протекают в одном месте – месте соприкосновения активного металла с раствором соли другого металла.
Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция:
Zn + CuSO4 → ZnSO4 + Cu
или в ионной форме: Zn0 + Cu2+ → Zn2+ + Cu0.
Здесь восстановитель – цинк – отдает электроны. Эта полуреакция выражается уравнением:
Zn0 – 2ē → Zn2+.
Окислитель – ион меди – принимает электроны. Уравнение этой полуреакции имеет вид:
Cu2+ + 2ē → Cu0.
Можно, однако, осуществить эту реакцию таким способом, что окислительная и восстановительная полуреакции окажутся пространственно разделенными, а электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока – по внешней цепи. Этот направленный поток электронов представляет собою электрический ток. Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами. Их называют также химическими источниками электрической энергии или химическими источниками тока (сокращенно ХИТ).
В простейшем случае гальванический элемент состоит из двух пластин или стержней (электродов первого рода), изготовленных из различных металлов (окислительно-восстановительных пар), погруженных в раствор электролита (чаще – это раствор соли металла). К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов. Электродами первого рода являются электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы. Например, металлический электрод – металл, погруженный в раствор своей соли Mе/Mеn+.
Электрод, на котором происходит процесс окисления (анодный процесс), называется анодом. Роль анода играет металл с меньшей алгебраической величиной электродного потенциала, т. е. более активный металл. Электрод, на котором осуществляется восстановление (катодный процесс), называется катодом (металл с большей алгебраической величиной электродного потенциала).
Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление – на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
Рассмотрим в качестве примера медно-цинковый гальванический элемент (элемент Якоби-Даниэля), образованный двумя электродами первого рода и работающий за счет энергии приведенной выше реакции между цинком и раствором сульфатом меди.
Этот элемент (рисунок 4) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора или соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала (рисунок4, а), или не соприкасаются, но взаимосвязь между ними осуществляется посредством проводника второго рода (электролитного мостика (рисунок 4, б).
а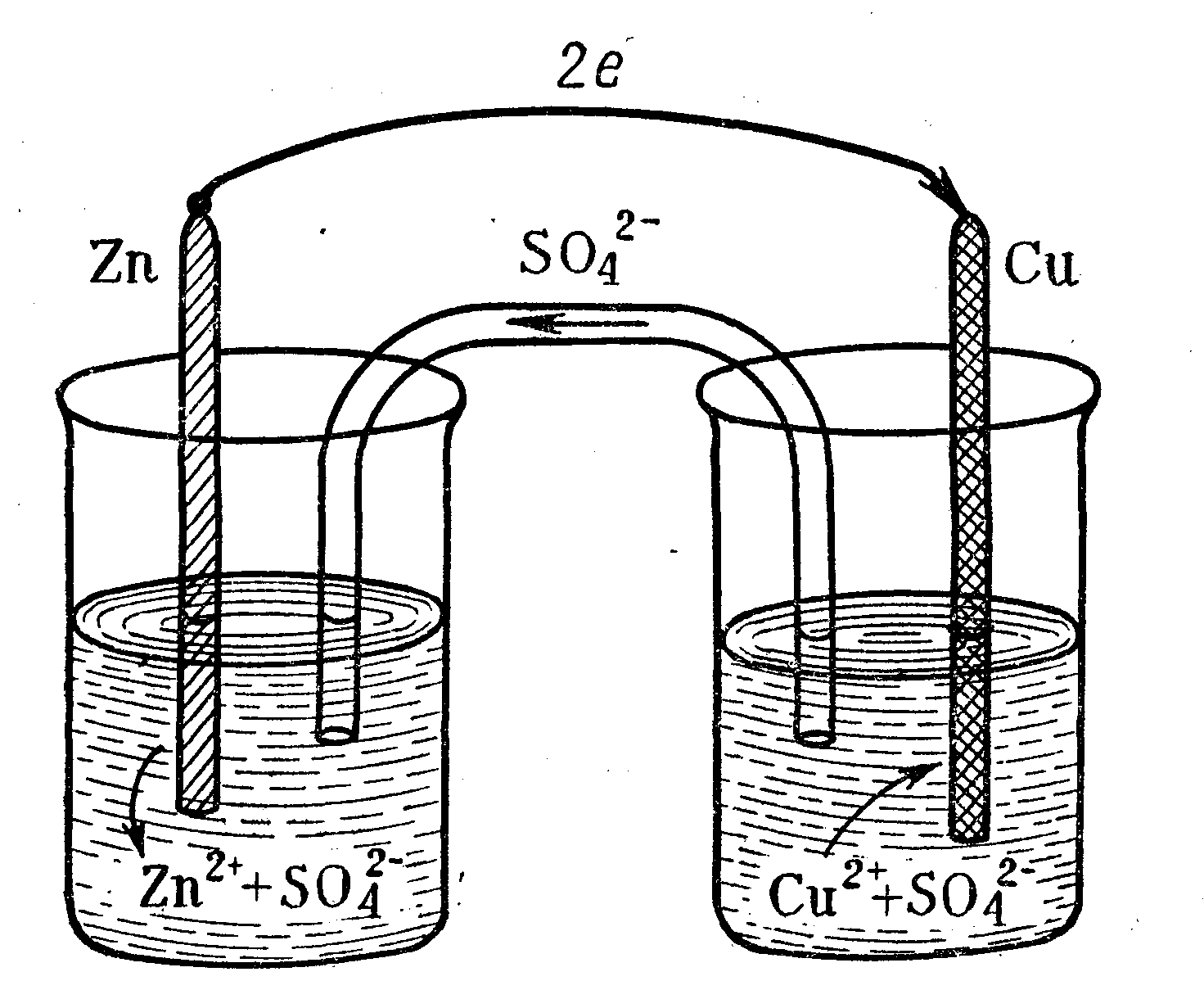 )
б)
)
б)
а) с растворами, соприкасающимися друг с другом;
б) с изолированными растворами
Рисунок 4 – Схема гальванического элемента Якоби-Даниэля.
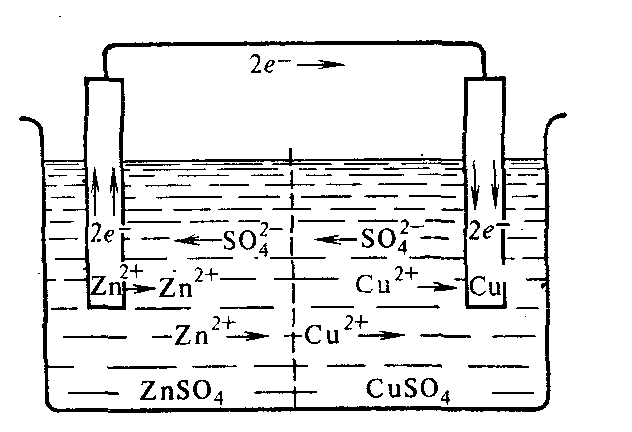
Работа гальванического элемента при замыкании цепи начинается с того, что электрод, изготовленный из более активного металла, в данном случае из цинка, взаимодействует с полярными молекулами воды, находящимися в соприкасающемся с поверхностью электрода растворе, по уравнению:
Zn0 + п Н2О → Zn2+∙ п Н2О + 2ē
или в упрощенной форме Zn0 – 2ē → Zn2+.
Образовавшиеся гидратированные катионы цинка переходят в раствор, а электроны заряжают отрицательно поверхность электрода. Электрод, на котором этот процесс происходит, получил название анода. Как видно, в данном случае анод заряжается отрицательно. В этом заключается первая стадия работы гальванического элемента – возникновение источника отрицательного электричества.
Осуществляется отвод высвобождающихся при этом электронов по внешней цепи с анода на катод в результате соединения цинкового электрода проволокой с медным электродом. В этом заключается вторая стадия работы гальванического элемента – прохождение электрического тока по проводнику.
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися катионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
Cu 2+∙ п Н2О + 2ē → Cu0 + п Н2О
или в упрощенной форме Cu2+ + 2ē → Cu0.
Таким образом, на медном электроде идет процесс восстановления меди, в связи с чем электрод, на котором этот процесс происходит, получил название катода. В этом заключается третья стадия работы гальванического элемента – разрядка ионов на катоде. Все три стадии работы гальванического элемента сопряжены между собой и идут с одинаковой скоростью. Число электронов, посылаемых в единицу времени анодом, равно числу электронов, проходящих в единицу времени через сечение проводника, и числу электронов, разряжающих в единицу времени катионы на катоде.
Суммарное уравнение реакции, протекающей в элементе (токообразующей реакции), получится при сложении уравнений обеих полуреакций:
Zn0 + Cu2+ → Zn2+ + Cu0
или в молекулярной форме:
Zn + CuSO4 → ZnSO4 + Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи (проводнику первого рода), на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
У цинкового электрода катионы выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами, так что здесь раствор заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы, находящиеся в растворе (Сu2+ и Zn2+), движутся от цинкового электрода к медному, а анионы SO42– – в обратном направлении. Движение ионов SO42– в растворе замыкает электрическую цепь гальванического элемента (например, если убрать электролитный мостик (рисунок 4, б), то электрический ток по внешнему проводнику протекать не будет).
Таким образом при замыкании внешней цепи, т. е. при соединении цинка с медью металлическим проводником, возникают самопроизвольные процессы растворения цинка (как более активного металла) на аноде и выделения меди (как менее активного металла) из раствора на катоде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не восстановится на медном электроде вся медь).
При схематическом изображении гальванического элемента граница раздела фаз между металлом и раствором обозначается одной вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой, которая отделяет анодное пространство от катодного. Слева записывается анод Zn¦Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Cu2+¦Cu – электрод с недостатком электронов, положительный полюс (+). Стрелками показано направление движения электронов во внешней цепи гальванического элемента.
Например, схема гальванического элемента Якоби-Даниэля изображается следующим образом (молекулярная форма):
2ē
Zn ZnSO4 CuSO4 Cu. |
Эта же схема может быть изображена в ионной форме:
2ē Zn Zn2+ Cu2+ Cu. |
Поскольку число электронов, которые за единицу времени отдает анод (цинк), равно числу электронов, принимаемых за это же время ионами катода (меди), скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Получаемая в процессе работы гальванического элемента энергия электрического тока равна произведению количества электричества, прошедшего от анода к катоду, на напряжение. Максимальное значение этого напряжения называется электродвижущей силой гальванического элемента.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором электродвижущая сила (ЭДС) элемента имеет положительное значение. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
ЭДС гальванического элемента определяется как разность электродных потенциалов катода и анода:
ЭДС = ЕК – ЕА. .
В случае элемента Якоби-Даниэля (–)Zn¦Zn2+||Cu2+¦Cu(+) для стандартных условий:
ЭДС = Е0Cu – Е0Zn = 0, 34 – (–0, 76) = 1,1 В
Для нестандартных условий ЭДС элемента Якоби-Даниэля находится из разности электродных потенциалов, вычисленных по уравнению Нернста.
studfile.net
Гальванический элемент: устройство, принцип работы, виды
Люди довольно часто сталкиваются с электрохимическими элементами в повседневной жизни: от одноразовых батареек АА в пультах дистанционного управления ТВ до литий-ионных батарей в смартфонах. Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.

Принцип работы
Гальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (h3SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.

Два типа ячеек
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».

Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее.
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Виды
Гальванические элементы классифицируются, как щелочные и нещелочные. Стандартная щелочная сухая батарея имеет цинковый А и К из диоксида марганца. Электролит выполнен в виде некислотной пасты. Обычно электролитом, используемым в щелочных батарейках — есть гидроксид калия. Она выполнена в форме стальной банки, заполненной диоксидом марганца в самой внутренней области К, и заполнена цинком и электролитом в центральной области А. Электролит, окружающий А, запускает химреакцию между ними.

График окислительно-восстановительной реакции
Типичная нещелочная батарея с сухими элементами имеет цинковый А и К из углеродного стержня/ диоксида марганца. Электролит обычно представляет собой кислое пастообразное вещество из смеси хлорида аммония и хлорида цинка. Физически она имеет обратную щелочной батареи конструкцию. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень/ диоксид марганца занимает внутреннюю область в качестве К. Электролит смешивается с К и обеспечивает химическую реакцию между К и А.
Общее мнение специалистов говорит о том, что химически щелочная батарея имеет преимущества по отношению к нещелочной. Хотя последние более надежные и дешевые, тем не менее, щелочные, нужны, когда требуется быстрое, сильнотоковое потребление, например, вспышка на камере с быстрой перезарядкой.
Щелочные батареи
Эта конструкция ячейки получила свое название благодаря использованию щелочных водных растворов в качестве электролитов. Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.

Щелочные батареи
Цинк в порошкообразной форме увеличивает площадь поверхности анода, что обеспечивает большее взаимодействие частиц. Это снижает внутреннее сопротивление и увеличивает плотность мощности. Катод, MnO2, произведен синтетически из-за его превосходства над природным MnO2, что дает рост плотности энергии. Как и в цинковой в углеродной ячейке, графит добавляется к катоду для увеличения проводимости.
Электролит КОН, обеспечивает высокую ионную проводимость. Оксид цинка часто включают для замедления коррозии цинкового анода. Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
Половинные реакции:
- Zn + 2OH — -> ZnO + h3O + 2 e —
- 2MnO2 + h3O + 2 e — -> Mn2O 3 + 2OH —
Общая реакция:
- Zn + 2MnO2 -> ZnO + Mn2O3 E = 1,5 В
Существуют и другие конструкции ячеек, которые относятся к категории щелочных, в том числе оксиды ртути, серебра и цинка. Ртуть и серебро дают еще более высокую плотность энергии, но стоят намного дороже и постепенно исключаются требованиями международных организаций из-за их высокой токсичности.
Солевые ячейки
Аккумуляторы с сухими элементами — это устройства, в которых используется электролит с очень низким содержанием влаги. Они контрастируют с батареями с мокрыми элементами, такими как свинцово-кислотные, в которых используется жидкий электролит. Электролит, используемый в большинстве устройств с сухими элементами, является пастой, которая, хотя и содержит влагу, тем не менее остается относительно сухой. Наиболее часто используемые формы сухих элементов — это батареи типа «С», «А», 9 вольт батарейки и для электронных часов.

Сухой элемент
Важно! Сухих элементы вырабатывают электроэнергию путем преобразования химической энергии в электричество. Выходные данные зависят от типа батареи с сухими элементами. Более популярными являются конструкции с использованием цинка и углерода или цинка и диоксида марганца.
Эти материалы помещаются в пасту электролита внутри батареи. Они реагируют друг с другом посредством химического процесса, в котором электролит, диоксид углерода или марганца реагирует с цинком, создавая электричество.
Литиевые аккумуляторы
Литий-ионная технология включает в себя несколько химических процессов: ионы лития хранятся в аноде или отрицательном электроде, и транспортируются во время разряда к катоду или положительному электроду в органическом электролите.
Наиболее популярными материалами являются графит для анода и оксид металла для катода на основе никеля, марганца и кобальта. Все эти материалы обладают хорошими свойствами интеркалирования лития, что позволяет хранить большое количество энергии.

Литий-ионный элемент
Выбор аккумуляторной технологии зависит от требований эксплуатации по производительности, сроку службы, безопасности и стоимости, причем каждый тип аккумулятора обеспечивает определенные функциональные возможности.
Преимущества литий-ионных аккумуляторов:
- Высокая плотность энергии. Высокая плотность энергии является одним из главных преимуществ технологии литиевых батарей, для того чтобы работать дольше.
- Саморазряд. Одной из проблем многих аккумуляторов является скорость саморазряда. Литий-ионные элементы в том, что скорость их саморазряда намного ниже, чем у Ni-Cad и NiMH. Обычно составляет около 5% в первые 4 часа после зарядки, но затем падает до 1 или 2% в месяц.
- Низкие эксплуатационные расходы, поскольку требуют технического обслуживания для обеспечения их производительности.
- Разнообразие типов: для бытовой электроники, для электроинструментов и электромобилей.
У таких батарей есть один существенный недостаток — им требуется встроенная схема защиты. Кроме того они страдают от старения и могут выдержать 500–1000 циклов зарядки-разрядки.
Устройство гальванического элемента
Гальваническая ячейка представляет собой простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию.
Строение гальванического элемента для литиевых батарей:
- Анод, при разряде отдает электроны во внешнюю цепь и окисляется во время электрохимической реакции. Большинство коммерческих элементов в настоящее время используют электрод на основе углерода/графита, однако можно использовать металл или сплав.
- Катод, на разряде принимает электроны из внешней цепи и восстанавливается во время электрохимической реакции. Обычно это переходный металлический оксид или фосфат.
- Электролит.
Обратите внимание! Строение электролита ионный проводник, при этом электронный изолятор, разделяет два электрода и обеспечивает среду для переноса заряда внутри ячейки между анодом и катодом. Электролитом обычно является неводный неорганический растворитель, содержащий растворенную соль лития, например LiPF6 в пропиленкарбонате.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.

Аккумуляторная батарейка
Клетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
- Реакция восстановления положительного электрода (катода): Li 1 -xCoO 2 + xLi + + xe- → LiCoO2
- Реакция окисления отрицательного электрода (анода): LiC 6 → xLi + + xC6 + e-
- Общая обратимая, окислительно-восстановительная, клеточная реакция: LiC 6 + CoO 2 C6 + LiCoO 2

Применение ячеек
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
rusenergetics.ru
Гальванический элемент: схема, принцип работы, состав
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.

Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.

Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условиях
Простой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Процесс изготовления
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
batareykaa.ru