Электролиз. Электролиз растворов. Электролиз расплавов
Электролиз — это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз — это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода (какие электроды бывают и какой в каком случае брать — рассказано дальше) и, конечно, электролит. Электролит — это раствор, который проводит электрический ток.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие — в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электрод, заряженный положительно — анод. Электрод, заряженный отрицательно — катод. При электролизе происходит окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют
В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
В домашних условиях, из тех веществ, что имеются практически у каждого, можно без труда получить, например, кислород, водород, хлор, медь, серу, а также слабую кислоту или щёлочь! Но будьте осторожны с хлором — этот газ ядовит!
Первый опыт проведём с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (можно взять кальцинированную соду), опустите туда электроды и включите источник питания. Как только ток пойдёт через раствор, сразу станут заметны пузырьки газа, которые образуются у электродов: у «+» будет выделяться кислород, у «-» водород. Именно такое распределение газов происходит из-за того, что возле анода «+» происходит скопление отрицательных ионов OH—, и восстановление кислорода, а возле катода «-» скапливаются ионы щелочного металла, которые содержатся в кальцинированной соде (Na2
 Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Li <K <Rb <Cs <Ba <Ca <Na <Mg <Al <Mn <Cr <Zn <Fe <Cd <Co <Ni <Sn <Pb <h3 <Cu <Ag <Hg <Pt <Au
В следующем опыте по электролизу будем получать чистую медь (Cu).
Для этого нам потребуется раствор медного купороса CuSO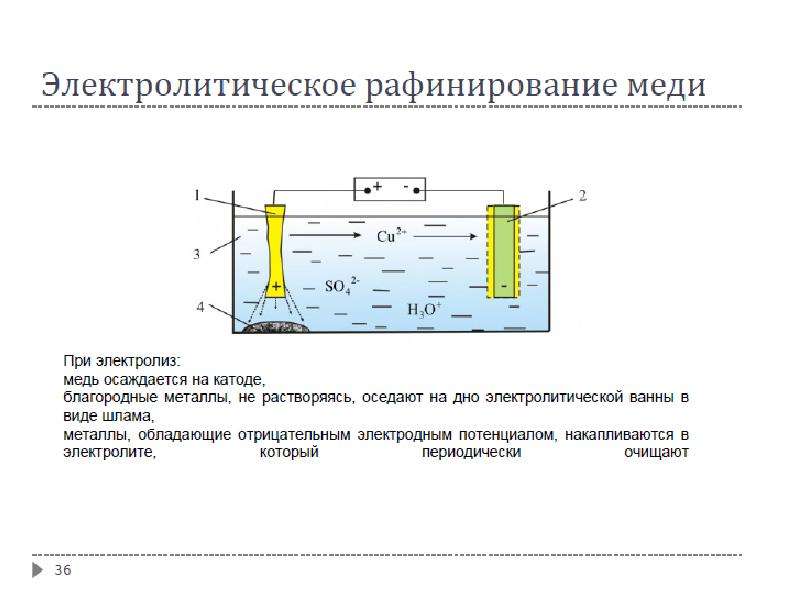
Мы провели 2 опыта по электролизу растворов и можем подвести результат:
При пропускании тока через раствор на положительном электроде — аноде — восстанавливаются отрицательно заряженные ионы (в нашем случае — кислород). Отрицательно заряженные ионы ещё называют
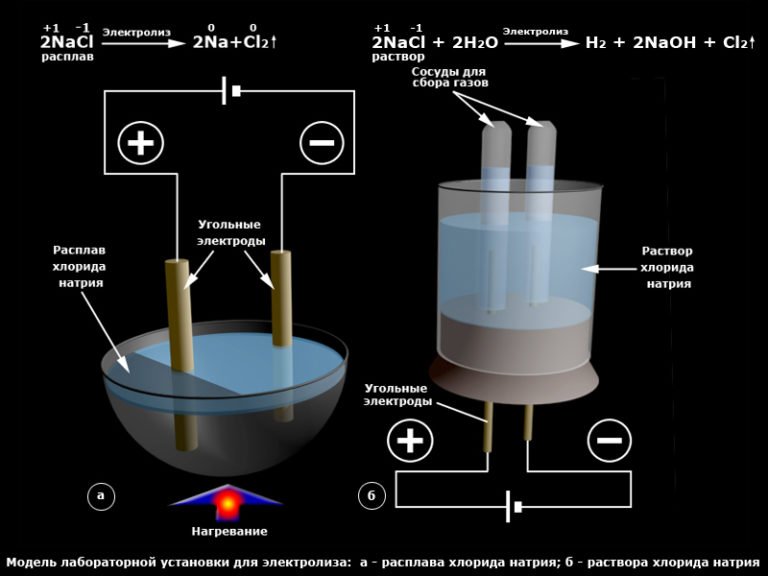
Проведём ещё один опыт по электролизу. На этот раз мы будем пропускать ток через раствор поваренной соли (NaCl).
Но должен заранее предупредить, этот электролиз нужно проводить в хорошо проветриваемой комнате, так как выделяемый из раствора чистый газ — хлор (Cl2) очень токсичен. Если хотите собрать этот газ (иди какой-нибудь другой), то можно воспользоваться предложенной ниже схемой:
Если хотите собрать этот газ (иди какой-нибудь другой), то можно воспользоваться предложенной ниже схемой:
Электролиз раствора поваренной соли. Схема сбора газа
Итак, начнём. Приготовьте раствор поваренной соли (NaCl). К положительному полюсу источника питания подключите инертный электрод (например — графитовый стержень), к отрицательному — подойдёт любой материал, проводящий ток. Опустите в него электроды и включите источник питания. Через несколько секунд уже можно почувствовать неприятный запах хлорки (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде мелких пузырьков у анода («+»). Чем дольше будет длиться процесс электролиза, тем больше концентрация хлора будет возле электролита. Если вы собираете хлор в пробирку или банку (хлор тяжелее воздуха, он будет находится на дне), не пробуйте «нюхать»его в банке — можно сильно отравится! (Статья о хлоре).
На аноде выделяется чистый газ хлор. При этом на катоде из раствора восстанавливается чистый водород (H
Электролиз расплавов
При электролизе расплавов в процессе участвуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ — хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл — натрий (Na). Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы. Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
Дополнительно об электролизе
В том случае, когда металл расположен в средней части ряда напряжения (от цинка до водорода) на катоде одновременно протекают два процесса: восстановление катиона металла и восстановление молекул воды. Рассмотрим электролиз водного раствора сульфата никеля с инертными электродами.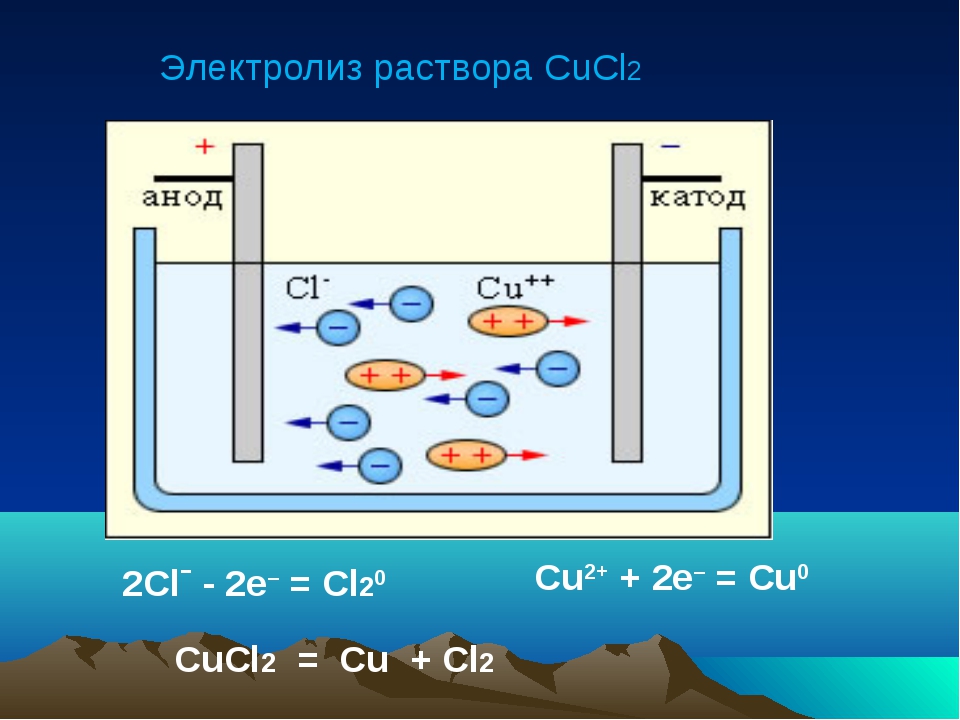
В растворе: NiSO4 = Ni2+ + SO42–;
На катоде:
K(-) Ni2+ + 2ē = Ni
2H2O + 2ē = H2 + 2OH–
Эти реакции никак не связаны между собой и суммировать их нельзя! Никакого простого соотношения между количеством никеля и водорода нет, оно зависит от концентрации, температуры, материала катода и прочих факторов.
На аноде:
А(+) (SO42– – не окисляются )
2H2O – 4ē = O2 + 4H+
Общих уравнений (катод + анод) в этом случае тоже будет два. Чтобы получить общее уравнение основной реакции, мы должны сложить уравнение основного процесса на катоде и уравнение анодного процесса, с учетом коэффициентов электронного баланса:
K(-) Ni2+ + 2ē = Ni |2
А(+) 2H2O
– 4ē = O2 + 4H
———————————————————
2Ni2+ + 2H2O = 2Ni + O2 + 4H+ – ионное,
2NiSO4 + 2H2O = 2Ni + O2 + 2H2SO4 – молекулярное уравнение основной реакции.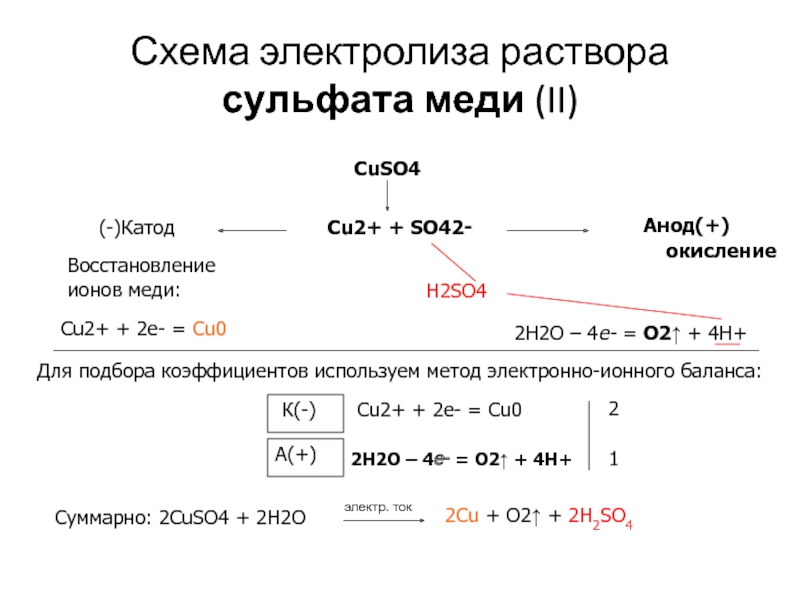
Аналогично получаем общее уравнение побочной реакции:
K(-) 2H2O + 2ē = H2 + 2OH–|2
А(+) 2H2O – 4ē = O2 + 4H+|1
———————————————————
6H2O = 2H2
2H2O = 2H2 + O2
Опять же, суммировать общие уравнения основной и побочной реакций нельзя! (а это встречается в некоторых пособиях).
В заданиях ЕГЭ вряд ли потребуется составлять общие уравнения реакций для таких случаев, как правило, требуется только написать уравнения отдельных процессов на электродах. Остальное скорее пригодится на олимпиадах.
Немного о расчетах. Если в некоторой задаче дано количество вещества никеля, полученного при электролизе, можно рассчитать, сколько соли подверглось электролизу, сколько серной кислоты образовалось. Нельзя рассчитать, сколько всего выделилось кислорода (он образуется и во второй реакции!). Или этой реакцией придется пренебречь.
Тем более (без дополнительных данных), нельзя рассчитать, сколько выделилось водорода.
Нельзя рассчитать, сколько всего выделилось кислорода (он образуется и во второй реакции!). Или этой реакцией придется пренебречь.
Тем более (без дополнительных данных), нельзя рассчитать, сколько выделилось водорода.
Если сказано, сколько выделилось кислорода – нельзя рассчитать ничего, кроме общего количества вступившей в реакцию воды.
Вот если сказано, сколько выделилось никеля и сколько кислорода – тогда можно рассчитать все.
Электролиз солей
Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
Электролизер
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав или водный раствор соли. Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
Электролиз расплава NaCl
При электролизе расплава NaCl на отрицательном электроде (катоде) происходит присоединение электронов ионом натрия Na+ и его восстановление. При этом вблизи электрода концентрация ионов Na+ уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na+.
Аналогично происходит миграция ионов Cl— к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl— -2e— → Cl20 |
| Катод | 2Na+ + 2e— → 2Na0 |
| 2Na+ + 2Cl— → 2Na0 + Cl20 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
Сложнее протекает электролиз водных растворов электролитов.
Электролиз водного раствора NaCl
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl— -2e— → Cl20 |
| Катод | 2H2O + 2e— → H20 +2OH— |
| 2H2O + 2Cl— → H20 + Cl20 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
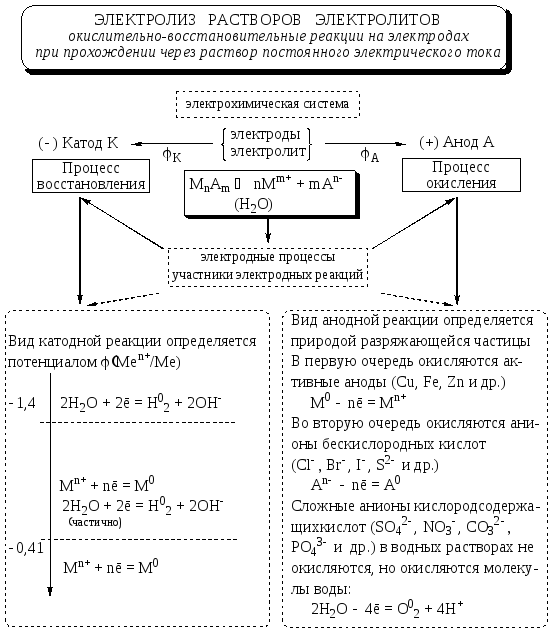
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu2+, Hg22+, Ag+, Hg2+, Pt2+ до Pt4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li+, Na+ … до Al3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn2+, Zn2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu2+, Ag+, Zn2+ сначала восстановится Ag+ (E = +0,79 В), затем Cu2+ (E = +0,337 В) и только потом Zn2+ (E = +0,76 В).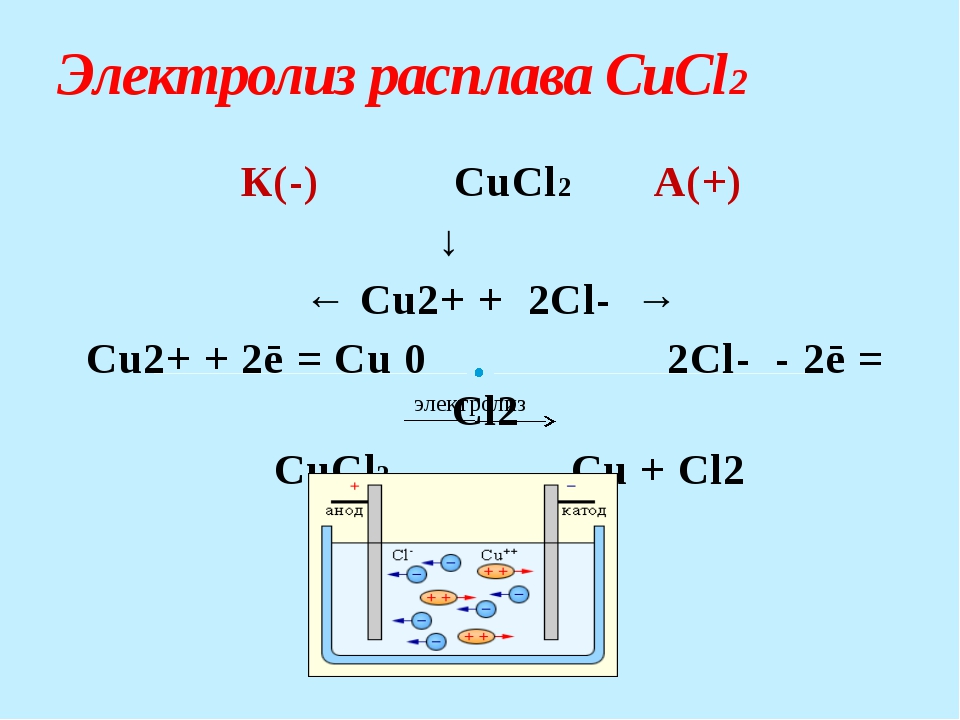
Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
- При электролизе бескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl— -2e— = Cl2
- При электролизе кислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e— = O2 + 4H+
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO32- + H2O -2e— = SO42- + 2H+
В таблице ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом | CuBr2 + H2O = Cu + Br2 + H2O K: Cu2+ + 2e— = Cu A: 2Br— -2e— = Br2 |
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом | K2SO4 + 2H2O = K2SO4 + 2H2 + O2 K: 2H2O +2e— = H2 + 2OH— A: 2H2O -4e— = O2 + 4H+ Т. |
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом | KI + H2O = 2KOH + H2 + I2 K: 2H2O +2e— = H2 + 2OH— A: 2I— -2e— = I2 |
| Водный раствор соли малоактивного металла с анодом из того же металла | CuSO4 K: Cu2+ + 2e— = Cu A: Cu — 2e— = Cu2+ |
Электролиз солей — количественные аспекты
Связь между количеством вещества, выделившегося при электролизе соли и количеством прошедшего через него электричества отражена в законах Фарадея.
1 закон Фарадея
Массы веществ (m), выделившихся на катоде или аноде (или образовавшиеся в катодном и анодном пространстве), пропорциональны количеству прошедшего через раствор или расплав электричества (Q):
m=kQ
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества.
2 закон Фарадея
Равные количества электричества в процессе электролиза выделяют эквивалентные количества различных веществ.
Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея.
m = ЭIt/F = ЭIt/96484,56, где
m – масса вещества,
Э – электрохимический эквивалент,
I – сила тока,
t – время электролиза.
Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом.
Задачи с решениями на составление уравнений электродных реакций, протекающих при электролизе, а также на применение законов Фарадея приведены в разделе Задачи к разделу Электролиз солей
Тестовое оборудование для установок по производству водорода электролизом воды
Водород является уникальным энергоносителем, обладающим высокими эксплуатационными и технологическими показателями. Он имеет очень высокой теплоту сгорания, а продуктом горения в кислороде является вода, которая может вновь использоваться для получения водорода. Низкая вязкость и плотность газа позволяют практически без потерь давления транспортировать его по трубопроводам. Водород может транспортироваться и храниться как в газообразном, так и сжиженном состоянии. А кроме того он безопасен для окружающей среды и не токсичен.
Водород может транспортироваться и храниться как в газообразном, так и сжиженном состоянии. А кроме того он безопасен для окружающей среды и не токсичен.
Однако в чистом виде водород в природе не встречается. Существует целый ряд методов его получения. Разнообразие этих методов — одно из преимуществ водородной энергетики. Нет сильной зависимости от какого-либо отдельного вида сырья.
Наиболее распространенным способом получения водорода является паровая конверсия посредством реакции углеводородов (природный газ) с паром при высоких температурах. При этом в качестве побочного продукта выделяются парниковые газы, выброс которых в настоящее время стараются минимизировать. Другой способ производства водорода – электролиз воды. Здесь отсутствуют вредные выбросы. А цена и эффективность процесса электролиза сопоставима с технологией паровой конверсии.
В электролизере под воздействием подаваемого напряжения вода разделяется на водород и кислород. Для получения более чистого водорода оба газа должны быть отделены друг от друга разделительной мембраной.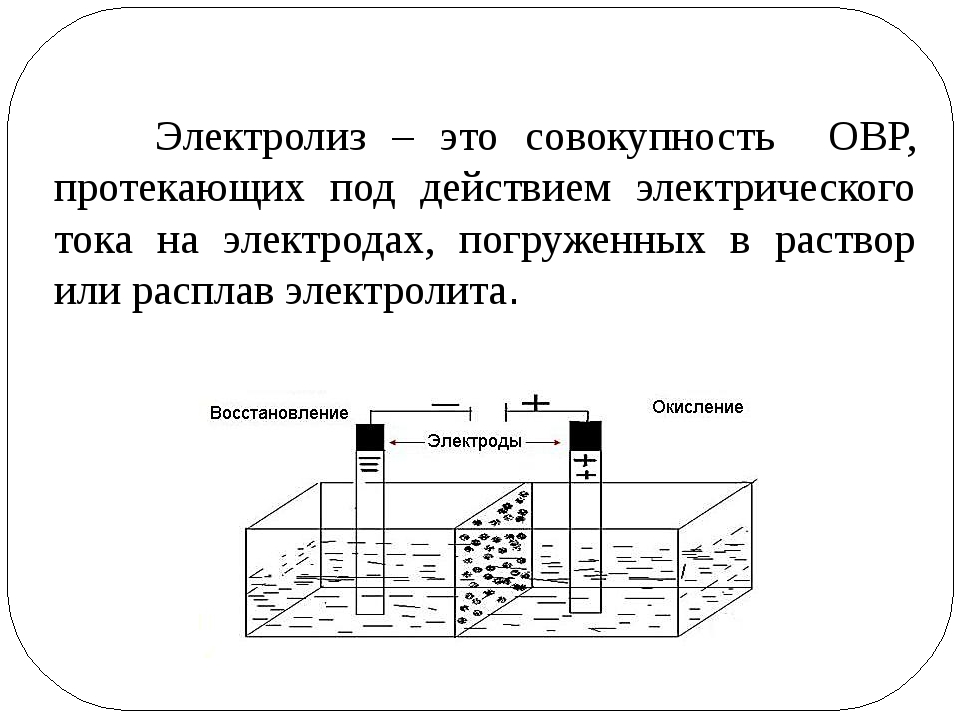 При создании электролизеров стоит задача определения характеристик пропускания таких мембран. Испытательное оборудование должно обеспечивать точную подачу чистых водорода и кислорода, а измерять расход и состав прошедшего через мембрану газа.
При создании электролизеров стоит задача определения характеристик пропускания таких мембран. Испытательное оборудование должно обеспечивать точную подачу чистых водорода и кислорода, а измерять расход и состав прошедшего через мембрану газа.
Специалистами Bronkhorst было предложено следующее решение. Подача кислорода к испытуемой мембране осуществлялась кориолисовым регулятором массового расхода серии miniCORI-FLOW, а водорода – тепловым регулятором расхода серии EL-FLOW Prestige. Часть подаваемого газа, которая проходит через мембрану, поступает в трехходовой кран. В одном положении крана можно измерять расход прошедшего газа с помощью теплового расходомера EL-FLOW Prestige. В другом – состав газа с помощью двойного датчика водород/кислород. Особенность использованного датчика состояла в том, что для его работы требовался определенный расход газа.
Высокая точность и стабильность поддержания расхода использованными расходомерами позволила с успехом решить поставленную задачу. Позже было принято решение об установке четвертого расходомера для измерения части подаваемого газа, не прошедшего через мембрану и имеющего высокую концентрацию кислорода. Выбор был сделан в пользу кориолисового расходомера серии miniCORI-FLOW.
Позже было принято решение об установке четвертого расходомера для измерения части подаваемого газа, не прошедшего через мембрану и имеющего высокую концентрацию кислорода. Выбор был сделан в пользу кориолисового расходомера серии miniCORI-FLOW.
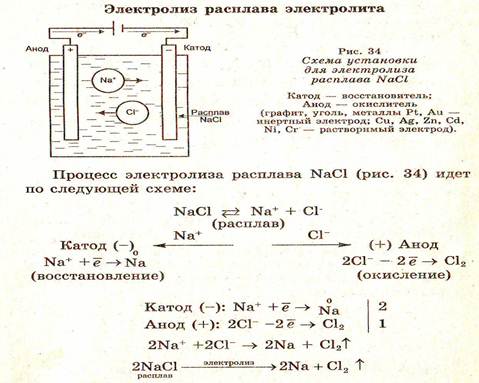
Технологическая схема электролиза никеля » Все о металлургии
07.05.2015
Технологические схемы электролиза никеля на разных заводах имеют много общего. Процессы электролиза, получения катодных листов и переработки скрапа в основе своей всюду одинаковы. Главное различие в схемах заключается в операциях очистки электролита и их последовательности, в частности в совместной или раздельной очистке от железа и кобальта.
На рис. 62 изображена типичная схема процесса электролиза никеля. В табл. 10 приведен примерный баланс никеля, кобальта и меди в цехе электролиза, работающем по этой схеме, а в табл. 11 — некоторые данные, характеризующие процесс электролиза никеля.
Электролиз никеля ведут в прямоугольных ваннах (рис 63), в которых помещены аноды, диафрагменные катодные ячейки и катоды.
 Расстояние между центрами катодов 170—200 мм. Питание электролитом катодных ячеек производится через резиновые трубки, на концы которых надеты насадки с калиброванным отверстием, регулирующим скорость подачи электролита.
Расстояние между центрами катодов 170—200 мм. Питание электролитом катодных ячеек производится через резиновые трубки, на концы которых надеты насадки с калиброванным отверстием, регулирующим скорость подачи электролита.Корпус ванны обычно представляет собой железобетонную прямотольную коробку длиной -6,3 м, шириной -1 м и высотой — 1,3 м. Йанны установлены на фундаменты. Для борьбы с утечками тока между корпусами ванн и фундаментом вставлены стеклянные или диабазовые изолирующие прокладки плитки. С этой же целью рабочие площадки не доведены до корпуса ванн на 2—3 см. Корпуса ванн внутри покрыты битумным лаком и оклеены рубероидом, по которому нанесен слой битуминоля. Ванна фугерована кислотоупорным кирпичом на портланд цементе в 1/4 кирпича.
С одной торцовой стороны ванны имеется фаолитовая сливная коробка с опущенной вниз трубкой (рис. 63). С помощью этого устройства анолит, забираемый на расстоянии 20—30 см от дна ванны, сливается в сборный желоб.
Для закрепления диафрагменных ячеек внутри ванн вдоль длинных сторон установлены деревянные гребенки с пазами (на рис.
 63 не показаны).
63 не показаны).В матричных ваннах электролиз ведется с катодами из листов нержавеющей стали или титана, называемых матрицами, на которых осаждают тонкий слой никеля Для облегчения отделения осадка края матриц с трех сторон экранируются рейками После окончания наращивания никеля (8—18 час.) с вынутых из ванн матриц сдирают никелевые листы. Листы эти обрезают специальными ножницами (размер не менее 800х800 мм) и правят—рихтуют Затем к листам прикрепляют (приклепывают или приваривают) ушки из никелевой ленты. Таким образом получают катодные «основы» для наращивания никеля.
Электрические ванны соединяются последовательно в серии с таким расчетом, чтобы напряжение на серии было порядка 200 в. В этом случае питание серии постоянным током производится с помощью ртутных выпрямителей.
Напряжение на ванне в период цикла нормального растворения составляет около 2,0 в, а к концу периода растворения анодов повышается до 3,5—4,0 в. Поэтому среднее напряжение на ванне, рассчитываемое по напряжению на серии и числу ванн в серии, составляет большую вeличину и равняется примерно 2,3—2,5 в.
 Баланс напряжения на ванне сильно зависит от состава электролита и плотности тока. Довольно сильно колеблется падение напряжения в диафрагме. Существенной составляющей баланса (не менее 50%) является падение напряжения в электролите.
Баланс напряжения на ванне сильно зависит от состава электролита и плотности тока. Довольно сильно колеблется падение напряжения в диафрагме. Существенной составляющей баланса (не менее 50%) является падение напряжения в электролите.Перед загрузкой анодов электролизная ванна очищается от шлама; чистятся и промываются шины и электродные ломики. В ванну загружается обычно 33 анода и устанавливается 32 диафрагменных ящика.
обтянутых брезентом соответствующего качества. Ванна подготовленная к пуску, заливается и не менее одного часа промывается чистым электролитом из общей циркуляционной системы цеха, после этого в диафрагменные ящики загружают никелевые основы и ванну включают в электрическую печь.
Температура электролита, подаваемого в ванны, должна быть не менее 55°. Срок использования анодов определяется напряжением иг ванне: когда напряжение достигает 4,5 в (при плотности тока 200—250 а/м2) и не снижается после зачистки контактов, ванна подлежит разгрузке. Нормальный срок наращивания катодов не менее 4 суток.
Выгруженный из ванн катодный никель подвергается промывке в несколько стадий: горячей водой (50—70°) до исчезновения видимых кристаллов сульфата, горячей проточной водой не менее 6 час., затем, по необходимости, последовательно подкисленной и проточной водой. Промытые катоды режутся, сортируются, маркируются и упаковываются в соответствии с нормами ГОСТа.
Обрезки катодного никеля, брак катодов, а также отмытые обрезки основ переплавляются на товарный металл.
Анодный скрап направляется в плавку на аноды. Несработанные полностью аноды используются в ваннах растворения.
После очередной операции растворения анодов ванна очищается от шлама. Для этого дают раствору отстояться не менее 1 час., затем отсифонивают раствор с помощью шланга, который держат в верхнем слое раствора, и, наконец, удаляют из ванны шлам. К этому шламу ванн осаждения присоединяют шлам матричных ванн, а также шлам, отделенный при отмывке скрапа и собранный при очистке желобов и сборников грязного электролита.
 Всю массу шлама подвергают кислотной обработке для извлечения никеля и затем направляют на извлечение платиноидов, а в некоторых случаях селена и теллура.
Всю массу шлама подвергают кислотной обработке для извлечения никеля и затем направляют на извлечение платиноидов, а в некоторых случаях селена и теллура.На рис. 64 представлены характерные снимки поверхности листов катодного никеля, полученных при разных плотностях тока. На рис. 65 изображены кромки катодных листов, полученных при нормальных условиях электролиза (верхние два), и дендритистые (нижние два), отвечающие процессу, протекающему при отсутствии экранирования краев катодов, неправильной их центровке или при несоответствии размеров анодов и катодных листов.
В процессе электролиза и очистки растворов имеют место безвозвратные потери никеля, которые необходимо непрерывно восполнять. Эта задача в ряде случаев может быть решена введением карбоната никеля, получаемого в кобальтовом производстве. Другой путь — дорастворение сработанных в ваннах осаждения анодов в специальных ваннах без диафрагм, электролитом в которых служит серная кислота (до 100 г/л), а катодами — бракованные матрицы из нержавеющей стали или медные листы.
 Растворение анодов в таких условиях сопровождается выделением водорода на катодах Когда концентрация никеля в электролите достигнет 100—120 г/л и кислотность снизится до 1—3 г/л, ванну останавливают, раствор сливают и подают в сборники грязного электролита. Наряду с электрохимическим применяют и химическое растворение какого-нибудь никелевого полупродукта, в частности с применением автоклавных процессов.
Растворение анодов в таких условиях сопровождается выделением водорода на катодах Когда концентрация никеля в электролите достигнет 100—120 г/л и кислотность снизится до 1—3 г/л, ванну останавливают, раствор сливают и подают в сборники грязного электролита. Наряду с электрохимическим применяют и химическое растворение какого-нибудь никелевого полупродукта, в частности с применением автоклавных процессов.Очистка анолита от примесей осуществляется в очистном отделении цеха электролиза.
Перекачка электролита в цехе производится центробежными кислотостойкими насосами, изготовленными из сплава «силекс» Как показали испытания, проведенные на комбинате «Североникель» В.Б. Жилкиным и др., очень хорошие результаты по коррозионной стойкости показали насосы, изготовленные комбинатом из титана.
Все трубопроводы во избежание коррозии фаолитизированы. Фильтрование пульп производится на фильтр прессах, свечных или барабанных антикоррозионных вакуум-фильтрах.
Особенно следует остановиться на методах подогрева раствора Простейший способ подогрева при помощи острого пара не всегда дает удовлетворительные результаты, так как может привести к значительному разбавлению раствора (особенно в тех случаях, когда для уменьшения потерь промывные воды соединяются с электролитом).
 Различного рода теплообменники, выполненные из нержавеющей стали, быстро корродируют в отработанном электролите, содержащем ионы Cu2 и значительные концентрации ионов Cl-.
Различного рода теплообменники, выполненные из нержавеющей стали, быстро корродируют в отработанном электролите, содержащем ионы Cu2 и значительные концентрации ионов Cl-.Получившие в последнее время распространение теплообменники из пропитанного графита могли бы оказаться перспективными, но они в условиях никелевого производства еще не испытаны.
Хорошие результаты показал способ нагрева раствора электрическим током, примененный на комбинате «Североникель». Нагрев по этому способу осуществляется в чанах с помощью угольных электродов, на которые подается мощность от 4000 до 9000 ква.
Очистка анолита от железа производится в последовательно включенных чанах с воздушным перемешиванием. Железо окисляется кислородом воздуха, а раствор нейтрализуется карбонатом никеля, вводимым в виде пульпы в головной пачук. Длительность операции составляет 1—2 часа и зависит от количества включенных в цепь чанов. Давление воздуха для перемешивания и очистки раствора должно быть не менее 1 ати.
 Полученный железный кек отфильтровывается и подвергается репульпации для извлечения никеля.
Полученный железный кек отфильтровывается и подвергается репульпации для извлечения никеля.Очистка от меди производится никелевым порошком, как описано выше. Остаточное содержание меди в растворе не должно превышать 5 мг/л.
Очистка от кобальта (а также свинца, органических примесей и оставшегося количества железа) осуществляется на комбинате «Североникель» с помощью хлора в чанах с воздушным перемешиванием. Раствор нейтрализуется пульпой карбоната никеля До рН = 3,2/4,2 (проверяется на фильтрате). Подача хлора регулируется по концентрации кобальта в очищенном электролите. Температура раствора должна поддерживаться не ниже 60° Необходимая длительность операции (до 2 час.) обеспечивается количеством включенных в цепь пачуков.
Отфильтрованный кобальтовый кек перерабатывается на кобальтовый концентрат путем кислой репульпации при 60—75°. В первой стадии процесса часть кека растворяется в концентрированной серной кислоте Во второй стадии происходит выделение кобальта из раствора по обменной реакции его с никелем кека.
 Отфильтрованный, промытый, и отдутый концентрат направляется в кобальтовое производство. Следует, однако, заметить, что на некоторых отечественных заводах применяется другая схема очистки от кобальта.
Отфильтрованный, промытый, и отдутый концентрат направляется в кобальтовое производство. Следует, однако, заметить, что на некоторых отечественных заводах применяется другая схема очистки от кобальта.За последние годы проведены значительные работы по интенсификации процесса электролиза никеля и его автоматизации. Разработаны автоматизированные процессы поддержания нужного pH католита, подачи никелевого порошка, перекачки растворов, поддержания необходимого уровня электролита в различных сборниках и некоторые другие. Имеющийся опыт подтверждает, что комплексная автоматизация цикла очистки возможна и сулит значительные выгоды. Комплексная автоматизация электролиза наталкивается на значительные трудности, обусловленные периодичностью процесса.
Раздаточный материал для сам.работы 11 класс «Электролиз»
Электролиз расплавов и растворов веществ
Электролиз – это окислительно – восстановительные реакции, протекающие на электродах, если через расплав или раствор электролита пропускают постоянный электрический ток.
Катод – восстановитель, отдаёт электроны катионам.
Анод – окислитель, принимает электроны от анионов.
Ряд активности катионов:Na+ Mg2+ Al3+ Zn2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+
Усиление окислительной способности
Ряд активности анионов:
I— Br —Cl— OH— NO3— CO32- SO42-
Возрастание восстановительной способности
Процессы, протекающие на электродах при электролизе расплавов
(не зависят от материала электродов и природы ионов).
1. На аноде разряжаются анионы (Am—; OH—), превращаясь в нейтральные атомы или молекулы
Am— — mē → A°; 4OH— — 4ē → O2↑ + 2H2O (процессы окисления).
2. На катоде разряжаются катионы (Men+, H+), превращаясь в нейтральные атомы или молекулы:
Men+ + nē → Me° ; 2H+ + 2ē → H20↑ (процессы восстановления).
Электролиз – это окислительно – восстановительные реакции, протекающие на электродах, если через расплав или раствор электролита пропускают постоянный электрический ток.
Катод – восстановитель, отдаёт электроны катионам.
Анод – окислитель, принимает электроны от анионов.
Ряд активности катионов:Na+ Mg2+ Al3+ Zn2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+
Усиление окислительной способности
Ряд активности анионов:
I— Br —Cl— OH— NO3— CO32- SO42-
Возрастание восстановительной способности
Процессы, протекающие на электродах при электролизе растворов
КАТОД (-)
Не зависят от материала катода; зависят от положения металла в ряду напряжений
АНОД (+)
Зависят от материала анода и природы анионов.
Анод нерастворимый (инертный), т.е. изготовлен из угля, графита, платины, золота.
Анод растворимый (активный), т.е. изготовлен из Cu, Ag, Zn, Ni, Fe и др. металлов (кроме Pt, Au)
1.В первую очередь восстанавливаются катионы металлов, стоящие в ряду напряжений после H2:
Men+ +nē → Me°
1.В первую очередь окисляются анионы бескислородных кислот (кроме F— ):
Am- — mē → A°
Анионы не окисляются.
Идёт окисление атомов металла анода:
Me° — nē → Men+
Катионы Men+переходят в раствор.
Масса анода уменьшается.
2.Катионы металлов средней активности, стоящие между Al иH2, восстанавливаются одновременно с водой:
Men+ + nē →Me°
2H2O + 2ē → H2↑ + 2OH—
2. Анионы оксокислот (SO42-, CO32-,..) и F— не окисляются, идёт окисление молекул H2O:
Анионы оксокислот (SO42-, CO32-,..) и F— не окисляются, идёт окисление молекул H2O:
2H2O — 4ē → O2↑ +4H+
3.Катионы активных металлов от Li до Al (включительно) не восстанавливаются, а восстанавливаются молекулы H2O:
2H2O + 2ē →H2↑ + 2OH—
3.При электролизе растворов щелочей окисляются ионы OH—:
4OH— — 4ē → O2↑ +2H2O
4.При электролизе растворов кислот восстанавливаются катионы H+:
2H + + 2ē → H20↑
ЭЛЕКТРОЛИЗ РАСПЛАВОВ
Задание 1. Составьте схему электролиза расплава бромида натрия. (Алгоритм 1.)
Составьте схему электролиза расплава бромида натрия. (Алгоритм 1.)
Выполнение действий
1.Составить уравнение диссоциации соли
NaBr → Na+ + Br—
2.Показать перемещение ионов к соответствующим электродам
K— (катод): Na+,
A+ (анод): Br—
3.Составить схемы процессов окисления и восстановления
K—: Na+ + 1ē → Na0 (восстановление),
A+ : 2Br— — 2ē →Br20 (окисление).
4.Составить уравнение электролиза расплава соли
2NaBr = 2Na +Br2
Задание 2. Составьте схему электролиза расплава гидроксида натрия. (Алгоритм 2.)
Последовательность действийВыполнение действий
1.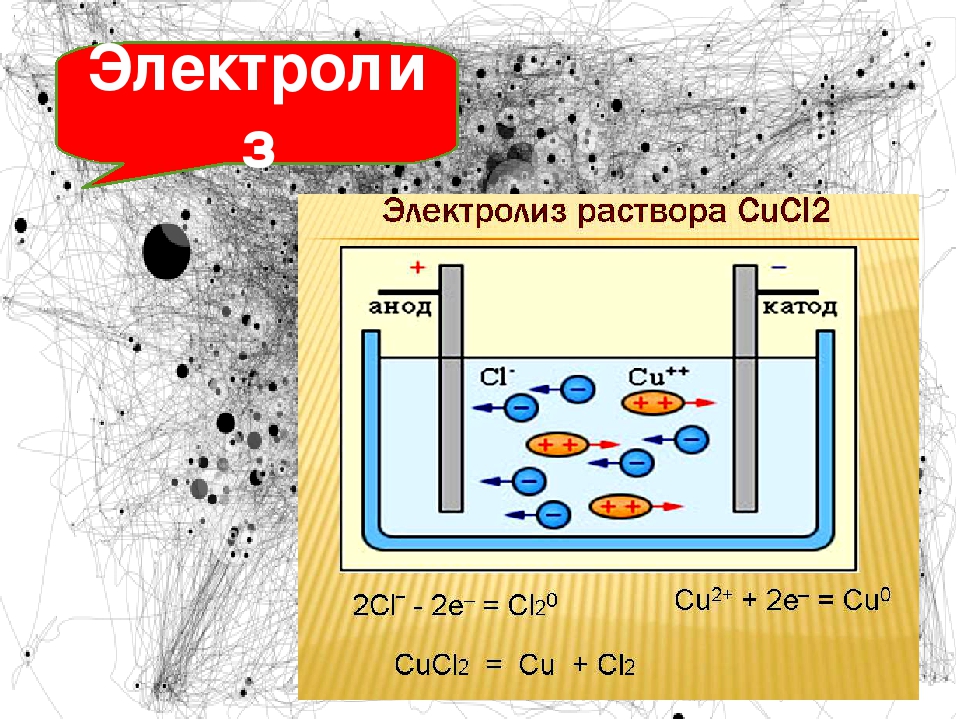 Составить уравнение диссоциации щёлочи
Составить уравнение диссоциации щёлочи
NaOH → Na+ + OH—
2.Показать перемещение ионов к соответствующим электродам
K—(катод): Na+,
A+ (анод): OH—.
3.Составить схемы процессов окисления и восстановления
K—: Na+ + 1ē → Na0 (восстановление),
A+: 4OH— — 4ē → 2H2O + O2↑ (окисление).
4.Составить уравнение электролиза расплава щёлочи
4NaOH = 4Na + 2H2O + O2↑
Задание 3. Составьте схему электролиза расплава сульфата натрия. (Алгоритм 3.)
Последовательность действийВыполнение действий
1.Составить уравнение диссоциации соли
Na2SO4 → 2Na+ + SO42-
2. Показать перемещение ионов к соответствующим электродам
Показать перемещение ионов к соответствующим электродам
K—(катод): Na+
A+(анод): SO42-
3.Составить схемы процессов восстановления и окисления
K—: Na+ + 1ē → Na0,
A+: 2SO42- — 4ē → 2SO3↑ + O2↑
4.Составить уравнение электролиза расплава соли
2Na2SO4 = 4Na + 2SO3↑ + O2↑
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Задание 1. Составить схему электролиза водного раствора хлорида натрия с использованием инертных электродов. (Алгоритм 1.)
Последовательность действийВыполнение действий
1.Составить уравнение диссоциации соли
NaCl → Na+ + Cl—
2. Выбрать ионы, которые будут разряжаться на электродах
Ионы натрия в растворе не восстанавливаются, поэтому идёт восстановление воды. Ионы хлора окисляются.
Ионы хлора окисляются.
3.Составить схемы процессов восстановления и окисления
K—: 2H2O + 2ē → H2↑ + 2OH—
A+: 2Cl— — 2ē → Cl2↑
4.Составить уравнение электролиза водного раствора соли
2NaCl + 2H2O = H2↑ + Cl2↑ + 2NaOH
Задание 2. Составить схему электролиза водного раствора сульфата меди (II) с использованием инертных электродов. (Алгоритм 2.)
Последовательность действийВыполнение действий
1.Составить уравнение диссоциации соли
CuSO4 → Cu2+ + SO42-
2. Выбрать ионы, которые будут разряжаться на электродах
На катоде восстанавливаются ионы меди. На аноде в водном растворе сульфат-ионы не окисляются, поэтому окисляется вода.
3.Составить схемы процессов восстановления и окисления
K—: Cu2+ + 2ē → Cu0
A+: 2H2O — 4ē → O2↑ +4H+
4. Составить уравнение электролиза водного раствора соли
Составить уравнение электролиза водного раствора соли
2CuSO4 +2H2O = 2Cu + O2↑ + 2H2SO4
Задание 3. Составить схему электролиза водного раствора водного раствора гидроксида натрия с использованием инертных электродов. (Алгоритм 3.)
Последовательность действийВыполнение действий
1.Составить уравнение диссоциации щёлочи
NaOH → Na+ + OH—
2. Выбрать ионы, которые будут разряжаться на электродах
Ионы натрия не могут восстанавливаться, поэтому на катоде идёт восстановление воды. На аноде окисляются гидроксид-ионы.
3.Составить схемы процессов восстановления и окисления
K—: 2H2O + 2ē → H2↑ + 2OH—
A+: 4OH— — 4ē → 2H2O + O2↑
4.Составить уравнение электролиза водного раствора щёлочи
2H2O = 2H2 ↑+ O2↑, т.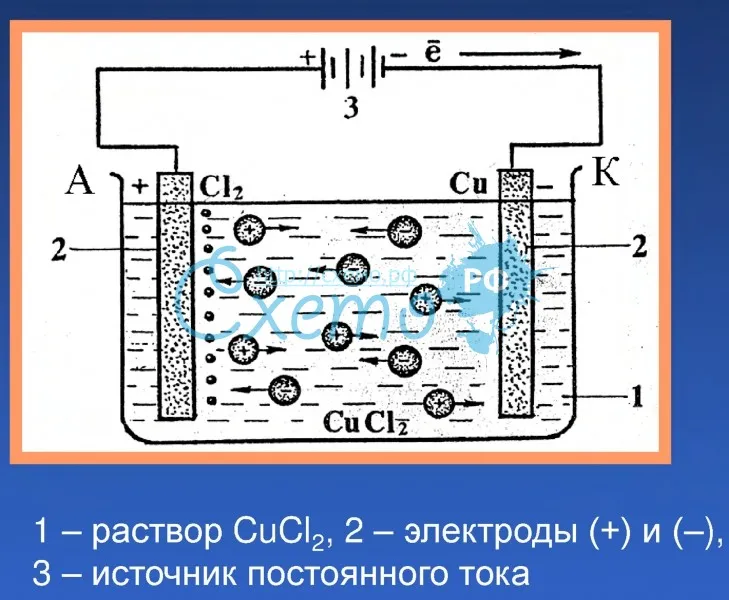 е. электролиз водного раствора щёлочи сводится к электролизу воды.
е. электролиз водного раствора щёлочи сводится к электролизу воды.
Запомнить. При электролизе кислородсодержащих кислот (H2SO4 и др.) , оснований (NaOH, Ca(OH)2 и др.), солей активных металлов и кислородсодержащих кислот (K2SO4 и др.) на электродах протекает электролиз воды: 2H2O = 2H2 ↑+ O2↑
Задание 4. Составить схему электролиза водного раствора нитрата серебра с использованием анода, изготовленного из серебра, т.е. анод – растворимый. (Алгоритм 4.)
Последовательность действийВыполнение действий
1.Составить уравнение диссоциации соли
AgNO3 → Ag+ + NO3—
2. Выбрать ионы, которые будут разряжаться на электродах
Выбрать ионы, которые будут разряжаться на электродах
На катоде восстанавливаются ионы серебра, серебряный анод растворяется.
3.Составить схемы процессов восстановления и окисления
K—: Ag+ + 1ē→ Ag0;
A+: Ag0 — 1ē→ Ag+
4.Составить уравнение электролиза водного раствора соли
Ag+ + Ag0 = Ag0 + Ag+ электролиз сводится к переносу серебра с анода на катод.
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
Катионы активных металловКатионы менее активных металлов
Катионы неактивных металлов
Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+
Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+
Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+
Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода
В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород)
Легко разряжаются, и восстанавливается только металл
Анионы кислородсодержащих кислот и фторид-ионГидроксид-ионы; анионы бескислородных кислот (кроме F−)
PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F−
OH−, Cl−, Br−, I−, S2−
Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода
Легко разряжаются
Получение неодима электролизом из расплавов
%PDF-1. 6
%
1 0 obj
>
endobj
5 0 obj /Title
>>
endobj
2 0 obj
>
/Encoding >
>>
>>
endobj
3 0 obj
>
endobj
4 0 obj
>
stream
6
%
1 0 obj
>
endobj
5 0 obj /Title
>>
endobj
2 0 obj
>
/Encoding >
>>
>>
endobj
3 0 obj
>
endobj
4 0 obj
>
stream
 Iˏ5;;;»PԛMUHg*Uu00g[email protected]]Pj-m|P@AP`VkK=cZIjL)i.T’)و$A0tb5,
Iˏ5;;;»PԛMUHg*Uu00g[email protected]]Pj-m|P@AP`VkK=cZIjL)i.T’)و$A0tb5,Электролитические ячейки — Химия LibreTexts
Гальванические элементы приводятся в действие спонтанной химической реакцией , которая производит электрический ток через внешнюю цепь. Эти элементы важны, потому что они являются основой для батарей, питающих современное общество. Но это не единственный вид электрохимической ячейки. В каждом случае обратная реакция не является спонтанной и требует для возникновения электрической энергии.
Введение
Общий вид реакции можно записать как:
\ [\ underset {\ longleftarrow \ text {Non spontaneous}} {\ overset {\ text {Spontaneous} \ longrightarrow} {\ text {Reactants} \ rightleftharpoons \ text {Products} + \ text {Электрическая энергия}}} \ ]
Можно построить ячейку, которая работает с химической системой, пропуская через систему электрический ток.Эти ячейки называются электролитическими ячейками . Электролитические элементы, как и гальванические элементы, состоят из двух полуэлементов: один — полуэлемент восстановления, другой — полуэлемент окисления. Однако направление потока электронов в электролитических ячейках может быть изменено на противоположное по сравнению с направлением спонтанного потока электронов в гальванических ячейках, но определение катода и анода остается прежним, где восстановление происходит на катоде, а окисление происходит на аноде. . Поскольку направления обеих полуреакций поменялись местами, изменился знак, но не величина потенциала клетки.
Электролитические элементы, как и гальванические элементы, состоят из двух полуэлементов: один — полуэлемент восстановления, другой — полуэлемент окисления. Однако направление потока электронов в электролитических ячейках может быть изменено на противоположное по сравнению с направлением спонтанного потока электронов в гальванических ячейках, но определение катода и анода остается прежним, где восстановление происходит на катоде, а окисление происходит на аноде. . Поскольку направления обеих полуреакций поменялись местами, изменился знак, но не величина потенциала клетки.
Электролитические элементы очень похожи на гальванические (гальванические) элементы в том смысле, что оба требуют солевого моста, оба имеют катодную и анодную стороны, и оба имеют постоянный поток электронов от анода к катоду. Однако между двумя ячейками есть и разительные различия. Основные отличия указаны ниже:
Рисунок \ (\ PageIndex {1} \): Электрохимические ячейки. Гальванический элемент (слева) преобразует энергию, выделяемую спонтанной окислительно-восстановительной реакцией, в электрическую энергию, которую можно использовать для выполнения работы.Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, которые соединены внешней электрической цепью; Кроме того, второе соединение, которое позволяет ионам перемещаться между отсеками (показано здесь вертикальной пунктирной линией, обозначающей пористый барьер), необходимо для поддержания электрической нейтральности. Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток.В электролитической ячейке (справа) внешний источник электроэнергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.
Гальванический элемент (слева) преобразует энергию, выделяемую спонтанной окислительно-восстановительной реакцией, в электрическую энергию, которую можно использовать для выполнения работы.Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, которые соединены внешней электрической цепью; Кроме того, второе соединение, которое позволяет ионам перемещаться между отсеками (показано здесь вертикальной пунктирной линией, обозначающей пористый барьер), необходимо для поддержания электрической нейтральности. Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток.В электролитической ячейке (справа) внешний источник электроэнергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.
| Электрохимический элемент (гальванический элемент) | Электролитическая ячейка |
|---|---|
| Гальванический элемент преобразует химическую энергию в электрическую. | Электролитическая ячейка преобразует электрическую энергию в химическую. |
| Здесь окислительно-восстановительная реакция является спонтанной и отвечает за производство электроэнергии. | Окислительно-восстановительная реакция не является спонтанной, и для ее инициирования необходимо подавать электрическую энергию.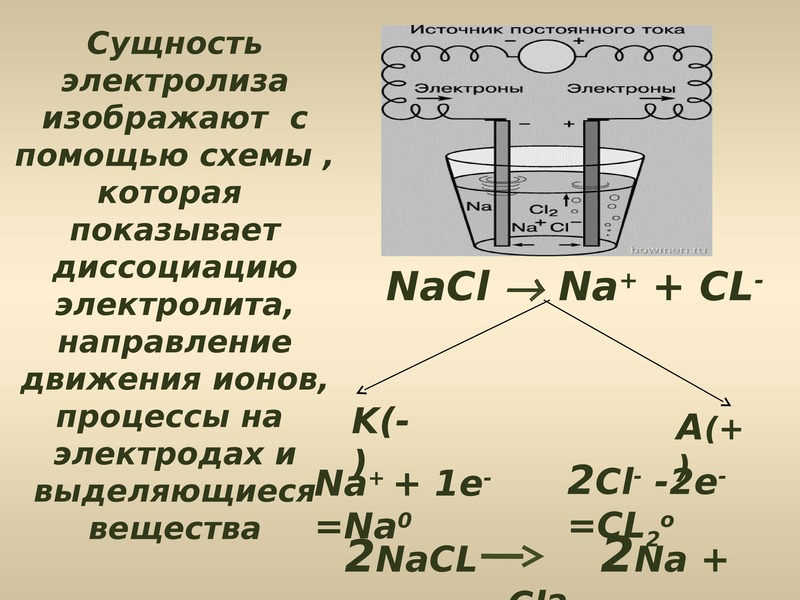 |
| Две полуячейки размещены в разных контейнерах, соединенных соляным мостиком или пористой перегородкой. | Оба электрода помещены в одну емкость в растворе расплавленного электролита. |
| Здесь анод отрицательный, а катод положительный. Реакция на аноде является окислительной, а на катоде — восстановительной. | Здесь анод положительный, а катод отрицательный. Реакция на аноде является окислительной, а на катоде — восстановительной. |
| Электроны поставляются окисляющимися частицами.Они перемещаются от анода к катоду во внешней цепи. | Внешняя батарея питает электроны. Они входят через катод и выходят через анод. |
Ячейки электролитические
Чтобы объяснить, что происходит в электролитической ячейке, давайте рассмотрим разложение расплавленного хлорида натрия на металлический натрий и газообразный хлор. Реакция написана ниже.
———> Несамопроизвольно (электролитическая ячейка) | ||||
2 Na Cl (л) | 2 Na (с) | + | Класс 2 (г) | |
<--------- Самопроизвольно (электрохимическая ячейка) | ||||
Если расплавленный \ (NaCl _ {(l)} \) поместить в контейнер и вставить инертные электроды \ (C _ {(s)} \), прикрепленные к положительной и отрицательной клеммам батареи, произойдет электролитическая реакция.- \]
Прогнозирование реакции электролиза
Есть четыре основных фактора, которые определяют, будет ли электролиз иметь место, даже если внешнее напряжение превышает расчетную величину:
- Перенапряжение или превышение напряжения иногда необходимо для преодоления взаимодействий на поверхности электрода.Чаще это случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, в то время как Pt (s) требует перенапряжения 0 В
- Может иметь место более одной электродной реакции, что означает, что может быть более одной полуреакции, оставляя две или более возможностей для реакции ячейки.
- Реагенты могут находиться в нестандартных условиях, что означает, что напряжение для полуэлементов может быть меньше или больше, чем количество в стандартных условиях.Например:
- Концентрация хлорид-иона = 5,5M, а не единица активности 1M. Это означает, что уменьшение хлорида = 1,31 В, а не 1,36 В
- Стандартное условие — иметь pH 4 в анодной полуячейке, но иногда в нестандартных состояниях pH может быть выше или ниже при изменении напряжения.
- Способность инертного электрода к электролизу зависит от реагентов в растворе электролита, в то время как активный электрод может работать сам по себе для проведения полуреакции окисления или восстановления.
Если учесть все четыре этих фактора, мы сможем успешно предсказать полуреакции электрода и общие реакции при электролизе.
Упражнение \ (\ PageIndex {1} \)
Предскажите электродные реакции и общую реакцию, если анод изготовлен из (а) меди и (б) платины.
Количественные аспекты электролиза
Майкл Фарадей обнаружил в 1833 году, что всегда существует простая взаимосвязь между количеством вещества, производимого или потребляемого на электроде во время электролиза, и количеством электрического заряда Q , который проходит через элемент.- \ rightarrow Ag \]
говорит нам, что когда 1 моль Ag + наносится на 1 моль Ag, с катода должен подаваться 1 моль e —. Поскольку отрицательный заряд одного электрона, как известно, составляет 1,6022 × 10 –19 Кл, мы можем умножить его на постоянную Авогадро, чтобы получить заряд на моль электронов. Эта величина называется Константа Фарадея , символ F :
.F = 1,6022 × 10 –19 C × 6,0221 × 10 23 моль –1 = 9.-} \) и \ (Q \).
Часто в экспериментах по электролизу измеряется электрический ток, а не количество электрического заряда. Поскольку кулонов определяется как количество заряда, которое проходит через фиксированную точку в электрической цепи, когда ток в один ампер течет в течение одной секунды, заряд в кулонах можно рассчитать, умножив измеренный ток (в амперах) на время (в секундах), в течение которого он течет:
\ [Q = It \]
В этом уравнении I представляет ток, а t представляет время.Если вы помните, что
кулон = 1 ампер × 1 секунда 1 C = 1 А с
можно настроить единицы времени для получения правильного результата. Теперь, когда мы можем предсказать полуреакции электрода и общие реакции при электролизе, также важно уметь рассчитывать количество потребляемых реагентов и произведенных продуктов. Для этих расчетов мы будем использовать постоянную Фарадея:
1 моль электрона = 96,485 C
заряд ( C ) = ток ( C / с ) x время (с)
( Кл / с ) = 1 кулон заряда в секунду = 1 ампер ( A )
Простое преобразование для любого типа задач:
- Преобразование любого заданного времени в секунды
- Возьмите заданный ток ( A ) в секундах, [1 c = (A) / (s)]
- Наконец, используйте стехиометрическое преобразование 1 моль электрона = 96 485 ° C (постоянная Фарадея)
Пример \ (\ PageIndex {1} \)
Электролиз растворенного образца брома можно использовать для определения количества брома в образце.- \]. Какую массу брома можно отложить за 3 часа при токе 1,18 А?
Решение :
3,00 часа x 60 мин / час x 60 сек / 1 мин x 1,18 C (A) /1 сек x 1 моль — / 96,485 C
= 0,132 моль —
Проблемы
1) Предскажите продукты электролиза, заполнив график:
Cl —, Br —, I —, H + , OH —, Cu 2+ , Pb 2+ , Ag +, K + , Na + ,
2) Рассчитайте количество электрического заряда, необходимого для пластины 1.386 моль Cr из кислого раствора K 2 Cr 2 O 7 согласно полууравнению
H 2 Cr 2 O 7 ( водн. ) + 12H + ( водн. ) + 12 e — → 2Cr ( s ) + 7 H 2 ( л )
3) Пероксид водорода, H 2 O 2 , может быть получен электролизом холодной концентрированной серной кислоты. Реакция на аноде
2H 2 SO 4 → H 2 S 2 O 8 + 2H + + 2 e —
Когда полученная пероксидисерная кислота, H 2 S 2 O 8 , кипятится при пониженном давлении, она разлагается:
2H 2 O + H 2 S 2 O 8 → 2H 2 SO 4 + H 2 O 2
Рассчитайте массу перекиси водорода, образовавшейся при токе 0.893 потока за 1 час.
4) Электролиз растворенного образца холрида можно использовать для определения количества хлорида в образце. На катоде полуреакция восстановления составляет Cl 2 + (водн.) + 2 e — -> 2 Cl — . Какую массу хлорида можно отложить за 6,25 часа током 1,11 А?
5) В электролитической ячейке электрод, на котором электроны входят в раствор, называется ______; химическое изменение, которое происходит на этом электроде, называется _______.
- анод, оксидирование
- анод редукционный
- катод, окисление
- катод, редукционный
- не может сказать, если мы не знаем, какие виды окисляются и восстанавливаются.
6) Как долго (в часах) должен поддерживаться ток 5,0 ампер на гальванической пластине 60 г кальция из расплавленного CaCl 2 ?
- 27 часов
- 8,3 часа
- 11 часов
- 16 часов
- 5.9 часов
- 7) Сколько времени в часах потребуется для гальванического нанесения 78 г платины из раствора [PtCl 6 ] 2 — при среднем токе 10 ампер при КПД электрода 80%?
- 8,4
- 5,4
- 16,8
- 11,2
- 12,4
8) Сколько фарадеев необходимо, чтобы восстановить 1,00 г алюминия (III) до металлического алюминия?
- 1.00
- 1,50
- 3,00
- 0,111
- 0,250
9) Найдите стандартный потенциал ячейки для электрохимической ячейки с помощью следующей реакции ячейки.
Zn (тв.) + Cu 2+ (водн.) → Zn 2+ (водн.) + Cu (т.)
ответов
1) . Cl — хлор H + водород
Cl — хлор Cu 2+ медь
I — йод H + водород
2) 12 моль e — требуется для получения 2 моль Cr, что дает нам стехиометрическое соотношение S ( e — / Cr).Затем можно использовать постоянную Фарадея для определения количества заряда.
n Cr n e — Q
Q = 1,386 моль Cr × × = 8,024 × 10 5 C
3) Произведение тока и времени дает нам количество электричества, Q . Зная это, мы легко вычисляем количество электронов: n e -. Затем из первого полууравнения мы можем найти количество пероксидисерной кислоты, а второе приводит к n h3O2 и, наконец, к m h3O2 .
= 05666 × г H 2 O 2 = 0,5666 г H 2 O 2
4) 0,259 моль —
5) д
6) д
7) б
8) д
9) Напишите полуреакции для каждого процесса.
Zn (s) → Zn 2+ (водн.) + 2 e —
Cu 2+ (водн.) + 2 e — → Cu (s)
Найдите стандартные потенциалы полуреакции восстановления.
E o восстановление Cu2 + = + 0,339 В
E o восстановление Zn2 + = — 0,762 В
Определите общий потенциал стандартной ячейки.
E o ячейка = + 1,101 V
Список литературы
- Петруччи и др. Общая химия: принципы и современные приложения. 9 изд. Река Аппер Сэдл, Нью-Джерси: Пирсон / Прентис Холл, 2007.
- Кольбе, Германн. Электролиз органических соединений.Эдинбург: Э. и С. Ливингстон, 1947.
- Стюарт, A.T. «Электролиз воды». Производство водорода 2001 13 мая
- Также все упомянутые «внешние ссылки».
Авторы и авторство
- Jasmine Briones, Калифорнийский университет в Дэвисе 2012
16.7 Электролиз — использование электричества для химии
До сих пор мы обсуждали, как можно производить электричество в результате химических реакций в батареях.Вместо этого некоторые реакции будут использовать электричество, чтобы вызвать реакцию. В этих реакциях реагентам передается электрическая энергия, заставляя их реагировать с образованием продуктов. Эти реакции имеют множество применений. Например, электролиз — это процесс, при котором электричество пропускается через жидкость или раствор, чтобы вызвать реакцию. Реакции электролиза не начнутся, если в систему не будет подана энергия извне. В случае реакций электролиза энергия вырабатывается аккумулятором.Думайте об электролизе и электролитических ячейках как о противоположности электрохимических ячеек:
Ячейки электрохимические | Ячейки электролитические | |
|---|---|---|
| Преобразование энергии | Химический → Электрический | Электрический → Химический |
| Самопроизвольная химическая реакция? | Есть | № |
| Значение E ° | Положительно | отрицательный |
В электрохимической ячейке спонтанная окислительно-восстановительная реакция используется для создания электрического тока; в электролитической ячейке произойдет обратное — потребуется электрический ток, чтобы вызвать несамопроизвольную химическую реакцию.Мы рассмотрим три примера электролитического процесса, сохраняя наше обсуждение на самом базовом уровне: электролиз расплавленного хлорида натрия, электролиз воды и гальваника.
Рисунок 16.7.1: Через воду проходит электрический ток, который расщепляет воду на водород и кислород.Если электроды, подключенные к клеммам батареи, поместить в жидкий хлорид натрия, ионы натрия будут перемещаться к отрицательному электроду и уменьшаться, в то время как ионы хлора перемещаются к положительному электроду и окисляются.-} \ rightarrow 2 \ ce {Na} + \ ce {Cl_2} \]
При соответствующей обработке аккумуляторной батареи можно добиться прочного прилипания восстанавливаемого в процессе электролиза металла к электроду. Использование электролиза для покрытия одного материала слоем металла называется гальваника . Обычно гальваникой покрывают дешевый металл слоем более дорогого и привлекательного металла. Многие покупают украшения, покрытые золотом. Иногда гальваника используется для получения металла с поверхности, который лучше проводит электричество.Если вы хотите иметь поверхностные свойства золота (привлекательный, коррозионно-стойкий или хороший проводник), но не хотите, чтобы изготовление целого объекта из чистого золота обходилось слишком дорого, ответ может заключаться в использовании дешевого металла. чтобы сделать объект, а затем гальванизировать тонкий слой золота на поверхности.
Рисунок 16.7.2: Серебряное покрытие.Для серебряной пластины такой предмет, как ложка (посуда с покрытием дешевле, чем чистое серебро), ложку помещают на место катода в установке для электролиза с раствором нитрата серебра.При включении тока ионы серебра мигрируют через раствор, касаются катода (ложки) и прилипают к нему. При наличии достаточного количества времени и осторожности всю ложку можно покрыть слоем серебра. Анодом для этой операции часто будет большой кусок серебра, из которого ионы серебра будут окисляться, и эти ионы попадут в раствор. Это способ обеспечить стабильную подачу ионов серебра для процесса гальваники.
- Половина реакции на катоде:
\ [\ ce {Ag ^ +} + \ ce {e ^ -} \ rightarrow \ ce {Ag} \]
- Полуреакция на аноде:
\ [\ ce {Ag} \ rightarrow \ ce {Ag ^ +} + \ ce {e ^ -} \]
Некоторый процент проданных золотых и серебряных украшений гальванизирован.Точки подключения в электрических переключателях часто покрываются золотом для улучшения электропроводности, а большинство хромированных деталей в автомобилях хромированы.
Электролиз расплавленного хлорида натрия
Если мы посмотрим на латинские корни слова «электролиз», мы узнаем, что оно означает, по сути, «разрушение» ( лизис ) с помощью электричества. В нашем первом примере электролитической ячейки будет рассмотрено, как можно использовать электрический ток для разделения ионного соединения на его элементы.Следующее уравнение представляет собой распад NaCl ( л ) :
2NaCl ( л ) → 2Na ( л ) + Cl 2 (г)
В этом процессе участвуют следующие полуреакции:
E ° | |||
| уменьшение | 2Na + (л) + 2e — → Na (с) | -2.71 В | |
| окисление | Класс — (л) → Класс 2 (г) + 2 e — | -1,36 В | |
Требуемое сетевое напряжение | — 4.07V | ||
Обратите внимание, что при сложении полуреакций получается отрицательное напряжение (-4,07 В). Это говорит нам о том, что общая реакция будет НЕ спонтанной, и для того, чтобы эта реакция произошла, потребуется минимум 4,07 вольт.
Как мы увидим, наша установка будет во многом похожа на наши электрохимические ячейки. Нам потребуются электроды и электролит для протекания электрического тока.
В нашем примере с NaCl электроды просто пропускают ток, но в противном случае они не будут напрямую участвовать в реакции.Электролитом будет фактический расплавленный (расплавленный) NaCl. Электроды и электролит должны пропускать электрический ток. Необходимо использовать расплавленный NaCl, поскольку твердые ионные соединения не несут электрический заряд.
Некоторые ключевые отличия от устройства электрохимической ячейки:
- Две половинные реакции не разделены солевым мостиком.
- Потребуется электрохимический элемент (или другой источник электрического тока).
Другие важные примечания:
- Анод электролитической ячейки является местом окисления, а катод — местом восстановления, как и в электрохимической ячейке.
- В электрохимической ячейке анод отрицательный, а катод положительный, но в электролитической ячейке все наоборот — анод положительный, а катод отрицательный.
Внимательно изучите схему нашей установки, уделяя особое внимание отслеживанию пути электронов. Пока электроны не совершат полный цикл, реакция не произойдет.
- Электроны «производятся» в батарее на аноде, в месте окисления.
- Электроны покидают электрохимическую ячейку через внешнюю цепь.
- Эти отрицательные электроны создают в электролитической ячейке отрицательный электрод, который притягивает положительные ионы Na + в электролите. Ионы Na + соединяются со свободными электронами и восстанавливаются (2Na + + 2e — → Na).
- Между тем, отрицательный Cl — притягивается к положительному электроду электролитической ячейки. На этом электроде хлор окисляется, высвобождая электроны (Cl — → Cl 2 + 2 e — ).
- Эти электроны проходят через внешнюю цепь, возвращаясь в электрохимическую ячейку.
Электролиз воды
Наш второй пример электролиза и электролитических ячеек связан с разложением воды. Мы обнаружим ситуацию, очень похожую на электролиз расплавленного NaCl. Следующее уравнение представляет разделение H 2 O ( l ) :
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
Может быть труднее предсказать вовлеченные полуреакции, но они:
E ° | |||
| уменьшение | 2H 2 O ( л ) + 2e — → H 2 + 2 OH — | -0.83 В | |
| окисление | 2H 2 O ( л ) → O 2 + 4H + + 4e — | -1,23 В | |
| (см. Примечание ниже для чистого уравнения) | |||
Требуемое сетевое напряжение | — 2.06V | ||
Настройка будет очень похожа на наш последний пример с некоторыми небольшими отличиями. Вода плохо переносит заряд, поэтому в воду добавляется электролит. Можно использовать уксус или слабую кислоту (уксусную кислоту). Для сбора образовавшихся газов водорода и кислорода часто добавляют перевернутые пробирки, как показано на схеме ниже.
Опять же, внимательно следите за траекторией электронов. Пока электроны не совершат полный цикл, реакция не произойдет.
2H 2 O ( л ) + 2e — → H 2 ( г ) + 2 OH — (водн.)
2H 2 O ( л ) → O 2 (г) + 4H + (водн.) + 4e —
- Электроны «производятся» в батарее на аноде, в месте окисления.
- Электроны покидают электрохимическую ячейку через внешнюю цепь.
- Эти отрицательные электроны создают в электролитической ячейке отрицательный электрод, который вызывает уменьшение содержания воды.
Обратите внимание, что область вокруг этого электрода станет основной по мере образования ионов OH — .
- Тем временем вода положительного электрода будет окисляться.
- Электроны, образующиеся в процессе окисления, возвращаются в электрохимическую ячейку.
Примечание к вычисленному уравнению электролиза воды:
Из полуреакций вы можете заметить, что сложение уравнений изначально не дает нам нашего чистого уравнения:
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
После того, как вы уравновесите количество электронов (умножьте уравнение редукции на 2), вы обнаружите, что в сумме уравнения фактически составляют:
6H 2 O ( л ) → 2H 2 ( г ) + O 2 (г) + 4H + (водный) + 4 OH — (водный )
Ионы водорода и гидроксида объединятся с образованием 4 моль H 2 O ( l ) .Определение нашего чистого количества H 2 O ( л ) вовлеченного дает нам окончательное уравнение:
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
Сводка
- Электрохимические ячейки состоят из анода и катода в двух отдельных растворах. Эти растворы соединены солевым мостиком и токопроводящим проводом.
- Электрический ток состоит из потока заряженных частиц.
- Электрод, на котором происходит окисление, называется анодом, а электрод, на котором происходит восстановление, называется катодом.
- При нанесении гальванических покрытий объект, который нужно покрыть, делают катодом.
Словарь
- Электрохимический элемент — Расположение электродов и ионных растворов, в котором окислительно-восстановительная реакция используется для выработки электричества (также известного как батарея).
- Электролиз — Химическая реакция, вызываемая электрическим током.
- Гальваника — Процесс, в котором электролиз используется как средство покрытия объекта слоем металла.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Производство водорода: электролиз | Министерство энергетики
Как это работает?
Подобно топливным элементам, электролизеры состоят из анода и катода, разделенных электролитом. Различные электролизеры работают по-разному, в основном из-за разного типа материала электролита и ионных частиц, которые он проводит.
Мембранные электролизеры с полимерным электролитом
В электролизере с мембраной с полимерным электролитом (PEM) электролит представляет собой твердый специальный пластик.
- Вода реагирует на аноде с образованием кислорода и положительно заряженных ионов водорода (протонов).
- Электроны проходят через внешнюю цепь, а ионы водорода избирательно перемещаются через PEM к катоду.
- На катоде ионы водорода объединяются с электронами из внешней цепи с образованием газообразного водорода. Анодная реакция: 2H 2 O → O 2 + 4H + + 4e — Катодная реакция: 4H + + 4e — → 2H 2
Электролизеры щелочные
Щелочные электролизеры работают за счет переноса гидроксид-ионов (OH — ) через электролит от катода к аноду с образованием водорода на катодной стороне.Электролизеры, использующие жидкий щелочной раствор гидроксида натрия или калия в качестве электролита, коммерчески доступны в течение многих лет. Новые подходы, использующие твердые щелочно-обменные мембраны (AEM) в качестве электролита, перспективны в лабораторных условиях.
Электролизеры на твердом оксиде
Твердооксидные электролизеры, в которых в качестве электролита используется твердый керамический материал, который избирательно проводит отрицательно заряженные ионы кислорода (O 2-) при повышенных температурах, вырабатывают водород несколько иначе.
- Пар на катоде соединяется с электронами из внешней цепи с образованием газообразного водорода и отрицательно заряженных ионов кислорода.
- Ионы кислорода проходят через твердую керамическую мембрану и реагируют на аноде с образованием газообразного кислорода и генерации электронов для внешнего контура.
Твердооксидные электролизеры должны работать при температурах, достаточно высоких для того, чтобы твердооксидные мембраны функционировали должным образом (около 700-800 ° C, по сравнению с электролизерами PEM, которые работают при 70-90 ° C, и коммерческими щелочными электролизерами, которые обычно работать при температуре ниже 100 ° C).Усовершенствованные лабораторные твердооксидные электролизеры на основе протонпроводящих керамических электролитов обещают снизить рабочую температуру до 500–600 ° C. Электролизеры на твердом оксиде могут эффективно использовать тепло, доступное при этих повышенных температурах (из различных источников, включая ядерную энергию), для уменьшения количества электроэнергии, необходимой для производства водорода из воды.
Почему рассматривается этот путь?
Электролиз — это ведущий способ производства водорода для достижения цели Hydrogen Energy Earthshot по снижению стоимости чистого водорода на 80% до 1 доллара за 1 килограмм за 1 десятилетие («11 11»).Водород, произведенный посредством электролиза, может привести к нулевым выбросам парниковых газов, в зависимости от источника используемой электроэнергии. Источник необходимой электроэнергии, включая ее стоимость и эффективность, а также выбросы в результате производства электроэнергии, необходимо учитывать при оценке выгод и экономической целесообразности производства водорода с помощью электролиза. Во многих регионах страны сегодняшняя электросеть не идеальна для обеспечения электроэнергией, необходимой для электролиза, из-за выделяемых парниковых газов и количества топлива, необходимого из-за низкой эффективности процесса производства электроэнергии.Производство водорода посредством электролиза используется для возобновляемых источников энергии (ветровой, солнечной, гидро-, геотермальной) и ядерной энергии. Эти способы производства водорода приводят к практически нулевым выбросам парниковых газов и загрязняющих веществ; тем не менее, необходимо значительно снизить производственные затраты, чтобы быть конкурентоспособными с более зрелыми углеродными технологиями, такими как риформинг природного газа.
Потенциал для синергизма с производством электроэнергии из возобновляемых источников
Производство водорода посредством электролиза может предложить возможности для синергизма с динамическим и прерывистым производством электроэнергии, что характерно для некоторых технологий возобновляемой энергетики.Например, несмотря на то, что стоимость энергии ветра продолжает падать, присущая ветру изменчивость является препятствием для эффективного использования энергии ветра. Водородное топливо и производство электроэнергии могут быть интегрированы в ветряную электростанцию, что позволит гибко менять производство, чтобы наилучшим образом согласовать доступность ресурсов с эксплуатационными потребностями системы и рыночными факторами. Кроме того, во время избыточного производства электроэнергии ветряными электростанциями вместо того, чтобы сокращать потребление электроэнергии, как это обычно делается, можно использовать это избыточное электричество для производства водорода путем электролиза.
Важно отметить …
- Сегодняшняя электросеть не является идеальным источником электроэнергии для электролиза, поскольку большая часть электроэнергии вырабатывается с использованием технологий, которые приводят к выбросам парниковых газов и являются энергоемкими. Производство электроэнергии с использованием технологий возобновляемой или ядерной энергии, либо отдельно от сети, либо как растущая часть сети, является возможным вариантом преодоления этих ограничений для производства водорода посредством электролиза.
- Министерство энергетики США и другие продолжают усилия по снижению стоимости производства электроэнергии на основе возобновляемых источников и развитию более эффективного производства электроэнергии на основе ископаемого топлива с улавливанием, использованием и хранением углерода. Например, производство ветровой электроэнергии быстро растет в Соединенных Штатах и во всем мире.
Исследования направлены на преодоление трудностей
- Выполнение целевого показателя затрат на чистый водород Hydrogen Shot в размере 1 долл. США / кг H 2 к 2030 году (и промежуточного целевого показателя в размере 2 долл. США / кг H 2 к 2025 г.) за счет лучшего понимания компромиссов производительности, стоимости и долговечности электролизера системы в прогнозируемых будущих динамических режимах работы, использующие электроэнергию без CO 2 .
- Уменьшение капитальных затрат на электролизер и баланс системы.
- Повышение энергоэффективности преобразования электроэнергии в водород в широком диапазоне рабочих условий.
- Повышение уровня понимания процессов деградации электролизных ячеек и батарей и разработка стратегий смягчения последствий для увеличения срока эксплуатации.
Эксперимент по электролизу воды — разделение воды
Электролиз — это процесс, при котором электрический ток пропускается через вещество, чтобы повлиять на химическое изменение.Химическое изменение происходит, когда вещество теряет электроны (окисление) или приобретает их (восстановление). В двух экспериментах, перечисленных ниже, первое реактивное вещество — вода, а второе — раствор сульфата меди.
Электролиз используется для удаления волос, секущихся соединений, а также в процессе производства для украшения, укрепления и повышения устойчивости металлических поверхностей к ржавчине.
>> Посмотрите это видео, чтобы увидеть гальваническое покрытие медного ключа >>
Эксперимент по электролизу воды и эксперимент по нанесению гальванических покрытий
Электролиз: разделение водыДля этого эксперимента вы можете собрать свои собственные принадлежности или купить полный комплект для электролиза воды.
Требуется наблюдение взрослых.
Что вам понадобится:
Чем вы занимаетесь:
1. Наполните химический стакан или стакан теплой водой.
2. Осторожно снимите ластики и металлические втулки, чтобы можно было заточить оба конца каждого карандаша. Эти карандаши — ваши электроды . Графит в них проводит электричество, но не растворяется в воде.
3. Отрежьте кусок картона, чтобы он поместился над стаканом, затем проделайте два отверстия в центре картона на расстоянии примерно дюйма друг от друга.Просуньте карандаши в отверстия и вставьте их в стакан. Они должны заходить в воду, но не касаться дна стакана. Картон удержит их на месте.
4. Подсоедините каждый карандаш к батарее с помощью зажима типа «крокодил», прикрепленного к оголенному графиту (грифель карандаша). Если у вас нет проводов с зажимом типа «крокодил», используйте два куска провода и снимите по 2,5 сантиметра изоляции с каждого конца. Оберните провод вокруг графита каждого карандаша и подключите провода к батарее. Возможно, вам понадобится скотч, чтобы закрепить провода на месте.
Что случилось:
Как только вы подключите провода к батарее, вы увидите пузырьки, появляющиеся вокруг каждого кончика карандаша в воде и плавающие вверх. Эти пузырьки являются компонентами воды — газообразным водородом и кислородом, — которые были разделены электричеством, когда оно перемещалось через воду от одного карандаша к другому. Карандаш, прикрепленный к отрицательной клемме батареи, собирает газообразный водород, а карандаш, подключенный к положительной клемме, собирает кислород.Один карандаш набирает больше пузырей, чем другой? Который из? Как вы думаете, почему это так?
(Подсказка: химическое название воды H 2 O, потому что на каждый атом кислорода приходится два атома водорода.)
Дальнейшие эксперименты:
- Попробуйте добавить электролит в воду в стакане. Вода сама по себе не так хорошо проводит электричество, но любой эксперимент с электролизом воды можно ускорить, добавив в воду поваренную соль. Когда это будет сделано, вы должны увидеть изменение скорости образования пузырьков.
Примечание по безопасности : при использовании соли может образовываться небольшое количество газообразного хлора, подобное количеству, присутствующему при использовании отбеливателя.
- Попробуйте разные типы батарей. Можно ли добиться электролиза с 1,5-вольтовой батареей? А если добавить электролит?
- С помощью настоящего электролизного оборудования вы можете собрать два газа в пробирки, чтобы измерить их количество и проверить их различные реакции на пламя.
- Чтобы электролиз работал как истинно возобновляемая энергия, вам необходимо использовать чистый источник энергии для запуска реакции.Проведите этот эксперимент с электролизом снова, используя солнечные элементы вместо батареи.
Гальваника использует форму электролиза, при которой электроды (проводники, обычно металлические) погружаются в раствор электролита и держатся отдельно друг от друга. Затем, используя постоянный ток в качестве источника питания, один из электродов покрывается металлом другого. Гальваникой пользуются ювелиры и производители посуды. Профессиональное гальваническое покрытие требует специальных химикатов и оборудования для создания высококачественного покрытия, но в этом эксперименте с электролизом вы можете попробовать свои силы в простой процедуре, которая позволит перенести медь на латунный ключ.
Требуется присмотр взрослых и оборудование для химической безопасности.
>> Посмотрите видео о нашем проекте, чтобы увидеть этот проект в действии!
Что вам понадобится:
Чем вы занимаетесь:
1. Подготовьте ключ к покрытию медью, очистив его зубной пастой или водой с мылом. Вытрите бумажным полотенцем.
2. Размешайте сульфат меди в стакане с горячей водой до тех пор, пока он не перестанет растворяться. Ваш раствор должен быть темно-синим. Дать остыть.
3.Используйте один зажим «крокодил», чтобы прикрепить медный электрод к положительной клемме батареи (теперь это анод ), а другой — для прикрепления ключа к отрицательной клемме (теперь она называется катодом ).
4. Частично подвесьте ключ в растворе, свободно обернув проволоку вокруг карандаша и поместив карандаш поперек горловины стакана. Зажим «крокодил» не должен касаться раствора.
5. Поместите медную полоску в раствор, убедившись, что она не касается ключа, а уровень раствора ниже зажима из крокодиловой кожи.Теперь электрическая цепь сформирована и течет ток.
6. Оставьте цепь работать на 20–30 минут или пока вы не будете довольны количеством меди на ключе.
Что случилось:
Раствор сульфата меди — это электролит, проводящий электричество от одного электрода к другому. При протекании тока на медном аноде происходит окисление (потеря электронов), в результате чего в раствор добавляются ионы меди. Эти ионы перемещаются по электрическому току к катоду, где происходит уменьшение (усиление электронов), нанося ионы меди на ключ.Ионы меди уже присутствовали в растворе сульфата меди до того, как вы начали, но реакция окисления на аноде продолжала заменять их в растворе, поскольку они были нанесены на ключ, поддерживая реакцию.
Этот проект имеет множество переменных, включая чистоту и гладкость ключа, прочность раствора сульфата меди и силу тока. Если на ключе начинает образовываться черная, похожая на сажу субстанция, значит, вашего раствора недостаточно для протекания тока.Выньте электроды и добавьте еще медного купороса. Когда вы вставляете их обратно, убедитесь, что анод и катод находятся как можно дальше друг от друга.
Есть много проектов, которые вы можете сделать с помощью гальваники! Одна интересная идея — использовать плоский кусок латуни в качестве катода и нарисовать на нем рисунок маркером на масляной основе. Медь не склеится там, где находится маркер. После нанесения покрытия вы можете использовать ацетон (или жидкость для снятия лака), чтобы стереть маркер, оставив рисунок латуни, проступающий сквозь медь.Если хотите, можете использовать немного полироли для металла, чтобы сделать медь блестящей.
Вы можете попробовать этот простой эксперимент с медным покрытием, в котором не используется электролиз и требуются только бытовые материалы.
Проекты в области возобновляемых источников энергии:Введение в электролиз путем электролиза расплавленных соединений
Экспериментальная
Одним из распространенных соединений для электролиза расплава является бромид свинца (II) — отчасти потому, что продукты легко видны, а отчасти потому, что его температура плавления не слишком высока.Экспериментальная установка будет выглядеть примерно так:
Ничего не происходит, пока бромид свинца (II) не расплавится.
Когда она тает, лампа загорается, показывая, что течет ток, и на положительном электроде (аноде) видны пузырьки коричневого газа.
На катоде вроде ничего не происходит, но потом, когда прибор разбирают, под катодом обнаруживается бусинка серебристого металла.
Что происходит?
Ничего не происходит, пока соединение не расплавится, потому что ионы не могут двигаться.
На катоде
Положительные ионы движутся к катоду (отрицательному электроду). Попадая туда, они собирают электроны с электрода и образуют нейтральные атомы.
Например, электролиз расплавленного бромида свинца (II) дает свинец на катоде:
Или, если вы подвергали электролизу расплавленный хлорид натрия:
Обратите внимание, что усиление электронов на катоде означает, что здесь происходит восстановление.Помните НЕФТЯНУЮ БУРОВКУ — уменьшение — это увеличение количества электронов.
На аноде
Отрицательные ионы притягиваются к положительному аноду и разряжаются за счет потери электронов. Например, в двух приведенных выше случаях вы получите хлор или бром.
Вы также можете отобразить эти уравнения как:
Потеря электронов означает, что на аноде происходит окисление.Помните OIL RIG — окисление — это потеря электронов.
Почему во внешней цепи течет ток?
Важно понимать, что в расплаве движутся ионы, тогда как в контуре движутся электроны.
Самый простой способ представить источник энергии — это электронный насос. Для каждого разряженного иона Pb 2+ два электрона удаляются с катода. На каждые два разряженных иона Br — два электрона осаждаются на аноде.
Вы можете думать об источнике энергии как о накачивании электронов по проводам, чтобы заполнить промежутки, появляющиеся в катоде, и в то же время откачивая новые электроны, высвобождающиеся на аноде.
Куда бы вы сейчас хотели пойти?
В меню «Электролиз». . .
В меню «Неорганическая химия». . .
В главное меню. . .
Наука ожила: химия / эксперименты
Характеристики электролизера
Электролизная ячейка часто используется в химии для получать химические вещества из других обычных химикатов. Хорошо известный пример — это электролиз поваренной соли с получением гидроксида натрия и хлора газ. Домашние химики также применяют электролиз хлорида натрия для получения хлоратные соли.Хорошее описание этого процесса дано на сайт Воутера Виссера. Нет необходимости снова вдаваться в подробности этого процесса.
На этой странице проводится более теоретический эксперимент. чтобы лучше понять свойства электролизера. Из с электрической точки зрения электролизер можно рассматривать как нелинейный резистор.
В этом эксперименте электролизная ячейка сделана из хорошо определенные свойства и ток определяется как функция напряжения.
Из этой характеристики некоторые другие интересные свойства можно вывести.
Необходимый химикаты:
Необходимый оборудование:
стакан, 200 мл
регулируемый блок питания
графитовые стержни
вольтметр
амперметр
Безопасность:
В этом эксперименте небольшой выделяется количество газообразного хлора.Когда разрешен только электролиз. запустить для считывания напряжений и токов, тогда реальной проблемы нет, но электролиз не должен продолжаться в течение более длительного времени, когда он выполняется внутри.
Используемый блок питания должен иметь встроенное ограничение тока. Не используйте автомобильный аккумулятор для этих эксперименты. Эти батареи могут производить огромное количество тока, если короткое замыкание или если электролиз проводится при полном напряжении 12 В.
Выбытие:
Установка, использованная в эксперименте
Натрий хлорид взвешивается. Для этого эксперимента было использовано 33 грамма. Эта сумма довольно произвольно, он должен быть таким, чтобы он растворялся без проблем примерно через 150 мл воды.
Берется объем 150 мл воды. Соль и вода помещаются в стакан, и вся соль растворяется.Это дает прозрачный и бесцветный решение.
Схема построена согласно следующей схеме. это Важно, чтобы вольтметр был подключен непосредственно параллельно к электролизер. Никаких потерь в проводах и внутреннем сопротивлении амперметра в этом случае не будет. влияют на измерения. Амперметр может быть интегрирован с использованной мощностью питания, или это может быть отдельный счетчик.
Источник питания постоянного тока должен быть регулируемым и иметь возможность обеспечения максимального выходного тока 5А или чего-то в этом роде.
На следующем рисунке показана реальная установка. Желтые провода зажимами типа «крокодил» подключаются к блоку питания со встроенным током метр. Напряжение измеряется над двумя графитовыми электродами, чтобы гарантировать, что напряжение на проводах и разъемах не влияет на измеренное напряжение на ячейке.
Графитовые стержни, использованные в этом эксперименте, представляют собой стержни из большой аккумулятор, диаметром 8 мм и погруженный в жидкость на 6 см.В общая площадь контакта между графитовыми стержнями и солевым раствором составляет примерно 15 см. Расстояние между стержнями примерно 6 см. Графитовые стержни обрабатываются льняным маслом, чтобы уменьшить их эрозию.
На картинке показан электролизер в действии. Пузыри и пена на поверхности хорошо видна на картинке.
Результаты экспериментов
Эксперимент проводился путем увеличения напряжения источник питания.Для определенной настройки как напряжение на ячейке, так и ток, протекающий через ячейку, был измерен. Значит, не блок питания напряжение было записано, но фактическое напряжение на ячейке.
Ниже приведены некоторые результаты измерений:
| Напряжение на ячейке (вольт) | Ток через ячейку (амперы) |
| 2,9 | 0,03 |
| 4.0 | 0,44 |
| 4,3 | 0,62 |
| 4,4 | 0,69 |
| 4,8 | 1,0 |
| 5,0 | 1,2 |
| 5,3 | 1,4 |
| 6,2 | 2,5 |
| 7,2 | 4.1 |
Результаты заносятся в график. Это было нарисовано от руки и Кривая построена по точкам измеренных данных. Кривая показывает, что характеристика такой ячейки сильно нелинейна. При низких напряжениях (менее 3 вольт), ток через элемент практически не проходит. При высоких напряжениях ток становится очень высоким.
Аналогичный эксперимент был проведен с погруженными электродами. всего 3 см в жидкости.Еще один эксперимент был проведен с расстоянием между электроды всего 1 см.
Эффект поднятия электродов так, что оставалось всего 3 см. погружение в жидкость было довольно драматичным. При 5,0 В ток упал с От 1,2 А до 0,65 А. Площадь контакта между жидкостью и электродами имеет прочную влияние на наблюдаемое сопротивление.
Эффект от перемещения электродов навстречу друг другу менее драматично. Трудно провести точные измерения (расстояние не могло быть легко контролируется и точно измеряется), но в результате сопротивление снижается.Но эффект не такой сильный, как уменьшение контакта площадь электродов.
Использование этой характеристики для практических целей
Когда такая характеристика электролизера становится определено, его можно использовать в практических целях, когда кто-то хочет создать электролизер, например для производства хлоратов.
Предположим, у вас есть фиксированный источник питания 12 В и вы хотите выполнить электролиз.Подать напряжение 12 В напрямую не получится. Текущий будет чрезмерно, и блок питания может быть перегружен. По крайней мере, жидкость будет становятся очень горячими, и графитовый анод сильно выветривается.
Имея под рукой график, легко определить, какой ток будет нарисован, когда резистор включен последовательно с ячейкой. Предположим, вы строите цепь, согласно следующей схеме:
Теперь резистор R должен быть выбран таким, чтобы ток потребляется и такой, что рассеиваемая мощность в резисторе не излишний.Используя график ВАХ, ток, который нарисованный для конкретного значения R может быть легко определен. Приведен пример здесь при R = 4 Ом.
Напряжение на резисторе R равно 12 В ячейка , где V cell — напряжение на ячейке. Итак, можно нарисовать ток через резистор как функция напряжения ячейки. Для клетки напряжение, равное 0, ток просто равен 12 / R. Для напряжения ячейки, равного до 12 В ток равен 0 (на резисторе не остается напряжения).Линия может быть проведенным между этими двумя точками. Поскольку ячейка и резистор соединенные последовательно, через них обоих должен проходить одинаковый ток. Эта точка можно легко определить, проведя пересечение графика и линии, который описывает резистор (в этот момент токи в обоих компонентах равны такой же). В этот момент считывается напряжение ячейки, и считывается ток ячейки.
Ниже приведен пример графика для резистора 4 Ом.При напряжении ячейки 0 ток через этот резистор равно 12/4 = 3 А. У ячейки напряжение 6 В, также 6 В остается на резисторе, поэтому в этот момент ток 6/4 = 1,5 А. Теперь у нас есть две точки, и мы можем провести линию между эти. Пересечение этой линии с графиком — реальное напряжение ячейки и ток, при котором схема будет работать.
В зависимости от точки пересечения напряжение ячейки будет быть примерно 5.5 В и ток элемента будет примерно 1,65 А.
Какая мощность рассеивается на резисторе? Сотовый напряжение равно 5,5 В, поэтому напряжение на резисторе равно 12 5,5 = 6,5 В. Ток через резистор 1,65 А. Мощность, рассеиваемая на резисторе, составляет 6,51,65 Вт. Этот составляет 10,7 Вт.
Дополнительные предметы для исследования
Влияние концентрации на график также интересно определить.С увеличением концентрации раствора сопротивление станет ниже, но насколько ниже? Удвоение концентрации не уменьшит сопротивление в 2 раза. Редокс-потенциал для преобразование хлорида в хлор и воды в водород и гидроксид-ион должно быть преодолевать, независимо от концентрации. Было бы очень хорошо, если бы такой набор графики могут быть получены для различных концентраций. Эксперимент, как выполненный здесь, делается в довольно высокой концентрации, но раствор не был насыщенный.
Расшифровка результатов
Результаты, полученные в этом эксперименте, можно объяснить. от свойств электролизеров. В этом разделе модель, описывается как электронный эквивалент. Электролизер вполне может быть моделируется как простая электронная схема, и эту модель можно использовать для описания электрические характеристики электролизера.
Редокс-потенциалы полуреакций, протекающих при электроды: напряжение ячейки
В электролизной ячейке два окислительно-восстановительных происходят реакции. Одна реакция на катоде и одна на аноде. В этом Например, происходят две следующие реакции:
На катоде: 2H 2 O + 2e → 2OH + H 2 (катод E = 0,83 В)
На аноде: 2Cl 2e → Cl 2 (E анод = +1.36 В)
Напряжение E на катоде является понижающим потенциалом. для реакции на катоде. Напряжение Е на аноде — снижение потенциал обратной реакции на аноде.
Чтобы иметь какую-либо реакцию, так называемое напряжение ячейки нужно как минимум наносить на ячейку. Напряжение элемента E элемента равно E анод — E катод . Для реакции в этом эксперименте E ячейка равно 1.36 (0,83) В, что составляет 2,19 В. Это напряжение используется посредством процесса передачи электронов от / к химическим соединениям.
Мощность I ячейка E ячейка , где I ячейка ток, потребляемый электролитической ячейкой, не преобразуется в тепло, но к новым химикатам. Эти новые химические вещества более энергичны, чем оригинальные. Итак, электрическая энергия преобразуется в потенциальную химическую энергию.
Интерфейс (площадь контакта) между электродами и жидкостью: перенапряжение
Если приложенное напряжение ниже E элемента , то ток не может течь. вообще.Электроны не могут передаваться от электродов к соединениям в решение или наоборот. Если напряжение выше E ячейки , то по идее, имеется достаточный потенциал для возникновения реакций, и в этом случае ток может течь. Однако на практике в дополнение к окислительно-восстановительному потенциалу потенциалы, перенапряжение необходимо для каждого электрода. Необходимо приложить дополнительные усилия в реакции, потому что электроны должны перейти от / к твердым металлическим или графитовым стержням в / из жидкости или даже в / из газа.
Суммарный ток через ячейку зависит от применяемого перенапряжение. Чем выше приложенное перенапряжение, тем больше протекает ток. через камеру. Итак, чтобы иметь определенный ток, нужно применить напряжение равно
E ячейка + η h3 + η Cl2 .
Здесь η h3 и η Cl2 — перенапряжения для катода и анода.
Теперь вопрос в том, сколько перенапряжения необходимо для определенный ток? Чтобы ответить на этот вопрос, нужно знать соотношение между током через поверхность раздела электрод / электролит и напряжение на этом интерфейсе (перенапряжение). Отношение тока / напряжения известен и может быть описан с помощью уравнения Батлера-Фольмера . Ниже, это описано более подробно для заинтересованного читателя. Это не простой линейное отношение.
А пока достаточно упомянуть, когда токи порядка 1 А требуется, то требуемое перенапряжение для каждого электрода обычно составляет всего несколько мВ, если только электродная реакция генерирует газ. Электродные реакции с выделением газа может потребоваться перенапряжение в несколько сотен мВ в чтобы продолжить с приемлемой скоростью. в электролиз NaCl, на обоих электродах образуется газ, поэтому необходимая общая Перенапряжение в такой электролизной ячейке является значительным.Для практических настройки, общее требуемое перенапряжение η h3 + η Cl2 обычно составляет около 1 В. При более низком перенапряжении ток очень мал и, следовательно, электродные реакции становятся очень медленными.
Резистивные потери в жидкости
Наконец, жидкость (электролит) имеет определенное сопротивление, которая зависит от концентрации и типа ионов в электролите. В ионы должны проходить через жидкость, и при этом они чувствуют сопротивление (трение) от других ионов и от молекул воды.Для средней ячейки и при высокой концентрации электролита это сопротивление менее 1 Ом.
Подводя итог, итоговая модель
Полная электролитическая ячейка может быть смоделирована как серия подключение пяти резистивных элементов:
Резистор нелинейный, описывается уравнением Батлера-Фольмера. В Основным параметром этого резистора является плотность тока обмена для производство газообразного хлора (подробнее об этом см. ниже).
Редокс-потенциал окисления хлорида к хлору. Это сильно нелинейный резистор, обладающий тем свойством, что когда приложенное напряжение ниже E анод (1,36 В в этом эксперимент), то ток вообще не течет. Когда приложенное напряжение превышает 1,36 В, тогда ток неограничен. Этот характеристика идеального стабилитрона, подключенного в обратном направлении. направление и номинальное напряжение стабилитрона 1.36 В.
Более-менее линейный резистор, который зависит от подвижности ионов в растворе. Это менее 1 Ом для средней ячейки.
Редокс-потенциал воды до водород. Это сильно нелинейный резистор, обладающий тем свойством, что при приложенное напряжение ниже E на катоде (0,83 В в этом эксперименте), то ток вообще не течет. Когда приложенное напряжение превышает 0.83 В, то ток неограничен. Это характеристика идеального стабилитрона, подключенного в обратном направлении и номинальное напряжение стабилитрона 0,83 В.
Резистор нелинейный, описывается уравнением Батлера-Фольмера. В основным параметром этого резистора является плотность тока обмена для производство газообразного водорода (подробнее об этом см. ниже).
На принципиальной схеме это выглядит следующим образом.Слева показана физическая установка, справа модель, описывающая ячейку. Два идеальных стабилитрона в модели гарантируют, что по крайней мере E элемент = 2,19 для протекания тока необходимо приложить напряжение. Резисторы OP Cl 2 и OP H 2 — нелинейные резисторы, моделирующие требуемые перенапряжение (символы с /// внутри символа резистора, обозначающие нелинейность). Резистор внизу моделирует омическое сопротивление электролит.
Когда ток через ячейку достаточно велик (не менее 100 мА), то, грубо говоря, OP Cl 2 и OP H 2 могут быть описываются как обычные полупроводниковые диоды, подключенные в прямом направлении. Диод характеризуется так называемым прямое падение напряжения . Для нормального кремниевого диода это прямое падение напряжения находится где-то между 600 мВ и 700 мВ.Для германиевого диода это где-то между 250 мВ и 300 мВ, а для диода Шоттки оно может составлять всего 150 мВ. Перенапряжения можно смоделировать в виде диодов с определенное прямое падение напряжения. Для реакций, в которых газ не образуется, это прямое падение напряжения составляет всего несколько мВ. Для изучаемой здесь реакции несколько 100 мВ (например, 300 … 700 мВ). Итак, хорошая аппроксимирующая модель следующая:
Остерегаться: имейте в виду, что изображенные здесь диоды не являются стандартными диодами.Прямое напряжение падение этих диодов не стандартное 600..700 мВ, но может быть где угодно от от нескольких мВ до 1 В. Только характеристика как у диода, а вот собственно числовая значения могут значительно отличаться. Нарисована общая характеристика диода. на картинке слева. Напряжение V d — прямое напряжение падение диода в этой модели.
Почему в цепи электролиза используется переменный резистор?
Почему в цепи электролиза используется переменный резистор?
у вас нет.вам нужно простое сопротивление. сопротивление этому ограничит количество тока. какой ток вы хотите запустить? какое напряжение питания? необходимое значение сопротивления можно найти, разделив напряжение на желаемый ток. Закон Ома.
При электролизе сопротивление раствора изменяется по мере протекания реакции. Желательно провести реакцию как можно быстрее, а значит максимально возможный ток. Чтобы продолжить работу при максимальном токе, можно использовать переменное сопротивление, включенное последовательно с источником питания постоянного тока.Это делается на коммерческой основе, поскольку создать автоматический источник постоянного тока с электронными схемами несложно.
Почему используется электролиз?
Электролизпроисходит в узком диапазоне напряжений. Эффективность процесса зависит от многих переменных, включая тип материала электрода (поверхность и подложка), общая площадь, расстояние между электродами, тип и концентрация электролита (например, naoh) и т. д.
Когда напряжение между электродами увеличивается, ток начинает течь при определенном напряжении отсечки между электродами, и образуются готовые электролитические продукты (для электролиза воды это должен быть кислород на аноде и водород на катоде) .
По мере увеличения напряжения ток, как и выход электролита, в определенной степени увеличивается. После достижения максимальной плотности тока электродов (по сравнению с процессами электролиза) дополнительное напряжение может иметь нежелательные эффекты. К ним относятся нагревание, эрозия самих электродов и прочее.
для относительно небольшой конфигурации с источниками постоянного входного напряжения добавление последовательного резистора к электролитической ячейке гарантирует, что общий ток, протекающий через ячейку, находится на нужном уровне для оптимальных выходных результатов, срока службы электродов и т. Д.
переменный резистор облегчает настройку ячейки для оптимизации. Одна из причин заключается в том, что постоянные резисторы производятся в соответствии с определенной спецификацией для их фактической силы, от 5 до 10%. Установка конечного сопротивления схемы может быть получена путем последовательного включения постоянного резистора (для большинства резисторов) с переменным резистором.

 е. происходит разложение воды
е. происходит разложение воды