Электролиз реферат по химии — Docsity
Министерство общего и профессионального образования Свердловской области МОУО г.Екатеринбурга образовательное учреждение муниципальная школа общего среднего образования №135 Чкаловского района Образовательная область естествознание Предмет химия ЭЛЕКТРОЛИЗ Введение Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электролиз является одним из важнейших направлений в электрохимии. Электрохимия принадлежит к числу тех немногих наук, дата рождения которых может быть установлена с высокой точностью. Это рубеж XVIII и XIX веков, когда благодаря знаменитым опытам итальянского физиолога Л. Гальвани и созданию итальянским физиком А. Вольта в 1799 г. «вольтова столба» — первого в истории человечества химического источника тока -были сформулированы проблемы, решение которых определило основные задачи электрохимии. «Без химии путь к познанию истинной природы электричества закрыт» — сказал М. В. Ломоносов. И, действительно, как бы следуя словам великого ученого, создавалась и развивается наука – электрохимия. Еще в начале позапрошлого столетия было установлено, что при прохождении электрического тока через водные растворы солей происходят химические превращения, приводящие к образованию новых веществ. В результате этого, в начале прошлого века возникло научное направление по изучению электрохимических процессов в растворах и расплавах веществ – электрохимия. К концу семидесятых годов оно разделилось на два самостоятельных раздела – ионику, изучающую явления электропроводности и движения заряженных частиц под воздействием электрического поля, и электродику, изучающую явления происходящие непосредственно на поверхности электродов, когда через границу электрод-раствор (расплав) протекает электрический ток. Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими. Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода.
В. Ломоносов. И, действительно, как бы следуя словам великого ученого, создавалась и развивается наука – электрохимия. Еще в начале позапрошлого столетия было установлено, что при прохождении электрического тока через водные растворы солей происходят химические превращения, приводящие к образованию новых веществ. В результате этого, в начале прошлого века возникло научное направление по изучению электрохимических процессов в растворах и расплавах веществ – электрохимия. К концу семидесятых годов оно разделилось на два самостоятельных раздела – ионику, изучающую явления электропроводности и движения заряженных частиц под воздействием электрического поля, и электродику, изучающую явления происходящие непосредственно на поверхности электродов, когда через границу электрод-раствор (расплав) протекает электрический ток. Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими. Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода. Технический или прикладной электролиз характеризуется сложностью протекающих в промышленных условиях электролитических процессов, различными видами электролиза, их зависимостью от природы электролита, типа электролитической ванны, оптимизации самих электролизных процессов. Электролитические процессы классифицируются следующим образом: • получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.) • получение металлов(литий, натрий, калий, берилий, магний, цинк, алюминий, медь и т.д.) • очистка металлов(медь, серебро,…) • получение металлических сплавов • получение гальванических покрытий • обработка поверхностей металлов(азотирование, борирование,электрополировка, очистка) • получение органических веществ • электродиализ и обессоливание воды 2 называется химическим источником энергии. Если же их протекание обусловлено подводом электрической энергии извне, то происходит электролиз. Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCl2 катионы магния по действием электрического поля движутся к отрицательному электроду.
Технический или прикладной электролиз характеризуется сложностью протекающих в промышленных условиях электролитических процессов, различными видами электролиза, их зависимостью от природы электролита, типа электролитической ванны, оптимизации самих электролизных процессов. Электролитические процессы классифицируются следующим образом: • получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.) • получение металлов(литий, натрий, калий, берилий, магний, цинк, алюминий, медь и т.д.) • очистка металлов(медь, серебро,…) • получение металлических сплавов • получение гальванических покрытий • обработка поверхностей металлов(азотирование, борирование,электрополировка, очистка) • получение органических веществ • электродиализ и обессоливание воды 2 называется химическим источником энергии. Если же их протекание обусловлено подводом электрической энергии извне, то происходит электролиз. Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCl2 катионы магния по действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются. Mg2++2e-=Mg Анионы хлора перемещаются к положительному электроду, и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия—окисление ионов хлора 2Cl-=2Cl+2e- а вторичным—связывание образующихся атомов хлора в молекулы: 2Cl=Cl2 Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgCl2: Mg2+ + 2Cl-l=Mg + Cl2 Эта реакция не может протекать самопроизвольно; энергия, необходимая для её осуществления, поступает от внешнего источника тока. Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод—положительно, т.е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента.
Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются. Mg2++2e-=Mg Анионы хлора перемещаются к положительному электроду, и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия—окисление ионов хлора 2Cl-=2Cl+2e- а вторичным—связывание образующихся атомов хлора в молекулы: 2Cl=Cl2 Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgCl2: Mg2+ + 2Cl-l=Mg + Cl2 Эта реакция не может протекать самопроизвольно; энергия, необходимая для её осуществления, поступает от внешнего источника тока. Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод—положительно, т.е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. При электролизе химическая реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. При рассмотрении электролиза растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются ещё ионы, являющиеся ещё продуктами диссоциации воды—Н+ и ОН-.В электролитическом поле ионы водорода перемещаются к катоду, а гидроксила— к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично у анода может происходить разряд как анионов электролита, так и ионов гидроксила. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего будет зависеть от соотношения электродных потенциалов соответствующих электрохимических систем.
При электролизе химическая реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. При рассмотрении электролиза растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются ещё ионы, являющиеся ещё продуктами диссоциации воды—Н+ и ОН-.В электролитическом поле ионы водорода перемещаются к катоду, а гидроксила— к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично у анода может происходить разряд как анионов электролита, так и ионов гидроксила. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего будет зависеть от соотношения электродных потенциалов соответствующих электрохимических систем. Это означает, что на 5 катоде будут восстанавливаться окисленные формы электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже. Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (рН=7) имеет значение φ=-0,059*7=-0,41 В. Отсюда ясно, что если электролит образован металлом, электродный потенциал которого значительно положительнее, чем –0,41 В, то из нейтрального раствора у катода будет выделяться металл.
Это означает, что на 5 катоде будут восстанавливаться окисленные формы электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже. Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (рН=7) имеет значение φ=-0,059*7=-0,41 В. Отсюда ясно, что если электролит образован металлом, электродный потенциал которого значительно положительнее, чем –0,41 В, то из нейтрального раствора у катода будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, в случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем –0,41 В, металл восстанавливаться не будет, а произойдёт выделение водорода. К таким металлам относятся металлы начала ряда напряжений—приблизительно до титана. Наконец, если потенциал металла близок к величине –0,41 В (металлы средней части ряда—Zn,Cr,Fe,Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. Электрохимическое выделение водорода из кислых растворов происходит вследствии разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды: 2Н2О + 2е- =Н2 + 2ОН- Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений.
Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, в случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем –0,41 В, металл восстанавливаться не будет, а произойдёт выделение водорода. К таким металлам относятся металлы начала ряда напряжений—приблизительно до титана. Наконец, если потенциал металла близок к величине –0,41 В (металлы средней части ряда—Zn,Cr,Fe,Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. Электрохимическое выделение водорода из кислых растворов происходит вследствии разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды: 2Н2О + 2е- =Н2 + 2ОН- Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений.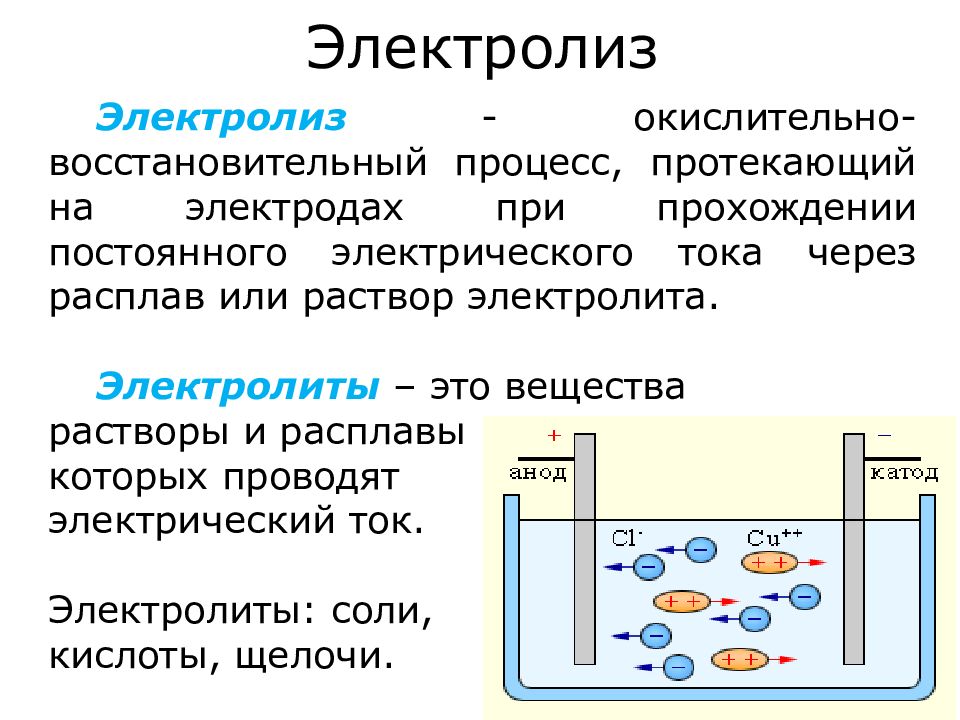 В ряде случаев большое значение имеют рН раствора, концентрация ионов металла и другие условия электролиза. При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще применяют графит уголь, платину. На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтористоводородной кислоты и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид 6 4ОН- =О2 + 2Н2О + 4е- а в кислой или нейтральной: 2Н2О =О2 + 4Н+ + 4е- В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом.
В ряде случаев большое значение имеют рН раствора, концентрация ионов металла и другие условия электролиза. При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще применяют графит уголь, платину. На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтористоводородной кислоты и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид 6 4ОН- =О2 + 2Н2О + 4е- а в кислой или нейтральной: 2Н2О =О2 + 4Н+ + 4е- В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом.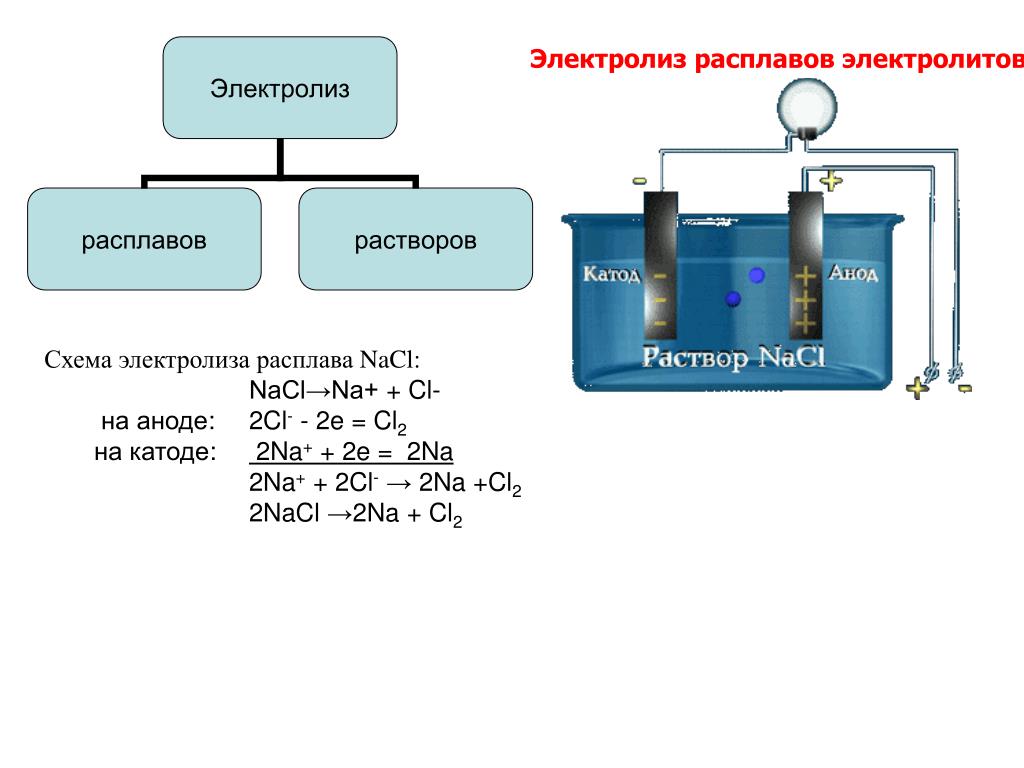 Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO42- 2SO42- =S2O82- + 2e- равен 2,010 В, что значительно превышает стандартный потенциал окисления воды (1,228 В). Стандартный потенциал окисления иона F- имеет ещё большее значение (2,87 В). При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI,HBr,HCl и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе HCl и её солей противоречит взаимному положению систем 2Cl- =2Cl + 2e- (φ=1,359 В) и 2Н2О =О2 + 4Н+ + 4е- (φ =1,228 В) в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением второго из этих двух электродных процессов— материал анода оказывает тормозящее действие на процесс выделения кислорода. В случае активного анода число конкурирующих окислительных процессов возрастает до трёх: электрохимическое окисление воды с выделением кислорода, разряд аниона (т.
Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO42- 2SO42- =S2O82- + 2e- равен 2,010 В, что значительно превышает стандартный потенциал окисления воды (1,228 В). Стандартный потенциал окисления иона F- имеет ещё большее значение (2,87 В). При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI,HBr,HCl и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе HCl и её солей противоречит взаимному положению систем 2Cl- =2Cl + 2e- (φ=1,359 В) и 2Н2О =О2 + 4Н+ + 4е- (φ =1,228 В) в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением второго из этих двух электродных процессов— материал анода оказывает тормозящее действие на процесс выделения кислорода. В случае активного анода число конкурирующих окислительных процессов возрастает до трёх: электрохимическое окисление воды с выделением кислорода, разряд аниона (т.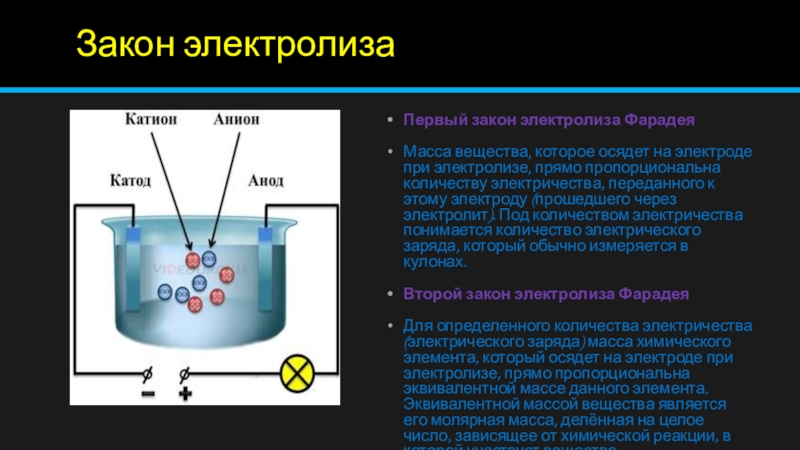 е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона. Рассмотрим несколько типичных случаев электролиза водных растворов. Электролиз раствора CuCl2 с инертным анодом. Медь в ряду напряжений расположена после водорода; поэтому у катода будет происходить разряд ионов Cu2+ и выделение металлической меди. У анода будут разряжаться хлорид- ионы. Схема электролиза раствора хлорида мели (II): CuCl2 Катод ← Cu2+ 2Cl- → Анод Cu2+ + 2e- =Cu 2Cl- =2Cl + 2e- 7 Факторы от которых зависит электролиз Эффективность электролиза оценивают рядом факторов, к которым относятся: сила тока, напряжение, плотность тока, КПД источника тока, выход по току, выход по веществу, коэффициент полезного действия электроэнергии (выход по энергии), расход электроэнергии на единицу полученного продукта.
е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона. Рассмотрим несколько типичных случаев электролиза водных растворов. Электролиз раствора CuCl2 с инертным анодом. Медь в ряду напряжений расположена после водорода; поэтому у катода будет происходить разряд ионов Cu2+ и выделение металлической меди. У анода будут разряжаться хлорид- ионы. Схема электролиза раствора хлорида мели (II): CuCl2 Катод ← Cu2+ 2Cl- → Анод Cu2+ + 2e- =Cu 2Cl- =2Cl + 2e- 7 Факторы от которых зависит электролиз Эффективность электролиза оценивают рядом факторов, к которым относятся: сила тока, напряжение, плотность тока, КПД источника тока, выход по току, выход по веществу, коэффициент полезного действия электроэнергии (выход по энергии), расход электроэнергии на единицу полученного продукта. Сила тока или нагрузка на электролизёр характеризуют его производительность. Чем выше сила тока, пропускаемого через электролизёр, тем больше продукта можно получить при эксплуатации данного электролизёра. Наблюдается тенденция к созданию мощных электролизёров, рассчитанных в некоторых случаях на десятки и сотни тысяч Ампер (производство хлора, алюминия и т.д.) напряжение на электролизёре складывается из нескольких составляющих: U=ea-ek + ∆ea + ∆ek + eэл.-eдиафр.+ eконт. где: U—общее напряжение на ячейке; ea и ek – равновесные потенциалы анодной и катодной реакции; eэл. и eдиафр – падение напряжения в электролите и в диафрагме; eконт.—падение напряжения в контактах. Сумма ea-ek называется напряжением разложения. Эта величина соответствует расходу на электролиз электроэнергии, которая идёт непосредственно на изменение внутренней энергии веществ. При электролизе стремятся к уменьшению напряжения на ячейке за счёт величины поляризации и омического состояния баланса напряжения, тоесть слагаемых, обусловленных необратимостью процесса.
Сила тока или нагрузка на электролизёр характеризуют его производительность. Чем выше сила тока, пропускаемого через электролизёр, тем больше продукта можно получить при эксплуатации данного электролизёра. Наблюдается тенденция к созданию мощных электролизёров, рассчитанных в некоторых случаях на десятки и сотни тысяч Ампер (производство хлора, алюминия и т.д.) напряжение на электролизёре складывается из нескольких составляющих: U=ea-ek + ∆ea + ∆ek + eэл.-eдиафр.+ eконт. где: U—общее напряжение на ячейке; ea и ek – равновесные потенциалы анодной и катодной реакции; eэл. и eдиафр – падение напряжения в электролите и в диафрагме; eконт.—падение напряжения в контактах. Сумма ea-ek называется напряжением разложения. Эта величина соответствует расходу на электролиз электроэнергии, которая идёт непосредственно на изменение внутренней энергии веществ. При электролизе стремятся к уменьшению напряжения на ячейке за счёт величины поляризации и омического состояния баланса напряжения, тоесть слагаемых, обусловленных необратимостью процесса. Напряжение разложения обусловлено природой реагирующего вещества, а поэтому не может быть изменено. Значения ∆ek и ∆ea могут быть изменены в зависимости от характера электрохимической реакции, протекающей на электроде, путём перемешевания, повышения температуры электролита, изменения состояния поверхности электрода и за счёт ряда других факторов. Падение напряжения в электролите, выражаемое уравнением R=ρl/s, где ρ —удельное сопротивление электролита, Ом·см, l—расстояние между электродами, см (без учета диафрагмы), S—площадь поперечного сечения электролита, через которую проходит электрический ток см2, может быть уменьшено, как следует из приведённого выражения, сближением электродов, введением в раствор более электроотрицательных добавок, а также повышением температуры. Если электролиз сопровождается образованием газов, то приведённое выше выражение не всегда точно соответствует падению напряжения в электролите. Это объясняется тем, что выделяющиеся на электродах пузырьки газов уменьшают активное сечение электролита S и удлиняют путь тока от одного электрода к другому.
Напряжение разложения обусловлено природой реагирующего вещества, а поэтому не может быть изменено. Значения ∆ek и ∆ea могут быть изменены в зависимости от характера электрохимической реакции, протекающей на электроде, путём перемешевания, повышения температуры электролита, изменения состояния поверхности электрода и за счёт ряда других факторов. Падение напряжения в электролите, выражаемое уравнением R=ρl/s, где ρ —удельное сопротивление электролита, Ом·см, l—расстояние между электродами, см (без учета диафрагмы), S—площадь поперечного сечения электролита, через которую проходит электрический ток см2, может быть уменьшено, как следует из приведённого выражения, сближением электродов, введением в раствор более электроотрицательных добавок, а также повышением температуры. Если электролиз сопровождается образованием газов, то приведённое выше выражение не всегда точно соответствует падению напряжения в электролите. Это объясняется тем, что выделяющиеся на электродах пузырьки газов уменьшают активное сечение электролита S и удлиняют путь тока от одного электрода к другому. Это явление называется газонаполнением, которое может быть определено как отношение объёма занимаемого в данный момент пузырьком воздуха к общему объёму электролитической ячейки. Влияние газонаполнения на электропроводность электролита может быть учтено с помощью следующего выпажения: ρ/ρ0=1-1.78φ+φ2 где ρ и ρ0 – соответственно удельные сопротивления сплошного и газонаполненного электролита, φ – газонаполнение. Величина φ может быть 10 уменьшена повышением температуры, а также особым устройством электродов, обеспечивающих свободное удалением газов из ячейки. Падение напряжения в диафрагме было оценено при решении вопроса о роли диафрагмы в электролизе. Что касается падения напряжения в контактах, то эта величина зависит от совершенства контактов, чистоты контактирующих поверхностей. Существует довольно много конструктивных решений электродных контактов. Коэффициентом полезного использования напряжения называется отношение напряжения разложения к общему напряжению на ванне: ηнапр=( ea-ek)/U Плотностью тока называется отношение силы, проходящего через электролит тока к величине поверхности электрода; измеряют в А/см2 (дм2 или м2).
Это явление называется газонаполнением, которое может быть определено как отношение объёма занимаемого в данный момент пузырьком воздуха к общему объёму электролитической ячейки. Влияние газонаполнения на электропроводность электролита может быть учтено с помощью следующего выпажения: ρ/ρ0=1-1.78φ+φ2 где ρ и ρ0 – соответственно удельные сопротивления сплошного и газонаполненного электролита, φ – газонаполнение. Величина φ может быть 10 уменьшена повышением температуры, а также особым устройством электродов, обеспечивающих свободное удалением газов из ячейки. Падение напряжения в диафрагме было оценено при решении вопроса о роли диафрагмы в электролизе. Что касается падения напряжения в контактах, то эта величина зависит от совершенства контактов, чистоты контактирующих поверхностей. Существует довольно много конструктивных решений электродных контактов. Коэффициентом полезного использования напряжения называется отношение напряжения разложения к общему напряжению на ванне: ηнапр=( ea-ek)/U Плотностью тока называется отношение силы, проходящего через электролит тока к величине поверхности электрода; измеряют в А/см2 (дм2 или м2).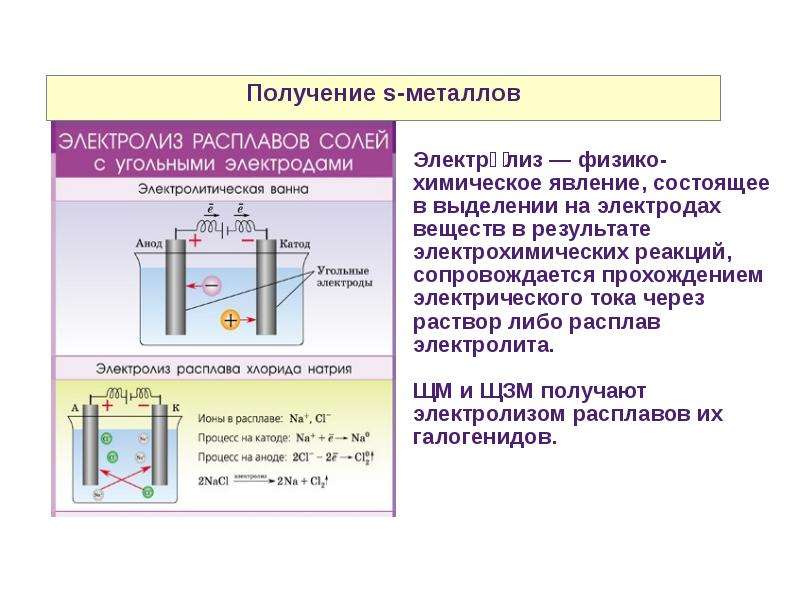 В промышленности работают с различными плотностями тока – от нескольких сотен А/см2 (гальваностегия, гидроэлектрометаллургия, производство Хлора) до нескольких тысяч А/см2 (электролиз расплавов, электросинтез и т.д.) Величина плотности тока характеризует количество продукта, получаемого с еденицы электродной поверхности, т.е. продуктивность электролизёра. Поэтому, если повышение плотности тока не вызывает падения выхода продукта электролиз, стремятся к проведению процесса с максимально возможными плотностями тока. Однако при выборе оптимальных значений плотностей тока в некоторых случаях необходимо принимать во внимание увелечение себестоимости продукта за счёт повышения расхода электроэнергии на электролиз вследствии увеличения напряжения с ростом плотности тока. При электролизе ток, который пропускают через электролит, может расходоваться на несколько параллельных электрохимических реакций. Например, при электролизе водных растворов реакциям электрохимического окисления или восстановления, сопутствует реакция разложения воды на О2 и Н2, выделяющиеся соответственно на аноде и катоде.
В промышленности работают с различными плотностями тока – от нескольких сотен А/см2 (гальваностегия, гидроэлектрометаллургия, производство Хлора) до нескольких тысяч А/см2 (электролиз расплавов, электросинтез и т.д.) Величина плотности тока характеризует количество продукта, получаемого с еденицы электродной поверхности, т.е. продуктивность электролизёра. Поэтому, если повышение плотности тока не вызывает падения выхода продукта электролиз, стремятся к проведению процесса с максимально возможными плотностями тока. Однако при выборе оптимальных значений плотностей тока в некоторых случаях необходимо принимать во внимание увелечение себестоимости продукта за счёт повышения расхода электроэнергии на электролиз вследствии увеличения напряжения с ростом плотности тока. При электролизе ток, который пропускают через электролит, может расходоваться на несколько параллельных электрохимических реакций. Например, при электролизе водных растворов реакциям электрохимического окисления или восстановления, сопутствует реакция разложения воды на О2 и Н2, выделяющиеся соответственно на аноде и катоде. При электролизе, криолитглиноземных расплавов ток в определённых условиях может расходоваться не только на выделение алюминия, но и на образование на катоде металического натрия. Следовательно, пропускаемый через элетролит ток распределяется между несколькими процессами, протекающими на данном электроде одновременно: I=i1+i2+i3+…+i n где: I – ток, протекаемый через электролизёр; i1 и i2 – ток, расходуемый в единицу на первую и второю электролитическую реакцию. Для того чтобы учитывать эффективность использования пропущенного через электролизёр количества электричества на образования того или иного продукта вводится понятие выхода по току. Выход по току – отношение количества теоритически необходимого для получения того или иного количества электричества (по закону Фарадея) к практически затраченному количеству электричества. С целью уменьшения затрат электроэнергии на побочные электрохимические реакции и повышения по току стремятся проводить электролиз в таких условиях, при которых 11 затруднено разложение растворителя, т.
При электролизе, криолитглиноземных расплавов ток в определённых условиях может расходоваться не только на выделение алюминия, но и на образование на катоде металического натрия. Следовательно, пропускаемый через элетролит ток распределяется между несколькими процессами, протекающими на данном электроде одновременно: I=i1+i2+i3+…+i n где: I – ток, протекаемый через электролизёр; i1 и i2 – ток, расходуемый в единицу на первую и второю электролитическую реакцию. Для того чтобы учитывать эффективность использования пропущенного через электролизёр количества электричества на образования того или иного продукта вводится понятие выхода по току. Выход по току – отношение количества теоритически необходимого для получения того или иного количества электричества (по закону Фарадея) к практически затраченному количеству электричества. С целью уменьшения затрат электроэнергии на побочные электрохимические реакции и повышения по току стремятся проводить электролиз в таких условиях, при которых 11 затруднено разложение растворителя, т.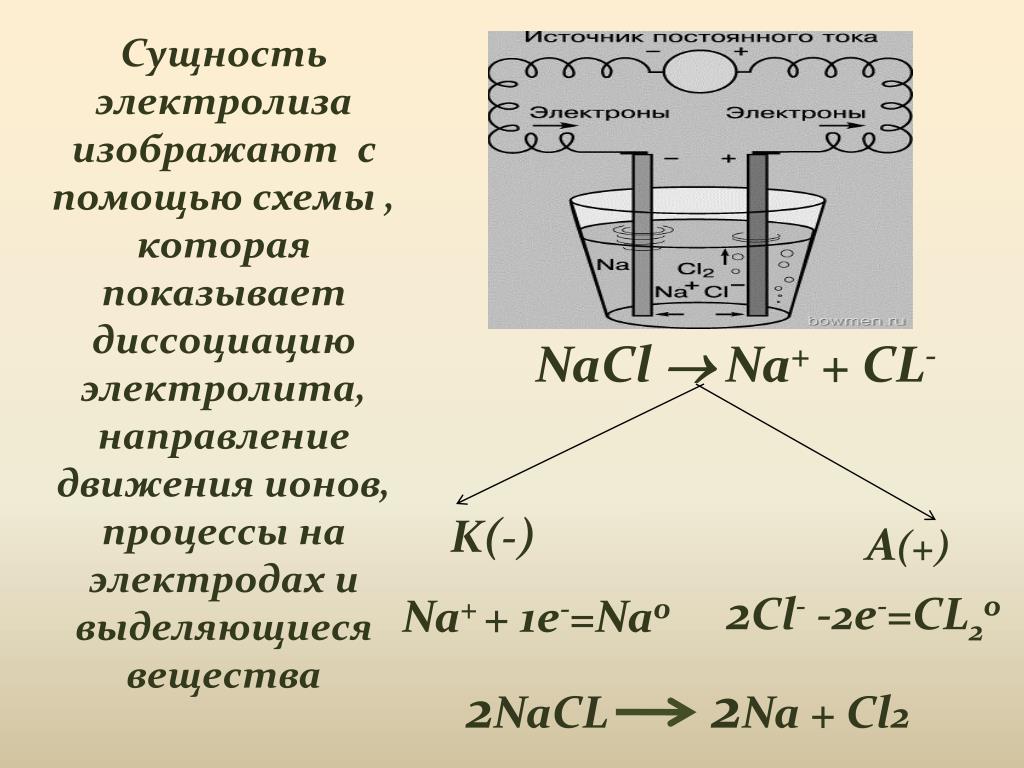 е. велика поляризация при окислении или восстановлении растворителя (например перенапряжение кислорода или водорода). Это достигается повышением плотности тока, изменением температуры электролита, подбором материала электролита и т. д. Выход по веществу – это отношение количества полученного в результате электрохимических реакций продукта к тому количеству, которое должно образоваться теоритически, исходя из данной загрузки исходного продукта. КПД использования электроэнергии (выход по энергии) – это отношение теоритически необходимого для получения единицы количества вещества электроэнергии к практически израсходованному. Теоретически необходимое количество электроэнергии – то количество ее, которое было бы необходимым для получения единицы количества вещества, если бы процесс происходил со 100% выходом по току и при напряжении, равном напряжению разложения. Следовательно, выход по энергии может быть определен по формуле: ηэ=Wп/N=ηтока * ηнапр Выход по току ηтока и по веществу, а также коэффициент полезного действия использования электроэнергии ηнапр обычно измеряют в процентах.
е. велика поляризация при окислении или восстановлении растворителя (например перенапряжение кислорода или водорода). Это достигается повышением плотности тока, изменением температуры электролита, подбором материала электролита и т. д. Выход по веществу – это отношение количества полученного в результате электрохимических реакций продукта к тому количеству, которое должно образоваться теоритически, исходя из данной загрузки исходного продукта. КПД использования электроэнергии (выход по энергии) – это отношение теоритически необходимого для получения единицы количества вещества электроэнергии к практически израсходованному. Теоретически необходимое количество электроэнергии – то количество ее, которое было бы необходимым для получения единицы количества вещества, если бы процесс происходил со 100% выходом по току и при напряжении, равном напряжению разложения. Следовательно, выход по энергии может быть определен по формуле: ηэ=Wп/N=ηтока * ηнапр Выход по току ηтока и по веществу, а также коэффициент полезного действия использования электроэнергии ηнапр обычно измеряют в процентах. Расход электроэнергии обычно относят к единице произведенного количества продукта измеряют в вт ч/кг или квт ч/т. Для расчета расхода электроэнергии постоянного тока на 1т произведенного электролизом продукта можно воспользоваться следующей формулой: W=1*106*U/k ηтока *1000 где: W – расход электроэнергии постоянного тока кВтч/т; U – напряжение на электролизере, В; k элктрохимический эквивалент, грамм/а*r; ηтока – выход по току, доли единицы; 1000 – коэффициент для перевода вт*ч в квт*ч. Расход электроэнергии переменного тока на единицу произведенного продукта может быть определен делением расхода электроэнергии постоянного тока на то же количество коэффициента при образовании переменного тока в постоянный. Между временем пропускания через раствор или расплав электролита электрического тока (количеством электричества) и количеством образующегося и расходуемого вещества имеются строгие количественные соотношения, определяемые законами Фарадея. 12 Диафрагма В тех случаях, когда необходимо исключить взаимодействие продуктов электролиза, образующихся на аноде и катоде, в электролизёр вводится пористая перегородка – диафрагма, разделяющая его минимум на два электродных пространства – анодное и катодное.
Расход электроэнергии обычно относят к единице произведенного количества продукта измеряют в вт ч/кг или квт ч/т. Для расчета расхода электроэнергии постоянного тока на 1т произведенного электролизом продукта можно воспользоваться следующей формулой: W=1*106*U/k ηтока *1000 где: W – расход электроэнергии постоянного тока кВтч/т; U – напряжение на электролизере, В; k элктрохимический эквивалент, грамм/а*r; ηтока – выход по току, доли единицы; 1000 – коэффициент для перевода вт*ч в квт*ч. Расход электроэнергии переменного тока на единицу произведенного продукта может быть определен делением расхода электроэнергии постоянного тока на то же количество коэффициента при образовании переменного тока в постоянный. Между временем пропускания через раствор или расплав электролита электрического тока (количеством электричества) и количеством образующегося и расходуемого вещества имеются строгие количественные соотношения, определяемые законами Фарадея. 12 Диафрагма В тех случаях, когда необходимо исключить взаимодействие продуктов электролиза, образующихся на аноде и катоде, в электролизёр вводится пористая перегородка – диафрагма, разделяющая его минимум на два электродных пространства – анодное и катодное. Раствор, заливаемый в анодное пространство, называется анолитом, в катодное – католитом. Диафрагмы бывают погружённые и фильтрующие. Погружённые диафрагмы должны иметь диффузионное сопротивление и быть селективно проницаемы лишь для ионов электролита, но задерживать продукты электролиза. Фильтрующие диафрагмы, обладающие низким диффузионным сопротивлением применяют в тех случаях, когда, электролиз проводят в противоположном направлении – электролит перетекает через диафрагму из одного электродного пространства в другое, навстречу движению ионов, обуславливающих электропроводность раствора. Диафрагмы характеризуются объёмной пористостью, протекаемостью, электрическим сопротивлением. Объёмная пористость диафрагмы, характеризуемая долей объёма пор к общему объёму диафрагмы, определяется уравнением: g=1-dкаж/dист где dкаж — кажущаяся плотность диафрагмы, dист – истинная плотность. Объёмная пористость измеряется в долях единицы или процентах. Протекаемость диафрагмы p зависит от площади диафрагмы, поверхности диафрагмы (S м2), толщины (δ см), гидростатическое давление h (см.
Раствор, заливаемый в анодное пространство, называется анолитом, в катодное – католитом. Диафрагмы бывают погружённые и фильтрующие. Погружённые диафрагмы должны иметь диффузионное сопротивление и быть селективно проницаемы лишь для ионов электролита, но задерживать продукты электролиза. Фильтрующие диафрагмы, обладающие низким диффузионным сопротивлением применяют в тех случаях, когда, электролиз проводят в противоположном направлении – электролит перетекает через диафрагму из одного электродного пространства в другое, навстречу движению ионов, обуславливающих электропроводность раствора. Диафрагмы характеризуются объёмной пористостью, протекаемостью, электрическим сопротивлением. Объёмная пористость диафрагмы, характеризуемая долей объёма пор к общему объёму диафрагмы, определяется уравнением: g=1-dкаж/dист где dкаж — кажущаяся плотность диафрагмы, dист – истинная плотность. Объёмная пористость измеряется в долях единицы или процентах. Протекаемость диафрагмы p зависит от площади диафрагмы, поверхности диафрагмы (S м2), толщины (δ см), гидростатическое давление h (см. вод. ст.), вязкости η (спуаз) и времени протекания r (час). p=kShr/δ η где k – коэффициент протекаемости, величина, характерная для данного вида диафрагмы. Электрическое сопротивление диафрагмы R может быть определено из сдедующего соотношения: R=ρδβ2/gS где – β – коэффициент извилистости пор, показывающий, во сколько раз длина поры превышает длину диафрагмы. Диафрагмы должны обладать хорошей химической стойкостью в условиях электролиза и достаточной механической прочностью. Материалом для изготовления диафрагмы служат асбест, керамика, пластмассы. В некоторых случаях, например при электролиз расплавов, применяют металлические диафрагмы. В последние годы в процессе электролиза получают распространение ионитовые диафрагмы, проницаемые только для ионов одного заряда (катионы или анионы) не только препятствует взаимодействию продуктов электролиза, но и позволяют предотвратить или существенно уменьшить образование окисления или восстановления этих продуктов на электродах. В этом случае применяют либо погруженные диафрагмы, либо ионитовые.
вод. ст.), вязкости η (спуаз) и времени протекания r (час). p=kShr/δ η где k – коэффициент протекаемости, величина, характерная для данного вида диафрагмы. Электрическое сопротивление диафрагмы R может быть определено из сдедующего соотношения: R=ρδβ2/gS где – β – коэффициент извилистости пор, показывающий, во сколько раз длина поры превышает длину диафрагмы. Диафрагмы должны обладать хорошей химической стойкостью в условиях электролиза и достаточной механической прочностью. Материалом для изготовления диафрагмы служат асбест, керамика, пластмассы. В некоторых случаях, например при электролиз расплавов, применяют металлические диафрагмы. В последние годы в процессе электролиза получают распространение ионитовые диафрагмы, проницаемые только для ионов одного заряда (катионы или анионы) не только препятствует взаимодействию продуктов электролиза, но и позволяют предотвратить или существенно уменьшить образование окисления или восстановления этих продуктов на электродах. В этом случае применяют либо погруженные диафрагмы, либо ионитовые. Количественное описание электролитических процессов. 15 Электролиз связан с наложением определённого электрического поля, под действием которого в электролите могут возникать некоторые характерные процессы. Электро-кинетические процессы происходят в тех случаях, когда одна фаза диспергированна в другой; к их числу относится электрофорез – движение взвешенных твёрдых частиц внутри жидкости. При наложении электрического поля наблюдается явление электроосмоса – движение жидкости относительно твердого тела. Аппарат для электролиза называется электролизёром или электролитической ванной. Простейшая схема электролизёра представлена на рис. 1. Корпус электролизёра изготовляют из стали, керамики, пластмассы, стекла. Для защиты от коррозии и действия высоких температур корпус электролизёра иногда изнутри гумлеируют, выкладывают пластмассой, огнеупорным кирпичём или коррозионностойкими в данной среде металлами. Для поддержания определённого теплого режима в некоторых случаях снабжают теплоизоляцией.
Количественное описание электролитических процессов. 15 Электролиз связан с наложением определённого электрического поля, под действием которого в электролите могут возникать некоторые характерные процессы. Электро-кинетические процессы происходят в тех случаях, когда одна фаза диспергированна в другой; к их числу относится электрофорез – движение взвешенных твёрдых частиц внутри жидкости. При наложении электрического поля наблюдается явление электроосмоса – движение жидкости относительно твердого тела. Аппарат для электролиза называется электролизёром или электролитической ванной. Простейшая схема электролизёра представлена на рис. 1. Корпус электролизёра изготовляют из стали, керамики, пластмассы, стекла. Для защиты от коррозии и действия высоких температур корпус электролизёра иногда изнутри гумлеируют, выкладывают пластмассой, огнеупорным кирпичём или коррозионностойкими в данной среде металлами. Для поддержания определённого теплого режима в некоторых случаях снабжают теплоизоляцией. Для изготовления катодов применяют сталь, многие цветные металлы, ртуть, свинец, платину, цинк, олово, медь, алюминий, сплавы металлов, уголь или графит. Аноды бывают растворимые и нерастворимые. Растворимые аноды изготавливают из вышеупомянутых цветных металлов, углеродной стали, некоторых других сплавов, нерастворимые аноды – из платины, графита или угля, никеля, нержавеющей стали, двуокиси свинца, двуокиси марганца, магнетита., в некоторых случаях используют биометаллические аноды, у которых тонкий слой драгоценного металла, например платины, наносится на токопроводящую основу из другого металла, инертного в данном электролите и в данных условиях. Материал для электрода выбирается с учётом многих факторов – природы исходного и конечного продуктов электролиза, природы электролита, условий проведения процесса и т.д. Электролитами могут быть минеральные или органические кислоты, соли и их смеси. В некоторых случаях электролит одновременно является исходным веществом для получения того или иного продукта электрохимического окисления или восстановления, в других случаях – лишь токопроводящей добавкой.
Для изготовления катодов применяют сталь, многие цветные металлы, ртуть, свинец, платину, цинк, олово, медь, алюминий, сплавы металлов, уголь или графит. Аноды бывают растворимые и нерастворимые. Растворимые аноды изготавливают из вышеупомянутых цветных металлов, углеродной стали, некоторых других сплавов, нерастворимые аноды – из платины, графита или угля, никеля, нержавеющей стали, двуокиси свинца, двуокиси марганца, магнетита., в некоторых случаях используют биометаллические аноды, у которых тонкий слой драгоценного металла, например платины, наносится на токопроводящую основу из другого металла, инертного в данном электролите и в данных условиях. Материал для электрода выбирается с учётом многих факторов – природы исходного и конечного продуктов электролиза, природы электролита, условий проведения процесса и т.д. Электролитами могут быть минеральные или органические кислоты, соли и их смеси. В некоторых случаях электролит одновременно является исходным веществом для получения того или иного продукта электрохимического окисления или восстановления, в других случаях – лишь токопроводящей добавкой. Растворителями для электролитов служат вода, спирты, пиридин, диметилформальдегид, ацетонитрил и некоторые другие органические соеденения или их смеси. Электролиз можно проводить и без растворителя, в расплаве электролита или смеси электролитов. 16 Применение в промышленности Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов. В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Металлы, которые не могут быть выделены из водных растворов вследствие высокого отрицательного потенциала получают в цветной металлургии электролизом расплавленных сред, в качестве которых служат соли этих металлов, содержащие добавки различных соединений, вводимые с целью понижения температуры плавления расплава, повышения электропроводности и т.
Растворителями для электролитов служат вода, спирты, пиридин, диметилформальдегид, ацетонитрил и некоторые другие органические соеденения или их смеси. Электролиз можно проводить и без растворителя, в расплаве электролита или смеси электролитов. 16 Применение в промышленности Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов. В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Металлы, которые не могут быть выделены из водных растворов вследствие высокого отрицательного потенциала получают в цветной металлургии электролизом расплавленных сред, в качестве которых служат соли этих металлов, содержащие добавки различных соединений, вводимые с целью понижения температуры плавления расплава, повышения электропроводности и т. д. К числу металлов, получаемых электролизом расплавленных сред относятся аллюминий, магний, цирконий, титан, уран, бериллий и ряд других металов. Электролиз применяют во многих отрослях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металических копий. В основу классификации промышленных ванн могут быть положены различные признаки. Например, по типу полярности ванны могут быть монополярными,биполярными и комбинировнными. В промышленных ваннах применяются различные типы катодов: неподвижные цельнометаллические, подвижные цельнометаллические(лента), неподвижные пористые неметаллические, насыпные металлические и т.д. Аноды же могут быть расходуемые(вступающие в химическую реакцию), растворимые твердые, растворимые жидкие, нерастворимые твердые и пористые, нерастворимые. Сочетание вышеперечисленных типов анодов и катодов с учетом целей электролиза приводит к следующим типам электролизеров: горизонтальные с жидким ртутным катодом, с вертикальными катодами и фильтруюшей диафрагмой, с горизонтальной диафрагмой, с проточным электролитом, с движущимися электродами, с насыпными электродами и т.
д. К числу металлов, получаемых электролизом расплавленных сред относятся аллюминий, магний, цирконий, титан, уран, бериллий и ряд других металов. Электролиз применяют во многих отрослях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металических копий. В основу классификации промышленных ванн могут быть положены различные признаки. Например, по типу полярности ванны могут быть монополярными,биполярными и комбинировнными. В промышленных ваннах применяются различные типы катодов: неподвижные цельнометаллические, подвижные цельнометаллические(лента), неподвижные пористые неметаллические, насыпные металлические и т.д. Аноды же могут быть расходуемые(вступающие в химическую реакцию), растворимые твердые, растворимые жидкие, нерастворимые твердые и пористые, нерастворимые. Сочетание вышеперечисленных типов анодов и катодов с учетом целей электролиза приводит к следующим типам электролизеров: горизонтальные с жидким ртутным катодом, с вертикальными катодами и фильтруюшей диафрагмой, с горизонтальной диафрагмой, с проточным электролитом, с движущимися электродами, с насыпными электродами и т. д. Для электролиза могут быть использованы следующие типы электролитов: водные растворы солей, кислот, оснований; неводные растворы в неорганических растворителях; неводные растворы в органических растворителях ; расплавленные соли; твердые электролиты; газы. К лучшим материалам для нерастворимых анодов относятся специальные сорта графита, двуокись свинца, магнетит, композиции на основе тантала и титана. Несмотря на большое разнообразие электролитов, электродов, электролизеров, имеются общие проблемы технического электролиза. К ним следует отнести перенос зарядов, тепла, массы, распределение электрических полей. Для ускорения процесса переноса целесообразно увеличивать скорости всех потоков и применять принудительную конвекцию. Электродные процессы могут контролироваться путем измерения предельных токов. 17 молоком. Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией. Электролиз растворов поваренной соли производится в ваннах с твердым железным (стальным) катодом и с диафрагмами и в ваннах с жидким ртутным катодом.
д. Для электролиза могут быть использованы следующие типы электролитов: водные растворы солей, кислот, оснований; неводные растворы в неорганических растворителях; неводные растворы в органических растворителях ; расплавленные соли; твердые электролиты; газы. К лучшим материалам для нерастворимых анодов относятся специальные сорта графита, двуокись свинца, магнетит, композиции на основе тантала и титана. Несмотря на большое разнообразие электролитов, электродов, электролизеров, имеются общие проблемы технического электролиза. К ним следует отнести перенос зарядов, тепла, массы, распределение электрических полей. Для ускорения процесса переноса целесообразно увеличивать скорости всех потоков и применять принудительную конвекцию. Электродные процессы могут контролироваться путем измерения предельных токов. 17 молоком. Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией. Электролиз растворов поваренной соли производится в ваннах с твердым железным (стальным) катодом и с диафрагмами и в ваннах с жидким ртутным катодом. Промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, дожны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво. Электролиз растворов хлорида натрия в ваннах со стальным катодом и графитовым анодом позволяет получать едкий натр, хлор и водород в одном электролизере. При прохождении постоянного электрического тока через водный раствор хлорида натрия можно ожидать выделения хлора: а также кислорода: (а) (б) 2OH- — 2ē→1/2О2+Н2О (а) или 2Cl- — 2ē→Cl2 (б) Нормальный электродный потенциал разряда OH- -ионов составляет +0,41 В, а нормальный электродный потенциал разряда ионов хлора равен +1,36 В. В нейтральном насыщенном растворе хлорида натрия концентрация гидроксильных ионов около 1·10-7 г-экв/л. При 25° С равновесный потенциал разряда гидроксильных ионов будет φар=0,82 В. Равновесный потенциал разряда ионов хлора при концентрации NaCl в растворе 4,6 г-экв/л равен φар=1,32 В. Следовательно, на аноде с малым перенапряжением должен в первую очередь разряжаться кислород.
Промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, дожны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво. Электролиз растворов хлорида натрия в ваннах со стальным катодом и графитовым анодом позволяет получать едкий натр, хлор и водород в одном электролизере. При прохождении постоянного электрического тока через водный раствор хлорида натрия можно ожидать выделения хлора: а также кислорода: (а) (б) 2OH- — 2ē→1/2О2+Н2О (а) или 2Cl- — 2ē→Cl2 (б) Нормальный электродный потенциал разряда OH- -ионов составляет +0,41 В, а нормальный электродный потенциал разряда ионов хлора равен +1,36 В. В нейтральном насыщенном растворе хлорида натрия концентрация гидроксильных ионов около 1·10-7 г-экв/л. При 25° С равновесный потенциал разряда гидроксильных ионов будет φар=0,82 В. Равновесный потенциал разряда ионов хлора при концентрации NaCl в растворе 4,6 г-экв/л равен φар=1,32 В. Следовательно, на аноде с малым перенапряжением должен в первую очередь разряжаться кислород. Однако на графитовых анодах перенапряжение кислорода много выше перенапряжения хлора и поэтому на них будет происходить в основном разряд ионов Cl- с выделением газообразного хлора по реакции (а). Выделение хлора облегчается при увелечении концентрации NaCl в растворе вследствии уменьшения при этом равновесного потенциала. Это является одной из причин использования при электролизе концентрированных растворов хлорида натрия, содержащих 310-315 г/л. На катоде в щелочном растворе происходит разряд молекул воды по уравнению h3O + ē→H + OH- Атомы водорода после рекомбинации выделяются в виде молекулярного водорода: 2H→h3 Разряд ионов натрия из водных растворов на твердом катоде невозможен вследствии более высокого потенциала их разряда по сравнению с водородом. Поэтому остающиеся в растворе гидроксильные ионы образуют с ионами натрия раствор щелочи. Процесс разложения NaCl можно выразить следующими реакциями: 2Cl- — 2ē→Cl2 Н2О + ē=2Н + ОН- 20 2H→h3 Просуммировав уравнения получим: 2Н2О + 2Cl-→ Cl2 + h3 + 2ОН- или 2Н2О + 2NaCl→ Cl2 + h3 + 2NaOH Тоесть на аноде идет образование хлора, а у катода – водорода и едкого натра.
Однако на графитовых анодах перенапряжение кислорода много выше перенапряжения хлора и поэтому на них будет происходить в основном разряд ионов Cl- с выделением газообразного хлора по реакции (а). Выделение хлора облегчается при увелечении концентрации NaCl в растворе вследствии уменьшения при этом равновесного потенциала. Это является одной из причин использования при электролизе концентрированных растворов хлорида натрия, содержащих 310-315 г/л. На катоде в щелочном растворе происходит разряд молекул воды по уравнению h3O + ē→H + OH- Атомы водорода после рекомбинации выделяются в виде молекулярного водорода: 2H→h3 Разряд ионов натрия из водных растворов на твердом катоде невозможен вследствии более высокого потенциала их разряда по сравнению с водородом. Поэтому остающиеся в растворе гидроксильные ионы образуют с ионами натрия раствор щелочи. Процесс разложения NaCl можно выразить следующими реакциями: 2Cl- — 2ē→Cl2 Н2О + ē=2Н + ОН- 20 2H→h3 Просуммировав уравнения получим: 2Н2О + 2Cl-→ Cl2 + h3 + 2ОН- или 2Н2О + 2NaCl→ Cl2 + h3 + 2NaOH Тоесть на аноде идет образование хлора, а у катода – водорода и едкого натра. При электролизе наряду с основными описанными процессами могут протекать и побочные, один из которых описывается уравнением (б). Помимо этого, хлор, выделяющийся на аноде, частично растворяется в электролите и гидролизуется по реакции Cl2 + Н2О↔НОCl + НCl В случае диффузии щелочи (ионов ОН-) к аноду или смешения катодных и анодных продуктов хлорноватистая и соляная кислоты нейтрализуются щелочью с образованием гипохлорита и хлорида натрия: НОC + NaOH=NaOC + Н2О HCl + NaOH=NaCl + Н2О Ионы ClO- на аноде легко окисляются в ClO3- . Следовательно, из-за побочных процессов при электролизе будут образовываться гипохлорит, хлорид и хлорат натрия, что снижает выход по току и коэфициент использования энергии. В щелочной среде облегчается выделение кислорода на аноде, что также будет ухудшать показатели электролиза. Чтобы уменьшить протекание побочных реакций, следует создать условия, препятствующие смешению катодных и анодных продуктов. К ним относятся разделение катодного и анодного пространств диафрагмой и фильтрация электролита через диафрагму в направлении, противоположном движению ОН- -ионов к аноду.
При электролизе наряду с основными описанными процессами могут протекать и побочные, один из которых описывается уравнением (б). Помимо этого, хлор, выделяющийся на аноде, частично растворяется в электролите и гидролизуется по реакции Cl2 + Н2О↔НОCl + НCl В случае диффузии щелочи (ионов ОН-) к аноду или смешения катодных и анодных продуктов хлорноватистая и соляная кислоты нейтрализуются щелочью с образованием гипохлорита и хлорида натрия: НОC + NaOH=NaOC + Н2О HCl + NaOH=NaCl + Н2О Ионы ClO- на аноде легко окисляются в ClO3- . Следовательно, из-за побочных процессов при электролизе будут образовываться гипохлорит, хлорид и хлорат натрия, что снижает выход по току и коэфициент использования энергии. В щелочной среде облегчается выделение кислорода на аноде, что также будет ухудшать показатели электролиза. Чтобы уменьшить протекание побочных реакций, следует создать условия, препятствующие смешению катодных и анодных продуктов. К ним относятся разделение катодного и анодного пространств диафрагмой и фильтрация электролита через диафрагму в направлении, противоположном движению ОН- -ионов к аноду. Такие диафрагмы называются фильтрующими диафрагмами и выполняются из асбеста. 21 Экспериментальная часть. Электролиз мы проводили на кафедре химии в УрГУ. Электролиз проводился при силе тока 2 А. Электролизер состоял из стеклянной электролитической ванны и графитовых электродов. Вещество Анодные процессы (+) φ Катодные процессы (-) φ 1. KJ J-;OH-;Н2O 2J—2ē→J2 +0,53 h3O; H+; K+ 2h3O + 2ē→h3 + 2OH- -0,41 Суммарное уравнение 2h3O + 2J-→ h3 + 2OH- + J2 или 2h3O + 2KJ→ h3 + 2KOH + J2 2. Pb(NO3)2 NO3-OH-;h3O 2h3O – 4ē→О2 + 4H+ +1,23 h3O; H+; Pb2+ Pb2+ + 2ē→Pb 2h3O + 2ē→h3+2OH- -0,13 -0,41 Суммарное уравнение Pb2+ + 2h3O →Pb + О2 + h3 + 2H+ или Pb(NO3)2 + 2h3O→ Pb + О2 + h3 + 2HNO3 3.Al2(SO4)3 SO42-;OH-;h3O 2h3O — 4ē→О2 + 4H+ +1,23 h3O; H+; Al3+ 2h3O + 2ē→h3 +2OH- │2 -0,41 Суммарное уравнение 6h3O→h3 + 4OH- + О2 + 4H+ или 2h3O→2h3 + О2 4.ZnCl2 Cl-;OH-;h3O 2Cl- — 2ē→Cl2 │2 +1,36 h3O; H+; Zn2+ Zn2+ + 2ē→Zn 2h3O + 2ē→h3+2OH- -0,76 -0,41 Суммарное уравнение Zn2+ + 4Cl- + 2h3O→Zn + h3 + 2OH- + 2Cl2 2ZnCl2 + 2h3O→Zn + h3 + Zn(ОН)2 + 2Cl2 Наблюдения 1.
Такие диафрагмы называются фильтрующими диафрагмами и выполняются из асбеста. 21 Экспериментальная часть. Электролиз мы проводили на кафедре химии в УрГУ. Электролиз проводился при силе тока 2 А. Электролизер состоял из стеклянной электролитической ванны и графитовых электродов. Вещество Анодные процессы (+) φ Катодные процессы (-) φ 1. KJ J-;OH-;Н2O 2J—2ē→J2 +0,53 h3O; H+; K+ 2h3O + 2ē→h3 + 2OH- -0,41 Суммарное уравнение 2h3O + 2J-→ h3 + 2OH- + J2 или 2h3O + 2KJ→ h3 + 2KOH + J2 2. Pb(NO3)2 NO3-OH-;h3O 2h3O – 4ē→О2 + 4H+ +1,23 h3O; H+; Pb2+ Pb2+ + 2ē→Pb 2h3O + 2ē→h3+2OH- -0,13 -0,41 Суммарное уравнение Pb2+ + 2h3O →Pb + О2 + h3 + 2H+ или Pb(NO3)2 + 2h3O→ Pb + О2 + h3 + 2HNO3 3.Al2(SO4)3 SO42-;OH-;h3O 2h3O — 4ē→О2 + 4H+ +1,23 h3O; H+; Al3+ 2h3O + 2ē→h3 +2OH- │2 -0,41 Суммарное уравнение 6h3O→h3 + 4OH- + О2 + 4H+ или 2h3O→2h3 + О2 4.ZnCl2 Cl-;OH-;h3O 2Cl- — 2ē→Cl2 │2 +1,36 h3O; H+; Zn2+ Zn2+ + 2ē→Zn 2h3O + 2ē→h3+2OH- -0,76 -0,41 Суммарное уравнение Zn2+ + 4Cl- + 2h3O→Zn + h3 + 2OH- + 2Cl2 2ZnCl2 + 2h3O→Zn + h3 + Zn(ОН)2 + 2Cl2 Наблюдения 1. На аноде интенсивное выделение газа, на катоде образование бурого окрашивания. Почувтсвовали характерный запах йода. После добавления крахмала раствор окрасился в синий цвет, что еще раз доказало присутствие йода. 22 25 Стандартные электродные потенциалы некоторых окислительно- 26 восстановительных систем № Окисленная форма Восстановленн ая форма Уравнение реакции В 1. Li+ Li Li+ + 1ē↔Li -3,05 2. K+ K K+ + 1ē↔K -2,92 3. Ba2+ Ba Ba2+ + 2ē ↔Ba -2,90 4. Ca2+ Ca Ca2+ + 2ē ↔Ca -2,87 5. Na+ Na Na+ + 1ē↔Na -2,71 6. Mg2+ Mg Mg2+ + 2ē↔Mg -2,36 7. Al3+ Al Al3+ + 3ē↔Al -1,66 8. Mn2+ Mn Mn2+ + 2ē↔Mn -1,05 9. SO32- S SO32- + 4ē + 3h3O ↔ S + 6OH- -0,90 10. SO42- SO32- SO42- + 2ē + h3O ↔ SO32- + 2OH- -0,90 11. NO3- NO2 NO3- + ē + h3O ↔ NO2 + 2OH- -0,85 12. h3O h3 h3O + 2ē↔ h3 + 2OH- -0,83 13. Zn2+ Zn Zn2+ + 2ē ↔Zn -0,76 14. Cr3+ Cr Cr3+ + 3ē↔Cr -0,74 15. Fe2+ Fe Fe2+ + 2ē↔Fe -0,44 16. Ni2+ Ni Ni2+ + 2ē↔Ni -0,25 17. Sn2+ Sn Sn2+ + 2ē↔Sn -0,14 18. Pb2+ Pb Pb2+ + 2ē↔Pb -0,13 19. 2H+ h3 2H+ + 2ē↔h3 0,00 20.
На аноде интенсивное выделение газа, на катоде образование бурого окрашивания. Почувтсвовали характерный запах йода. После добавления крахмала раствор окрасился в синий цвет, что еще раз доказало присутствие йода. 22 25 Стандартные электродные потенциалы некоторых окислительно- 26 восстановительных систем № Окисленная форма Восстановленн ая форма Уравнение реакции В 1. Li+ Li Li+ + 1ē↔Li -3,05 2. K+ K K+ + 1ē↔K -2,92 3. Ba2+ Ba Ba2+ + 2ē ↔Ba -2,90 4. Ca2+ Ca Ca2+ + 2ē ↔Ca -2,87 5. Na+ Na Na+ + 1ē↔Na -2,71 6. Mg2+ Mg Mg2+ + 2ē↔Mg -2,36 7. Al3+ Al Al3+ + 3ē↔Al -1,66 8. Mn2+ Mn Mn2+ + 2ē↔Mn -1,05 9. SO32- S SO32- + 4ē + 3h3O ↔ S + 6OH- -0,90 10. SO42- SO32- SO42- + 2ē + h3O ↔ SO32- + 2OH- -0,90 11. NO3- NO2 NO3- + ē + h3O ↔ NO2 + 2OH- -0,85 12. h3O h3 h3O + 2ē↔ h3 + 2OH- -0,83 13. Zn2+ Zn Zn2+ + 2ē ↔Zn -0,76 14. Cr3+ Cr Cr3+ + 3ē↔Cr -0,74 15. Fe2+ Fe Fe2+ + 2ē↔Fe -0,44 16. Ni2+ Ni Ni2+ + 2ē↔Ni -0,25 17. Sn2+ Sn Sn2+ + 2ē↔Sn -0,14 18. Pb2+ Pb Pb2+ + 2ē↔Pb -0,13 19. 2H+ h3 2H+ + 2ē↔h3 0,00 20. Cu2+ Cu Cu2+ + 2ē↔Cu 0,34 21. Ag+ Ag Ag+ + 1ē↔Ag 0,80 22. NO3- NO2 NO3- + ē + 2H+↔ NO2 + h3O 0,81 23. Br2 2Br- Br2 + 2ē↔2Br- 1,07 24. O2 h3O O2 + 4ē + 4H+↔2h3O 1,23 25. Cl2 2Cl- Cl2 + 2ē↔2Cl- 1,36 26. Au3+ Au Au3+ + 3ē↔Au 1,50 27. F2 2F- F2 + 2ē↔2F- 2,87 27
Cu2+ Cu Cu2+ + 2ē↔Cu 0,34 21. Ag+ Ag Ag+ + 1ē↔Ag 0,80 22. NO3- NO2 NO3- + ē + 2H+↔ NO2 + h3O 0,81 23. Br2 2Br- Br2 + 2ē↔2Br- 1,07 24. O2 h3O O2 + 4ē + 4H+↔2h3O 1,23 25. Cl2 2Cl- Cl2 + 2ē↔2Cl- 1,36 26. Au3+ Au Au3+ + 3ē↔Au 1,50 27. F2 2F- F2 + 2ē↔2F- 2,87 27
Электролиз (2) (Реферат) — TopRef.ru
М
Екатеринбург 2001г.
инистерство общего и профессионального образованияСвердловской области
МОУО г.Екатеринбурга
образовательное
учреждение муниципальная школа
общего
среднего образования №135
Чкаловского района
Образовательная область
естествознание
Предмет химия
ЭИсполнители: учащиеся 11
класса «Д»
Саламатов Евгений Дмитриевич
Казаков Евгений Анатольевич
Научный руководитель:
Полянская Ольга Анатольевна.
учитель химии школы №135
Рецензент районого тура:
Нохлин
Сергей Семенович.
доцент кафедры неорганической
химии УрГУ
ЛЕКТРОЛИЗВведение
Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электролиз является одним из важнейших направлений в электрохимии.
Электрохимия принадлежит к числу тех немногих наук, дата рождения которых может быть установлена с высокой точностью. Это рубеж XVIII и XIX веков, когда благодаря знаменитым опытам итальянского физиолога Л. Гальвани и созданию итальянским физиком А. Вольта в 1799 г. «вольтова столба» — первого в истории человечества химического источника тока -были сформулированы проблемы, решение которых определило основные задачи электрохимии. «Без химии путь к познанию истинной природы электричества закрыт» — сказал М.В. Ломоносов. И, действительно, как бы следуя словам великого ученого, создавалась и развивается наука – электрохимия.
Еще
в начале позапрошлого столетия было
установлено, что при прохождении
электрического тока через водные
растворы солей происходят химические
превращения, приводящие к образованию
новых веществ. В результате этого, в
начале прошлого века возникло научное
направление по изучению электрохимических
процессов в растворах и расплавах
веществ – электрохимия. К концу
семидесятых годов оно разделилось на
два самостоятельных раздела – ионику,
изучающую явления электропроводности
и движения заряженных частиц под
воздействием электрического поля, и
электродику, изучающую явления
происходящие непосредственно на
поверхности электродов, когда через
границу электрод-раствор (расплав)
протекает электрический ток.
Химические превращения, происходящие
при воздействии электрического тока
на вещества, называются электролитическими.
В результате этого, в
начале прошлого века возникло научное
направление по изучению электрохимических
процессов в растворах и расплавах
веществ – электрохимия. К концу
семидесятых годов оно разделилось на
два самостоятельных раздела – ионику,
изучающую явления электропроводности
и движения заряженных частиц под
воздействием электрического поля, и
электродику, изучающую явления
происходящие непосредственно на
поверхности электродов, когда через
границу электрод-раствор (расплав)
протекает электрический ток.
Химические превращения, происходящие
при воздействии электрического тока
на вещества, называются электролитическими.
Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода.
Технический или
прикладной электролиз характеризуется
сложностью протекающих в промышленных
условиях электролитических процессов,
различными видами электролиза, их
зависимостью от природы электролита,
типа электролитической ванны, оптимизации
самих электролизных процессов.
Электролитические процессы классифицируются следующим образом:
получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.)
получение металлов(литий, натрий, калий, берилий, магний, цинк, алюминий, медь и т.д.)
очистка металлов(медь, серебро,…)
получение металлических сплавов
получение гальванических покрытий
обработка поверхностей металлов(азотирование, борирование,электрополировка, очистка)
получение органических веществ
электродиализ и обессоливание воды
нанесение пленок при помощи электрофореза
Актуальность
электролиза объясняется тем, что многие
вещества получают именно этим способом.
Например, такие металлы как никель,
натрий, чистый водород и другие, получают
только с помощью этого метода. Кроме
того с его помощью электролиза
относительно легко можно получить
чистые металлы, массовая доля самого
элемента в которых стремиться к ста
процентам.
На сегодняшний день большой популярностью пользуются различные предметы, покрытые драгоценными металлами. (позолоченные или посеребренные вещи).
К тому же металлические изделия покрывают слоем другого металла электролитическим способомс целью защитить его от коррозии.
Таким образом, исследование электрохимических процессов, определение факторов, влияющих на них, установление новых способов использования процессов электролиза в промышленных условиях сохранило свою актуальность и востребованность в наши дни.
В своей работе нами были определены следующие задачи:
— ознакомление с теоритическими основами электролитических процессов;
— определить влияние различных факторов на качественный и количественный состав продуктов электролиза;
— выделить области практического применения электролиза;
—
экспериментально определить влияние
качественного состава исходного
электролита на состав продуктов
электролиза.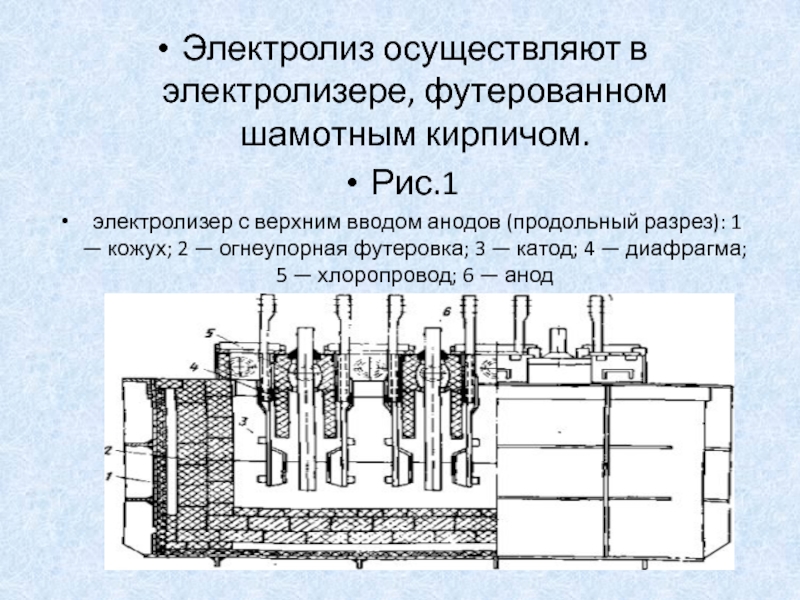
Теоритеческое обоснование процессов электролиза.
Электролиз протекает только в тех средах, которые проводят электрический ток. Способностью проводить ток обладают также водные растворы оснований и солей. Безводные кислоты – очень плохие проводники, но водные растворы кислот хорошо проводят ток. Растворы кислот, оснований и солей в других жидкостях в большинстве случаев тока не проводят, но и осмотическое давление таких растворов оказывается нормальным, точно так же не проводят тока водные растворы сахара, спирта, глицерина и другие растворы с нормальным осмотическим давлением.
Различные отношения веществ к электрическому току можно иллюстрировать следующим опытом.
Соеденим
провода идущие от осветительной сети,
с двумя угольными электродами. В один
из проводов включим электрическую
лампу, позволяющую грубо судить о наличии
тока в цепи. Погрузим теперь свободные
концы электродов в сухую поваренную
соль или безводную серную кислоту. Лампа
не загорается, т.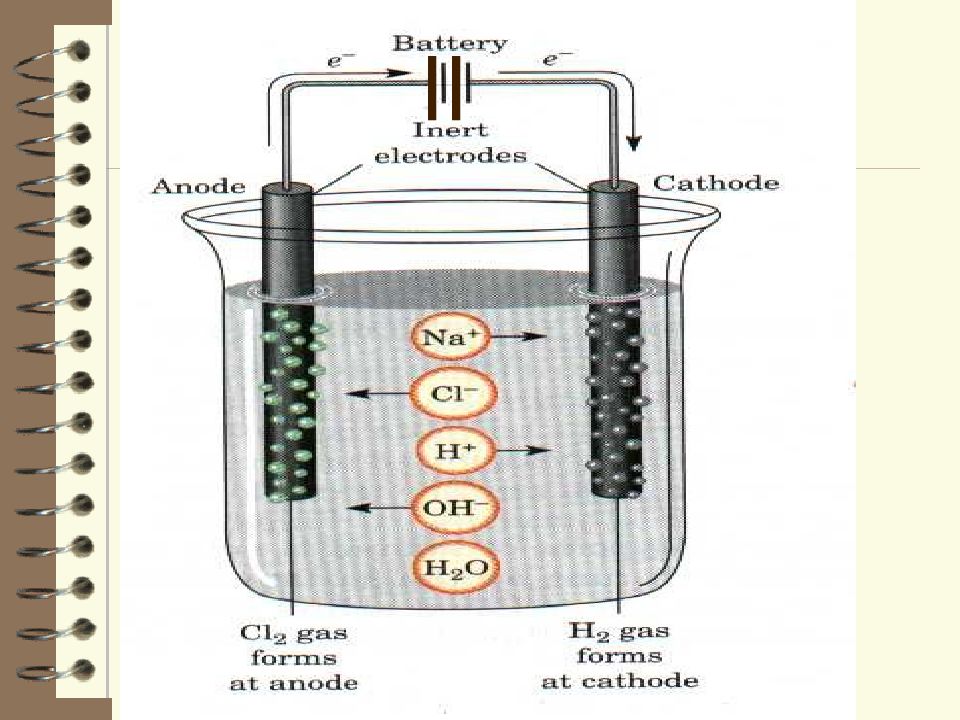 к. эти вещества не
проводят тока и цепь остается не
замкнутой. То же самое происходит, если
погрузить электроды в стакан с чистой
дестиллированной водой. Но стоит только
растворить в воде немного соли или
прибавить к ней какой-нибудь кислоты
или основания, как лампа тотчас же
начинает ярко светиться. Свечение
прекращается если опустить электроды
в раствор сахара или глицерина и т.п.
к. эти вещества не
проводят тока и цепь остается не
замкнутой. То же самое происходит, если
погрузить электроды в стакан с чистой
дестиллированной водой. Но стоит только
растворить в воде немного соли или
прибавить к ней какой-нибудь кислоты
или основания, как лампа тотчас же
начинает ярко светиться. Свечение
прекращается если опустить электроды
в раствор сахара или глицерина и т.п.
Таким образом, среди растворов способностью проводить ток обладают преимущественно водные растворы кислот, оснований и солей. Сухие соли, безводные кислоты и основания (в твердом виде) тока не проводят; почти не проводит тока чистая вода, очевидно, что при растворении в воде кислоты основания или соли подвергаются каким-то глубоким изменениям, которые и обуславливают электропроводность получаемых растворов.
Электрический
ток, проходя через растворы, вызывает
в них, так же как и в расплавах, химические
изменения, выражающиеся в том, что из
растворов выделяются продукты разложения
растворенного вещества или растворителя.
Химический процесс, происходящий при пропускании тока через раствор электролита, называется электролизом. Исследуя продукта, выделяющиеся у электрода, при электролизе кислот, оснований и солей, установили, что у катодов всегда выделяются металлы и водород, а у анода кислотные остатки или гидроксильные группы, которые затем подвергаются дальнейшим изменениям. Таким образом, первичными продуктами электролиза оказываются те же части кислот, оснований и солей, которые при реакциях обмена, не изменяются, переходят из одного вещества в другое.
Теперь, рассмотрим процесс электролиза подробнее.
Через
проводники первого рода электричество
переносится электронами, а через
проводники второго рода—ионами. В тех
местах электрической цепи, где проводник
первого рода граничит с проводником
второго рода, электроны вступают во
взаимодействие с ионами—происходят
электрохимические процессы. Если эти
процессы протекают самопроизвольно,
то система называется химическим
источником энергии. Если же их протекание
обусловлено подводом электрической
энергии извне, то происходит электролиз.
Если эти
процессы протекают самопроизвольно,
то система называется химическим
источником энергии. Если же их протекание
обусловлено подводом электрической
энергии извне, то происходит электролиз.
Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCl2 катионы магния по действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются.
Электролиз | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Раздел: Электрохимия
Открытие электролиза стало возможным после изобретения Вольтом батареи гальванических элементов (1799). Уже в 1800 г. английские исследователи Никольсон и Карлейль открыли электролиз: они установили, что при прохождении постоянного тока в воде или водных растворах вода распадается на водород и кислород. Более поздние исследования были завершены в 1833 г. Майклом Фарадеем в виде законов. Ионы, образующие ток в электролитах (рис. 7.16), имеют названия:
Более поздние исследования были завершены в 1833 г. Майклом Фарадеем в виде законов. Ионы, образующие ток в электролитах (рис. 7.16), имеют названия:
Анионы (гр. — восходящий) — отрицательно заряженные ионы, движущиеся к аноду;
Катионы (идущие книзу) — положительно заряженные ионы, движущиеся к катоду.
При прохождении тока через электролит ионы подходят к электродам, где могут; выделяться на электродах, нейтрализоваться на них, вступать во вторичные реакции с электродами или же с растворителем. Продукты вторичных реакций выделяются на электродах или переходят в раствор.
В упрощенном понимании:
выделение на электродах составных электролита при прохождении тока в нем называется электролизом.
| Рис. 7.16. Ток в электролитах |
Рассмотрим примеры:
а)
- Электролит — водный раствор HCl.

- Диссоциация: HCl ⇆ H+ + Cl—.
- Анод: 2Cl— — 2e— → Cl2.
- Катод: 2H+ + 2e— → H2.
Здесь расходуется растворенное вещество, а на электродах выделяются газообразные водород и хлор. Вторичных реакций нет.
б)
- Водный раствор H2SO4.
- Диссоциация: H2SO4 ⇆ 2H+ + SO2-4; H2O ⇆ H+ + OH—.
- Анод: 4OH— — 4e— → 2H2O + O2.
- Катод: 2H+ + 2e— → H2.
- В растворе остается: SO2-4 + 2H+ → H2SO4. Материал с сайта http://worldofschool.ru
Эта реакция происходит, если электроды изготовлены из платины или никеля. Кислород выделяется на аноде.
Кислород выделяется на аноде.
в)
- Электроды медные. Водный раствор CuSO4.
- Диссоциация: CuSO4 ⇆ Cu2+ + SO2-4; H2O ⇆ H+ + OH—.
- Катод: Cu2+ + 2e— → Cu0 — выделяется на катоде.
- Анод: 4OH— — 4e— → 2H2O + O2 — кислород выделяется на аноде.
Анод растворяется, а медь выделяется на катоде.
На этой странице материал по темам:Электролиз физика формулы
Как применяется электролиз кратко
Электролиз физика
Знак и величину заряда иона обозначают правым верхним индексом.
Что называется электролизом?
Электролиз. Электролиз растворов.
 Электролиз расплавов
Электролиз расплавовЭлектролиз — это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз — это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода (какие электроды бывают и какой в каком случае брать — рассказано дальше) и, конечно, электролит. Электролит — это раствор, который проводит электрический ток.
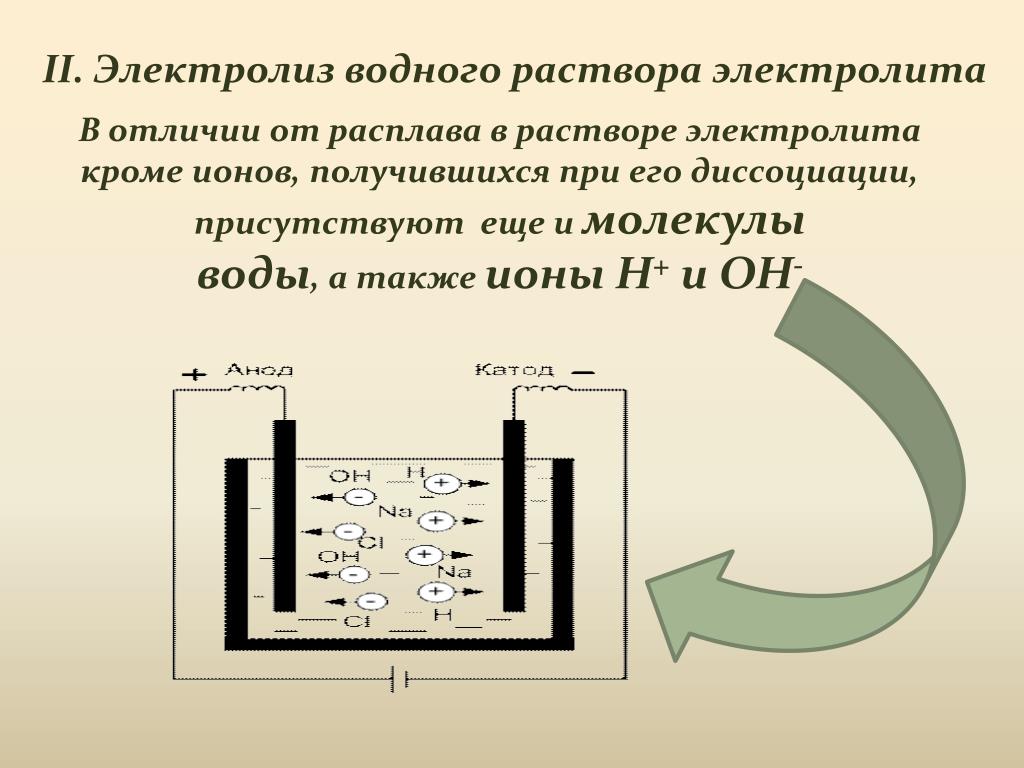
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие — в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита. Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электрод, заряженный положительно — анод. Электрод, заряженный отрицательно — катод. При электролизе происходит окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют инертным электродом. В качестве инертного анода можно взять графит (углерод) или платину.
В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
В домашних условиях, из тех веществ, что имеются практически у каждого, можно без труда получить, например, кислород, водород, хлор, медь, серу, а также слабую кислоту или щёлочь! Но будьте осторожны с хлором — этот газ ядовит!
Первый опыт проведём с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (можно взять кальцинированную соду), опустите туда электроды и включите источник питания. Как только ток пойдёт через раствор, сразу станут заметны пузырьки газа, которые образуются у электродов: у «+» будет выделяться кислород, у «-» водород. Именно такое распределение газов происходит из-за того, что возле анода «+» происходит скопление отрицательных ионов OH—, и восстановление кислорода, а возле катода «-» скапливаются ионы щелочного металла, которые содержатся в кальцинированной соде (Na2CO3), имеющие положительный заряд (Na+) и одновременно происходит восстановление водорода. Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Li <K <Rb <Cs <Ba <Ca <Na <Mg <Al <Mn <Cr <Zn <Fe <Cd <Co <Ni <Sn <Pb <h3 <Cu <Ag <Hg <Pt <Au
В следующем опыте по электролизу будем получать чистую медь (Cu).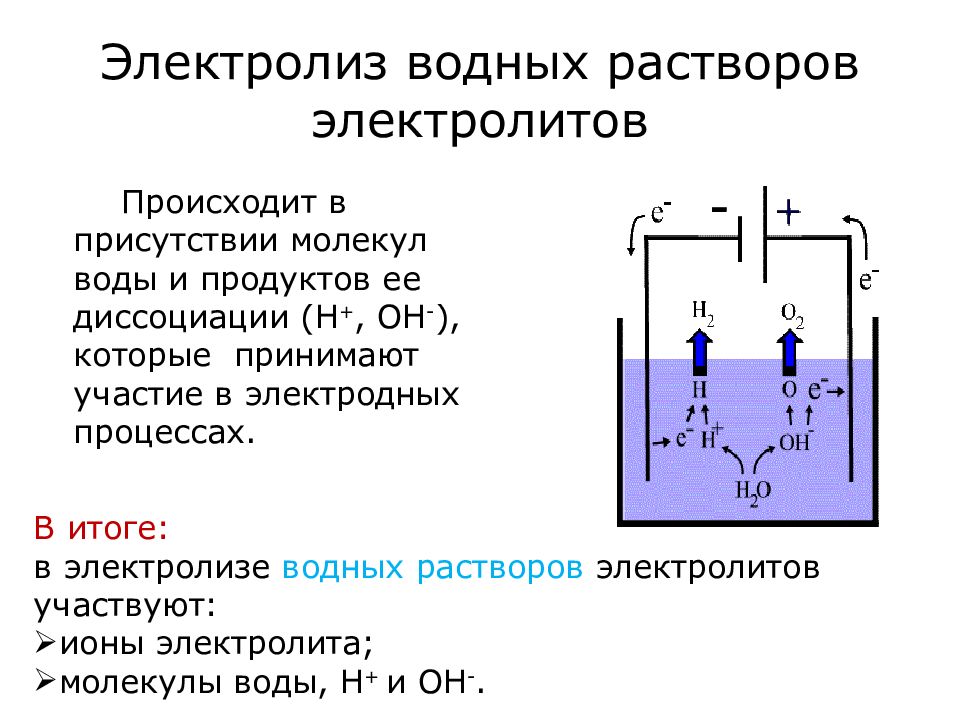
Для этого нам потребуется раствор медного купороса CuSO4, который содержит растворённую медь. Медь стоит в ряду напряжений металлов после водорода, поэтому она и будет выделятся на электроде. Приготовьте раствор медного купороса, опустите в него электроды и включите источник питания. Как и в предыдущем опыте с раствором кальцинированной соды, на адоде «+» будет восстанавливаться кислород. В то же время катод «-» будет покрываться тёмно-красным слоем меди, которая восстанавливается из раствора до чистого металла.
Мы провели 2 опыта по электролизу растворов и можем подвести результат:
При пропускании тока через раствор на положительном электроде — аноде — восстанавливаются отрицательно заряженные ионы (в нашем случае — кислород). Отрицательно заряженные ионы ещё называют анионами. На отрицательном электроде — катоде — восстанавливаются положительные ионы (в нашем случае это водород и медь).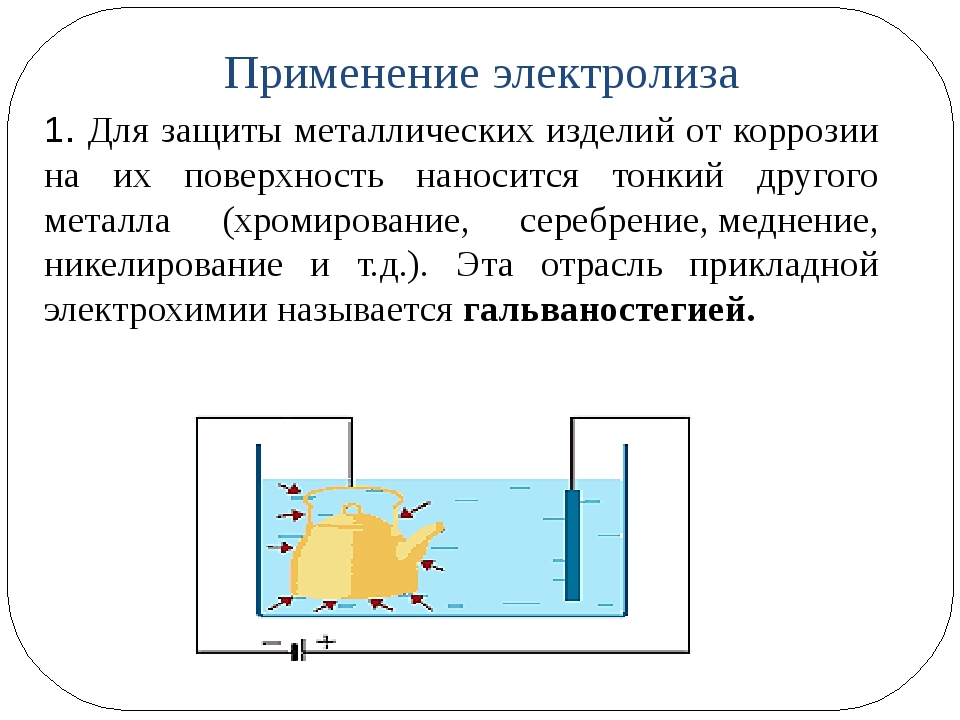 Положительные ионы называют катионами.
Катионами обычно выступают все металлы и водород. Но в некоторых химических соединениях катионами являются газы и неметаллы.
Это зависит от степени окисления элемента в химическом соединении.
Положительные ионы называют катионами.
Катионами обычно выступают все металлы и водород. Но в некоторых химических соединениях катионами являются газы и неметаллы.
Это зависит от степени окисления элемента в химическом соединении.
Проведём ещё один опыт по электролизу. На этот раз мы будем пропускать ток через раствор поваренной соли (NaCl).
Но должен заранее предупредить, этот электролиз нужно проводить в хорошо проветриваемой комнате, так как выделяемый из раствора чистый газ — хлор (Cl2) очень токсичен. Если хотите собрать этот газ (иди какой-нибудь другой), то можно воспользоваться предложенной ниже схемой:
Электролиз раствора поваренной соли. Схема сбора газа
Итак, начнём. Приготовьте раствор поваренной соли (NaCl). К положительному полюсу источника питания подключите инертный электрод (например — графитовый стержень), к отрицательному — подойдёт любой материал, проводящий ток. Опустите в него электроды и включите источник питания. Через несколько секунд уже можно почувствовать неприятный запах хлорки (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде мелких пузырьков у анода («+»). Чем дольше будет длиться процесс электролиза, тем больше концентрация хлора будет возле электролита. Если вы собираете хлор в пробирку или банку (хлор тяжелее воздуха, он будет находится на дне), не пробуйте «нюхать»его в банке — можно сильно отравится! (Статья о хлоре).
На аноде выделяется чистый газ хлор. При этом на катоде из раствора восстанавливается чистый водород (H2) и восстанавливаться натрий, который будет тут же вступать в реакцию с водой, образуя натриевую щёлочь.
Опустите в него электроды и включите источник питания. Через несколько секунд уже можно почувствовать неприятный запах хлорки (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде мелких пузырьков у анода («+»). Чем дольше будет длиться процесс электролиза, тем больше концентрация хлора будет возле электролита. Если вы собираете хлор в пробирку или банку (хлор тяжелее воздуха, он будет находится на дне), не пробуйте «нюхать»его в банке — можно сильно отравится! (Статья о хлоре).
На аноде выделяется чистый газ хлор. При этом на катоде из раствора восстанавливается чистый водород (H2) и восстанавливаться натрий, который будет тут же вступать в реакцию с водой, образуя натриевую щёлочь.
Электролиз расплавов
При электролизе расплавов в процессе участвуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ — хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл — натрий (Na). Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы.
Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы.
Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
Больше чем просто источник энергии
Водород используется в различных промышленных процессах, начиная от производства синтетического топлива и нефтехимии до изготовления полупроводников и электромобилей на водородных топливных элементах. Чтобы уменьшить вредное воздействие на окружающую среду в связи с производством 70 млн тонн водорода в год, некоторые страны обращаются к ядерной энергетике.
«Например, перевод всего лишь 4% текущего производства водорода на электроэнергию, вырабатываемую АЭС, позволил бы уменьшить выбросы углекислого газа на 60 млн тонн в год, — объясняет Хамис. — А если бы весь водород производился с использованием ядерной энергии, то можно было бы говорить о сокращении выбросов углекислого газа на более чем 500 млн тонн в год».
Ядерные энергетические реакторы могут быть соединены с установкой по производству водорода в единую систему когенерации для экономически эффективного производства одновременно электроэнергии и водорода. При производстве водорода когенерационная система оснащается компонентами либо для электролиза, либо для термохимических процессов. Электролиз — это процесс выделения водорода и кислорода из молекул воды с помощью постоянного электрического тока. Электролиз воды проходит при относительно низких температурах от 80°C до 120°C, в то время как электролиз водяного пара проводится при гораздо более высоких температурах и поэтому является более эффективным. Электролиз пара может идеально подходить для интеграции с усовершенствованными высокотемпературными АЭС, поскольку для этого процесса требуется подвод теплоносителя с температурой от 700°C до 950°C.
Термохимические процессы позволяют производить водород с помощью химических реакций с определенными соединениями при высоких температурах для расщепления молекул воды.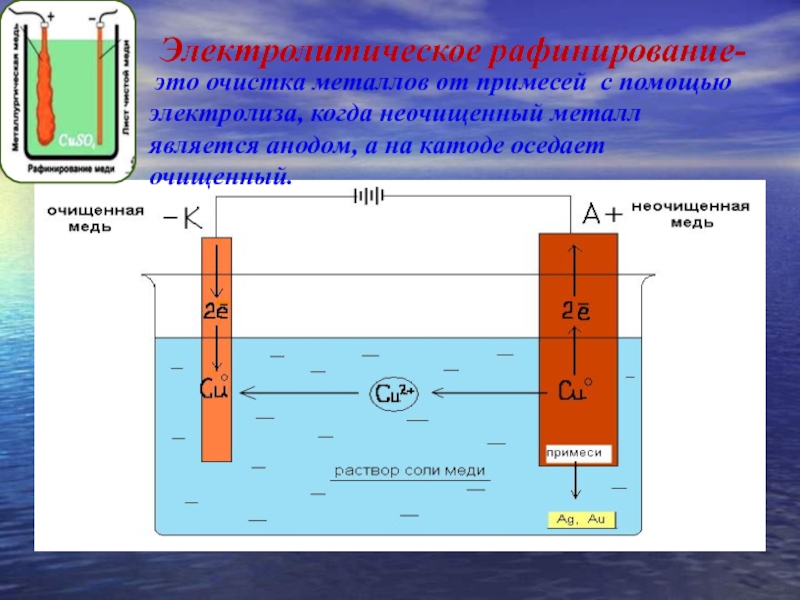 Усовершенствованные ядерные реакторы, способные работать при очень высоких температурах, также могут использоваться в целях производства тепла для этих процессов.
Усовершенствованные ядерные реакторы, способные работать при очень высоких температурах, также могут использоваться в целях производства тепла для этих процессов.
«Производство водорода с использованием серно-йодного цикла, в частности, имеет большой потенциал в плане расширения масштабов применения для обеспечения устойчивой и долгосрочной эксплуатации, — рассказывает Хамис. — Разработка этого метода с использованием конструкций японского реактора HTTR и китайских конструкций HTR‑PM 600 и HTR‑10 является весьма многообещающей, в рамках других исследовательских инициатив также продолжает наблюдаться отличный прогресс».
В настоящее время несколько стран внедряют производство водорода с использованием АЭС или изучают такую возможность в целях содействия декарбонизации своего энергетического, промышленного и транспортного секторов. Это позволяет также увеличить отдачу от АЭС, что может способствовать повышению ее рентабельности.
МАГАТЭ оказывает поддержку странам, заинтересованным в производстве водорода, посредством различных инициатив, в том числе проектов координированных исследований и технических совещаний. Оно разработало также Программу экономической оценки водорода (HEEP) — инструмент для проведения экономической оценки крупномасштабного производства водорода с помощью ядерной энергии. В начале 2020 года МАГАТЭ запустило также электронный учебный курс, посвященный производству водорода с помощью ядерной когенерации.
Оно разработало также Программу экономической оценки водорода (HEEP) — инструмент для проведения экономической оценки крупномасштабного производства водорода с помощью ядерной энергии. В начале 2020 года МАГАТЭ запустило также электронный учебный курс, посвященный производству водорода с помощью ядерной когенерации.
«Производство водорода с использованием АЭС имеет большой потенциал в плане содействия усилиям по декарбонизации, но сначала необходимо решить ряд вопросов, таких как определение экономической целесообразности включения производства водорода в более широкую энергетическую стратегию, — говорит Хамис. — Для производства водорода с помощью термохимических процессов расщепления воды требуются инновационные реакторы, работающие при очень высоких температурах, однако в ближайшие годы ввод таких реакторов в эксплуатацию не ожидается. Аналогичным образом, чтобы серно-йодный процесс окончательно оформился и мог использоваться в коммерческих масштабах, нужно еще несколько лет НИОКР». Он добавляет, что с лицензированием ядерно-энергетических систем, включающих не связанные с производством электроэнергии применения, также могут возникать сложности.
Он добавляет, что с лицензированием ядерно-энергетических систем, включающих не связанные с производством электроэнергии применения, также могут возникать сложности.
Датский консорциум планирует электролиз мощностью 1,3 ГВт на основе ветровой энергии
Аэропорты Копенгагена и скандинавские компании AP Moller — Maersk, DSV Panalpina, DFDS, SAS и Ørsted объединись для реализации комплексного проекта по производству и потреблению зеленого водорода.
Н2 будет вырабатываться электролизом с помощью офшорной ветровой электроэнергии, за которую будет отвечать Ørsted, один из крупнейших мировых игроков в офшорной ветроэнергетике. Кстати, компания уже имеет опыт участия в водородных мега-проектах, она участвует в британском проекте Gigastack.
Начало производство водорода запланировано уже на 2023 год. Это будет тестовое предприятие с мощностью электролизёра 10 МВт. К 2027 году мощность должна быть увеличена до 250 МВт, а к 2030 году завод должен заработать в полную силу.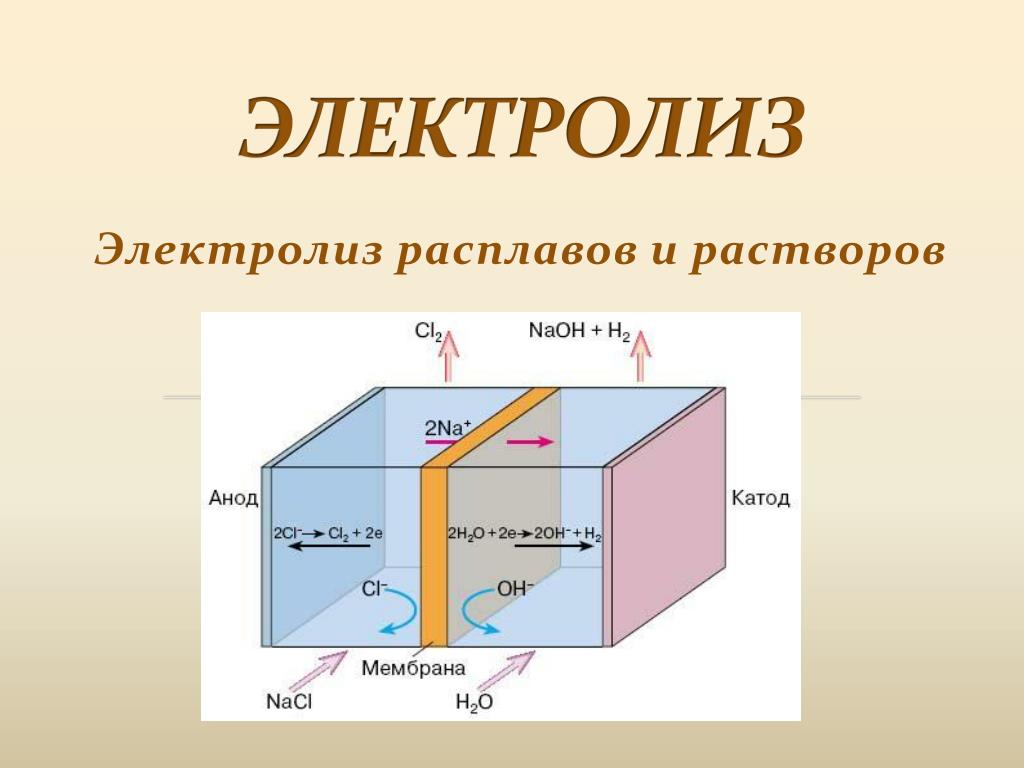 Речь идёт об электролизной установке в 1,3 ГВт, которая будет способна производить 250 000 тонн экологически чистого водорода в год, и станет одним из крупнейших в мире объектов подобного рода.
Речь идёт об электролизной установке в 1,3 ГВт, которая будет способна производить 250 000 тонн экологически чистого водорода в год, и станет одним из крупнейших в мире объектов подобного рода.
Установка будет расположена на территории Большого Копенгагена и сможет поставлять возобновляемый водород для автобусов с нулевым уровнем выбросов и большегрузных грузовиков под управлением DSV Panalpina, возобновляемый метанол для судов AP Moller — Maersk и возобновляемое авиационное топливо (e-керосин) для самолетов SAS и воздушного транспорта в аэропортах Копенгагена.
Партнёры заявляют, что реализация проекта позволит к 2030 году заместить примерно 30% ископаемого топлива, используемого аэропортом Копенгагена.
Ветровая электроэнергия, предположительно, будет поставляться от объектов, расположенных в районе острова Борнхольм.
Электролизная установка станет не только потенциальным краеугольным камнем в декарбонизации предприятий-партнеров, но и внесет важный вклад в достижение амбициозной цели Дании по сокращению выбросов углерода на 70% к 2030 году (от уровня 1990 г).
Если технико-экономическое обоснование подтвердит жизнеспособность проекта, окончательное инвестиционное решение для первого этапа может быть принято уже в 2021 году.
Дорогие читатели!
В эти тяжелые времена эпидемии Covid-19 и экономического кризиса мы продолжаем публиковать профессиональные новости и независимую энергетическую аналитику.
Рынок рекламы сегодня практически замер, а чтобы сводить концы с концами нужны средства. Поэтому, дорогие читатели, помогите чем можете, пожертвуйте по силам:
Яндекс Кошелёк или
Карта Сбербанка: 4276 3801 2452 1241
Оценка будущих цен на зеленый водород для США и Европы
Оценка будущих цен на зеленый водород для США и Европы
Международный совет по чистому транспорту (International Council on Clean Transportation, ICCT) опубликовал доклад с расчётами экономики зеленого (электролизного) водорода «Оценки затрат на производство водорода электролизом: Соединенные Штаты и Европа».
Авторы отмечают, что в опубликованных ранее докладах других «высокостатусных» организаций при прогнозировании будущих цен на зеленый водород учитывается недостаточное количество параметров – в основном капитальные затраты на электролизёры и стоимость электроэнергии. Хотя на самом деле статей расходов гораздо больше.
«В данном исследовании мы предполагаем, что затраты включают в себя капвложения в электролизер, замену электролизера (при необходимости), электричество, воду, трубопроводы, капвложения в компрессор, хранилище (краткосрочное) на производственной площадке и другие операционные расходы», — пояснили они. Соответственно, доклад претендует на «наиболее полный и прозрачный» расчёт цен на водород.
В исследовании рассматриваются только три технологии генерации, применяемые для производства водорода — солнечная фотоэлектрическая, наземная и морская ветровая энергетика, а также три типа электролизёров: щелочные (AE), с протонообменной мембраной (PEM) и твердооксидные (SOE).
Авторы рассматривают три сценария.
Сценарий 1 «Сетевое подключение». Предполагается, что электролизёр подключен к электрическим сетям, как всякий потребитель, и поэтому может производить водород круглосуточно, работать с КИУМ, равным 100%. Соответствующий договор с энергоснабжающей организацией или генератором обеспечивает приобретение исключительно возобновляемой энергии.
Сценарий 2 «Прямое подключение». Электролизёр работает вне рамок централизованной системы энергоснабжения, и получает электроэнергию непосредственно от ВИЭ-генератора. Цена на электроэнергию в таком случае может быть ниже, поскольку не включает в себя затраты на передачу и сбыт. С другой стороны, КИУМ электролизёра соответствует КИУМ генератора. Вопросы оптимизации генерирующих систем, например, совмещение солнечной и ветровой генерации в докладе не рассматриваются.
Сценарий 3 «Избыточное электричество». В данном случае электролизёр подключен к системе, как и в Сценарии 1, но на его работу идёт только «лишнее» электричество, вырабатываемое солнечными и ветровыми электростанциям, то есть та электроэнергия, которая в противном случае была бы «потеряна» в результате принудительной остановки выработки (curtailment). Стоимость такой электроэнергии авторы принимают за ноль, а продолжительность периодов такой лишней выработки составляет у них четыре часа в день.
Стоимость такой электроэнергии авторы принимают за ноль, а продолжительность периодов такой лишней выработки составляет у них четыре часа в день.
Поскольку выработка ветровых и солнечных электростанций и, соответственно, цена на зеленую электроэнергию зависит от географического положения, это также учитывалось в расчётах цен на зеленый водород.
Прогноз цен по указанным сценариям представлен в следующей таблице:
Как мы видим, цены довольно высоки, то есть выше, чем «обещают» многие другие авторы.
В исследовании были проанализированы последние доклады с прогнозами цен на зелёный водород, выпущенные BloombergNEF, Международным энергетическим агентством (МЭА) и Международным агентством по возобновляемой энергии (IRENA).
Например, в докладе «Перспективы водородной экономики» (Hydrogen Economy Outlook), опубликованном BloombergNEF, содержатся гораздо более оптимистичные оценки будущих цен. Его авторы ожидают, что цена на зеленый водород упадет до 1,4-2,9 долларов США за кг к 2030 году и 0,8-1,0 долларов США за кг к 2050 году. «Эти цифры игнорируют важные системные затраты, связанные с созданием полностью работающей установки для электролиза h3 и сосредоточиваются только на затратах на электролизер и затратах, связанных с покупкой электроэнергии и воды», — говорится на это в докладе ICCT.
«Эти цифры игнорируют важные системные затраты, связанные с созданием полностью работающей установки для электролиза h3 и сосредоточиваются только на затратах на электролизер и затратах, связанных с покупкой электроэнергии и воды», — говорится на это в докладе ICCT.
Аналогичная критика («игнорируются важные системные затраты») достаётся и докладу МЭА «Будущее водорода» (The Future of Hydrogen, 2019), и докладу IRENA «Водород: перспектива возобновляемых источников энергии» (Hydrogen: A renewable energy perspective, 2019).
Применительно к докладу IRENA отмечено, что низкая цена h3 получена в результате «сочетания чрезмерно оптимистичных цен на электроэнергию и игнорирования других системных затрат».
Следует отметить, что доклад ICCT вышел почти одновременно с другой аналитической работой, которую провели немецкие исследователи из компании Prognos. Их оценки будущей стоимости зеленого водорода также весьма консервативны и схожи с выводами рассматриваемой публикацией ICCT.
Таким образом, можно признать, что существует довольно высокая степень неопределенности по поводу будущих цен на зеленый водород. Впрочем, она присутствует всегда при прогнозировании будущего в нашем быстроменяющемся мире.
Ранее сообщалось, что по мнению аналитиков инвестиционного банка Morgan Stanley, в США зеленый водород может стать конкурентоспособным с серым, получаемым из ископаемого топлива, уже в 2023 году.
Читайте самые интересные истории ЭлектроВестей в Telegram и Viber
% PDF-1.4
%
1549 0 объект
>
эндобдж
xref
1549 105
0000000016 00000 н.
0000002456 00000 н.
0000002718 00000 н.
0000002776 00000 н.
0000004249 00000 н.
0000004820 00000 н.
0000004907 00000 н.
0000005011 00000 н.
0000005150 00000 н.
0000005291 00000 н.
0000005404 00000 н.
0000005562 00000 н.
0000005622 00000 н.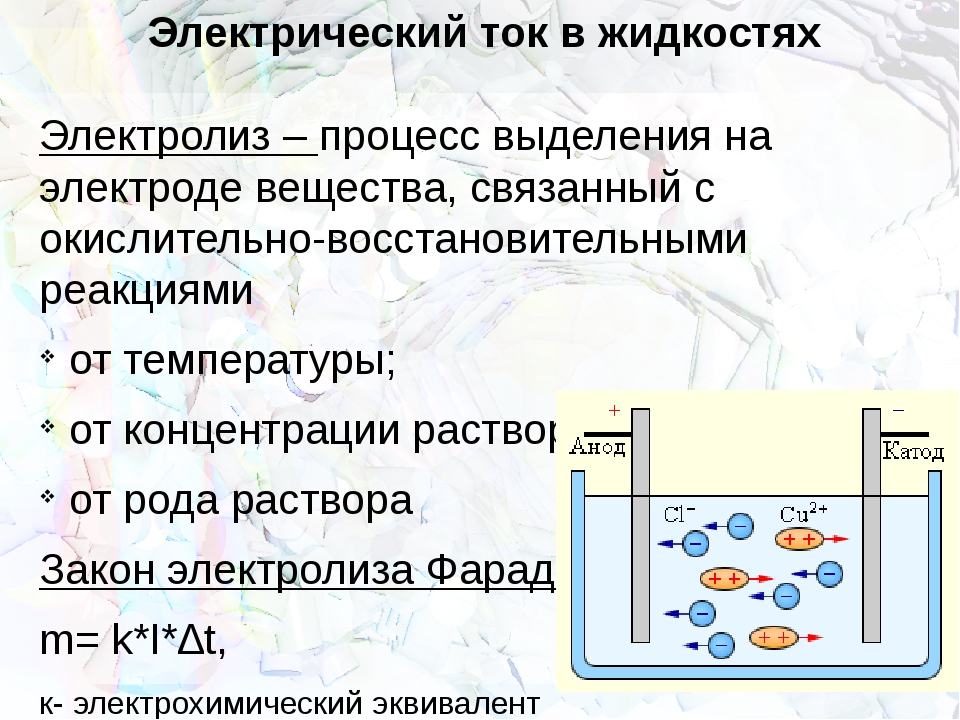 0000005731 00000 н.
0000005872 00000 н.
0000005986 00000 н.
0000006047 00000 н.
0000006178 00000 п.
0000006239 00000 п.
0000006376 00000 п.
0000006437 00000 н.
0000006601 00000 п.
0000006662 00000 н.
0000006771 00000 н.
0000006876 00000 н.
0000007036 00000 н.
0000007097 00000 п.
0000007205 00000 н.
0000007315 00000 н.
0000007440 00000 н.
0000007501 00000 н.
0000007624 00000 н.
0000007685 00000 н.
0000007800 00000 н.
0000007860 00000 н.
0000007920 00000 н.
0000007981 00000 н.
0000008042 00000 н.
0000008103 00000 п.
0000008164 00000 н.
0000008225 00000 н.
0000008348 00000 п.
0000008409 00000 п.
0000008528 00000 н.
0000008589 00000 н.
0000008716 00000 н.
0000008777 00000 н.
0000008922 00000 н.
0000008983 00000 п.
0000009107 00000 п.
0000009168 00000 п.
0000009229 00000 п.
0000009290 00000 н.
0000009441 00000 п.
0000009502 00000 н.
0000009562 00000 н.
0000009622 00000 н.
0000009666 00000 н.
0000010106 00000 п.
0000010204 00000 п.
0000010850 00000 п.
0000005731 00000 н.
0000005872 00000 н.
0000005986 00000 н.
0000006047 00000 н.
0000006178 00000 п.
0000006239 00000 п.
0000006376 00000 п.
0000006437 00000 н.
0000006601 00000 п.
0000006662 00000 н.
0000006771 00000 н.
0000006876 00000 н.
0000007036 00000 н.
0000007097 00000 п.
0000007205 00000 н.
0000007315 00000 н.
0000007440 00000 н.
0000007501 00000 н.
0000007624 00000 н.
0000007685 00000 н.
0000007800 00000 н.
0000007860 00000 н.
0000007920 00000 н.
0000007981 00000 н.
0000008042 00000 н.
0000008103 00000 п.
0000008164 00000 н.
0000008225 00000 н.
0000008348 00000 п.
0000008409 00000 п.
0000008528 00000 н.
0000008589 00000 н.
0000008716 00000 н.
0000008777 00000 н.
0000008922 00000 н.
0000008983 00000 п.
0000009107 00000 п.
0000009168 00000 п.
0000009229 00000 п.
0000009290 00000 н.
0000009441 00000 п.
0000009502 00000 н.
0000009562 00000 н.
0000009622 00000 н.
0000009666 00000 н.
0000010106 00000 п.
0000010204 00000 п.
0000010850 00000 п.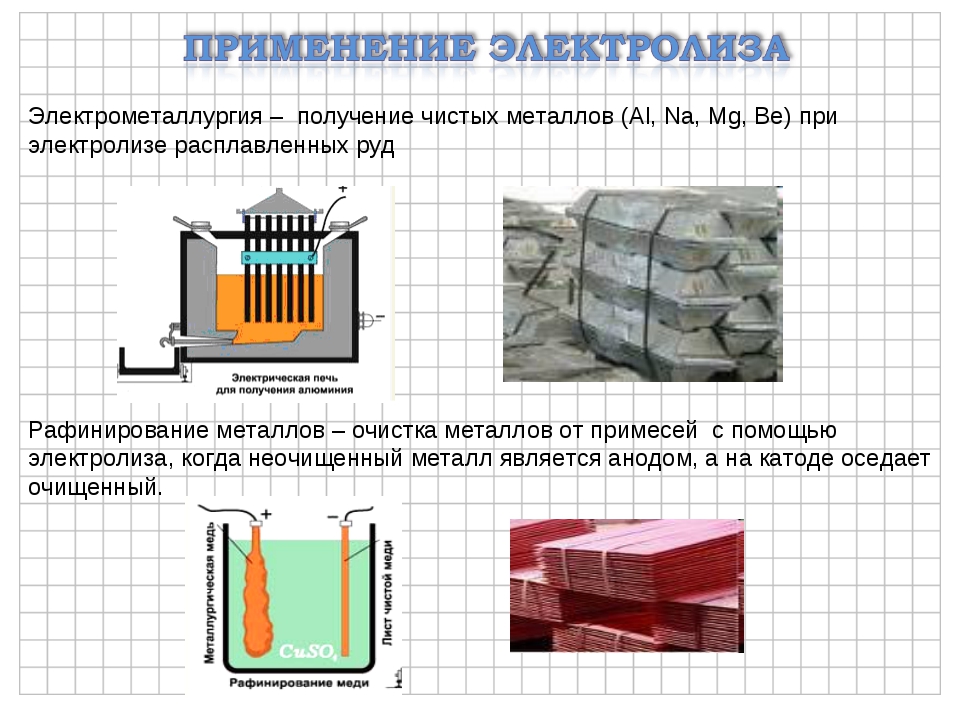 0000012055 00000 п.
0000012619 00000 п.
0000012649 00000 п.
0000012706 00000 п.
0000012737 00000 п.
0000012963 00000 п.
0000012987 00000 п.
0000015073 00000 п.
0000015097 00000 п.
0000016977 00000 п.
0000017001 00000 п.
0000018880 00000 п.
0000018904 00000 п.
0000020791 00000 п.
0000020815 00000 н.
0000022685 00000 п.
0000022709 00000 п.
0000024566 00000 п.
0000024784 00000 п.
0000025098 00000 п.
0000025257 00000 п.
0000025550 00000 п.
0000026037 00000 п.
0000026061 00000 п.
0000027972 00000 н.
0000027996 00000 н.
0000029953 00000 п.
0000054467 00000 п.
0000054490 00000 н.
0000054513 00000 п.
0000054536 00000 п.
0000055368 00000 п.
0000055448 00000 п.
0000055656 00000 п.
0000055876 00000 п.
0000075295 00000 п.
0000081958 00000 н.
0000082167 00000 п.
0000095466 00000 п.
0000097974 00000 п.
0000098054 00000 п.
0000098104 00000 п.
0000002912 00000 н.
0000004225 00000 н.
трейлер
]
>>
startxref
0
%% EOF
1550 0 объект
>
/ Контуры 1554 0 R
>>
эндобдж
1551 0 объект
>
эндобдж
1552 0 объект
>
эндобдж
1652 0 объект
>
поток
HU} le 53 sN’041l? І: vC \! 7zm ل cr ) f 4: h & F] 4> [(ysW ^ pcPP; x ((> W] G ~ tgn: Xy د ߯ nXeVLŇT \ iX} e`S5 * ޱ ] ggq {1 # k! f) & jTO + Q & t cf * IZJBDNm5FZb41?% & 2R hLX ^ Bhya˜
v {RerH ͦ13ePop ٴ -123 SɼΥmV5, \ d * Jp2 鬠% ɤLK $ ‘OɣY6-1frkl _4QVS89FZ2 / kʌ) A & * JZdjbZd * UI4i [
U`) J NDVU # * 418M [FIZ) 3HKh9’wVeH) & 9fmN 鯾 ‘= ^ V: lcPHw! Nј Ա’7 xcNg_: 8; = 뙑 CO; ˽0 # gC.
0000012055 00000 п.
0000012619 00000 п.
0000012649 00000 п.
0000012706 00000 п.
0000012737 00000 п.
0000012963 00000 п.
0000012987 00000 п.
0000015073 00000 п.
0000015097 00000 п.
0000016977 00000 п.
0000017001 00000 п.
0000018880 00000 п.
0000018904 00000 п.
0000020791 00000 п.
0000020815 00000 н.
0000022685 00000 п.
0000022709 00000 п.
0000024566 00000 п.
0000024784 00000 п.
0000025098 00000 п.
0000025257 00000 п.
0000025550 00000 п.
0000026037 00000 п.
0000026061 00000 п.
0000027972 00000 н.
0000027996 00000 н.
0000029953 00000 п.
0000054467 00000 п.
0000054490 00000 н.
0000054513 00000 п.
0000054536 00000 п.
0000055368 00000 п.
0000055448 00000 п.
0000055656 00000 п.
0000055876 00000 п.
0000075295 00000 п.
0000081958 00000 н.
0000082167 00000 п.
0000095466 00000 п.
0000097974 00000 п.
0000098054 00000 п.
0000098104 00000 п.
0000002912 00000 н.
0000004225 00000 н.
трейлер
]
>>
startxref
0
%% EOF
1550 0 объект
>
/ Контуры 1554 0 R
>>
эндобдж
1551 0 объект
>
эндобдж
1552 0 объект
>
эндобдж
1652 0 объект
>
поток
HU} le 53 sN’041l? І: vC \! 7zm ل cr ) f 4: h & F] 4> [(ysW ^ pcPP; x ((> W] G ~ tgn: Xy د ߯ nXeVLŇT \ iX} e`S5 * ޱ ] ggq {1 # k! f) & jTO + Q & t cf * IZJBDNm5FZb41?% & 2R hLX ^ Bhya˜
v {RerH ͦ13ePop ٴ -123 SɼΥmV5, \ d * Jp2 鬠% ɤLK $ ‘OɣY6-1frkl _4QVS89FZ2 / kʌ) A & * JZdjbZd * UI4i [
U`) J NDVU # * 418M [FIZ) 3HKh9’wVeH) & 9fmN 鯾 ‘= ^ V: lcPHw! Nј Ա’7 xcNg_: 8; = 뙑 CO; ˽0 # gC.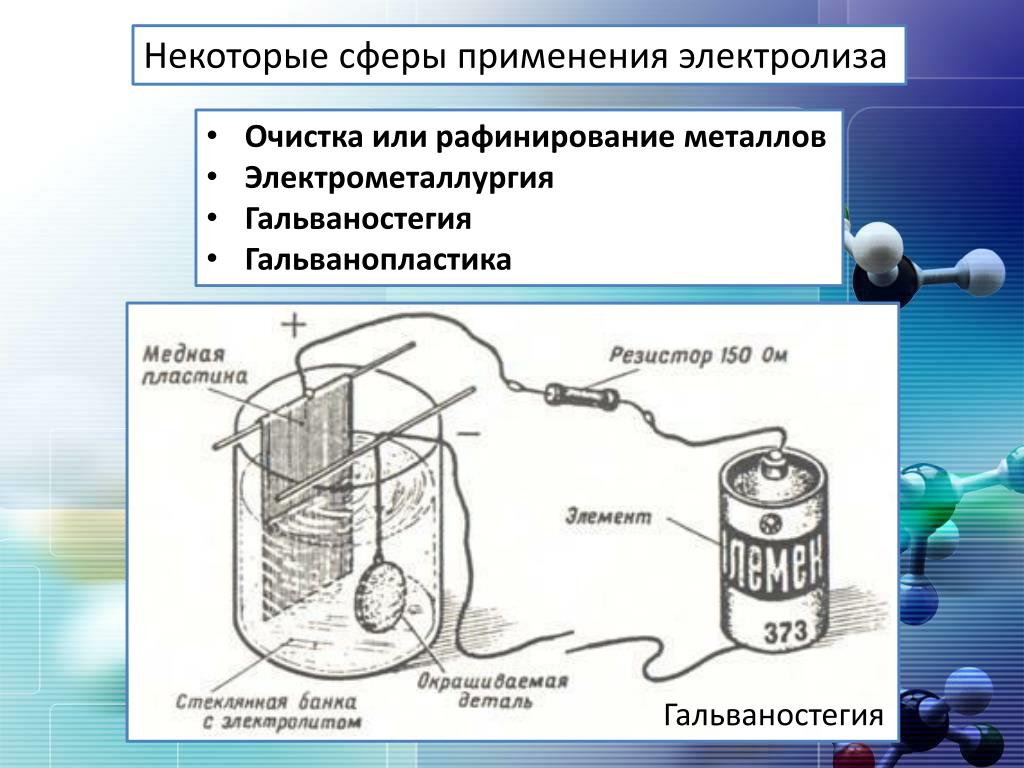 d% n072p83 | R
d% n072p83 | R
Окончательный технический отчет по щелочному электролизу
Версия PDF также доступна для скачивания.
Кто
Люди и организации, связанные либо с созданием этого отчета, либо с его содержанием.
Какие
Описательная информация, помогающая идентифицировать этот отчет.Перейдите по ссылкам ниже, чтобы найти похожие предметы в Электронной библиотеке.
Когда
Даты и периоды времени, связанные с этим отчетом.
Статистика использования
Когда последний раз использовался этот отчет?
Взаимодействовать с этим отчетом
Вот несколько советов, что делать дальше.
Версия PDF также доступна для скачивания.
Ссылки, права, повторное использование
Международная структура взаимодействия изображений
Распечатать / Поделиться
Печать
электронная почта
Твиттер
Facebook
Tumblr
Reddit
Ссылки для роботов
Полезные ссылки в машиночитаемых форматах.
Ключ архивных ресурсов (ARK)
Международная структура взаимодействия изображений (IIIF)
Форматы метаданных
Изображений
URL
Статистика
Буржуа, Ричард; Санборн, Стивен и Ассимакопулос, Элиот. Окончательный технический отчет по щелочному электролизу,
отчет,
13 июля 2006 г .;
Соединенные Штаты.
(https://digital.library.unt.edu/ark:/67531/metadc892859/:
по состоянию на 5 июня 2021 г.), Библиотеки Университета Северного Техаса, Цифровая библиотека UNT, https://digital.library.unt.edu; кредитование Департамента государственных документов библиотек ЕНТ.
Окончательный технический отчет по щелочному электролизу,
отчет,
13 июля 2006 г .;
Соединенные Штаты.
(https://digital.library.unt.edu/ark:/67531/metadc892859/:
по состоянию на 5 июня 2021 г.), Библиотеки Университета Северного Техаса, Цифровая библиотека UNT, https://digital.library.unt.edu; кредитование Департамента государственных документов библиотек ЕНТ.
Объем рынка электролиза воды 309 долларов США.9 миллионов к 2026 году при среднегодовом темпе роста 9%
БАНГАЛОР, Индия, 22 декабря 2020 г. / PRNewswire / — Рынок водного электролиза сегментирован по типам: традиционный щелочной электролизер, электролизер из PEM, по областям применения — электростанции, сталелитейный завод, электроника и фотоэлектрическая энергия, промышленные газы, накопители энергии или Заправка топливом для FCEV, Электроэнергия на газ, прочее. Этот отчет опубликован в Valuates Reports в категории Energy & Utilities . Он также охватывает анализ глобальных и региональных возможностей и отраслевой прогноз до 2026 года.
Он также охватывает анализ глобальных и региональных возможностей и отраслевой прогноз до 2026 года.
Согласно прогнозам, к 2026 году объем мирового рынка электролиза воды достигнет 309,9 млн долларов США по сравнению с 185,3 млн долларов США в 2020 году при среднегодовом темпе роста 9% в течение 2021-2026 годов.
Основными факторами, способствующими росту размера рынка электролиза воды, являются: увеличение использования электролиза воды в отраслях конечного потребления, растущий спрос на безуглеродный источник энергии, высокоэффективный способ интеграции возобновляемых источников энергии через электроэнергию в энергоносители. газовый объект.
Отчет включает объем рынка по странам и регионам за период 2015-2026 гг.Он также включает размер рынка и прогноз по типу и по сегментам приложений с точки зрения производственных мощностей, цены и выручки на период 2015-2026 гг.
Запрос образца: https://reports.valuates.com/request/sample/QYRE-Othe-1Q406/Water_Electrolysis_Market
ТЕНДЕНЦИИ, ВЛИЯЮЩИЕ НА РЫНОК ВОДНОГО ЭЛЕКТРОЛИЗА
Отсутствие надежной электросети во многих странах является ключевым фактором, который стимулирует использование электролиза воды в качестве средства производства электроэнергии. Кроме того, производство и более рациональное использование электроэнергии с помощью электролиза воды сократит количество топлива, необходимого для производства электроэнергии, и количество выделяемых парниковых газов. Ожидается, что эти преимущества, предлагаемые электролизом воды, увеличат объем рынка электролиза воды.
Кроме того, производство и более рациональное использование электроэнергии с помощью электролиза воды сократит количество топлива, необходимого для производства электроэнергии, и количество выделяемых парниковых газов. Ожидается, что эти преимущества, предлагаемые электролизом воды, увеличат объем рынка электролиза воды.
Глобальный переход к водородной энергетической инфраструктуре — еще один важный фактор, который может существенно увеличить размер мирового рынка электролиза воды.Установки для электролиза воды возникли как обязательный метод, позволяющий эффективно разделять фильтрованную воду на кислород и водород. Хотя внедрение водородных технологий во многих регионах является относительно низким из-за нехватки пресной воды, исследования и разработки постепенно проводятся для разработки машин для электролиза воды, в которых загрязненная или соленая вода может распределяться без очистки.
Ожидается, что рост мирового спроса на машины для электролиза воды будет медленнее, чем в предыдущем году, в результате пандемии COVID-19. Цепочка поставок сырья и других основных компонентов, необходимых для производства машин для электролиза воды, в значительной степени нарушена ограничениями на транспорт и трансграничную торговлю. Хотя ожидается, что выручка резко упадет в первые два квартала 2020 года, рынок, вероятно, продемонстрирует признаки улучшения к последнему кварталу 2020 года.
Цепочка поставок сырья и других основных компонентов, необходимых для производства машин для электролиза воды, в значительной степени нарушена ограничениями на транспорт и трансграничную торговлю. Хотя ожидается, что выручка резко упадет в первые два квартала 2020 года, рынок, вероятно, продемонстрирует признаки улучшения к последнему кварталу 2020 года.
Просмотреть полный отчет: https://reports.valuates.com/market-reports/QYRE-Othe-1Q406/water-electrolysis
АНАЛИЗ ДОЛИ РЫНКА ЭЛЕКТРОЛИЗА ВОДЫ
Ожидается, чтоАзиатско-Тихоокеанский регион будет занимать самую большую долю рынка электролиза воды в течение прогнозируемого периода.Такое доминирование в Азиатско-Тихоокеанском регионе объясняется строгим государственным регулированием по сокращению углеродного следа в этом регионе.
Европа занимала вторую по величине долю рынка электролиза воды в 2018 году благодаря развитой инфраструктуре для электролиза воды в отрасли. Химическая промышленность в Европе является основным пользователем рынка электролиза воды, в связи с чем ожидается рост рынка в течение прогнозируемого периода.
Запрос региональных отчетов: https: // reports.valuates.com/request/regional/QYRE-Othe-1Q406/Water_Electrolysis_Market
ЛУЧШИЕ КОМПАНИИ НА РЫНКЕ ВОДНОГО ЭЛЕКТРОЛИЗА
Ожидается, что участники рынкасосредоточатся на создании продуктов и исследовательской деятельности, чтобы получить конкурентное преимущество на рынке в период после COVID-19.
Proton On-Site — крупнейший поставщик в 2019 году, на долю которого приходится около 18% общемировых продаж. Другие ведущие компании на рынке электролиза воды:
- 718-й НИИ ЦНИИ
- Teledyne Energy Systems
- Водородная промышленность
- Nel Водород
- Сучжоу Цзинли
- Пекин Чжундянь
- Макфи
- Сименс
- Материк Тяньцзинь
- Areva h3gen
- Shandong Saksay Hydrogen Energy
- Yangzhou Chungdean Hydrogen Equipment
- Асахи Касей
- Idroenergy Spa
- Erredue SpA
- Шэньси Хуа Цинь
- Эко-решения Kobelco
- ELB Elektrolysetechnik GmbH
- ITM Power
- Toshiba
СЕГМЕНТ ПО ВИДАМ КЛЮЧЕЙ
- Традиционный щелочной электролизер
- Электролизер PEM
СЕГМЕНТ ПО КЛЮЧЕВЫМ ПРИЛОЖЕНИЯМ
- Электростанции
- Металлургический завод
- Электроника и фотогальваника
- Промышленные газы
- Хранение энергии или заправка топливом для FCEV
- Электроэнергия на газ
- Другое.

СЕГМЕНТ ПО КЛЮЧЕВЫМ РЕГИОНАМ
Рынок электролиза воды проанализирован, и информация о размере рынка предоставлена по регионам (странам).
Ключевыми регионами, рассматриваемыми в отчете о рынке водного электролиза, являются Северная Америка, Европа, Китай и Япония. Он также охватывает ключевые регионы (страны), а именно США, Канаду, Германию, Францию, Великобританию, Италию, Россию, Китай, Японию, Южную Корею, Индию, Австралию, Тайвань, Индонезию, Таиланд, Малайзию, Филиппины, Вьетнам, Мексику. , Бразилия, Турция, Саудовская Аравия, ОАЭ и др.
Купить сейчас для одного пользователя: https://reports.valuates.com/api/directpaytoken?rcode=QYRE-Othe-1Q406&lic=single-user
Купить сейчас для корпоративных пользователей: https://reports.valuates.com/api/directpaytoken?rcode=QYRE-Othe-1Q406&lic=enterprise-license
ПОДПИСКА
Мы ввели индивидуальную подписку для наших клиентов. Пожалуйста, оставьте заметку в разделе комментариев, чтобы узнать о наших планах подписки.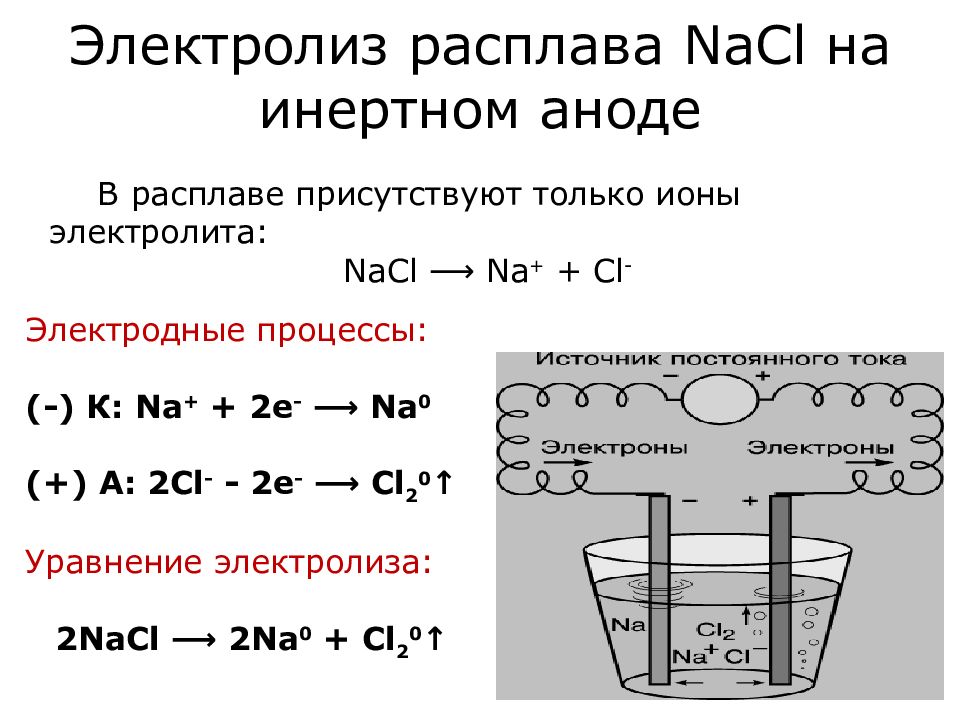
ПОДОБНЫЕ ОТЧЕТЫ
— В 2019 году объем мирового рынка электролиза воды PEM составил 77 миллионов долларов США, и ожидается, что он достигнет 110 долларов США.6 миллионов к концу 2026 г., при среднегодовом темпе роста 7,5% в течение 2021-2026 гг. По прогнозам, к 2026 году Азиатско-Тихоокеанский регион и ЕС будут занимать основную долю рынка электролиза воды с ПЭМ. Этот рост обусловлен ростом среднего класса в регионах, повышением уровня жизни и быстро развивающейся инфраструктурой.
— Глобальный рынок систем электролиза морской воды сегментирован по типу продукта — солоноватая вода, рассол, применение — муниципальное, морское, промышленное, другое, по ключевым игрокам, регион — Северная Америка, LAMEA, Ближний Восток, Азиатско-Тихоокеанский регион.пр.
— Мировой рынок электролиза щелочной воды сегментирован по типам — 10 м3 / ч, < 30 м3 / ч, < 50 м3 / ч, < 80 м3 / ч, ≥80 м3 / ч, применения — Электростанции, Сталь Завод, электроника и фотоэлектрическая энергия, промышленные газы, прочее, по ключевым игрокам, регион — Северная Америка, LAMEA, Ближний Восток, Азиатско-Тихоокеанский регион. пр.
пр.
— Глобальный рынок водородного оборудования для электролиза воды сегментирован по типу — традиционный щелочной тип, тип PEM, по применению — электростанция, сталелитейный завод, по ключевым игрокам, регион — Северная Америка, LAMEA, Ближний Восток, Азиатско-Тихоокеанский регион.пр.
— Мировой рынок систем электролиза воды сегментирован по типу — традиционный щелочной электролизер, электролизер с PEM, по применению — электростанции, сталелитейный завод, электроника и фотоэлектрическая энергия, промышленные газы, накопление энергии или топливо для FCEV, другие, по ключевым игрокам Регион — Северная Америка, LAMEA, Ближний Восток, Азиатско-Тихоокеанский регион. пр.
— Азиатско-Тихоокеанский рынок водного электролиза сегментирован по типу — мелкомасштабный тип, средний тип, крупномасштабный тип, по применению — электростанции, сталелитейный завод, электроника и фотоэлектрическая энергия, промышленные газы, накопление энергии или топливо для FCEV, Остальные по технологии — Традиционный щелочной электролизер, Электролизер PEM от ключевых игроков, Регион — Азиатско-Тихоокеанский регион.
— Рынок электролиза воды в странах Европы, Ближнего Востока и Африки сегментирован по типу — мелкомасштабный тип, средний тип, крупномасштабный тип, по применению — электростанции, сталелитейный завод, электроника и фотоэлектрическая энергия, промышленные газы, накопление энергии или топливо для FCEV, другие, по технологиям — Традиционный щелочной электролизер, Электролизер PEM по ключевым игрокам, Регион — EMEA.
— Японский рынок водного электролиза сегментирован по типу — мелкомасштабный тип, средний тип, крупномасштабный тип, по применению — электростанции, сталелитейный завод, электроника и фотоэлектрическая энергия, промышленные газы, накопление энергии или топливо для FCEV, другие, по технологии — Традиционный щелочной электролизер, Электролизер PEM от ключевых игроков, Регион — Япония.
— Рынок электролиза PEM воды в США сегментирован по типу — мелкомасштабный тип, средний тип, крупномасштабный тип, по применению — электростанции, сталелитейный завод, электроника и фотоэлектрическая энергия, промышленные газы, накопление энергии или топливо для FCEV Остальные, по ключевым игрокам, Регион — США.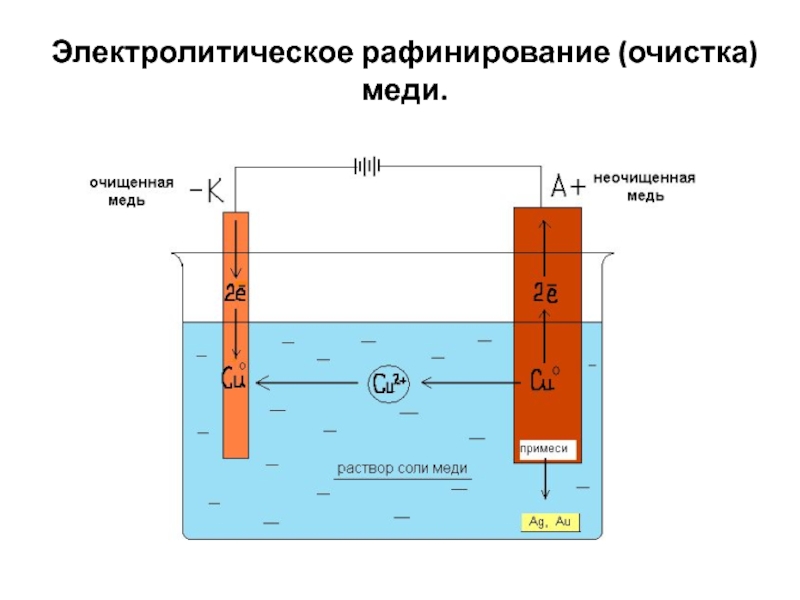
Нажмите здесь, чтобы просмотреть соответствующие отчеты по рынку электролиза воды
О НАС:
Valuates предлагает углубленное изучение рынка в различных отраслях.Наш обширный репозиторий отчетов постоянно обновляется в соответствии с меняющимися потребностями отраслевого анализа.
Наша команда рыночных аналитиков поможет вам выбрать лучший отчет, охватывающий вашу отрасль. Мы понимаем требования вашей ниши, специфичные для вашего региона, и поэтому предлагаем индивидуальную настройку отчетов. Благодаря нашей настройке вы можете запросить любую конкретную информацию из отчета, которая соответствует вашим потребностям в анализе рынка.
Для достижения единообразного представления о рынке данные собираются из различных первичных и вторичных источников, на каждом этапе применяются методики триангуляции данных для уменьшения отклонений и поиска согласованного представления о рынке.Каждый образец, который мы предоставляем, содержит подробную методологию исследования, использованную для создания отчета. Пожалуйста, также свяжитесь с нашим отделом продаж, чтобы получить полный список наших источников данных.
Пожалуйста, также свяжитесь с нашим отделом продаж, чтобы получить полный список наших источников данных.
СВЯЗАТЬСЯ С НАМИ:
Проверяет отчеты
[адрес электронной почты защищен]
Для бесплатного звонка в США + 1- (315) -215-3225
Для звонка IST + 91-8040957137
WhatsApp: +91 9945648335
Веб-сайт: https: //reports.valuates .com
Twitter — https://twitter.com/valuatesreports
Linkedin — https: // in.linkedin.com/company/valuatesreports
Facebook — https://www.facebook.com/valuatesreports
: https://mma.prnewswire.com/media/1082232/Valuates_Reports_Logo.jpg
ИСТОЧНИК оценивает отчеты
Производство водорода с помощью электролиза воды PEM — Обзор
Основные моменты
- •
Электролиз воды — одна из наиболее многообещающих альтернатив для хранения энергии из возобновляемых источников энергии.
- •
Электролиз воды с ПЭМ обеспечивает надежное решение для будущего чистого производства водорода высокой степени чистоты.

- •
Обзор электролиза воды PEM, включая проблемы, научные и технологические достижения.
- •
Четко обсуждаемые быстрые разработки в области электролиза воды на основе ПЭМ, включая высокоэффективные электрокатализаторы.
Реферат
Водород — самый эффективный энергоноситель. Водород можно получить из различных источников сырья, включая воду. Среди многих методов производства водорода экологически чистый и высокочистый водород можно получить путем электролиза воды.Однако с точки зрения устойчивости и воздействия на окружающую среду электролиз воды из ПЭМ считался наиболее многообещающим методом для высокоэффективного производства водорода из возобновляемых источников энергии и выделяет только кислород в качестве побочного продукта без каких-либо выбросов углерода. Более того, произведенные водород (H 2 ) и кислород (O 2 ) непосредственно используются для топливных элементов и промышленных применений.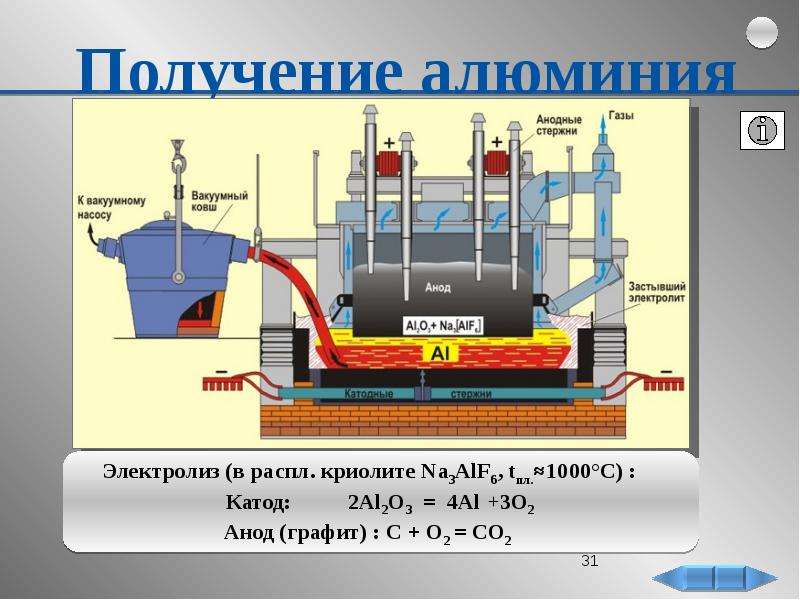 Однако общее расщепление воды приводит к тому, что только 4% мирового промышленного водорода производится путем электролиза воды, в основном из-за экономических проблем.В настоящее время возросшее стремление к производству зеленого водорода увеличило интерес к электролизу воды из PEM. Таким образом, недавно были завершены значительные исследования по разработке экономичных электрокатализаторов для электролиза воды на основе ПЭМ. В этом обзоре мы обсудили недавние разработки в области электролиза воды на основе ПЭМ, включая высокоэффективные и недорогие электрокатализаторы на основе HER и OER, а также решены новые и старые проблемы, связанные с электрокатализаторами и компонентами элементов PEM.Этот обзор будет способствовать дальнейшим усовершенствованиям исследований и дорожной карте, чтобы поддержать разработку водного электролизера PEM как коммерчески осуществимой цели производства водорода.
Однако общее расщепление воды приводит к тому, что только 4% мирового промышленного водорода производится путем электролиза воды, в основном из-за экономических проблем.В настоящее время возросшее стремление к производству зеленого водорода увеличило интерес к электролизу воды из PEM. Таким образом, недавно были завершены значительные исследования по разработке экономичных электрокатализаторов для электролиза воды на основе ПЭМ. В этом обзоре мы обсудили недавние разработки в области электролиза воды на основе ПЭМ, включая высокоэффективные и недорогие электрокатализаторы на основе HER и OER, а также решены новые и старые проблемы, связанные с электрокатализаторами и компонентами элементов PEM.Этот обзор будет способствовать дальнейшим усовершенствованиям исследований и дорожной карте, чтобы поддержать разработку водного электролизера PEM как коммерчески осуществимой цели производства водорода.
Ключевые слова
Производство водорода
Электролиз воды PEM
Электрокатализаторы
Реакция выделения водорода (HER)
Реакция выделения кислорода (OER)
Рекомендуемые статьиЦитирующие статьи (0)
Посмотреть аннотацию © 2019 Авторы. Производство и хостинг компанией Elsevier B.V. от имени KeAi Communications Co., Ltd.
Производство и хостинг компанией Elsevier B.V. от имени KeAi Communications Co., Ltd.
Рекомендуемые статьи
Цитирование статей
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.

- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.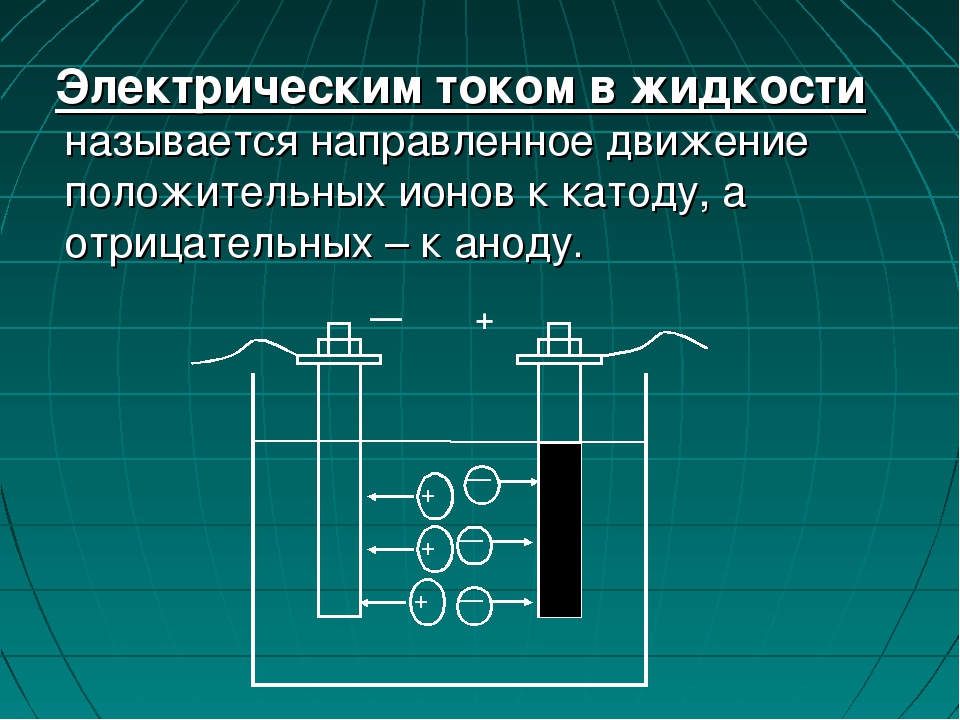
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Отчет о мировом рынке продаж электролиза воды в 2021 г.
Отчет о глобальном рынке продаж электролиза воды в 2021 г.
Сводка
Анализ и аналитика рынка: глобальный рынок электролиза воды
На основании нашего недавнего исследования ожидается, что он вырастет на 26. 37% в 2021 году, а размер рынка составит 268,73 в 2021 году по сравнению с 212,65 миллиона долларов США в 2020 году. Объем рынка водного электролиза достигнет 639,81 доллара США в 2027 году, а среднегодовой темп роста 16,83% с 2021 по 2027 год.
37% в 2021 году, а размер рынка составит 268,73 в 2021 году по сравнению с 212,65 миллиона долларов США в 2020 году. Объем рынка водного электролиза достигнет 639,81 доллара США в 2027 году, а среднегодовой темп роста 16,83% с 2021 по 2027 год.
Global Water Electrolysis Объем и размер рынка
Мировой рынок электролиза воды сегментирован по компаниям, регионам (странам), типам и применению. Игроки, заинтересованные стороны и другие участники глобального рынка электролиза воды смогут получить преимущество, поскольку они используют отчет как мощный ресурс.Сегментарный анализ фокусируется на продажах, выручке и прогнозе по регионам (странам), по типам и приложениям на период 2016-2027 гг.
Компанией
718-й научно-исследовательский институт CSIC
Протон на месте
Гидрогеника
Teledyne Energy Systems
Suzhou Jingli
McPhy
TianJin Mainland
Siemens
Nel Hydrogen
Toshiba
Yangzhou Chungdean Hydrogen Equipment
Areva h3gen
ITMenergy Power
Erredue SpA
Kobelco Eco-Solutions
ShaanXi HuaQin
EM Solution
Beijing Zhongdian
h3B2
Elchemtech
Asahi Kasei
Verde LLC
Thyssenkrupp
Сегмент по типу
Традиционный щелочной электролизер 41
Электроника и фотоэлектрическая промышленность
Промышленные газы
Хранение энергии или топливо для FCEV
Энергия на газ
Другое
По регионам
Северная Америка
Европа
Китай
Япония
Ближний Восток и Африка
Индия
Другие регионы
- 1 ОБЗОР ОТЧЕТА
- 1.
 1 Объем продукта для электролиза воды
1 Объем продукта для электролиза воды - 1.2 Сегмент электролиза воды по типу
- 1.2.1 Глобальные продажи электролиза воды по типу (2016, 2021 и 2027 годы)
- 1.2.2 Традиционный щелочной электролизер
- 1.2.3 Электролизер PEM
- 1.3 Вода Сегмент электролиза по приложениям
- 1.3.1 Глобальное сравнение продаж водного электролиза по приложениям (2016, 2021 и 2027 годы)
- 1.3.2 Электростанции
- 1.3.3 Металлургический завод
- 1.3.4 Электроника и фотовольтаика
- 1.3.5 Промышленные газы
- 1.3.6 Хранение энергии или заправка топливом для FCEV
- 1.3.7 Энергия на газ
- 1.4 Оценки и прогнозы мирового рынка электролиза воды (2016-2027)
- 1.4.1 Объем мирового рынка электролиза воды по темпам роста (2016-2027)
- 1.4.2 Объем мирового рынка электролиза воды по темпам роста (2016-2027)
- 1.4.3 Глобальные тенденции цен на электролиз воды (2016-2027)
- 2 ОЦЕНКИ И ПРОГНОЗЫ ЭЛЕКТРОЛИЗА ВОДЫ ПО РЕГИОНАМ
- 2.
 1 Размер мирового рынка электролиза воды по регионам: 2016 VS 2021 VS 2027
1 Размер мирового рынка электролиза воды по регионам: 2016 VS 2021 VS 2027 - 2.2 Ретроспективный рыночный сценарий глобального электролиза воды по регионам (2016-2021)
- 2.2.1 Доля мирового рынка продаж электролиза воды по регионам (2016-2021)
- 2.2.2 Доля мирового рынка электролиза воды по регионам (2016-2021 гг.)
- 2.3 Оценки и прогнозы мирового рынка электролиза воды по регионам (2022-2027 гг.)
- 2.3.1 Оценки и прогнозы мировых продаж электролиза воды по регионам (2022- 2027)
- 2.3.2 Глобальный прогноз доходов от электролиза воды по регионам (2022-2027)
- 2.4 Географический анализ рынка: рыночные факты и цифры
- 2.4.1 Оценки и прогнозы электролиза воды в Северной Америке (2016-2027)
- 2.4.2 Оценки электролиза воды в Европе и прогнозы (2016-2027)
- 2.4.3 Оценки и прогнозы электролиза воды в Китае (2016-2027)
- 2.4.4 Оценки и прогнозы электролиза воды в Японии (2016-2027)
- 2.4.5 Оценки и прогнозы электролиза воды на Ближнем Востоке и в Африке (2016-2027 гг.
 )
) - 2.4.6 Оценки и прогнозы электролиза воды в Индии (2016-2027 гг.)
- 3 ЛАНДШАФТ СОРЕВНОВАНИЙ ПО ЭЛЕКТРОЛИЗУ ВОДЫ ПО ИГРОКАМ
- 3.1 Мировые лидеры в области электролиза воды по продажам (2016-2021)
- 3.2 Крупнейшие мировые игроки в водном электролизе по выручке (2016-2021)
- 3.3 Доля мирового рынка водного электролиза по типу компании (уровень 1, уровень 2 и уровень 3) и (на основе дохода по электролизу воды по состоянию на 2020 год)
- 3.4 Глобальная средняя цена электролиза воды по компаниям (2016-2021 гг.)
- 3.4.1 Глобальное географическое распределение производителей электролиза воды
- 3.5 Слияния и поглощения, планы расширения
- 4 РАЗМЕР РЫНКА ЭЛЕКТРОЛИЗА ВОДЫ ПО ТИПАМ
- 4.1 Глобальный электролиз воды Исторический обзор рынка по типу (2016-2021)
- 4.1.1 Доля мирового рынка продаж электролиза воды по типу (2016-2021)
- 4.1.2 Доля мирового рынка выручки от электролиза воды по типу (2016-2021)
- 4.
 1.3 Мировая цена на электролиз воды по типу (2016-2021)
1.3 Мировая цена на электролиз воды по типу (2016-2021) - 4.2 Глобальные оценки и прогнозы рынка электролиза воды по типу (2022-2027)
- 4.2.1 Глобальный прогноз продаж электролиза воды по типу (2022-2027)
- 4.2. 2 Глобальный прогноз доходов от электролиза воды по типам (2022-2027 гг.)
- 4.2.3 Глобальный прогноз цен на электролиз воды по типам (2022-2027 гг.) Рассмотрение по заявке (2016-2021)
- 5.1.1 Доля мирового рынка продаж электролиза воды по приложениям (2016-2021 гг.)
- 5.1.2 Доля мирового рынка доходов от электролиза воды по приложениям (2016-2021 гг.)
- 5.1.3 Мировые цены на электролиз воды по приложениям (2016-2021 гг.)
- 5.2 Оценки и прогнозы мирового рынка электролиза воды по приложениям (2022-2027)
- 5.2.1 Глобальный прогноз продаж электролиза воды по приложениям (2022-2027)
- 5.2.2 Прогноз мировых доходов от электролиза воды по приложениям (2022-2027)
- 5.2.3 Глобальный прогноз цен на электролиз воды по приложениям (2022-2027)
- 6 ФАКТЫ И ЦИФРЫ РЫНКА ЭЛЕКТРОЛИЗА ВОДЫ В СЕВЕРНОЙ АМЕРИКЕ
- -2021)
- 6.
 1.2 Выручка от электролиза воды в Северной Америке по компаниям (2016-2021 гг.)
1.2 Выручка от электролиза воды в Северной Америке по компаниям (2016-2021 гг.) - 6.2 Распределение продаж в Северной Америке после электролиза воды по типам
- 6.2.1 Распределение продаж продаж водного электролиза в Северной Америке по типам (2016-2021)
- 6.2.2 Распределение продаж водного электролиза в Северной Америке по типу (2022-2027)
- 6.3 Распределение продаж водного электролиза в Северной Америке по приложениям
- 6.3.1 Распределение продаж водного электролиза в Северной Америке по приложениям (2016-2021)
- 6.3.2 Северная Америка Распределение продаж водного электролиза по областям применения (2022-2027)
- 7 ФАКТЫ И ЦИФРЫ ЕВРОПЕЙСКОГО РЫНКА ЭЛЕКТРОЛИЗА ВОДЫ
- 7.1 Продажи компаний для электролиза воды в Европе по компаниям
- 7.1.1 Объем продаж водного электролиза в Европе по компаниям (2016-2021 гг.) (2016-2021)
- 7.2.2 Распределение продаж водного электролиза в Европе по типам (2022-2027)
- 7.
 3 Распределение продаж водного электролиза в Европе по приложениям
3 Распределение продаж водного электролиза в Европе по приложениям - 7.3.1 Распределение продаж водного электролиза в Европе по приложениям (2016-2021)
- 7.3.2 Распределение продаж водного электролиза в Европе по приложениям (2022-2027)
- 8 ФАКТЫ И ЦИФРЫ РЫНКА ВОДНОГО ЭЛЕКТРОЛИЗА В КИТАЕ
- 8.1 Продажи компаний для водного электролиза в Китае по компаниям
- 8.1.1 Продажи в Китае по компаниям для водного электролиза (2016-2021)
- 8.1.2 Выручка от электролиза воды в Китае по компаниям (2016-2021)
- 8.2 Распределение продаж электролиза воды в Китае по типам
- 8.2.1 Распределение продаж электролиза воды в Китае по типам (2016-2021)
- 8.2.2 Распределение продаж водного электролиза в Китае по типам (2022-2027)
- 8.3 Распределение продаж водного электролиза в Китае по приложениям
- 8.3.1 Распределение продаж водного электролиза в Китае по приложениям (2016-2021)
- 8.3.2 Распределение продаж в Китае для водного электролиза по заявке (2022-2027)
- 9 ФАКТЫ И ЦИФРЫ О РЫНКЕ ЭЛЕКТРОЛИЗА ВОДЫ В ЯПОНИИ
- 9.
 1 Продажи компании для водного электролиза в Японии
1 Продажи компании для водного электролиза в Японии - 9.1.1 Продажи компании в Японии для электролиза воды (2016-2021)
- 9.1.2 Выручка от электролиза воды в Японии по компаниям (2016-2021 гг.)
- 9.2 Распределение продаж в Японии после электролиза воды по типам
- 9.2.1 Распределение продаж в Японии по типу электролиза воды по типу (2016-2021 гг.)
- 9.2.2 Распределение продаж в Японии после электролиза воды по типу Тип (2022-2027)
- 9.3 Распределение продаж в Японии для водного электролиза по приложениям
- 9.3.1 Распределение продаж в Японии для водного электролиза по приложениям (2016-2021)
- 9.3.2 Распределение продаж в Японии для водного электролиза по приложениям (2022-2027)
- 10 ФАКТЫ И ЦИФРЫ РЫНКА ВОДНОГО ЭЛЕКТРОЛИЗА БЛИЖНЕГО ВОСТОКА И АФРИКИ
- 10.1 Продажи компании по электролизу воды на Ближнем Востоке и в Африке
- 10.1.1 Продажи компании по электролизу воды на Ближнем Востоке и в Африке (2016-2021)
- 10.
 1.2 Выручка от электролиза воды на Ближнем Востоке и в Африке по компаниям (2016-2021)
1.2 Выручка от электролиза воды на Ближнем Востоке и в Африке по компаниям (2016-2021) - 10.2 Распределение продаж водного электролиза на Ближнем Востоке и в Африке по типам
- 10.2.1 Распределение продаж на Ближнем Востоке и в Африке по типу (2016-2021 гг.)
- 10.2.2 Распределение продаж на Ближнем Востоке и в Африке для водного электролиза по типам (2022-2027 гг.) )
- 10.3 Распределение продаж водного электролиза на Ближнем Востоке и в Африке по приложениям
- 10.3.1 Распределение продаж водного электролиза на Ближнем Востоке и в Африке по приложениям (2016-2021 гг.)
- 10.3.2 Распределение продаж на Ближнем Востоке и в Африке для водного электролиза по приложениям (2022-2027 гг.) )
- 11 ИНДИЙСКИЙ РЫНОК ЭЛЕКТРОЛИЗА ВОДЫ ФАКТЫ И ЦИФРЫ
- 11.1 Продажи компании для электролиза воды в Индии
- 11.1.1 Продажи компании для электролиза воды в Индии (2016-2021)
- 11.1.2 Выручка от электролиза воды в Индии по компаниям (2016-2021 гг.
 )
) - 11.2 Распределение продаж продаж электролиза воды в Индии по типам
- 11.2.1 Распределение продаж в Индии после электролиза воды по типам (2016-2021 гг.)
- Тип (2022-2027)
- 11.3 Распределение продаж водного электролиза в Индии по приложениям
- 11.3.1 Распределение продаж в Индии для водного электролиза по приложениям (2016-2021)
- 11.3.2 Распределение продаж в Индии для водного электролиза по приложениям (2022-2027)
- 12 ПРОФИЛИ КОМПАНИИ И КЛЮЧЕВЫЕ ЦИФРЫ В ВОДНО-ЭЛЕКТРОЛИЗОВОМ БИЗНЕСЕ
- 12.1 718-й научно-исследовательский институт CSIC
- 12.1.1 718-й научно-исследовательский институт информации корпорации CSIC
- 12.1.2 718-й научно-исследовательский институт CSIC Обзор бизнеса
- 12.1.3 718-й научно-исследовательский институт CSIC по продажам, выручке и валовой прибыли (2016 г.) -2021)
- 12.1.4 718-й научно-исследовательский институт CSIC предлагает продукты для электролиза воды
- 12.
 1.5 718-й научно-исследовательский институт CSIC Последние разработки
1.5 718-й научно-исследовательский институт CSIC Последние разработки - 12.2 Протон на месте
- 12.2.1 Информация Proton On-Site Corporation
- 12.2.2 Обзор бизнеса Proton On-Site
- 12.2.3 Продажи, выручка и валовая прибыль от протонного электролиза воды на месте (2016-2021)
- 12.2.4 Протонная вода на месте Предлагаемые продукты для электролиза
- 12.2.5 Протон на месте Последние разработки
- 12.3 Гидрогеника
- 12.3.1 Информация Hydrogenics Corporation
- 12.3.2 Обзор бизнеса гидрогеники
- 12.3.3 Водородный электролизер Продажи, выручка и валовая прибыль (2016 г. -2021)
- 12.3.4 Предлагаемые продукты для электролиза воды в гидрогенизме
- 12.3.5 Последние разработки в области гидрогенизации
- 12.4 Teledyne Energy Systems
- 12.4.1 Информация корпорации Teledyne Energy Systems
- 12.4.2 Обзор бизнеса компании Teledyne Energy Systems
- 12.4.3 Электролиз воды в компании Teledyne Energy Systems Продажи, выручка и валовая прибыль (2016-2021)
- 12.
 4.4 Предлагаемые продукты электролиза воды Teledyne Energy Systems
4.4 Предлагаемые продукты электролиза воды Teledyne Energy Systems - 12.4.5 Последние разработки Teledyne Energy Systems
- 12.5 Suzhou Jingli
- 12.5.1 Информация о Suzhou Jingli Corporation
- 12.5.2 Обзор бизнеса Suzhou Jingli
- 12.5.3 Продажи, выручка и валовая прибыль (2016-2021)
- 12.5.4 Предлагаемые продукты для электролиза воды Suzhou Jingli
- 12.5.5 Suzhou Jingli Последние разработки
- 12.6 McPhy
- 12.6.1 Информация о McPhy Corporation
- 12.6.2 Обзор бизнеса McPhy
- 12.6.3 Продажи, выручка и валовая прибыль McPhy Water Electrolysis (2016-2021)
- 12.6.4 Предлагаемые продукты для электролиза воды McPhy
- 12.6.5 Последние разработки McPhy
- 12,7 Материковая часть Тяньцзиня
- 12.7.1 Информация о материковой части Тяньцзинь
- 12.7.2 Обзор бизнеса материковой части Тяньцзинь
- 12.7.3 Продажи, выручка и выручка от продаж, выручка и Валовая прибыль (2016-2021)
- 12.
 7.4 Предлагаемые продукты для электролиза воды на материковой части Тяньцзиня
7.4 Предлагаемые продукты для электролиза воды на материковой части Тяньцзиня - 12.7,5 Тяньцзинь на материковой части Последние разработки
- 12,8 Siemens
- 12.8.1 Информация корпорации Siemens
- 12.8.2 Обзор бизнеса Siemens
- 12.8.3 Продажи, выручка и валовая прибыль Siemens для электролиза воды (2016-2021)
- 12.8.4 Предлагаемые продукты для электролиза воды Siemens
- 12.8.5 Последние разработки Siemens
- 12.9 Nel Hydrogen
- 12.9.1 Nel Hydrogen Corporation Информация
- 12.9.2 Обзор бизнеса Nel Hydrogen
- 12.9.3 Продажи, выручка и валовая прибыль при электролизе водородной воды Nel (2016-2021)
- 12.9.4 Предлагаемые продукты для электролиза азота в воде
- 12.9.5 Последние разработки в области водородного азота
- 12.10 Toshiba
- 12.10.1 Информация корпорации Toshiba
- 12.10.2 Обзор бизнеса Toshiba
- 12.10.3 Продажи, выручка и валовая прибыль Toshiba Water Electrolysis (2016-2021)
- 12.
 10.4 Предлагаемые продукты для электролиза воды Toshiba
10.4 Предлагаемые продукты для электролиза воды Toshiba - 12.10.5 Последние разработки Toshiba
- 12.11 Yangzhou Chungdean Hydrogen Equipment
- 12.11.1 Yangzhou Chungdean Hydrogen Equipment Corporation Информация
- 12.11.2 Yangzhou Chungdean Hydrogen Equipment Business Overview
- 12.11.3 Yangzhou Chungdean Hydrogen Equipment Water Electrolysis Sales, выручка и валовая прибыль (2016-2021)
- 12.11.4 Yangzhou Chungdean Hydrogen Equipment Water Предлагаемые продукты для электролиза
- 12.11.5 Последние разработки водородного оборудования Yangzhou Chungdean
- 12.12 Areva h3gen
- 12.12.1 Информация корпорации Areva h3gen
- 12.12.2 Обзор бизнеса Areva h3gen
- 12.12.3 Продажи, выручка и валовая прибыль Areva h3gen для электролиза воды (2016-2021)
- 12.12.4 Предлагаемые продукты для электролиза воды Areva h3gen
- 12.12.5 Areva h3gen Последние разработки
- 12.13 ITM Power
- 12.
 13.1 Информация ITM Power Corporation
13.1 Информация ITM Power Corporation - 12.13.2 Обзор бизнеса ITM Power
- 12.13.3 Продажи, выручка и валовая прибыль ITM Power Water Electrolysis (2016-2021)
- 12.13.4 Предлагаемые продукты для электролиза воды ITM Power
- 12.13.5 Последние разработки ITM Power
- 12.14 Idroenergy Spa
- 12.14.1 Информация корпорации Idroenergy Spa
- 12.14.2 Обзор бизнеса Idroenergy Spa
- 12.14.3 Idroenergy Spa Water Electrolis Выручка и валовая прибыль (2016-2021)
- 12.14.4 Предлагаемые продукты для электролиза воды Idroenergy Spa
- 12.14.5 Idroenergy Spa Последние разработки
- 12.15 Erredue SpA
- 12.15.1 Информация Erredue SpA Corporation
- 12.15.2 Обзор бизнеса Erredue SpA
- 12.15.3 Продажи, выручка и валовая прибыль Erredue SpA при электролизе воды (2016-2021)
- 12.15.4 Электролиз воды Erredue SpA Предлагаемые продукты
- 12.15.5 Последние разработки Erredue SpA
- 12.
 16 Kobelco Eco-Solutions
16 Kobelco Eco-Solutions - 12.16.1 Информация о Kobelco Eco-Solutions Corporation
- 12.16.2 Обзор бизнеса Kobelco Eco-Solutions
- 12.16.3 Продажи, выручка и валовая прибыль от Kobelco Eco-Solutions для электролиза воды (2016-2021)
- 12.16.4 Предлагаемые продукты для электролиза воды Kobelco Eco-Solutions
- 12.16.5 Kobelco Eco-Solutions Последние разработки
- 12.17 ShaanXi HuaQin
- 12.17 .1 Информация корпорации ShaanXi HuaQin
- 12.17.2 Обзор бизнеса ShaanXi HuaQin
- 12.17.3 Продажи, выручка и валовая прибыль компании ShaanXi HuaQin для электролиза воды (2016-2021)
- 12.17.4 Предлагаемые продукты для электролиза воды ShaanXi HuaQin
- 12.17.5 ShaanXi HuaQin Последние разработки
- 12.18 Решение EM Solution
- 12.18.1 Информация корпорации EM Solution
- 12.18.2 Обзор бизнеса EM Solution
- 12.18.3 EM Solution Water Electrolysis Sales, Выручка и валовая прибыль (2016-2021)
- 12.18.4 Предлагаемые продукты электролиза воды в растворе ЭМ
- 12,19 Пекин Чжундянь
- 12.19.1 Информация о корпорации Beijing Zhongdian
- 12.19.2 Обзор бизнеса в Пекине Zhongdian
- 12.19.3 Продажи, выручка и валовая прибыль в Пекине Zhongdian (2016-2021)
- 12.19.4 Предлагаются продукты для водного электролиза в Пекине
- 12.19.5 Пекин Zhongdian Последние разработки
- 12.20 h3B2
- 12.20.1 Информация о корпорации h3B2
- 12.20.2 Обзор бизнеса h3B2
- 12.20.3 h3B2 Продажи, выручка и валовая прибыль (2016-2021)
- 12.20,4 h3B2 Предлагаемые продукты для электролиза воды
- 12.20.5 h3B2 Последние разработки
- 12.21 Elchemtech
- 12.21.1 Информация корпорации Elchemtech
- 12.21.2 Обзор бизнеса Elchemtech
- 12.21.3 Валовые продажи Elchemtech и прибыль от продаж за 2016 г. -2021)
- 12.21.4 Предлагаемые продукты электролиза воды Elchemtech
- 12.22 Asahi Kasei
- 12.22.1 Информация Asahi Kasei Corporation
- 12.22.2 Обзор бизнеса Asahi Kasei
- 12.22.3 Продажи, выручка и валовая прибыль Asahi Kasei для водного электролиза (2016-2021)
- 12.22.4 Предлагаемые продукты для водного электролиза Asahi Kasei
- 12.22.5 Asahi Kasei Последние разработки
- 12.23 Verde LLC
- 12.23.1 Информация о корпорации Verde LLC
- 12.23.2 Обзор бизнеса Verde LLC
- 12.23.3 Продажи, выручка и валовая прибыль ООО Verde LLC при электролизе воды (2016-2021)
- 12.23.4 Предлагаемые продукты для водного электролиза Verde LLC
- 12.23.5 Verde LLC Последние разработки
- 12.24 Thyssenkrupp
- 12.24.1 Информация о Thyssenkrupp Corporation
- 12.24.2 Обзор бизнеса Thyssenkrupp
- 12.24.3 Thyssenkrupp Маржинальные продажи и продажи электролиза воды (2016-2021)
- 12.24.4 Предлагаемые продукты для электролиза воды Thyssenkrupp
- 12.24.5 Thyssenkrupp Последние разработки
- 13 ЭЛЕКТРОЛИЗ ВОДЫ АНАЛИЗ ЗАТРАТ НА ПРОИЗВОДСТВО
- 13.1 Основное сырье для электролиза воды
- 13.1.1 Основное сырье
- 13.1.2 Динамика цен на основное сырье
- 13.1.3 Основные поставщики сырья
- 13.2 Режим и процесс производства электролиза воды
- 13.3 Анализ производственной цепочки электролиза воды
- 14 МАРКЕТИНГОВЫЙ КАНАЛ, ДИСТРИБЬЮТОРЫ И КЛИЕНТЫ
- 14.1 Маркетинговый канал
- 14.2 Список дистрибьюторов электролиза воды
- 14.3 Потребители электролиза воды
- 15 ДИНАМИКА РЫНКА 15311 9031 Тенденции рынка электролиза воды
- 15.2 Движущие силы рынка электролиза воды
- 15,3 Проблемы рынка электролиза воды
- 15,4 Ограничения рынка электролиза воды
- 15,5 COVID-19
- 15,6 Региональная политика в период после COVID-19 стратегии
- 15,7
- 15.8 Первичные интервью с ключевыми участниками водного электролиза (лидерами мнений)
- 16 ВЫВОДЫ И ЗАКЛЮЧЕНИЕ ИССЛЕДОВАНИЙ
- 17 ПРИЛОЖЕНИЕ
- 17.1 Методология исследования
- 17.1.1 Методология / подход к исследованию
- 17.1.2 Источник данных
- 17.2 Сведения об авторе
- 17.3 Заявление об ограничении ответственности
- Список таблиц
- Таблица 1. Рост мировых продаж электролиза воды (в миллионах долларов США) Ставка по типу (2016, 2021 и 2027)
- Таблица 2. Глобальные продажи электролиза воды (в миллионах долларов США) Сравнение по приложениям (2016, 2021 и 2027 годы)
- Таблица 3. Мировой рынок Объем рынка электролиза воды (в миллионах долларов США) по регионам: 2016 г., 2021 г. и 2027 г.
- Таблица 4.Глобальные продажи электролиза воды (единицы) по регионам (2016-2021)
- Таблица 5. Доля мирового рынка продаж электролиза воды по регионам (2016-2021)
- Таблица 6. Мировые доходы от электролиза воды (в миллионах долларов США) Доля рынка по регионам (2016-2021)
- Таблица 7. Доля мировых доходов от электролиза воды по регионам (2016-2021)
- Таблица 8. Глобальные продажи от электролиза воды (единицы) Прогноз по регионам (2022-2027)
- Таблица 9. Глобальный электролиз воды Прогноз доли рынка продаж по регионам (2022-2027)
- Таблица 10.Глобальный прогноз доходов от электролиза воды (в миллионах долларов США) по регионам (2022-2027)
- Таблица 11. Глобальный прогноз доли доходов от электролиза воды по регионам (2022-2027)
- Таблица 12. Глобальные продажи от электролиза воды (единица) ключевых компаний (2016-2021)
- Таблица 13. Доля мировых продаж электролиза воды по компаниям (2016-2021)
- Таблица 14. Мировые доходы от электролиза воды (в миллионах долларов США) по компаниям (2016-2021)
- Таблица 15. Global Water Доля доходов от электролиза по компаниям (2016-2021)
- Таблица 16.Глобальный электролиз воды по типу компании (уровень 1, уровень 2 и уровень 3) и (на основе дохода от электролиза воды по состоянию на 2020 год)
- Таблица 17. Средняя цена электролиза воды на мировом рынке (тыс. Долл. США за единицу) ключевой компании (2016-2021)
- Таблица 18. Производственная база и головной офис по производству электролиза воды
- Таблица 19. Производители предлагаемого продукта для электролиза воды
- Таблица 20. Слияния и поглощения, планы расширения
- Таблица 21.Глобальные продажи электролиза воды (единицы) по типу (2016-2021)
- Таблица 22. Доля мировых продаж электролиза воды по типу (2016-2021)
- Таблица 23. Мировая выручка от электролиза воды (в миллионах долларов США) Доля рынка по типу ( 2016-2021)
- Таблица 24. Доля мировых доходов от электролиза воды по типу (2016-2021)
- Таблица 25. Глобальная цена электролиза воды (тыс. Долл. США за единицу) по типу (2016-2021)
- Таблица 26. Глобальная вода Продажи электролиза (единицы) по типу (2022-2027)
- Таблица 27.Доля мировых продаж от электролиза воды по типу (2022-2027)
- Таблица 28. Доля мирового рынка от электролиза воды (в миллионах долларов США) по типу (2022-2027)
- Таблица 29. Доля мирового дохода от электролиза воды по типу (2022- 2027)
- Таблица 30. Глобальная цена электролиза воды (тыс. Долл. США за единицу) по типу (2022-2027)
- Таблица 31. Глобальные продажи электролиза воды (единицы) по приложениям (2016-2021)
- Таблица 32. Глобальная вода Доля продаж электролиза по областям применения (2016-2021 гг.)
- Таблица 33.Мировая выручка от электролиза воды (в миллионах долларов США) Доля рынка по приложениям (2016-2021)
- Таблица 34. Доля мировых доходов от электролиза воды по приложениям (2016-2021)
- Таблица 35. Мировая цена электролиза воды (тыс. Долл. США за единицу) по приложениям (2016-2021)
- Таблица 36. Мировые продажи электролиза воды (единицы) по приложениям (2022-2027)
- Таблица 37. Доля мировых продаж водного электролиза по приложениям (2022-2027)
- Таблица 38. Мировая вода Доходы от электролиза (в миллионах долларов США) Доля рынка по приложениям (2022-2027)
- Таблица 39.Доля мировых доходов от электролиза воды по приложениям (2022-2027)
- Таблица 40. Глобальная цена электролиза воды (тыс. Долл. США за единицу) по приложениям (2022-2027)
- Таблица 41. Продажи в Северной Америке с разбивкой по компаниям (2016-2021 гг.) ) & (Единица)
- Таблица 42. Доля рынка продаж электролиза воды в Северной Америке по компаниям (2016-2021 гг.)
- Таблица 43. Выручка от электролиза воды в Северной Америке по компаниям (2016-2021 гг.) И (млн долларов США)
- Таблица 44. Доли рынка выручки от электролиза воды в Северной Америке по компаниям (2016-2021)
- Таблица 45.Продажи с использованием электролиза воды в Северной Америке по типам (2016-2021 гг.) И (единицы)
- Таблица 46. Доля рынка продаж электролиза воды в Северной Америке по типам (2016-2021 гг.)
- Таблица 47. Продажи в странах с электролизом воды в Северной Америке по типам (2022–2022 гг.) 2027) & (Единица)
- Таблица 48. Доля рынка сбыта водного электролиза в Северной Америке по типу (2022-2027)
- Таблица 49. Продажи в Северной Америке с разбивкой по областям применения (2016-2021) и (Единица)
- Таблица 50 . Доля рынка продаж электролиза воды в Северной Америке по приложениям (2016-2021)
- Таблица 51.Продажи для электролиза воды в Северной Америке по приложениям (2022-2027) и (единицам)
- Таблица 52. Доля рынка продаж электролиза воды в Северной Америке по приложениям (2022-2027 гг.)
- Таблица 53. Продажи в Европе для электролиза воды по компаниям (2016-2021 гг.) ) & (Единица)
- Таблица 54. Доля рынка продаж электролиза воды в Европе по компаниям (2016-2021 гг.)
- Таблица 55. Выручка от электролиза воды в Европе по компаниям (2016-2021 гг.) И (млн долларов США)
- Таблица 56. Доля рынка выручки от электролиза воды в Европе по компаниям (2016-2021)
- Таблица 57.Продажи с использованием электролиза воды в Европе по типам (2016-2021 гг.) И (единицы)
- Таблица 58. Доля рынка продаж электролиза воды в Европе по типам (2016-2021 гг.) (Единица)
- Таблица 60. Доля рынка сбыта электролиза воды в Европе по типам (2022-2027)
- Таблица 61. Продажи электролиза воды в Европе по приложениям (2016-2021) и (Единица)
- Таблица 62. Продажи электролиза воды в Европе Доля рынка по приложениям (2016-2021)
- Таблица 63.Продажи для электролиза воды в Европе по приложениям (2022-2027) и (единицы)
- Таблица 64. Доля рынка продаж электролиза воды в Европе по приложениям (2022-2027 гг.)
- Таблица 65. Продажи в Китае с разбивкой по компаниям (2016-2021 гг.) И (Единицы)
- Таблица 66. Доля рынка продаж электролиза воды в Китае по компаниям (2016-2021 гг.)
- Таблица 67. Выручка от электролиза воды в Китае по компаниям (2016-2021 гг.) И (млн долларов США)
- Таблица 68. Вода в Китае Доля рынка выручки от электролиза по компаниям (2016-2021)
- Таблица 69.Продажи в Китае с разбивкой по типу (2016-2021 гг.) И (единицы)
- Таблица 70. Доля рынка продаж электролиза воды в Китае по типу (2016-2021 гг.) 59
Высокоэнергетические явления при электролизе воды
Как следует из рис. 4 (а), скорость Si-образца увеличивается менее чем за 10 мкм с. Поскольку начальное ускорение велико ~ 70 g , где g — ускорение свободного падения, мы заключаем, что процессы носят взрывной характер.Наличие звука — дополнительная характерная черта взрыва. Эти сигнатуры могут быть получены в результате реакции горения между газами H 2 и O 2 в начальном пузырьке. Если пузырек заполнен стехиометрической смесью газов, энергия сгорания оценивается как E com = 2 N | Δ H | / 3, где N — количество молекул газа. в пузырьке, Δ H ≈ −242 кДж / моль — энтальпия образования воды.Число N можно выразить с помощью уравнения состояния при комнатной температуре до сгорания. Таким образом, получаем, что E com ≈ 0,3 μ Дж для начального радиуса пузырька R in ≈ 22 μ м. Этот размер соответствует приблизительной оценке из видео. Отношение полезной работы к энергии взрыва Вт / E ком ~ 1 можно сравнить с аналогичным значением, полученным в исх.8, где работу выполняла гибкая мембрана, закрывающая микрокамеру.
Подводное горение и взрывы исследовались во многих работах (см., Например, ссылки 17, 18, 19, 20, 21), но сравнивать результаты с нашим случаем сложно из-за гораздо большего масштаба событий и различных геометрических характеристик. конфигурация экспериментов и моделирования. Горение в пузырьках диаметром от 10 мкм до м рассматривалось в работе [5]. 22, но он поддерживался высокой температурой внутри пузыря, быстро схлопывающегося в акустическом поле.
Прямое сравнение можно провести с экспериментом 23 , в котором горение наблюдалось в пузырьке (в воде) диаметром 2 мм, содержащем ацетилено-кислородную смесь. Значительная энергия в 20 мДж поступала от искры для воспламенения нормального горения в пузырьке. В нашем случае реакция инициируется спонтанно в меньшем пузыре, но темпы надувания сопоставимы: 6 м / с в нашем случае против 8 м / с в исх. 23. Еще одна важная величина — это плотность энергии. В нашем случае это можно оценить непосредственно из эксперимента как E ev / V in = 5 — 21 МДж / м 3 , где — начальный объем пузыря.Большой интервал здесь связан с неопределенностью начального размера пузырька. Если использовать E com вместо экспериментального значения E ev , объем V в выпадает, и мы находим теоретическое значение 6,5 МДж / м 3 для водородно-кислородное горение. Эту плотность энергии можно сравнить с 15 МДж / м 3 для ацетилено-кислородной смеси. Он отличается от такового для водорода-кислорода тем, что энтальпия сгорания ацетилена довольно велика,.Из сравнения можно сделать вывод, что мы действительно наблюдаем горение водорода в микропузырьках.
Исходный пузырек, содержащий стехиометрическую смесь газов, образуется путем слияния НБ, полученных электрохимическим процессом с переменной полярностью 8 . Для этого плотность NB должна быть настолько высокой, чтобы пузырьки почти соприкасались. Вот почему события разделены временем около 50 мс, как видно на рис. 2. После взрыва система ждет, пока новые NB будут собраны рядом со структурой.Колебания локальной концентрации нанопузырьков объясняют, что щелчки происходили не совсем регулярно.
Причина самопроизвольного инициирования реакции в относительно большом микропузырьке не ясна. В NB, содержащих смесь газов, реакция может быть инициирована как поверхностный процесс 9 , но для более крупных пузырьков этот механизм должен подавляться из-за меньшего отношения поверхности к объему. Стехиометрические пузырьки, создаваемые микрофлюидным генератором, выдерживают не менее 900 мс.С другой стороны, в пузырьках, образованных при коалесценции NB, реакция инициируется спонтанно менее чем за 10 мкм с. Мы не знаем причину этой разницы, но она может быть связана с нанокаплями, оставшимися в пузыре после слияния многих NB. Плотно упакованные NB заполняют только 74% объема, остальное — жидкость, заключенная между пузырьками. После слияния пузырьков захваченная жидкость образует нанокапли, распределенные внутри МБ. В этом МБ любая молекула газа отделена от жидкости на наноскопическое расстояние.Возможно, это может сыграть роль в инициировании реакции.
Когда взрыв происходит в начальной МБ, давление и температура в пузыре повышаются. Если теплообмен со стенками медленный по сравнению с реакцией, энергия сгорания E com расходуется только на нагрев водяного пара, образующегося в реакции. Предполагая, что размер пузырька изменяется незначительно во время фазы горения, мы можем найти давление в пузырьке из уравнения состояния как P / P 0 ≈ 2 | Δ H | / 3 T 0 = 64.7, где P 0 ≈ 1 бар — давление окружающей среды, а T 0 — комнатная температура. Наиболее эффективным каналом теплообмена является испарение воды со стенок энергичными молекулами. Для таких молекул время, необходимое для достижения стенки, оценивается как, где D gg — коэффициент самодиффузии водяного пара. При нормальных условиях D gg ≈ 2,8 × 10 −5 м 2 / с, и мы находим τ h ~ 10 μ с; это время масштабируется с температурой как ( T / T 0 ) 1/2 .Самовозгорание в микропузырьках и нанопузырьках происходит за несколько микросекунд 9 . Поскольку и время теплообмена, и время сгорания сравнимы, давление и температура в начальном пузырьке сразу после сгорания определяется динамикой, но в любом случае ожидается, что она будет высокой. Источник звука — скачок давления. Во время фазы надувания давление уменьшается и опускается ниже атмосферного по инерции, как это происходит, например, при кавитации.На завершающем этапе пузырек сжимается и исчезает. Масштаб времени для теплообмена объясняет, почему полезная работа, наблюдаемая в этом исследовании, намного больше, чем в микросистеме 8 . В последнем случае начальный пузырек имел радиус R в ≈ 5 мкм м. Из-за меньшего размера теплообмен происходит намного быстрее, а давление и температура достигают меньших значений.
В качестве альтернативы можно попытаться объяснить наблюдаемые явления нагревом электролита током Фарадея (джоулевым нагревом).Пузырь пара мог образоваться из-за нагрева. Однако нагрев электролита должен приводить к увеличению тока. Этот эффект можно использовать как встроенный термометр 11 . Наблюдается лишь небольшое повышение температуры между щелчками, как описано в разделе «Дополнительная информация», рис. 2S. В этом сценарии нет движущей силы для надувания пузыря, поскольку давление в пузыре не может достичь высокого значения. В качестве дополнительного сценария можно представить, что ток, проходящий через небольшой объем жидкости, испаряет этот объем, создавая начальный пузырь с высоким давлением внутри.Число молекул в пузырьке оценивается как N v < E ev / Δ H v ≈ 4,4 × 10 12 , где E ev ≈ 0,3 μ Дж — наблюдаемая энергия, а Δ H v = 41 кДж / моль — энтальпия парообразования воды. Мы взяли только верхний предел, так как нагревом молекул пренебрегли.Для этого N v радиус испаренной жидкой сферы должен быть R l <3,2 μ м. Экспериментальное значение плотности тока Фарадея оценивается как j F ≈ 200 А / см 2 . Он аналогичен тому, который используется для нормально работающих микроустройств 10,11 . Этот ток может передавать энергию E ev ≈ 0,3 μ Дж к N v молекулам за время τ E , которое можно найти из соотношения, где U = 6.75 В. Это дает τ E > 700 μ с, что значительно больше, чем время, необходимое для образования начального пузыря, которое меньше 10 μ с.
Для применения в микрокомпьютерах электрохимическое производство взрывного газа неэффективно. Вместо этого необходимо обеспечить соответствующие условия в микрообъеме с предварительно смешанными газами. Если объем закрыт гибкой мембраной, взрыв сдвинет мембрану вверх. Поэтому критически важным шагом является понимание того, почему газ самовоспламеняется в МБ, полученных электрохимическим способом, и обеспечение правильных условий в микрообъеме.
В заключение, мы наблюдали высокоэнергетические события при электролизе воды, вызванные короткими импульсами напряжения переменной полярности. Процесс сопровождается звуковыми щелчками, которые происходят синхронно с падениями тока в системе. Наблюдения объяснялись самовозгоранием газов H 2 и O 2 в исходном пузыре диаметром около 40 мкм м.




 1 Объем продукта для электролиза воды
1 Объем продукта для электролиза воды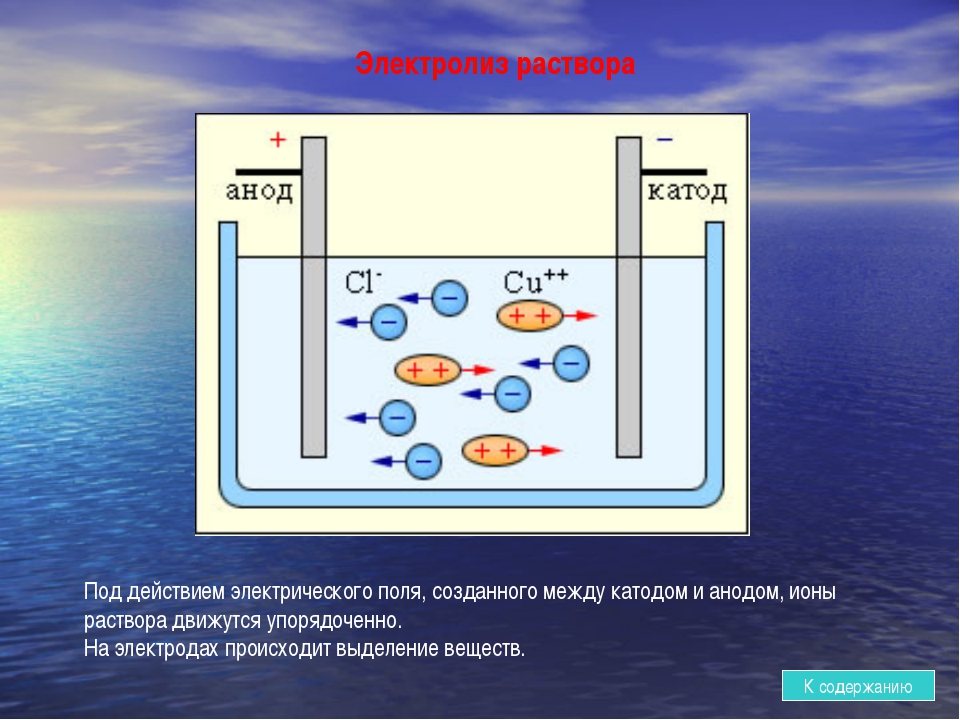 1 Размер мирового рынка электролиза воды по регионам: 2016 VS 2021 VS 2027
1 Размер мирового рынка электролиза воды по регионам: 2016 VS 2021 VS 2027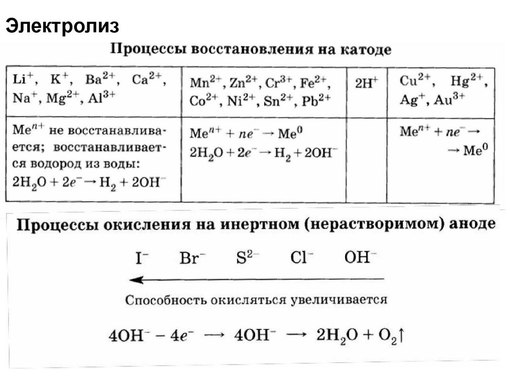 )
) 1.3 Мировая цена на электролиз воды по типу (2016-2021)
1.3 Мировая цена на электролиз воды по типу (2016-2021) 1.2 Выручка от электролиза воды в Северной Америке по компаниям (2016-2021 гг.)
1.2 Выручка от электролиза воды в Северной Америке по компаниям (2016-2021 гг.) 3 Распределение продаж водного электролиза в Европе по приложениям
3 Распределение продаж водного электролиза в Европе по приложениям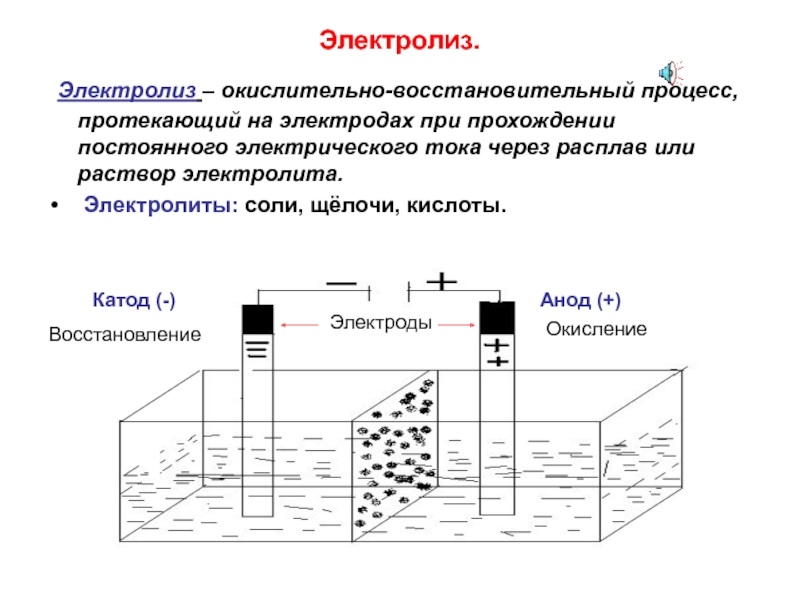 1 Продажи компании для водного электролиза в Японии
1 Продажи компании для водного электролиза в Японии 1.2 Выручка от электролиза воды на Ближнем Востоке и в Африке по компаниям (2016-2021)
1.2 Выручка от электролиза воды на Ближнем Востоке и в Африке по компаниям (2016-2021) )
) 1.5 718-й научно-исследовательский институт CSIC Последние разработки
1.5 718-й научно-исследовательский институт CSIC Последние разработки 4.4 Предлагаемые продукты электролиза воды Teledyne Energy Systems
4.4 Предлагаемые продукты электролиза воды Teledyne Energy Systems 7.4 Предлагаемые продукты для электролиза воды на материковой части Тяньцзиня
7.4 Предлагаемые продукты для электролиза воды на материковой части Тяньцзиня 10.4 Предлагаемые продукты для электролиза воды Toshiba
10.4 Предлагаемые продукты для электролиза воды Toshiba 13.1 Информация ITM Power Corporation
13.1 Информация ITM Power Corporation 16 Kobelco Eco-Solutions
16 Kobelco Eco-Solutions