Электролиз, подготовка к ЕГЭ по химии
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu д.
д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO4

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
Теперь вы точно будете знать, что выделяется на катоде ;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к
Урок по химии «Электролиз»
Цель урока: сформировать у учащихся понятие процесса электролиза.
Задачи урока:
- Сформировать умение определять процессы, происходящие на электродах, составлять суммарное уравнение реакции электролиза.
- Развивать у школьников умение пользоваться опорными знаниями, составлять конспект урока.
- Углубить знание окислительно-восстановительных процессов, сформировать понимание практического значение электролиза в природе и жизни человека.
- Развивать мышление, умение делать логические выводы из наблюдений по опыту.
- Закрепить умения и навыки химического
эксперимента, умение работать с таблицами,
справочными материалами, дополнительной
литературой, опорными схемами.

Оборудование: таблица растворимости, индикаторная шкала, штатив с пробирками, растворы фенолфталеина, сульфата меди (II), хлорида натрия, хлорида алюминия, прибор для определения электропроводимости растворов, толстостенные химические стаканы, опорные схемы урока, физическая карта России, плакаты “Электролиз водных растворов”, “Применение электролизов”.
Эпиграф: “Открытия в области электрохимии представляют собой одну из самых больших революций в химии и открывают эру новых открытий” (Джон Фредерик Даниэль, английский электрохимик).
Ход урока
1. Постановка проблемы.
Наш сегодняшний урок мне хотелось бы начать с античной легенды:
“Некий мастер, имя которого история не
сохранила, принес римскому императору Тиберию,
правившему в начале I века н.э., чашу из металла,
напоминающего серебро, но только более легкого.
Но история не знает безвозвратных потерь. В 1827 году немецкий ученый Фридрих Вёлер получает несколько граммов, а через несколько лет уже несколько килограммов нового легкого, прочного, блестящего металла. Но металл стоил также дорого, как серебро. Французы изготовили из него кирасы охранникам императора и игрушку наследнику Его Величества. В этом ларце находиться изделие из этого металла. Оно необходимо каждому из нас. Что же находиться в ларце? (Ответивший на вопрос ученик достает из ларца алюминиевую ложку.)
Кстати, в 1852 году это чайная ложечка весом 25 грамм стоила бы 30 долларов.
Послушаем сообщение о стоимости алюминия в 19
веке, о работах Фридриха Вёлера и Чарльза Холла.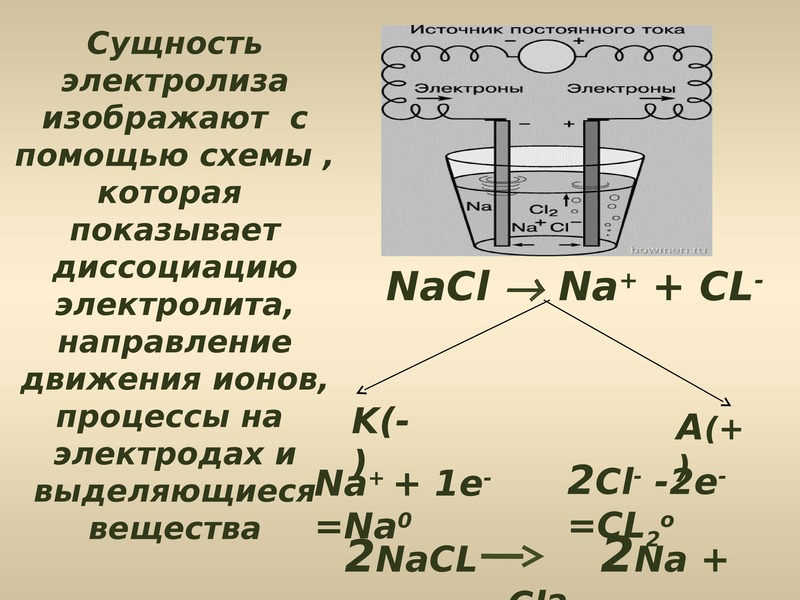
Учащийся выступает с сообщением.
Найдем на географической карте России центры получения алюминия.
Учащиеся называют города Волгоград и Красноярск.
Почему же именно в этих городах расположены крупнейшие заводы по производству алюминия?
Учащиеся констатируют факт расположения заводов по производству алюминия вблизи крупных электростанций.
Таким образом, мы пришли к выводу, что для получения алюминия необходимы значительные затраты электроэнергии, и в записи уравнения реакции получения алюминия по способу Чарльза Холла не хватает знака “” — знака электролиза.
Сегодня мы вторгаемся в область электрохимии и рассмотрим явление электролиза. Запишем тему урока.
2. Основная часть.
Вопрос: “Что же называется электролизом ?”.
“Электро” – электрический ток, “лизис” –
разложение.
Делается вывод, что электролиз – это процесс, в результате которого происходит разложение вещества под действием постоянного электрического тока.
Разложить можно практически любое вещество, поместив его в электролизер. Но в каком виде? Обычно в жидком, т.е. в виде раствора.
На плакате изображено, что в раствор
электролита опускаются электроды, соединенные с
источником постоянного электрического тока.
Отрицательно заряженный электрод называется
катод и условно обозначается К (-). Положительно
заряженный электрод называется анод и
обозначается А (+). В межэлектродном пространстве
находится диссоциирующий на ионы электролит.
Катионы, заряженные положительно, перемещаются в
сторону катода, а анионы, заряженные
положительно, в сторону анода. На катоде будет
происходить электрохимическое восстановление
катионов или молекул воды, а на аноде
электрохимическое окисление анионов или молекул
воды.
Дается определение: электролиз – совокупность окислительно-восстановительных процессов, протекающих в электролитах при пропускании постоянного электрического тока.
Данный прибор имитирует работу электролизера. Он поможет нам выполнить тестовое задание, текс которого находиться у вас на столах :
Задача.
При электролизе раствора какой соли можно одновременно получить 0,2 моль нерастворимого основания и 13,44 л газообразных продуктов (н.у.)? Напишите уравнения процессов, происходящих на электродах в ионной и молекулярной формах:
1) CuSO4;
2) NaCl;
3) AlCl3.
(ВолгГТУ, 2004 год.)
Определим соотношение количеств газообразных продуктов и нерастворимого основания, выполним предварительные расчеты:
v (осадка) = 0,2 моль
V (газов) = 13,44 л
v (газов): v (осадка) = ?
v (газов) =V(газов) : Vm = 13. 44 : 22,4 = 0,6 моль
44 : 22,4 = 0,6 моль
v (газов): v (осадка) = 0,6 : 0,2 = 6 : 2 = 3 : 1
Из текста задания ясно, что нам необходимо составить уравнения электролиза растворов, определить катодные и анодные процессы, выполнить необходимые расчеты. Кто первый хочет попробовать выполнить задание п. а)?
Напишем сначала процесс электролитической диссоциации, происходящий в данном растворе.
А) CuSO4 —>Cu2+ + SO42-
Катион меди (II) будет перемещаться в сторону катода.
Но поскольку в околокатодном пространстве будут находиться также молекулы воды, то мы запишем это таким образом:
К(-) Cu2+
H2O
Пользуясь опорным конспектом [приложение № 1], определите катион меди (II) или молекулы воды будут восстанавливаться на поверхности катода?
Катион Cu2+ входит в 3 группу катионов и он
будет восстанавливаться. Вода восстановлению в
данном случае не подвергается:
Вода восстановлению в
данном случае не подвергается:
К(-) Cu2+ + 2 е Cu0
H2O
Определим теперь процессы, происходящие на аноде.
Сульфат – анион будет перемещаться в сторону анода, в околоанодном пространстве будут так же находиться молекулы воды:
А (+) SO42-
H2O
На аноде будет происходить электрохимическое окисление молекул воды, так как анион SO42 является анионом кислотного остатка оксокислоты и окислению не подвергается (1 группа анионов):
А (+) SO42-
2H2O- 4 е —>О20 + 4Н+
Определим соотношение коэффициентов так же, как в обычном электронном балансе:
К(-) Cu2+ + 2 е —>Cu0 (2)
H2O
А (+) SO42-
2H2O- 4 е —>О20 + 4Н+ (1)
Составим электронно-ионное уравнение, с учетом коэффициентов:
2Cu2+ +2H2O —> 2Cu0 + О20 + 4Н+
Полное электронно-ионное уравнение напишем с учетом ионов, не участвовавших в окислительно-восстановительном процессе:
2Cu2+ +2H2O + 2 SO42 —> 2Cu0 + О20 + 4Н+ + 2 SO42
Теперь мы легко напишем суммарное уравнение электролиза, не забыв поставить знак электролиза:
2CuSO4 + 2 H2O —> O2 + 2Cu + 2H2SO4
Получился ли в результате реакции осадок?
Определите это с помощью таблице растворимости.
В результате реакции электролиза осадок не образовался.
Может быть выделился газ?
В околоанодном пространстве происходит выделение кислорода.
Проверим это опытным путем – проведем электролиз водного раствора сульфата меди (II). Что вы наблюдаете?
Поверхность одного из электродов покрывается пузырьками газа.
Перейдем к выполнению задания п. б).
NaCl —> Na+ + Cl –
K (-) Na+
2H2O— 2 e —> 2OH – + H2 (2) (1)
A (+)2Cl – — 2 e —> Cl20 (2) (1)
H2O
2H2O + 2Cl – —>2OH – + H2 + Cl2
2Na+ + 2H2O + 2Cl – —>2OH + H2 + Cl20
+ 2Na+
2 NaCl + 2H2O —> 2NaOH + H2 + Cl2
Получились ли теперь осадок и газообразные вещества?
Осадка нет, но в околокатодном пространстве
происходит выделение водорода, а в околоанодном
пространстве – хлора.
Проверим это опытным путем – проведем электролиз водного раствора хлорида натрия. Что вы наблюдаете?
Поверхность обоих электродов покрывается пузырьками газа, в присутствии фенолфталеина раствор окрашивается в малиновый цвет.
Выполним задание п. в).
AlCl3 —> Al3+ + 3Cl –
K (-) Al3+
2H2O + 2 e 2OH – + H20 (6) (3)
A(+)6Cl – — 6 e —> 3Cl20 (2) (1)
H2O
6H2O + 6Cl — —> 3H2 +6OH – + 3Cl2
6H2O + 6Cl —+2Al3+ —> 3H2 +6OH – +
3Cl2+2Al3+
2AlCl3 + 6H2O —>3H20 +3Cl2 + 2Al(OH)3
С помощью таблицы растворимости определяем,
что вещество Al(OH)3 не растворимо и выпадает
в осадок. В околоанодном пространстве выделяется
газообразный хлор, в околокатодном пространстве
– водород.
В околоанодном пространстве выделяется
газообразный хлор, в околокатодном пространстве
– водород.
Проверим это опытным путем – проведем электролиз водного раствора хлорида алюминия. Что вы наблюдаете?
Происходит помутнение раствора.
По уравнению реакции определяем соотношение количеств газообразных продуктов и осадка.
2AlCl3 + 6H2O —>3H20 +3Cl2 + 2Al(OH)3
6 моль газов 2 моль осадка
v (газов): v (осадка) = 6: 2 = 3 : 1
Это в точности совпадает с нашими расчетами. Значит правильный ответ в этом задании в)
3. Разрешение проблемы.
Мы выполнили с вами задание, но алюминий в
результате электролиза не получили. В качестве
сырья мы должны взять оксид алюминия, в воде не
растворимый. Но электролит в электролизере
должен быть жидким. Как быть?
Как быть?
Сделать расплав.
Обратимся к тексту учебника §18. Какой процесс протекает при электролизе расплава глинозема в криолите?
Al2O3 — 2Al3 + + 3O2 –
K (-) Al3+ + 3 e —> Al0 (4)
A(+) 2O2 – — 4 e —> O02 (3)
4Al3 + + 6O2 — —> 4Al0 + 3O20
2Al2O3 —>4Al + 3O2
Мы рассмотрели с вами химические основы современного промышленного способа получения алюминия.
4. Практическое значение электролиза.
Но только ли для этого необходим электролиз? О практическом значении электролиза послушаем сообщение.
Ученик делает сообщение и выполняет
демонстрационные опыты.
5. Подведение итогов, проверка результативности.
Проверим результативность нашей совместной работы, напишем графический диктант, текст которого вы видите на своих столах :
Графический диктант.
- Электролиз можно считать окислительно-восстановительной реакцией, происходящей под воздействием электрического тока.
- Катод – отрицательно заряженный электрод;
- На катоде происходит процесс электрохимического окисления;
- Анион SO42 – будет окисляться на аноде в водном растворе;
- Анион Cl – будет окисляться на аноде в водном растворе;
- Катион Na + будет восстанавливаться на катоде в водном растворе;
- Катион Cu2 + будет восстанавливаться на катоде в водном растворе;
- Алюминий получают электролизом расплава Al2O3 в криолите;
- При электролизе раствора NaCl можно получить
щелочь NaOH и газы H2 и Cl2.

Ученики заполняют бланк химического диктанта:
Фамилия, имя_______________________________________
1 2 3 4 5 6 7 8 9 10
ДА
НЕТ
Оценка:_______________
Учащимся предлагается поменяться с соседом заполненными бланками, выставить друг другу оценки по оценочной шкале: 5 – 6 правильных ответов – оценка “3”, 7 – 8 правильных ответов – оценка “4”, 9 – правильных ответов – оценка “5”. На доске открывается шаблон с правильными ответами:
Прошу поднять руку тех учеников, которые справились с графическим диктантам на “хорошо” и “отлично”.
6. Домашнее задание.
§18, упражнение № 29, 31, 37(письменно).
Трое учеников получают карточки с дополнительным индивидуальным заданием:
Карточка № 1.
Сколько килограмм алюминия можно получить при электролизе 1 тонны глинозема?
Карточка № 2.
При электролизе раствора какой соли можно одновременно получить 2 моль нерастворимого гидроксида и 44,8 л газообразных продуктов (н.у.)? напишите уравнения процессов, происходящих на электродах в ионной и молекулярной формах:
1) CuCl2;
2) Cu(NO3)2;
3) Mg(NO3)2
ВолгГТУ, 2004 год.
Карточка № 3.
В конце ХХ века появились новые данные о принципиальной возможности получения металлического алюминия в древности. Институт прикладной физики Китайского Академии наук сообщил о результатах исследования гробница полководца Чжоу-Чжу, похороненного в 297 году н.э.. спектральный анализ орнамента, украшающего саркофаг, показал, что он состоит из сплава: 85% алюминия, 10% меди, 5% магния. Анализ повторяли несколько раз. Результаты оказались те же. Как могли древние китайские мастера получить сплав алюминия?
Приложение.
Конспект урока по химии на тему «Электролиз»,9 класс
Электролиз.
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при пропускании постоянного электрического тока через электрохимическую систему, состоящую из двух электродов, опущенных в расплав или раствор электролита.
Энергия, необходимая для протекания химической реакции, поступает от внешнего источника тока.
Зависимость количества вещества, образовавшегося при электролизе от времени и силы тока описывается обобщённым законом Фарадея.
, где
m – масса образовавшегося при электролизе вещества (г)
M – молярная масса вещества (г/моль)
N – количество отдаваемых или принимаемых ē.
I – сила тока (А)
t – продолжительность процесса (с)
f – постоянная Фарадея, характеризующая количество электричества, необходимое для выделения M/n данного вещества.
f = 96500 Кл/моль
Катод – это электрод, на котором происходит восстановление. Он заряжен отрицательно, поэтому к нему движутся катионы.
Анод – это электрод, на котором происходит окисление. Он заряжен положительно, поэтому к нему движутся анионы.
Электролиз расплавов солей и щелочей.
При расплавлении мы имеем дело только с одним веществом – электролитом. При расплавлении электролиты диссоциируют на катионы и анионы, которые, при пропускании электрического тока, движутся к соответствующим электродам.
Электролиз расплава хлорида калия – KCl.
K(-) A(-)
- , 2Cl— 2ē → Cl20
1
эл. ток
2Cl + 2K+ → Cl20 + 2K0
эл. ток
KCl K+ + Cl 2KCl → Cl20↑ + 2K0
Электролиз расплава гидроксида калия – KOH
KOH K+ + OH
OH,
4OH 4ē → 2H2O + O20
1
эл. ток
ток
4K+ + 4OH → K0 + 2H2O + O20
эл. ток
4KOH → 4K0 + 2H2O +O20↑
Вывод: при электролизе расплавов однозначно на катоде выделяется металл, а на аноде – газ-галоген (в случае галогенидов) или газ-кислород в (случае щелочей).
Электролиз в водных растворах.
В водных растворах электролитов (солей, кислот, щелочей) помимо самого электролита всегда присутствуют молекулы воды. Из-за присутствия воды, электролиз растворов по сравнению с электролизом расплавов, усложняется конкурирующими процессами на электродах. Какие процессы будут протекать у электродов при электролизе зависит прежде всего от относительных значений электродных потенциалов соответствующих электрохимических систем.
На катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал.
На аноде будут окисляться окисленные формы электрохимических систем, имеющих наименьший электродный потенциал.
Выбор восстанавливающейся частицы на катоде.
На катоде возможно протекание двух процессов:
Восстановление металла: Men+ + nē → Me0,
Восстановление воды: 2H2O + 2ē → H20 + 2OH, φ0 = -0.41В
2H2O + 2ē → H20 + 2OH
Параллельно могут протекать и восстановление металла и восстановление воды
В концентрированных растворах реальнее восстановление металла, а в разбавленных — воды
Восстанавливаются ионы
водорода.
Восстанавливается металл:
Men+ + nē → Me0
Выбор окисляющейся частицы на аноде.
Различают электролиз с инертными (нерастворимыми) и активными (растворимыми) электродами. Они отличаются тем, что в случае активного анода к конкурирующим процессам добавляется процесс растворения материала анода.
вода2H2O — 4ē → O20 + 4H+
Окисляется OH
4OH — 4ē → O20 + 2H2O
Окисляется анион
2A — 2ē → A20
*выделяется хлор, так как материал анода тормозит окисление воды с выделением кислорода
Электролиз расплавов и растворов (солей, щелочей, кислот) — «Химическая продукция»
Что такое электролиз расплавов и растворов (солей, щелочей, кислот)
Что такое электролиз расплавов и растворов (солей, щелочей, кислот)
Представьте источник постоянного тока, у него можно обнаружить положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
NaCl = Na+ + Cl−
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na+ направятся к отрицательно заряженному электроду – катоду. В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−. То есть на катоде протекает процесс:
Na+ + 1e− = Na0,
А на аноде:
Cl− − 1e− = Cl
Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
Сl∙ + ∙Cl = Cl2
Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
2Cl− − 2e− = Cl2
То есть мы имеем:
Катод: Na+ + 1e− = Na0
Анод: 2Cl− − 2e− = Cl2
Подведем электронный баланс:
Na+ + 1e− = Na0 |∙2
2Cl− − 2e− = Cl2 |∙1<
Сложим левые и правые части обоих уравнений полуреакций, получим:
2Na+ + 2e− + 2Cl− − 2e−= 2Na0 + Cl2
Сократим два электрона аналогично тому, как это делается в алгебре получим ионное уравнение электролиза:
2Na++ 2Cl− = 2Na0 + Cl2
далее, объединив ионы Na+ и Cl− получим, уравнение электролиза расплава хлорида натрия:
2NaCl(ж. ) => 2Na + Cl2
) => 2Na + Cl2
Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
Другими словами, ни у катионов Na+, ни у анионов Cl− не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Строение молекулы воды
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
При этом могут происходить процессы:
Катод:
2H2O + 2e− = 2OH− + H2
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
В таком случае является возможным только восстановление молекул воды на катоде.
Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
2H2O + 2e− = 2OH− + H2
Это касается металлов, находящихся в начале ряда активности по Al включительно.
2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
2H2O + 2e− = 2OH− + H2
Men+ + ne = Me0
К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
2Н+ + 2е− = Н2 – в случае кислоты
Men+ + ne = Me0 – в случае соли
На аноде тем временем ситуация следующая:
1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F−), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
2Сl− − 2e = Cl2
S2- − 2e = So
Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
4ОН− − 4е− = 2H2O + O2
3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F−) на аноде идет процесс окисления молекул воды:
2H2O – 4e− = O2 + 4H+
4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
2RCOO− − 2e− = R-R + 2CO2
Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
Пример №1
Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
Решение
При расплавлении хлорида цинка происходит его диссоциация:
ZnCl2 = Zn2+ + 2Cl−
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
Катод: Zn2+ + 2e− = Zn0 |∙1
Анод: 2Cl− − 2e− = Cl2 |∙1
ZnCl2 = Zn + Cl2
Пример №2
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.
Катод:
2H2O + 2e− = 2OH− + H2
Zn2+ + 2e− = Zn0
Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
Анод:
2Cl− − 2e− = Cl2
В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
Пример №3
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
Нитрат меди в растворе находится в продиссоциированном состоянии:
Cu(NO3)2 = Cu2+ + 2NO3−
Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
Катод:
Cu2+ + 2e− = Cu0
Нитрат-ион NO3− — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом:
Катод: Cu2+ + 2e− = Cu0 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
2Cu(NO3)2 + 2H2O = 2Cu0 + O2 + 4HNO3
Пример №4
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
Решение:
Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
СН3СООК = СН3СОО− + К+
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
Катод:
2H2O + 2e− = 2OH− + H2
Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
Анод:
2СН3СОО− − 2e− = CH3−CH3 + 2CO2
Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
Катод: 2H2O + 2e− = 2OH− + H2 |∙1
Анод: 2СН3СОО− − 2e− = CH3−CH3 + 2CO2 |∙1
2H2O + 2СН3СОО− = 2OH− + Н2+ CH3−CH3 + 2CO2
Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
2H2O + 2СН3СООK = 2KOH + Н2+ CH3−CH3 + 2CO2
Пример №5
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
H2SO4 = 2H+ + SO42-
На катоде будет происходить восстановление катионов водорода H+ , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
Катод: 2Н+ + 2e− = H2 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
4Н+ + 2H2O = 2H2 + O2 + 4H+
Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
2H2O = 2H2 + O2
Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.
Пример №6
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
Диссоциация гидроксида натрия:
NaOH = Na+ + OH−
На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
Катод: 2H2O + 2e− = 2OH− + H2 |∙2
Анод: 4OH− − 4e− = O2 + 2H2O |∙1
4H2O + 4OH− = 4OH− + 2H2 + O2 + 2H2O
Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
2H2O = 2H2 + O2
Электролиз Ионная теория электролиза.
При пропускании постоянного электрического тока через электролит на электродах протекают химические реакции. Этот процесс называется электролиз, что означает разложение (вещества) с помощью электричества.
Этот процесс называется электролиз, что означает разложение (вещества) с помощью электричества.
В разд. 8.1 было указано, что электролит -это такая жидкость, которая при пропускании через нее электрического тока подвергается химической реакции. Электролитом может быть расплавленная соль, как, например, расплав бромида свинца(Н), либо водный раствор какой-либо кислоты, основания или соли.
Электрический ток подводится к электролиту с помощью электродов — проволочных проводников, металлических стержней или пластин, осуществляющих электрический контакт с электролитом. Отрицательно заряженный электрод это катод, а положительный электрод -анод. Электроды, которые не вступают в химические реакции, находясь в контакте с электролитами и при пропускании через них электрического тока, называются инертными электродами. К числу инертных электродов относятся графит и платина.
ИОННАЯ ТЕОРИЯ ЭЛЕКТРОЛИЗА
Согласно этой теории, прохождение постоянного электрического тока через электролит осуществляется с помощью ионов. На электродах происходит перенос электронов к ионам либо от них. Поэтому процессы, протекающие на электродах, могут рассматриваться как восстановительные или окислительные полуреакции. Таким образом, электролиз представляет собой окислительно-восстановительный процесс.
На электродах происходит перенос электронов к ионам либо от них. Поэтому процессы, протекающие на электродах, могут рассматриваться как восстановительные или окислительные полуреакции. Таким образом, электролиз представляет собой окислительно-восстановительный процесс.
На аноде всегда осуществляется окислительная полуреакция. В этой реакции анионы теряют электроны и разряжаются, превращаясь в нейтральные частицы. Поэтому анод выступает в роли места стока электронов с анионов.
На катоде всегда осуществляется восстановительная полуреакция. Здесь катионы приобретают электроны и разряжаются, превращаясь в нейтральные частицы. Поэтому катод выступает в роли источника электронов для катионов.
Пример
Электролиз расплавленного бромида свинца(Н) состоит из двух полуреакций:
1) на аноде разряжаются бромид-ионы. (Уравнение этой полуреакции имеет
вид
2Вг-(ж.) = Вг2(г.) + 2е-
Эта полуреакция представляет собой окисление.)
2) на катоде разряжаются ионы свинца. (Уравнение этой полуреакции:
(Уравнение этой полуреакции:
РЬ2+(тв.) + 2е- = РЬ(ж.)
Эта полуреакция представляет собой восстановление.)
Следует отметить, что реакции, протекающие на аноде и катоде в каждой конкретной системе, предопределяются полярностью источника тока во внешней электрической цепи. Отрицательный полюс внешнего источника тока (батареи) поставляет электроны одному из электродов электролитической ячейки. Это обусловливает отрицательный заряд данного электрода. Он и становится катодом. Поскольку этот электрод заряжен отрицательно, он в свою очередь вызывает такую электродную реакцию, в которой происходит потребление электронов. Таким образом, на этом электроде осуществляется восстановительный процесс. На другом электроде электроны перетекают из электролитической ячейки обратно во внешнюю цепь, что делает этот электрод положительным электродом. Значит, этот электрод играет роль анода. Из-за его положительного заряда на нем протекает реакция, которая сопровождается отдачей электронов, т. е. окисление.
е. окисление.
Схематическое изображение всего процесса электролиза представлено на рис. 10.6.
Оглавление:
Электролиз реферат по химии — Docsity
Министерство общего и профессионального образования Свердловской области МОУО г.Екатеринбурга образовательное учреждение муниципальная школа общего среднего образования №135 Чкаловского района Образовательная область естествознание Предмет химия ЭЛЕКТРОЛИЗ Введение Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электролиз является одним из важнейших направлений в электрохимии. Электрохимия принадлежит к числу тех немногих наук, дата рождения которых может быть установлена с высокой точностью. Это рубеж XVIII и XIX веков, когда благодаря знаменитым опытам итальянского физиолога Л. Гальвани и созданию итальянским физиком А. Вольта в 1799 г. «вольтова столба» — первого в истории человечества химического источника тока -были сформулированы проблемы, решение которых определило основные задачи электрохимии. «Без химии путь к познанию истинной природы электричества закрыт» — сказал М.В. Ломоносов. И, действительно, как бы следуя словам великого ученого, создавалась и развивается наука – электрохимия. Еще в начале позапрошлого столетия было установлено, что при прохождении электрического тока через водные растворы солей происходят химические превращения, приводящие к образованию новых веществ. В результате этого, в начале прошлого века возникло научное направление по изучению электрохимических процессов в растворах и расплавах веществ – электрохимия. К концу семидесятых годов оно разделилось на два самостоятельных раздела – ионику, изучающую явления электропроводности и движения заряженных частиц под воздействием электрического поля, и электродику, изучающую явления происходящие непосредственно на поверхности электродов, когда через границу электрод-раствор (расплав) протекает электрический ток. Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими. Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода. Технический или прикладной электролиз характеризуется сложностью протекающих в промышленных условиях электролитических процессов, различными видами электролиза, их зависимостью от природы электролита, типа электролитической ванны, оптимизации самих электролизных процессов. Электролитические процессы классифицируются следующим образом: • получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.) • получение металлов(литий, натрий, калий, берилий, магний, цинк, алюминий, медь и т.д.) • очистка металлов(медь, серебро,…) • получение металлических сплавов • получение гальванических покрытий • обработка поверхностей металлов(азотирование, борирование,электрополировка, очистка) • получение органических веществ • электродиализ и обессоливание воды 2 называется химическим источником энергии. Если же их протекание обусловлено подводом электрической энергии извне, то происходит электролиз. Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCl2 катионы магния по действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются. Mg2++2e-=Mg Анионы хлора перемещаются к положительному электроду, и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия—окисление ионов хлора 2Cl-=2Cl+2e- а вторичным—связывание образующихся атомов хлора в молекулы: 2Cl=Cl2 Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgCl2: Mg2+ + 2Cl-l=Mg + Cl2 Эта реакция не может протекать самопроизвольно; энергия, необходимая для её осуществления, поступает от внешнего источника тока. Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод—положительно, т.е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. При электролизе химическая реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. При рассмотрении электролиза растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются ещё ионы, являющиеся ещё продуктами диссоциации воды—Н+ и ОН-.В электролитическом поле ионы водорода перемещаются к катоду, а гидроксила— к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично у анода может происходить разряд как анионов электролита, так и ионов гидроксила. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего будет зависеть от соотношения электродных потенциалов соответствующих электрохимических систем. Это означает, что на 5 катоде будут восстанавливаться окисленные формы электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже. Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (рН=7) имеет значение φ=-0,059*7=-0,41 В. Отсюда ясно, что если электролит образован металлом, электродный потенциал которого значительно положительнее, чем –0,41 В, то из нейтрального раствора у катода будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, в случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем –0,41 В, металл восстанавливаться не будет, а произойдёт выделение водорода. К таким металлам относятся металлы начала ряда напряжений—приблизительно до титана. Наконец, если потенциал металла близок к величине –0,41 В (металлы средней части ряда—Zn,Cr,Fe,Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. Электрохимическое выделение водорода из кислых растворов происходит вследствии разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды: 2Н2О + 2е- =Н2 + 2ОН- Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют рН раствора, концентрация ионов металла и другие условия электролиза. При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще применяют графит уголь, платину. На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтористоводородной кислоты и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид 6 4ОН- =О2 + 2Н2О + 4е- а в кислой или нейтральной: 2Н2О =О2 + 4Н+ + 4е- В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO42- 2SO42- =S2O82- + 2e- равен 2,010 В, что значительно превышает стандартный потенциал окисления воды (1,228 В). Стандартный потенциал окисления иона F- имеет ещё большее значение (2,87 В). При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI,HBr,HCl и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе HCl и её солей противоречит взаимному положению систем 2Cl- =2Cl + 2e- (φ=1,359 В) и 2Н2О =О2 + 4Н+ + 4е- (φ =1,228 В) в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением второго из этих двух электродных процессов— материал анода оказывает тормозящее действие на процесс выделения кислорода. В случае активного анода число конкурирующих окислительных процессов возрастает до трёх: электрохимическое окисление воды с выделением кислорода, разряд аниона (т.е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона. Рассмотрим несколько типичных случаев электролиза водных растворов. Электролиз раствора CuCl2 с инертным анодом. Медь в ряду напряжений расположена после водорода; поэтому у катода будет происходить разряд ионов Cu2+ и выделение металлической меди. У анода будут разряжаться хлорид- ионы. Схема электролиза раствора хлорида мели (II): CuCl2 Катод ← Cu2+ 2Cl- → Анод Cu2+ + 2e- =Cu 2Cl- =2Cl + 2e- 7 Факторы от которых зависит электролиз Эффективность электролиза оценивают рядом факторов, к которым относятся: сила тока, напряжение, плотность тока, КПД источника тока, выход по току, выход по веществу, коэффициент полезного действия электроэнергии (выход по энергии), расход электроэнергии на единицу полученного продукта. Сила тока или нагрузка на электролизёр характеризуют его производительность. Чем выше сила тока, пропускаемого через электролизёр, тем больше продукта можно получить при эксплуатации данного электролизёра. Наблюдается тенденция к созданию мощных электролизёров, рассчитанных в некоторых случаях на десятки и сотни тысяч Ампер (производство хлора, алюминия и т.д.) напряжение на электролизёре складывается из нескольких составляющих: U=ea-ek + ∆ea + ∆ek + eэл.-eдиафр.+ eконт. где: U—общее напряжение на ячейке; ea и ek – равновесные потенциалы анодной и катодной реакции; eэл. и eдиафр – падение напряжения в электролите и в диафрагме; eконт.—падение напряжения в контактах. Сумма ea-ek называется напряжением разложения. Эта величина соответствует расходу на электролиз электроэнергии, которая идёт непосредственно на изменение внутренней энергии веществ. При электролизе стремятся к уменьшению напряжения на ячейке за счёт величины поляризации и омического состояния баланса напряжения, тоесть слагаемых, обусловленных необратимостью процесса. Напряжение разложения обусловлено природой реагирующего вещества, а поэтому не может быть изменено. Значения ∆ek и ∆ea могут быть изменены в зависимости от характера электрохимической реакции, протекающей на электроде, путём перемешевания, повышения температуры электролита, изменения состояния поверхности электрода и за счёт ряда других факторов. Падение напряжения в электролите, выражаемое уравнением R=ρl/s, где ρ —удельное сопротивление электролита, Ом·см, l—расстояние между электродами, см (без учета диафрагмы), S—площадь поперечного сечения электролита, через которую проходит электрический ток см2, может быть уменьшено, как следует из приведённого выражения, сближением электродов, введением в раствор более электроотрицательных добавок, а также повышением температуры. Если электролиз сопровождается образованием газов, то приведённое выше выражение не всегда точно соответствует падению напряжения в электролите. Это объясняется тем, что выделяющиеся на электродах пузырьки газов уменьшают активное сечение электролита S и удлиняют путь тока от одного электрода к другому. Это явление называется газонаполнением, которое может быть определено как отношение объёма занимаемого в данный момент пузырьком воздуха к общему объёму электролитической ячейки. Влияние газонаполнения на электропроводность электролита может быть учтено с помощью следующего выпажения: ρ/ρ0=1-1.78φ+φ2 где ρ и ρ0 – соответственно удельные сопротивления сплошного и газонаполненного электролита, φ – газонаполнение. Величина φ может быть 10 уменьшена повышением температуры, а также особым устройством электродов, обеспечивающих свободное удалением газов из ячейки. Падение напряжения в диафрагме было оценено при решении вопроса о роли диафрагмы в электролизе. Что касается падения напряжения в контактах, то эта величина зависит от совершенства контактов, чистоты контактирующих поверхностей. Существует довольно много конструктивных решений электродных контактов. Коэффициентом полезного использования напряжения называется отношение напряжения разложения к общему напряжению на ванне: ηнапр=( ea-ek)/U Плотностью тока называется отношение силы, проходящего через электролит тока к величине поверхности электрода; измеряют в А/см2 (дм2 или м2). В промышленности работают с различными плотностями тока – от нескольких сотен А/см2 (гальваностегия, гидроэлектрометаллургия, производство Хлора) до нескольких тысяч А/см2 (электролиз расплавов, электросинтез и т.д.) Величина плотности тока характеризует количество продукта, получаемого с еденицы электродной поверхности, т.е. продуктивность электролизёра. Поэтому, если повышение плотности тока не вызывает падения выхода продукта электролиз, стремятся к проведению процесса с максимально возможными плотностями тока. Однако при выборе оптимальных значений плотностей тока в некоторых случаях необходимо принимать во внимание увелечение себестоимости продукта за счёт повышения расхода электроэнергии на электролиз вследствии увеличения напряжения с ростом плотности тока. При электролизе ток, который пропускают через электролит, может расходоваться на несколько параллельных электрохимических реакций. Например, при электролизе водных растворов реакциям электрохимического окисления или восстановления, сопутствует реакция разложения воды на О2 и Н2, выделяющиеся соответственно на аноде и катоде. При электролизе, криолитглиноземных расплавов ток в определённых условиях может расходоваться не только на выделение алюминия, но и на образование на катоде металического натрия. Следовательно, пропускаемый через элетролит ток распределяется между несколькими процессами, протекающими на данном электроде одновременно: I=i1+i2+i3+…+i n где: I – ток, протекаемый через электролизёр; i1 и i2 – ток, расходуемый в единицу на первую и второю электролитическую реакцию. Для того чтобы учитывать эффективность использования пропущенного через электролизёр количества электричества на образования того или иного продукта вводится понятие выхода по току. Выход по току – отношение количества теоритически необходимого для получения того или иного количества электричества (по закону Фарадея) к практически затраченному количеству электричества. С целью уменьшения затрат электроэнергии на побочные электрохимические реакции и повышения по току стремятся проводить электролиз в таких условиях, при которых 11 затруднено разложение растворителя, т.е. велика поляризация при окислении или восстановлении растворителя (например перенапряжение кислорода или водорода). Это достигается повышением плотности тока, изменением температуры электролита, подбором материала электролита и т. д. Выход по веществу – это отношение количества полученного в результате электрохимических реакций продукта к тому количеству, которое должно образоваться теоритически, исходя из данной загрузки исходного продукта. КПД использования электроэнергии (выход по энергии) – это отношение теоритически необходимого для получения единицы количества вещества электроэнергии к практически израсходованному. Теоретически необходимое количество электроэнергии – то количество ее, которое было бы необходимым для получения единицы количества вещества, если бы процесс происходил со 100% выходом по току и при напряжении, равном напряжению разложения. Следовательно, выход по энергии может быть определен по формуле: ηэ=Wп/N=ηтока * ηнапр Выход по току ηтока и по веществу, а также коэффициент полезного действия использования электроэнергии ηнапр обычно измеряют в процентах. Расход электроэнергии обычно относят к единице произведенного количества продукта измеряют в вт ч/кг или квт ч/т. Для расчета расхода электроэнергии постоянного тока на 1т произведенного электролизом продукта можно воспользоваться следующей формулой: W=1*106*U/k ηтока *1000 где: W – расход электроэнергии постоянного тока кВтч/т; U – напряжение на электролизере, В; k элктрохимический эквивалент, грамм/а*r; ηтока – выход по току, доли единицы; 1000 – коэффициент для перевода вт*ч в квт*ч. Расход электроэнергии переменного тока на единицу произведенного продукта может быть определен делением расхода электроэнергии постоянного тока на то же количество коэффициента при образовании переменного тока в постоянный. Между временем пропускания через раствор или расплав электролита электрического тока (количеством электричества) и количеством образующегося и расходуемого вещества имеются строгие количественные соотношения, определяемые законами Фарадея. 12 Диафрагма В тех случаях, когда необходимо исключить взаимодействие продуктов электролиза, образующихся на аноде и катоде, в электролизёр вводится пористая перегородка – диафрагма, разделяющая его минимум на два электродных пространства – анодное и катодное. Раствор, заливаемый в анодное пространство, называется анолитом, в катодное – католитом. Диафрагмы бывают погружённые и фильтрующие. Погружённые диафрагмы должны иметь диффузионное сопротивление и быть селективно проницаемы лишь для ионов электролита, но задерживать продукты электролиза. Фильтрующие диафрагмы, обладающие низким диффузионным сопротивлением применяют в тех случаях, когда, электролиз проводят в противоположном направлении – электролит перетекает через диафрагму из одного электродного пространства в другое, навстречу движению ионов, обуславливающих электропроводность раствора. Диафрагмы характеризуются объёмной пористостью, протекаемостью, электрическим сопротивлением. Объёмная пористость диафрагмы, характеризуемая долей объёма пор к общему объёму диафрагмы, определяется уравнением: g=1-dкаж/dист где dкаж — кажущаяся плотность диафрагмы, dист – истинная плотность. Объёмная пористость измеряется в долях единицы или процентах. Протекаемость диафрагмы p зависит от площади диафрагмы, поверхности диафрагмы (S м2), толщины (δ см), гидростатическое давление h (см. вод. ст.), вязкости η (спуаз) и времени протекания r (час). p=kShr/δ η где k – коэффициент протекаемости, величина, характерная для данного вида диафрагмы. Электрическое сопротивление диафрагмы R может быть определено из сдедующего соотношения: R=ρδβ2/gS где – β – коэффициент извилистости пор, показывающий, во сколько раз длина поры превышает длину диафрагмы. Диафрагмы должны обладать хорошей химической стойкостью в условиях электролиза и достаточной механической прочностью. Материалом для изготовления диафрагмы служат асбест, керамика, пластмассы. В некоторых случаях, например при электролиз расплавов, применяют металлические диафрагмы. В последние годы в процессе электролиза получают распространение ионитовые диафрагмы, проницаемые только для ионов одного заряда (катионы или анионы) не только препятствует взаимодействию продуктов электролиза, но и позволяют предотвратить или существенно уменьшить образование окисления или восстановления этих продуктов на электродах. В этом случае применяют либо погруженные диафрагмы, либо ионитовые. Количественное описание электролитических процессов. 15 Электролиз связан с наложением определённого электрического поля, под действием которого в электролите могут возникать некоторые характерные процессы. Электро-кинетические процессы происходят в тех случаях, когда одна фаза диспергированна в другой; к их числу относится электрофорез – движение взвешенных твёрдых частиц внутри жидкости. При наложении электрического поля наблюдается явление электроосмоса – движение жидкости относительно твердого тела. Аппарат для электролиза называется электролизёром или электролитической ванной. Простейшая схема электролизёра представлена на рис. 1. Корпус электролизёра изготовляют из стали, керамики, пластмассы, стекла. Для защиты от коррозии и действия высоких температур корпус электролизёра иногда изнутри гумлеируют, выкладывают пластмассой, огнеупорным кирпичём или коррозионностойкими в данной среде металлами. Для поддержания определённого теплого режима в некоторых случаях снабжают теплоизоляцией. Для изготовления катодов применяют сталь, многие цветные металлы, ртуть, свинец, платину, цинк, олово, медь, алюминий, сплавы металлов, уголь или графит. Аноды бывают растворимые и нерастворимые. Растворимые аноды изготавливают из вышеупомянутых цветных металлов, углеродной стали, некоторых других сплавов, нерастворимые аноды – из платины, графита или угля, никеля, нержавеющей стали, двуокиси свинца, двуокиси марганца, магнетита., в некоторых случаях используют биометаллические аноды, у которых тонкий слой драгоценного металла, например платины, наносится на токопроводящую основу из другого металла, инертного в данном электролите и в данных условиях. Материал для электрода выбирается с учётом многих факторов – природы исходного и конечного продуктов электролиза, природы электролита, условий проведения процесса и т.д. Электролитами могут быть минеральные или органические кислоты, соли и их смеси. В некоторых случаях электролит одновременно является исходным веществом для получения того или иного продукта электрохимического окисления или восстановления, в других случаях – лишь токопроводящей добавкой. Растворителями для электролитов служат вода, спирты, пиридин, диметилформальдегид, ацетонитрил и некоторые другие органические соеденения или их смеси. Электролиз можно проводить и без растворителя, в расплаве электролита или смеси электролитов. 16 Применение в промышленности Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов. В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Металлы, которые не могут быть выделены из водных растворов вследствие высокого отрицательного потенциала получают в цветной металлургии электролизом расплавленных сред, в качестве которых служат соли этих металлов, содержащие добавки различных соединений, вводимые с целью понижения температуры плавления расплава, повышения электропроводности и т.д. К числу металлов, получаемых электролизом расплавленных сред относятся аллюминий, магний, цирконий, титан, уран, бериллий и ряд других металов. Электролиз применяют во многих отрослях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металических копий. В основу классификации промышленных ванн могут быть положены различные признаки. Например, по типу полярности ванны могут быть монополярными,биполярными и комбинировнными. В промышленных ваннах применяются различные типы катодов: неподвижные цельнометаллические, подвижные цельнометаллические(лента), неподвижные пористые неметаллические, насыпные металлические и т.д. Аноды же могут быть расходуемые(вступающие в химическую реакцию), растворимые твердые, растворимые жидкие, нерастворимые твердые и пористые, нерастворимые. Сочетание вышеперечисленных типов анодов и катодов с учетом целей электролиза приводит к следующим типам электролизеров: горизонтальные с жидким ртутным катодом, с вертикальными катодами и фильтруюшей диафрагмой, с горизонтальной диафрагмой, с проточным электролитом, с движущимися электродами, с насыпными электродами и т.д. Для электролиза могут быть использованы следующие типы электролитов: водные растворы солей, кислот, оснований; неводные растворы в неорганических растворителях; неводные растворы в органических растворителях ; расплавленные соли; твердые электролиты; газы. К лучшим материалам для нерастворимых анодов относятся специальные сорта графита, двуокись свинца, магнетит, композиции на основе тантала и титана. Несмотря на большое разнообразие электролитов, электродов, электролизеров, имеются общие проблемы технического электролиза. К ним следует отнести перенос зарядов, тепла, массы, распределение электрических полей. Для ускорения процесса переноса целесообразно увеличивать скорости всех потоков и применять принудительную конвекцию. Электродные процессы могут контролироваться путем измерения предельных токов. 17 молоком. Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией. Электролиз растворов поваренной соли производится в ваннах с твердым железным (стальным) катодом и с диафрагмами и в ваннах с жидким ртутным катодом. Промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, дожны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво. Электролиз растворов хлорида натрия в ваннах со стальным катодом и графитовым анодом позволяет получать едкий натр, хлор и водород в одном электролизере. При прохождении постоянного электрического тока через водный раствор хлорида натрия можно ожидать выделения хлора: а также кислорода: (а) (б) 2OH- — 2ē→1/2О2+Н2О (а) или 2Cl- — 2ē→Cl2 (б) Нормальный электродный потенциал разряда OH- -ионов составляет +0,41 В, а нормальный электродный потенциал разряда ионов хлора равен +1,36 В. В нейтральном насыщенном растворе хлорида натрия концентрация гидроксильных ионов около 1·10-7 г-экв/л. При 25° С равновесный потенциал разряда гидроксильных ионов будет φар=0,82 В. Равновесный потенциал разряда ионов хлора при концентрации NaCl в растворе 4,6 г-экв/л равен φар=1,32 В. Следовательно, на аноде с малым перенапряжением должен в первую очередь разряжаться кислород. Однако на графитовых анодах перенапряжение кислорода много выше перенапряжения хлора и поэтому на них будет происходить в основном разряд ионов Cl- с выделением газообразного хлора по реакции (а). Выделение хлора облегчается при увелечении концентрации NaCl в растворе вследствии уменьшения при этом равновесного потенциала. Это является одной из причин использования при электролизе концентрированных растворов хлорида натрия, содержащих 310-315 г/л. На катоде в щелочном растворе происходит разряд молекул воды по уравнению h3O + ē→H + OH- Атомы водорода после рекомбинации выделяются в виде молекулярного водорода: 2H→h3 Разряд ионов натрия из водных растворов на твердом катоде невозможен вследствии более высокого потенциала их разряда по сравнению с водородом. Поэтому остающиеся в растворе гидроксильные ионы образуют с ионами натрия раствор щелочи. Процесс разложения NaCl можно выразить следующими реакциями: 2Cl- — 2ē→Cl2 Н2О + ē=2Н + ОН- 20 2H→h3 Просуммировав уравнения получим: 2Н2О + 2Cl-→ Cl2 + h3 + 2ОН- или 2Н2О + 2NaCl→ Cl2 + h3 + 2NaOH Тоесть на аноде идет образование хлора, а у катода – водорода и едкого натра. При электролизе наряду с основными описанными процессами могут протекать и побочные, один из которых описывается уравнением (б). Помимо этого, хлор, выделяющийся на аноде, частично растворяется в электролите и гидролизуется по реакции Cl2 + Н2О↔НОCl + НCl В случае диффузии щелочи (ионов ОН-) к аноду или смешения катодных и анодных продуктов хлорноватистая и соляная кислоты нейтрализуются щелочью с образованием гипохлорита и хлорида натрия: НОC + NaOH=NaOC + Н2О HCl + NaOH=NaCl + Н2О Ионы ClO- на аноде легко окисляются в ClO3- . Следовательно, из-за побочных процессов при электролизе будут образовываться гипохлорит, хлорид и хлорат натрия, что снижает выход по току и коэфициент использования энергии. В щелочной среде облегчается выделение кислорода на аноде, что также будет ухудшать показатели электролиза. Чтобы уменьшить протекание побочных реакций, следует создать условия, препятствующие смешению катодных и анодных продуктов. К ним относятся разделение катодного и анодного пространств диафрагмой и фильтрация электролита через диафрагму в направлении, противоположном движению ОН- -ионов к аноду. Такие диафрагмы называются фильтрующими диафрагмами и выполняются из асбеста. 21 Экспериментальная часть. Электролиз мы проводили на кафедре химии в УрГУ. Электролиз проводился при силе тока 2 А. Электролизер состоял из стеклянной электролитической ванны и графитовых электродов. Вещество Анодные процессы (+) φ Катодные процессы (-) φ 1. KJ J-;OH-;Н2O 2J—2ē→J2 +0,53 h3O; H+; K+ 2h3O + 2ē→h3 + 2OH- -0,41 Суммарное уравнение 2h3O + 2J-→ h3 + 2OH- + J2 или 2h3O + 2KJ→ h3 + 2KOH + J2 2. Pb(NO3)2 NO3-OH-;h3O 2h3O – 4ē→О2 + 4H+ +1,23 h3O; H+; Pb2+ Pb2+ + 2ē→Pb 2h3O + 2ē→h3+2OH- -0,13 -0,41 Суммарное уравнение Pb2+ + 2h3O →Pb + О2 + h3 + 2H+ или Pb(NO3)2 + 2h3O→ Pb + О2 + h3 + 2HNO3 3.Al2(SO4)3 SO42-;OH-;h3O 2h3O — 4ē→О2 + 4H+ +1,23 h3O; H+; Al3+ 2h3O + 2ē→h3 +2OH- │2 -0,41 Суммарное уравнение 6h3O→h3 + 4OH- + О2 + 4H+ или 2h3O→2h3 + О2 4.ZnCl2 Cl-;OH-;h3O 2Cl- — 2ē→Cl2 │2 +1,36 h3O; H+; Zn2+ Zn2+ + 2ē→Zn 2h3O + 2ē→h3+2OH- -0,76 -0,41 Суммарное уравнение Zn2+ + 4Cl- + 2h3O→Zn + h3 + 2OH- + 2Cl2 2ZnCl2 + 2h3O→Zn + h3 + Zn(ОН)2 + 2Cl2 Наблюдения 1. На аноде интенсивное выделение газа, на катоде образование бурого окрашивания. Почувтсвовали характерный запах йода. После добавления крахмала раствор окрасился в синий цвет, что еще раз доказало присутствие йода. 22 25 Стандартные электродные потенциалы некоторых окислительно- 26 восстановительных систем № Окисленная форма Восстановленн ая форма Уравнение реакции В 1. Li+ Li Li+ + 1ē↔Li -3,05 2. K+ K K+ + 1ē↔K -2,92 3. Ba2+ Ba Ba2+ + 2ē ↔Ba -2,90 4. Ca2+ Ca Ca2+ + 2ē ↔Ca -2,87 5. Na+ Na Na+ + 1ē↔Na -2,71 6. Mg2+ Mg Mg2+ + 2ē↔Mg -2,36 7. Al3+ Al Al3+ + 3ē↔Al -1,66 8. Mn2+ Mn Mn2+ + 2ē↔Mn -1,05 9. SO32- S SO32- + 4ē + 3h3O ↔ S + 6OH- -0,90 10. SO42- SO32- SO42- + 2ē + h3O ↔ SO32- + 2OH- -0,90 11. NO3- NO2 NO3- + ē + h3O ↔ NO2 + 2OH- -0,85 12. h3O h3 h3O + 2ē↔ h3 + 2OH- -0,83 13. Zn2+ Zn Zn2+ + 2ē ↔Zn -0,76 14. Cr3+ Cr Cr3+ + 3ē↔Cr -0,74 15. Fe2+ Fe Fe2+ + 2ē↔Fe -0,44 16. Ni2+ Ni Ni2+ + 2ē↔Ni -0,25 17. Sn2+ Sn Sn2+ + 2ē↔Sn -0,14 18. Pb2+ Pb Pb2+ + 2ē↔Pb -0,13 19. 2H+ h3 2H+ + 2ē↔h3 0,00 20. Cu2+ Cu Cu2+ + 2ē↔Cu 0,34 21. Ag+ Ag Ag+ + 1ē↔Ag 0,80 22. NO3- NO2 NO3- + ē + 2H+↔ NO2 + h3O 0,81 23. Br2 2Br- Br2 + 2ē↔2Br- 1,07 24. O2 h3O O2 + 4ē + 4H+↔2h3O 1,23 25. Cl2 2Cl- Cl2 + 2ē↔2Cl- 1,36 26. Au3+ Au Au3+ + 3ē↔Au 1,50 27. F2 2F- F2 + 2ē↔2F- 2,87 27
«Без химии путь к познанию истинной природы электричества закрыт» — сказал М.В. Ломоносов. И, действительно, как бы следуя словам великого ученого, создавалась и развивается наука – электрохимия. Еще в начале позапрошлого столетия было установлено, что при прохождении электрического тока через водные растворы солей происходят химические превращения, приводящие к образованию новых веществ. В результате этого, в начале прошлого века возникло научное направление по изучению электрохимических процессов в растворах и расплавах веществ – электрохимия. К концу семидесятых годов оно разделилось на два самостоятельных раздела – ионику, изучающую явления электропроводности и движения заряженных частиц под воздействием электрического поля, и электродику, изучающую явления происходящие непосредственно на поверхности электродов, когда через границу электрод-раствор (расплав) протекает электрический ток. Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими. Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода. Технический или прикладной электролиз характеризуется сложностью протекающих в промышленных условиях электролитических процессов, различными видами электролиза, их зависимостью от природы электролита, типа электролитической ванны, оптимизации самих электролизных процессов. Электролитические процессы классифицируются следующим образом: • получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.) • получение металлов(литий, натрий, калий, берилий, магний, цинк, алюминий, медь и т.д.) • очистка металлов(медь, серебро,…) • получение металлических сплавов • получение гальванических покрытий • обработка поверхностей металлов(азотирование, борирование,электрополировка, очистка) • получение органических веществ • электродиализ и обессоливание воды 2 называется химическим источником энергии. Если же их протекание обусловлено подводом электрической энергии извне, то происходит электролиз. Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCl2 катионы магния по действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются. Mg2++2e-=Mg Анионы хлора перемещаются к положительному электроду, и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия—окисление ионов хлора 2Cl-=2Cl+2e- а вторичным—связывание образующихся атомов хлора в молекулы: 2Cl=Cl2 Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgCl2: Mg2+ + 2Cl-l=Mg + Cl2 Эта реакция не может протекать самопроизвольно; энергия, необходимая для её осуществления, поступает от внешнего источника тока. Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод—положительно, т.е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. При электролизе химическая реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. При рассмотрении электролиза растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются ещё ионы, являющиеся ещё продуктами диссоциации воды—Н+ и ОН-.В электролитическом поле ионы водорода перемещаются к катоду, а гидроксила— к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично у анода может происходить разряд как анионов электролита, так и ионов гидроксила. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего будет зависеть от соотношения электродных потенциалов соответствующих электрохимических систем. Это означает, что на 5 катоде будут восстанавливаться окисленные формы электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже. Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (рН=7) имеет значение φ=-0,059*7=-0,41 В. Отсюда ясно, что если электролит образован металлом, электродный потенциал которого значительно положительнее, чем –0,41 В, то из нейтрального раствора у катода будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, в случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем –0,41 В, металл восстанавливаться не будет, а произойдёт выделение водорода. К таким металлам относятся металлы начала ряда напряжений—приблизительно до титана. Наконец, если потенциал металла близок к величине –0,41 В (металлы средней части ряда—Zn,Cr,Fe,Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. Электрохимическое выделение водорода из кислых растворов происходит вследствии разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды: 2Н2О + 2е- =Н2 + 2ОН- Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют рН раствора, концентрация ионов металла и другие условия электролиза. При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще применяют графит уголь, платину. На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтористоводородной кислоты и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид 6 4ОН- =О2 + 2Н2О + 4е- а в кислой или нейтральной: 2Н2О =О2 + 4Н+ + 4е- В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO42- 2SO42- =S2O82- + 2e- равен 2,010 В, что значительно превышает стандартный потенциал окисления воды (1,228 В). Стандартный потенциал окисления иона F- имеет ещё большее значение (2,87 В). При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI,HBr,HCl и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе HCl и её солей противоречит взаимному положению систем 2Cl- =2Cl + 2e- (φ=1,359 В) и 2Н2О =О2 + 4Н+ + 4е- (φ =1,228 В) в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением второго из этих двух электродных процессов— материал анода оказывает тормозящее действие на процесс выделения кислорода. В случае активного анода число конкурирующих окислительных процессов возрастает до трёх: электрохимическое окисление воды с выделением кислорода, разряд аниона (т.е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона. Рассмотрим несколько типичных случаев электролиза водных растворов. Электролиз раствора CuCl2 с инертным анодом. Медь в ряду напряжений расположена после водорода; поэтому у катода будет происходить разряд ионов Cu2+ и выделение металлической меди. У анода будут разряжаться хлорид- ионы. Схема электролиза раствора хлорида мели (II): CuCl2 Катод ← Cu2+ 2Cl- → Анод Cu2+ + 2e- =Cu 2Cl- =2Cl + 2e- 7 Факторы от которых зависит электролиз Эффективность электролиза оценивают рядом факторов, к которым относятся: сила тока, напряжение, плотность тока, КПД источника тока, выход по току, выход по веществу, коэффициент полезного действия электроэнергии (выход по энергии), расход электроэнергии на единицу полученного продукта. Сила тока или нагрузка на электролизёр характеризуют его производительность. Чем выше сила тока, пропускаемого через электролизёр, тем больше продукта можно получить при эксплуатации данного электролизёра. Наблюдается тенденция к созданию мощных электролизёров, рассчитанных в некоторых случаях на десятки и сотни тысяч Ампер (производство хлора, алюминия и т.д.) напряжение на электролизёре складывается из нескольких составляющих: U=ea-ek + ∆ea + ∆ek + eэл.-eдиафр.+ eконт. где: U—общее напряжение на ячейке; ea и ek – равновесные потенциалы анодной и катодной реакции; eэл. и eдиафр – падение напряжения в электролите и в диафрагме; eконт.—падение напряжения в контактах. Сумма ea-ek называется напряжением разложения. Эта величина соответствует расходу на электролиз электроэнергии, которая идёт непосредственно на изменение внутренней энергии веществ. При электролизе стремятся к уменьшению напряжения на ячейке за счёт величины поляризации и омического состояния баланса напряжения, тоесть слагаемых, обусловленных необратимостью процесса. Напряжение разложения обусловлено природой реагирующего вещества, а поэтому не может быть изменено. Значения ∆ek и ∆ea могут быть изменены в зависимости от характера электрохимической реакции, протекающей на электроде, путём перемешевания, повышения температуры электролита, изменения состояния поверхности электрода и за счёт ряда других факторов. Падение напряжения в электролите, выражаемое уравнением R=ρl/s, где ρ —удельное сопротивление электролита, Ом·см, l—расстояние между электродами, см (без учета диафрагмы), S—площадь поперечного сечения электролита, через которую проходит электрический ток см2, может быть уменьшено, как следует из приведённого выражения, сближением электродов, введением в раствор более электроотрицательных добавок, а также повышением температуры. Если электролиз сопровождается образованием газов, то приведённое выше выражение не всегда точно соответствует падению напряжения в электролите. Это объясняется тем, что выделяющиеся на электродах пузырьки газов уменьшают активное сечение электролита S и удлиняют путь тока от одного электрода к другому. Это явление называется газонаполнением, которое может быть определено как отношение объёма занимаемого в данный момент пузырьком воздуха к общему объёму электролитической ячейки. Влияние газонаполнения на электропроводность электролита может быть учтено с помощью следующего выпажения: ρ/ρ0=1-1.78φ+φ2 где ρ и ρ0 – соответственно удельные сопротивления сплошного и газонаполненного электролита, φ – газонаполнение. Величина φ может быть 10 уменьшена повышением температуры, а также особым устройством электродов, обеспечивающих свободное удалением газов из ячейки. Падение напряжения в диафрагме было оценено при решении вопроса о роли диафрагмы в электролизе. Что касается падения напряжения в контактах, то эта величина зависит от совершенства контактов, чистоты контактирующих поверхностей. Существует довольно много конструктивных решений электродных контактов. Коэффициентом полезного использования напряжения называется отношение напряжения разложения к общему напряжению на ванне: ηнапр=( ea-ek)/U Плотностью тока называется отношение силы, проходящего через электролит тока к величине поверхности электрода; измеряют в А/см2 (дм2 или м2). В промышленности работают с различными плотностями тока – от нескольких сотен А/см2 (гальваностегия, гидроэлектрометаллургия, производство Хлора) до нескольких тысяч А/см2 (электролиз расплавов, электросинтез и т.д.) Величина плотности тока характеризует количество продукта, получаемого с еденицы электродной поверхности, т.е. продуктивность электролизёра. Поэтому, если повышение плотности тока не вызывает падения выхода продукта электролиз, стремятся к проведению процесса с максимально возможными плотностями тока. Однако при выборе оптимальных значений плотностей тока в некоторых случаях необходимо принимать во внимание увелечение себестоимости продукта за счёт повышения расхода электроэнергии на электролиз вследствии увеличения напряжения с ростом плотности тока. При электролизе ток, который пропускают через электролит, может расходоваться на несколько параллельных электрохимических реакций. Например, при электролизе водных растворов реакциям электрохимического окисления или восстановления, сопутствует реакция разложения воды на О2 и Н2, выделяющиеся соответственно на аноде и катоде. При электролизе, криолитглиноземных расплавов ток в определённых условиях может расходоваться не только на выделение алюминия, но и на образование на катоде металического натрия. Следовательно, пропускаемый через элетролит ток распределяется между несколькими процессами, протекающими на данном электроде одновременно: I=i1+i2+i3+…+i n где: I – ток, протекаемый через электролизёр; i1 и i2 – ток, расходуемый в единицу на первую и второю электролитическую реакцию. Для того чтобы учитывать эффективность использования пропущенного через электролизёр количества электричества на образования того или иного продукта вводится понятие выхода по току. Выход по току – отношение количества теоритически необходимого для получения того или иного количества электричества (по закону Фарадея) к практически затраченному количеству электричества. С целью уменьшения затрат электроэнергии на побочные электрохимические реакции и повышения по току стремятся проводить электролиз в таких условиях, при которых 11 затруднено разложение растворителя, т.е. велика поляризация при окислении или восстановлении растворителя (например перенапряжение кислорода или водорода). Это достигается повышением плотности тока, изменением температуры электролита, подбором материала электролита и т. д. Выход по веществу – это отношение количества полученного в результате электрохимических реакций продукта к тому количеству, которое должно образоваться теоритически, исходя из данной загрузки исходного продукта. КПД использования электроэнергии (выход по энергии) – это отношение теоритически необходимого для получения единицы количества вещества электроэнергии к практически израсходованному. Теоретически необходимое количество электроэнергии – то количество ее, которое было бы необходимым для получения единицы количества вещества, если бы процесс происходил со 100% выходом по току и при напряжении, равном напряжению разложения. Следовательно, выход по энергии может быть определен по формуле: ηэ=Wп/N=ηтока * ηнапр Выход по току ηтока и по веществу, а также коэффициент полезного действия использования электроэнергии ηнапр обычно измеряют в процентах. Расход электроэнергии обычно относят к единице произведенного количества продукта измеряют в вт ч/кг или квт ч/т. Для расчета расхода электроэнергии постоянного тока на 1т произведенного электролизом продукта можно воспользоваться следующей формулой: W=1*106*U/k ηтока *1000 где: W – расход электроэнергии постоянного тока кВтч/т; U – напряжение на электролизере, В; k элктрохимический эквивалент, грамм/а*r; ηтока – выход по току, доли единицы; 1000 – коэффициент для перевода вт*ч в квт*ч. Расход электроэнергии переменного тока на единицу произведенного продукта может быть определен делением расхода электроэнергии постоянного тока на то же количество коэффициента при образовании переменного тока в постоянный. Между временем пропускания через раствор или расплав электролита электрического тока (количеством электричества) и количеством образующегося и расходуемого вещества имеются строгие количественные соотношения, определяемые законами Фарадея. 12 Диафрагма В тех случаях, когда необходимо исключить взаимодействие продуктов электролиза, образующихся на аноде и катоде, в электролизёр вводится пористая перегородка – диафрагма, разделяющая его минимум на два электродных пространства – анодное и катодное. Раствор, заливаемый в анодное пространство, называется анолитом, в катодное – католитом. Диафрагмы бывают погружённые и фильтрующие. Погружённые диафрагмы должны иметь диффузионное сопротивление и быть селективно проницаемы лишь для ионов электролита, но задерживать продукты электролиза. Фильтрующие диафрагмы, обладающие низким диффузионным сопротивлением применяют в тех случаях, когда, электролиз проводят в противоположном направлении – электролит перетекает через диафрагму из одного электродного пространства в другое, навстречу движению ионов, обуславливающих электропроводность раствора. Диафрагмы характеризуются объёмной пористостью, протекаемостью, электрическим сопротивлением. Объёмная пористость диафрагмы, характеризуемая долей объёма пор к общему объёму диафрагмы, определяется уравнением: g=1-dкаж/dист где dкаж — кажущаяся плотность диафрагмы, dист – истинная плотность. Объёмная пористость измеряется в долях единицы или процентах. Протекаемость диафрагмы p зависит от площади диафрагмы, поверхности диафрагмы (S м2), толщины (δ см), гидростатическое давление h (см. вод. ст.), вязкости η (спуаз) и времени протекания r (час). p=kShr/δ η где k – коэффициент протекаемости, величина, характерная для данного вида диафрагмы. Электрическое сопротивление диафрагмы R может быть определено из сдедующего соотношения: R=ρδβ2/gS где – β – коэффициент извилистости пор, показывающий, во сколько раз длина поры превышает длину диафрагмы. Диафрагмы должны обладать хорошей химической стойкостью в условиях электролиза и достаточной механической прочностью. Материалом для изготовления диафрагмы служат асбест, керамика, пластмассы. В некоторых случаях, например при электролиз расплавов, применяют металлические диафрагмы. В последние годы в процессе электролиза получают распространение ионитовые диафрагмы, проницаемые только для ионов одного заряда (катионы или анионы) не только препятствует взаимодействию продуктов электролиза, но и позволяют предотвратить или существенно уменьшить образование окисления или восстановления этих продуктов на электродах. В этом случае применяют либо погруженные диафрагмы, либо ионитовые. Количественное описание электролитических процессов. 15 Электролиз связан с наложением определённого электрического поля, под действием которого в электролите могут возникать некоторые характерные процессы. Электро-кинетические процессы происходят в тех случаях, когда одна фаза диспергированна в другой; к их числу относится электрофорез – движение взвешенных твёрдых частиц внутри жидкости. При наложении электрического поля наблюдается явление электроосмоса – движение жидкости относительно твердого тела. Аппарат для электролиза называется электролизёром или электролитической ванной. Простейшая схема электролизёра представлена на рис. 1. Корпус электролизёра изготовляют из стали, керамики, пластмассы, стекла. Для защиты от коррозии и действия высоких температур корпус электролизёра иногда изнутри гумлеируют, выкладывают пластмассой, огнеупорным кирпичём или коррозионностойкими в данной среде металлами. Для поддержания определённого теплого режима в некоторых случаях снабжают теплоизоляцией. Для изготовления катодов применяют сталь, многие цветные металлы, ртуть, свинец, платину, цинк, олово, медь, алюминий, сплавы металлов, уголь или графит. Аноды бывают растворимые и нерастворимые. Растворимые аноды изготавливают из вышеупомянутых цветных металлов, углеродной стали, некоторых других сплавов, нерастворимые аноды – из платины, графита или угля, никеля, нержавеющей стали, двуокиси свинца, двуокиси марганца, магнетита., в некоторых случаях используют биометаллические аноды, у которых тонкий слой драгоценного металла, например платины, наносится на токопроводящую основу из другого металла, инертного в данном электролите и в данных условиях. Материал для электрода выбирается с учётом многих факторов – природы исходного и конечного продуктов электролиза, природы электролита, условий проведения процесса и т.д. Электролитами могут быть минеральные или органические кислоты, соли и их смеси. В некоторых случаях электролит одновременно является исходным веществом для получения того или иного продукта электрохимического окисления или восстановления, в других случаях – лишь токопроводящей добавкой. Растворителями для электролитов служат вода, спирты, пиридин, диметилформальдегид, ацетонитрил и некоторые другие органические соеденения или их смеси. Электролиз можно проводить и без растворителя, в расплаве электролита или смеси электролитов. 16 Применение в промышленности Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов. В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Металлы, которые не могут быть выделены из водных растворов вследствие высокого отрицательного потенциала получают в цветной металлургии электролизом расплавленных сред, в качестве которых служат соли этих металлов, содержащие добавки различных соединений, вводимые с целью понижения температуры плавления расплава, повышения электропроводности и т.д. К числу металлов, получаемых электролизом расплавленных сред относятся аллюминий, магний, цирконий, титан, уран, бериллий и ряд других металов. Электролиз применяют во многих отрослях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металических копий. В основу классификации промышленных ванн могут быть положены различные признаки. Например, по типу полярности ванны могут быть монополярными,биполярными и комбинировнными. В промышленных ваннах применяются различные типы катодов: неподвижные цельнометаллические, подвижные цельнометаллические(лента), неподвижные пористые неметаллические, насыпные металлические и т.д. Аноды же могут быть расходуемые(вступающие в химическую реакцию), растворимые твердые, растворимые жидкие, нерастворимые твердые и пористые, нерастворимые. Сочетание вышеперечисленных типов анодов и катодов с учетом целей электролиза приводит к следующим типам электролизеров: горизонтальные с жидким ртутным катодом, с вертикальными катодами и фильтруюшей диафрагмой, с горизонтальной диафрагмой, с проточным электролитом, с движущимися электродами, с насыпными электродами и т.д. Для электролиза могут быть использованы следующие типы электролитов: водные растворы солей, кислот, оснований; неводные растворы в неорганических растворителях; неводные растворы в органических растворителях ; расплавленные соли; твердые электролиты; газы. К лучшим материалам для нерастворимых анодов относятся специальные сорта графита, двуокись свинца, магнетит, композиции на основе тантала и титана. Несмотря на большое разнообразие электролитов, электродов, электролизеров, имеются общие проблемы технического электролиза. К ним следует отнести перенос зарядов, тепла, массы, распределение электрических полей. Для ускорения процесса переноса целесообразно увеличивать скорости всех потоков и применять принудительную конвекцию. Электродные процессы могут контролироваться путем измерения предельных токов. 17 молоком. Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией. Электролиз растворов поваренной соли производится в ваннах с твердым железным (стальным) катодом и с диафрагмами и в ваннах с жидким ртутным катодом. Промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, дожны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво. Электролиз растворов хлорида натрия в ваннах со стальным катодом и графитовым анодом позволяет получать едкий натр, хлор и водород в одном электролизере. При прохождении постоянного электрического тока через водный раствор хлорида натрия можно ожидать выделения хлора: а также кислорода: (а) (б) 2OH- — 2ē→1/2О2+Н2О (а) или 2Cl- — 2ē→Cl2 (б) Нормальный электродный потенциал разряда OH- -ионов составляет +0,41 В, а нормальный электродный потенциал разряда ионов хлора равен +1,36 В. В нейтральном насыщенном растворе хлорида натрия концентрация гидроксильных ионов около 1·10-7 г-экв/л. При 25° С равновесный потенциал разряда гидроксильных ионов будет φар=0,82 В. Равновесный потенциал разряда ионов хлора при концентрации NaCl в растворе 4,6 г-экв/л равен φар=1,32 В. Следовательно, на аноде с малым перенапряжением должен в первую очередь разряжаться кислород. Однако на графитовых анодах перенапряжение кислорода много выше перенапряжения хлора и поэтому на них будет происходить в основном разряд ионов Cl- с выделением газообразного хлора по реакции (а). Выделение хлора облегчается при увелечении концентрации NaCl в растворе вследствии уменьшения при этом равновесного потенциала. Это является одной из причин использования при электролизе концентрированных растворов хлорида натрия, содержащих 310-315 г/л. На катоде в щелочном растворе происходит разряд молекул воды по уравнению h3O + ē→H + OH- Атомы водорода после рекомбинации выделяются в виде молекулярного водорода: 2H→h3 Разряд ионов натрия из водных растворов на твердом катоде невозможен вследствии более высокого потенциала их разряда по сравнению с водородом. Поэтому остающиеся в растворе гидроксильные ионы образуют с ионами натрия раствор щелочи. Процесс разложения NaCl можно выразить следующими реакциями: 2Cl- — 2ē→Cl2 Н2О + ē=2Н + ОН- 20 2H→h3 Просуммировав уравнения получим: 2Н2О + 2Cl-→ Cl2 + h3 + 2ОН- или 2Н2О + 2NaCl→ Cl2 + h3 + 2NaOH Тоесть на аноде идет образование хлора, а у катода – водорода и едкого натра. При электролизе наряду с основными описанными процессами могут протекать и побочные, один из которых описывается уравнением (б). Помимо этого, хлор, выделяющийся на аноде, частично растворяется в электролите и гидролизуется по реакции Cl2 + Н2О↔НОCl + НCl В случае диффузии щелочи (ионов ОН-) к аноду или смешения катодных и анодных продуктов хлорноватистая и соляная кислоты нейтрализуются щелочью с образованием гипохлорита и хлорида натрия: НОC + NaOH=NaOC + Н2О HCl + NaOH=NaCl + Н2О Ионы ClO- на аноде легко окисляются в ClO3- . Следовательно, из-за побочных процессов при электролизе будут образовываться гипохлорит, хлорид и хлорат натрия, что снижает выход по току и коэфициент использования энергии. В щелочной среде облегчается выделение кислорода на аноде, что также будет ухудшать показатели электролиза. Чтобы уменьшить протекание побочных реакций, следует создать условия, препятствующие смешению катодных и анодных продуктов. К ним относятся разделение катодного и анодного пространств диафрагмой и фильтрация электролита через диафрагму в направлении, противоположном движению ОН- -ионов к аноду. Такие диафрагмы называются фильтрующими диафрагмами и выполняются из асбеста. 21 Экспериментальная часть. Электролиз мы проводили на кафедре химии в УрГУ. Электролиз проводился при силе тока 2 А. Электролизер состоял из стеклянной электролитической ванны и графитовых электродов. Вещество Анодные процессы (+) φ Катодные процессы (-) φ 1. KJ J-;OH-;Н2O 2J—2ē→J2 +0,53 h3O; H+; K+ 2h3O + 2ē→h3 + 2OH- -0,41 Суммарное уравнение 2h3O + 2J-→ h3 + 2OH- + J2 или 2h3O + 2KJ→ h3 + 2KOH + J2 2. Pb(NO3)2 NO3-OH-;h3O 2h3O – 4ē→О2 + 4H+ +1,23 h3O; H+; Pb2+ Pb2+ + 2ē→Pb 2h3O + 2ē→h3+2OH- -0,13 -0,41 Суммарное уравнение Pb2+ + 2h3O →Pb + О2 + h3 + 2H+ или Pb(NO3)2 + 2h3O→ Pb + О2 + h3 + 2HNO3 3.Al2(SO4)3 SO42-;OH-;h3O 2h3O — 4ē→О2 + 4H+ +1,23 h3O; H+; Al3+ 2h3O + 2ē→h3 +2OH- │2 -0,41 Суммарное уравнение 6h3O→h3 + 4OH- + О2 + 4H+ или 2h3O→2h3 + О2 4.ZnCl2 Cl-;OH-;h3O 2Cl- — 2ē→Cl2 │2 +1,36 h3O; H+; Zn2+ Zn2+ + 2ē→Zn 2h3O + 2ē→h3+2OH- -0,76 -0,41 Суммарное уравнение Zn2+ + 4Cl- + 2h3O→Zn + h3 + 2OH- + 2Cl2 2ZnCl2 + 2h3O→Zn + h3 + Zn(ОН)2 + 2Cl2 Наблюдения 1. На аноде интенсивное выделение газа, на катоде образование бурого окрашивания. Почувтсвовали характерный запах йода. После добавления крахмала раствор окрасился в синий цвет, что еще раз доказало присутствие йода. 22 25 Стандартные электродные потенциалы некоторых окислительно- 26 восстановительных систем № Окисленная форма Восстановленн ая форма Уравнение реакции В 1. Li+ Li Li+ + 1ē↔Li -3,05 2. K+ K K+ + 1ē↔K -2,92 3. Ba2+ Ba Ba2+ + 2ē ↔Ba -2,90 4. Ca2+ Ca Ca2+ + 2ē ↔Ca -2,87 5. Na+ Na Na+ + 1ē↔Na -2,71 6. Mg2+ Mg Mg2+ + 2ē↔Mg -2,36 7. Al3+ Al Al3+ + 3ē↔Al -1,66 8. Mn2+ Mn Mn2+ + 2ē↔Mn -1,05 9. SO32- S SO32- + 4ē + 3h3O ↔ S + 6OH- -0,90 10. SO42- SO32- SO42- + 2ē + h3O ↔ SO32- + 2OH- -0,90 11. NO3- NO2 NO3- + ē + h3O ↔ NO2 + 2OH- -0,85 12. h3O h3 h3O + 2ē↔ h3 + 2OH- -0,83 13. Zn2+ Zn Zn2+ + 2ē ↔Zn -0,76 14. Cr3+ Cr Cr3+ + 3ē↔Cr -0,74 15. Fe2+ Fe Fe2+ + 2ē↔Fe -0,44 16. Ni2+ Ni Ni2+ + 2ē↔Ni -0,25 17. Sn2+ Sn Sn2+ + 2ē↔Sn -0,14 18. Pb2+ Pb Pb2+ + 2ē↔Pb -0,13 19. 2H+ h3 2H+ + 2ē↔h3 0,00 20. Cu2+ Cu Cu2+ + 2ē↔Cu 0,34 21. Ag+ Ag Ag+ + 1ē↔Ag 0,80 22. NO3- NO2 NO3- + ē + 2H+↔ NO2 + h3O 0,81 23. Br2 2Br- Br2 + 2ē↔2Br- 1,07 24. O2 h3O O2 + 4ē + 4H+↔2h3O 1,23 25. Cl2 2Cl- Cl2 + 2ē↔2Cl- 1,36 26. Au3+ Au Au3+ + 3ē↔Au 1,50 27. F2 2F- F2 + 2ē↔2F- 2,87 27
Электролиз и химические реакции — Справочник химика 21
Аккумуляторы при разряде отдают ток, накопленный в процессе заряда в результате химических реакций, происходящих при электролизе. Простейшим аккумулятором является кислотный или свинцовый аккумулятор. Он состоит из свинцовых пластин, погруженных в сосуд, наполненный серной кислотой. Свинец и кислота вступают в реакцию [c.156]Как и в случае химического источника э.лектрической энергии, электрод, на котором происходит восстановление, называется катодом э.лектрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод — положительно, т. е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. [c.282]
Химические процессы при электролизе. Электролиз представляет собой процесс, в котором химические реакции происходят под действием электрического тока. Химические превращения при электролизе могут быть весьма различными в зависимости главным образом от вида электролита и растворителя, а также от материала электродов и присутствия других веществ в растворе. Наиболее общей является следующая схема процесса. [c.443]
Наряду с научным интересом гальванические элементы имеют чрезвычайно большое техническое значение. Они служат, с одной стороны, как источники тока (например, аккумуляторы), с другой стороны, для проведения химических реакций, которые осуществляются трудно или в других условиях вообще не осуществляются. Известными примерами таких процессов, которые технически проводят в большом масштабе, является электролиз хлоридов щелочных металлов, электролитическое производство алюминия и электролитическое осаждение металлов в виде поверхностных слоев (гальванические покрытия). [c.272]
Электрогравиметрический метод основан на выделении элемента из раствора в свободном состоянии (иногда в виде оксидов) с помощью электролиза на взвешенном электроде. По увеличению массы предварительно взвешенного электрода вычисляют содержание определяемого элемента в пробе. Этот метод относится, как показывает его название, к гравиметрическим методам. При анализе продукции цветной металлургии электрогравиметрический метод применяют для определения содержания меди в сплавах, черновой меди, для разделения и определения содержания меди и никеля при совместном их присутствии. При электролизе химическая реакция на электродах протекает под действием электрического тока (внешний электролиз). [c.41]
Другими словами, в основе электрохимических методов лежит процесс электролиза — химические реакции, протекающие под действием электрического тока на электродах, помещенных в раствор электролита. В электрическом поле положительно заряженные ионы (катионы) движутся к катоду, отрицательно заряженные (анионы) — к аноду. На катоде происходит восстановление, а на аноде — окисление ионов или молекул, входящих в состав электролита. Количество образующихся на электродах веществ и количество пропущенного электричества связаны законами Фарадея [1—5]. [c.307]
Рассматривая процессы в гальваническом элементе, мы видели, что в нем происходит реакция окисления-восстановления. При электролизе (рис. 40) окисление происходит на положительном электроде, к которому движутся анионы поэтому он называется анодом. Восстановление происходит на отрицательном электроде — катоде. В элементе нет»тока, посылаемого некоторой внешней э. д. с., — он сам является генератором электрической энергии. Поэтому процессы, происходящие в элементе, обратны по смыслу процессам, происходящим при электролизе. Если при электролизе химические реакции текут принудительно за счет электрической энергии, подводимой от постороннего источника, то в элементе, наоборот, химические реакции, текущие самопроизвольно, служат причиной возникновения электрической энергии. Окисление в элементе происходит на отрицательном электроде, восстановление — на положительном. Можно условиться связывать названия электродов не со знаком заряда, а с процессом. Тогда отрицательный электрод на котором протекает окисление, будет называться анодом, а положительный — катодом. [c.242]
Инверсионной вольтамперометрией (ИВ) называют вольтамперометрию, в которой аналитический сигнал определяется концентрацией ЭАВ не в растворе, а на поверхности или в объеме электрода. Обычно регистрации вольтамперограммы в Р1В предшествует накопление ЭАВ из раствора путем электролиза, химической реакции или адсорбции. С этой целью электрод предварительно выдерживают в анализируемом растворе в течение определенного времени, называемого временем накопления н- В течение этого времени на поверхности электрода или в его объеме концентрируется определяемое вещество или продукт его электрохимического или химического превращения. [c.58]
Такое равновесие достигается в некотором весьма значительном интервале изменения потенциалов пластин (электродов). Однако по мере увеличения потенциала электродов наступает момент, при котором установления такого равновесия уже не наблюдается, и между электродами начинает течь постоянный ток, подчиняющийся закону Ома. Процесс сопровождается химическими реакциями на электродах (электролиз). Потенциал, при котором в растворе начинает течь постоянный ток, получил название потенциала разложения. [c.553]
Электрохимия. Изучается взаимодействие электрических явлений и химических реакций (электролиз, химические источники электрического тока, теория электросинтеза). В электрохимию включают обычно учение о свойствах растворов электролитов, которое с равным правом можно отнести и к учению о растворах. [c.19]
Химическая реакция цинковая обманка обжигается, затем обожженный материал обрабатывается серной кислотой. Полученный раствор сульфата цинка очищается от сопутствующих элементов и далее подвергается электролизу. [c.250]
При электролизе растворов и расплавов основными процессами являются окислительно-восстановительные электрохимические реакции на электродах. Причем, в отличие от аналогичных химических реакций, протекающих в объёме, процессы окисления и восстановления пространственно разделены на аноде идет отдача электронов (окисление), а на катоде их присоединение (восстановление). [c.187]
К электродным процессам относятся две группы процессов, тесно связанные между собой. Во-первых, процессы возникновения разности потенциалов и. следовательно, электрического тока в результате протекания химической реакции, например в гальванических элементах. Во-вторых, обратные им химические процессы, совершающиеся при электролизе, которые возникают при пропускании электрического тока через раствор и связаны с переходом тока с проводника одного рода в проводник другого рода. [c.414]
Совокупность химических реакций, которые протекают на электродах в растворах или расплавах при пропускании через них электрического тока, называется электролизом. [c.84]
При протекании электрического тока на границе металл — раствор образуется тонкая плотная пленка барьерного типа (рис. 13.1), рост которой происходит в результате миграции в ней ионов алюминия навстречу ионам кислорода. Толщина барьерного слоя (0,01—0,1 мкм) остается приблизительно постоянной в течение электролиза, так как внешняя его сторона подвергается растворяющему воздействию электролита по химической реакции [c.80]
В настоящее время считается, что при электролизе растворов хлорида натрия ЫаСЮз образуется не только по электрохимической, но и по химической реакции. При сравнительно [c.180]
Лимитирующей стадией всего процесса окисления алифатических спиртов до карбоновых кислот является медленная химическая реакция (33.3). Следовательно, условия проведения процесса электролиза, оказывающие влияние на скорость лимитирующей стадии, будут в целом определять эффективность электрохимического окисления спиртов. [c.208]
Уравнения реакций электролиза являются такими же химическими уравнениями, как и все остальные уравнения реакций. Поэтому по ним можно производить все те же самые расчеты, что и по другим уравнениям химических реакций. Кроме того, при электролизе [c.178]
Применительно к химическим процессам второй закон термодинамики можно сформулировать так всякое химическое взаимодействие при неизменных давлении или объеме и постоянстве температуры протекает в направлении уменьшения свободной энергии системы. Пределом протекания химических реакций (т. е. условием равновесия) является достижение некоторого минимального для данных условий значения свободной энергии системы О или Р. Процессы протекают самопроизвольно и дают некоторую полезную работу, если Р0 и ДС>0 процессы не могут при заданных условиях (у, Т или р, Т) протекать самопроизвольно и возможны лишь при получении работы извне (например, реакции при электролизе, фотохимические реакции и др.). Изменение термодинамических функций А[1, АР, А/, АО и А5 для любых реакций рассчитывают по закону Гесса аналогично вычислению тепловых эффектов реакций. Значения термодинамических функций при стандартных условиях / = 25°С и р=101 325 Па приводятся в справочных таблицах. [c.61]
Электрохимия — раздел физической химии, изучающий процессы превращения энергии химической реакции в электрическую и, наоборот, электрической энергии в химическую. Первый процесс протекает в гальванических элементах, второй при электролизе. [c.359]
Процессы, протекающие при электролизе, по существу обратны процессам, имеющим место в гальванических элементах. При электролизе анод заряжен положительно, а катод — отрицательно. При работе гальванического элемента энергия самопроизвольно протекающей реакщт превращается в электрическую, тогда как при электролизе химические реакции осуществляются за счет электрической энергии внешнего источника. На аноде, как и в случае химических источников тока, происходит окисление, на катоде— восстановление. При электролизе из возможных процессов будет [c.161]
Отличительной особенностью здесь является то, что при электролизе химические реакции осуществляются за счет электрической энергии внешнего источника, тогда как при работе гальванического элемента энергия самопроизвольно прохекающей химической реакции превращается в электрическую. [c.262]
Позднее, с открытием и исследованием электрической, лучистой, химТ1ческой и других форм энергии, постепенно в круг рассматриваемых термодинамикой вопросов включается и изучение этих форм энергии. Быстро расширялась и область практического применения термодинамических методов исследования. Уже не только паровая машина и процессы превращения механической энергии в теплоту исследуются на основе.законов термодинамики, но и электрические машины, холодильные машины, компрессоры, двигатели внутреннего сгорания, реактивные двигатели. Гальванические элементы, а также процессы электролиза, различные химические реакции, атмосферные явления, некоторые процессы, протекающие в растительных и животных организмах, и многие другие исследуются не только в отношении их энергетического баланса, но и в отношении возможности, направления и предела самопроизвольного протекания процесса в данных условиях. Они исследуются также в отношении установления условий равновесия, определения максимального количества полезной работы, которая может быть получена при проведении рассматриваемого процесса в тех или иных условиях, или, наоборот, минимального количества работы, которое необходимо затратить для осуществ- [c.178]
Окислительные и восстановительные процессы, происходящие на электродах при пропускании постоянного электрического тока через систему, включающую электролит, называются электролизом. Химические реакции, протекающие прн электролизе, осуществляются при помощи энергии электрического тока, подведенного извне. Следовательно, при электролизе происходит преобразование электрической энергии в химическую. Процесс , окисления и восстановления в этом случае протекают раздельно, т.е. на различных электродах. Электрод, на коттэром происходит восстановление, называется катодом, а электрод, на котором происходит окисление, — анодом. Катод подключен к отрицательному полюсу, и поэтому к нему движутся катионы, анод — к положИ тельному полюсу, и к нему движутся анионы. Вследствие этих процессов осуществляется перемещение электронов по внешней цепи. [c.239]
В процессе электролиза химическая реакция протекает в иадравлении, противоположном самопроизвольному, при иаложеЕШИ на ячейку постоянного па пряжения от внешнего источника. Ячейка состоят из двух электродов, контактирующие с раствором. Если рщ, общее напряжение, наложенкое на ячейку, распределяется следующим образом [c.384]
Одно из первых конкретных представлений о природе химической связи возникло на основании экспериментального исследования электролиза английским ученым Майклом Фарадеем (1791-1867). (Электролиз означает разрыв на части при помощи электричества .) Если расплавить хлорид натрия, нагрев его выше 80ГС, и погрузить в расплав два электрода (катод и анод), как показано на рис. 1-8, а затем пропустить через расплавленную соль электрический ток, на электродах начнут протекать химические реакции ионы натрия будут мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия [c.41]
Реакции электролиза являются такими же химическими реакциями, как и все остальные. Поэтому по реакциям электролиза можно производить стехиометрические расчеты точно так же, как это было сделано для других реакций. Останавливаться подробно мы на этом сейчас не станем. Но для реакций, протекающих под действием элеирического тока, существуют специфичные количественные соотношения, названные в честь ученого, установившего эти законы, законами Фарадея. [c.272]
Протекание электрического тока через электролиты приводит к их электролизу, при котбром химическая реакция поддерживается за счет электрической энергии внешнего источника. [c.78]
То же относится и к химическим процессам. Взаимодействие водорода и кислорода с образованием воды может происходить самопроизвольно, и осуществление этой реакции дает возможность получать соответствующее количессво работы. Но, затрачивая работу, можно осуществить и обратную реакцию — разложения воды на водород и кислород, — например, путем электролиза. И другие химические реакции, которые по своим термодинамическим параметрам не могут в данных условиях совершаться самопроизвольно, можно проводить, затрачивая работу извне. Большей частью это осуществляют или путем электролиза, или при электрическом разряде в газах, или действием света, или же путем повышения давления (причем одновременно изменяются и условия проведения реакции). Из хорошо известных процессов такого рода можно назвать фотосинтез в растениях, получение натрия и хлора путем электролиза расплавленного хлористого натрия, получение металлического алюминия из бокситов путем электролиза, синтез аммиака при высоком давлении и др. [c.209]
По направлению взаимного превращения электрической и химической форм энергии различают две группы электрохимических си- стем. При электролизе за счет внешней электрической энергии возникают химические реакции. Переход энергии химического процесса в электрическ.ую осуществляется в химических источниках тока (галь-ванические элементы, аккумуляторы). [c.454]
Электролиз щироко применяется при промышленном получении fнoгиx металлов (К, N3, Са, Mg, А1). В промьшшенных электролизерах под воздействием подводимого электрического тока на одном из электродов выделяются газовые образования. В результате электролитической диссоциации молекул на электродах происходит рост газовых пузырьков, которые изолируют часть поверхности элеюрода. Это приводит к перераспределению потенциала на электроде и изменяет скорость протекания химической реакции. Вследствие этого происходит увеличение разности потенциалов, что ведет к повьппению энергозатрат. Для эффективного управления производством необходим учет влияния пузырьков на распределение электрического поля. Математическое моделирование позволяет провести расчет и анализ электрического поля [1]. [c.118]
Пример 7 [30, с. 604—606]. Рассчитать количество теплоты, выделившееся при электрохимическом получении цинка, прн следующих исходных данных. Электролиз идет при силе тока 10000 А и напряжении 3,4 В. Выход по току для цинка т)=80%, концентрация h3SO4 в вытекающем отработанном электролите 80 г/л, концентрация цинка в протекающем свежем электролите 118 г/л. Суммарная химическая реакция процесса разложения ZnS04 следующая [c.229]
Во втором случае независимо от того, участвует ли определяемое вещество в электрохимической реакции или нет, из специально введенного электроактивного вещества (вспомогательный реагег т) электролитически получают кулонометрический титрант (промежуточный реагент), способный количественно вступать в химическую реакцию с определяемым компонентом. Зная количество электричества, израсходованное в процессе электролиза, можно рассчитать массу определяемого компонента. [c.144]
Роль вторичных химических реакций исключительно велика в условиях, благоприятствующих их протеканию, выход по току h3S2O8 приближается к нулю. Поэтому факторы, тормозящие скорость гидролиза целевого продукта, существенно повышают выход по току ионов персульфата. Такими факторами являются температура электролита, продолжительность электролиза и концентрация гидролизующегося вещества. [c.185]
Реакция (460) протекает самопроизвольно, что соответствует понижению свободной энтальпии. При протекании электродных реакций (461) и (462) между электродами измеряется разность потенциалов е. При этом потенциал водородного электрода оказывается отрицательнее хлорного. Пр1и образовании 1 моля соляной кислоты ток совершает работу Рг, где F — число Фарадея, равное количеству электричества, необходимому для выделения при электролизе 1 г-экв. вещества (/ = 96491 А-с/г-экв.). Если в реакции принимает участие п электронов, то суммарная работа равна пР , например, для реакции (460) 2Ръ. В том случае, если процесс проводится обратимо (при бесконечно малом токе), работа системы равна изменению свободной энтальпии химической реакции. Согласно первому закону термодинамики, [c.310]
термоэлектричества | физика | Британника
термоэлектричество , также называемое эффектом Пельтье-Зеебека , прямое преобразование тепла в электричество или электричества в тепло с помощью двух взаимосвязанных механизмов, эффекта Зеебека и эффекта Пельтье.
Когда два металла находятся в электрическом контакте, электроны перетекают из одного, в котором электроны менее связаны, в другой. Связывание измеряется расположением так называемого уровня Ферми электронов в металле; чем выше уровень, тем ниже привязка.Уровень Ферми представляет собой разграничение энергии в зоне проводимости металла между уровнями энергии, занятыми электронами, и уровнями, которые не заняты. Энергия электрона на уровне Ферми составляет — Вт относительно свободного электрона вне металла. Поток электронов между двумя контактирующими проводниками продолжается до тех пор, пока изменение электростатического потенциала не приведет к одинаковому значению уровней Ферми двух металлов ( W 1 и W 2 ).Этот электростатический потенциал называется контактным потенциалом ϕ 12 и определяется выражением e ϕ 12 = W 1 — W 2 , где e составляет 1,6 × 10 −19 . кулон.
Подробнее по этой теме
электричество: термоэлектричество
Когда два металла находятся в электрическом контакте, электроны выходят из одного, в котором электроны менее связаны, в другой….
Если замкнутая цепь сделана из двух разных металлов, в цепи не будет чистой электродвижущей силы, потому что два контактных потенциала противостоят друг другу и ток не будет течь. Будет ток, если температура одного из переходов будет повышена по сравнению с температурой второго. В цепи генерируется чистая электродвижущая сила, поскольку маловероятно, что два металла будут иметь уровни Ферми с одинаковой температурной зависимостью. Для поддержания разницы температур тепло должно поступать в горячий спай и уходить из холодного спая; это согласуется с тем фактом, что ток можно использовать для выполнения механической работы.Генерация тепловой электродвижущей силы на стыке называется эффектом Зеебека (в честь немецкого физика эстонского происхождения Томаса Иоганна Зеебека). Электродвижущая сила приблизительно линейна с разницей температур между двумя соединениями разнородных металлов, которые называются термопарами. Для термопары, изготовленной из железа и константана (сплав 60 процентов меди и 40 процентов никеля), электродвижущая сила составляет около пяти милливольт, когда холодный спай находится при 0 ° C, а горячий спай — при 100 ° C.Одно из основных приложений эффекта Зеебека — измерение температуры. Химические свойства среды, температура которой измеряется, и требуемая чувствительность определяют выбор компонентов термопары.
Поглощение или выделение тепла в соединении, в котором есть электрический ток, называется эффектом Пельтье (в честь французского физика Жана-Шарля Пельтье). Эффекты Зеебека и Пельтье также возникают на стыке металла и полупроводника и на стыке двух полупроводников.Развитие полупроводниковых термопар (например, состоящих из теллурида висмута типа n и типа p ) сделало использование эффекта Пельтье практичным для охлаждения. Комплекты таких термопар соединены последовательно электрически и параллельно термически. Когда электрический ток течет, между двумя переходами возникает разница температур, которая зависит от тока. Если температура более горячего спая поддерживается низкой за счет отвода тепла, второй спай может быть на десятки градусов холоднее и работать как холодильник.Холодильники Пельтье используются для охлаждения небольших тел; они компактны, не имеют движущихся механических частей и могут регулироваться для поддержания точной и стабильной температуры. Они используются во многих приложениях, например, для поддержания постоянной температуры образца, когда он находится на столике микроскопа.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчас Эта статья была недавно отредактирована и обновлена Уильямом Л. Хошем.Узнайте больше в этих связанных статьях Britannica:
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Ячейки электролитические
Электролитический Ячейки
Гальванические элементы используют спонтанную химическую реакцию, чтобы управлять электрический ток через внешнюю цепь.Эти клетки важны, потому что они являются основой для батарей, питающих современное общество. Но это не единственный вид электрохимического клетка. Также возможно построить ячейку, которая работает на химическая система, пропуская электрический ток через система. Эти ячейки называются электролитическими ячейками . Электролиз используется для запуска окислительно-восстановительной реакции в направление, в котором это не происходит спонтанно.
Электролиз Расплавленный NaCl
Идеализированная ячейка для электролиза хлорида натрия показано на рисунке ниже.Источником постоянного тока является подключен к паре инертных электродов, погруженных в расплавленный натрий хлористый. Поскольку соль нагревается до плавления, Na + ионы текут к отрицательному электроду, и Cl — ионы текут к положительному электроду.
Когда ионы Na + сталкиваются с отрицательным электродом, батарея имеет достаточно большой потенциал, чтобы заставить эти ионы собирать электроны с образованием металлического натрия.
| Отрицательный электрод (катод) : | Na + + e — Na |
Cl — ионы, которые сталкиваются с положительным электродом окисляются до газа Cl 2 , который при этом выделяется электрод.
| Положительный электрод (анод) : | 2 класса — Класс 2 + 2 e — |
Чистый эффект от прохождения электрического тока через расплав соли в этой ячейке должен разложить хлорид натрия на его элементы, металлический натрий и газообразный хлор.
| Электролиз NaCl : | |||
| Катод (-): | Na + + e — Na | ||
| Анод (+): | 2 класса — Класс 2 + 2 e — |
Потенциал, необходимый для окисления ионов Cl — до Cl 2 равно -1.36 вольт и потенциал, необходимый для восстановления Na + ионов к металлическому натрию составляет -2,71 вольт. Аккумулятор, используемый для вождения поэтому эта реакция должна иметь потенциал не менее 4,07 вольт.
Этот пример объясняет, почему процесс называется электролиз . Суффикс — лизис происходит от греческого корня, означающего ослабить или разделить. Электролиз буквально использует электрический ток, чтобы разделить соединение на его элементы.
| электролизный | ||
| 2 NaCl ( л ) | 2 Na ( л ) + Cl 2 ( г ) |
Этот пример также иллюстрирует разницу между гальваническими ячейки и электролитические ячейки.Гальванические элементы используют данную энергию отключается в результате спонтанной реакции на выполнение электромонтажных работ. Электролитический клетки используют электрическую работу в качестве источника энергии, чтобы управлять реакция в обратном направлении.
Пунктирная вертикальная линия в центре рисунка выше представляет собой диафрагму, удерживающую производимый газ Cl 2 на аноде от контакта с металлическим натрием генерируется на катоде. Функция этой диафрагмы может быть понять, обратившись к более реалистичному изображению Показана коммерческая ячейка Дауна, используемая для электролиза хлорида натрия. на рисунке ниже.
Газообразный хлор, образующийся на графитовом аноде, вставленном в дно этой ячейки пузырится сквозь расплавленный натрий хлорид в воронку наверху ячейки. Натрий металлический, который формы на катоде всплывают через расплав хлорида натрия в натрийсборное кольцо, из которого периодически осушен. Диафрагма, разделяющая два электрода, представляет собой экран из железной сетки, предотвращающий взрывную реакцию, произошло бы, если бы продукты реакции электролиза попали в контакт.
Сырье для ячейки Даунса представляет собой смесь 3: 2 по массе CaCl 2 и NaCl. Эта смесь используется, потому что она имеет температура плавления 580 o C, тогда как чистый хлорид натрия должен быть нагрет до температуры более 800 o C, прежде чем он расплавится.
Электролиз водного NaCl
На рисунке ниже показан идеализированный рисунок ячейки, в которой водный раствор хлорида натрия подвергается электролизу.
И снова ионы Na + мигрируют в сторону отрицательный электрод и ионы Cl — мигрируют в сторону положительный электрод. Но теперь есть два вещества, которые можно восстановленные на катоде: ионов Na + и молекул воды.
| Катод (-): | |||
| Na + + e — Na | E o красный = -2.71 В | ||
| 2 H 2 O + 2 e — Н 2 + 2 ОН — | E o красный = -0,83 V |
Потому что восстановить воду намного легче, чем Na + ионов, единственным продуктом, образующимся на катоде, является газообразный водород.
| Катод (-): | 2 H 2 O ( l ) + 2 e — H 2 ( г ) + 2 OH — ( водн. ) |
Есть также два вещества, которые могут окисляться при анод: Cl — ионы и молекулы воды.
| Анод (+): | |||
| 2 класса — Класс 2 + 2 e — | E o Ox = -1,36 V | ||
| 2 H 2 O O 2 + 4 H + + 4 e — | E o вол = -1.23 В |
Потенциалы стандартного состояния для этих полуреакций таковы, что близко друг к другу, что мы могли бы ожидать увидеть смесь Cl 2 и O 2 собирают газ на аноде. На практике единственный Продукт этой реакции — Cl 2 .
| Анод (+): | 2 класса — Класс 2 + 2 e — |
На первый взгляд кажется, что окислить воду проще ( E o ox = -1.23 вольт), чем ионы Cl — ( E o ox = -1,36 вольт). Однако стоит отметить, что ячейка никогда не позволял достичь стандартных условий. Решение обычно 25% NaCl по массе, что значительно снижает потенциал, необходимый для окисления иона Cl — . PH ячейка также держится очень высоко, что снижает окисление потенциал для воды. Решающим фактором является явление, известное как перенапряжение , то есть дополнительное напряжение, которое должно быть применяется к реакции, чтобы заставить ее происходить со скоростью, с которой она произошло бы в идеальной системе.
В идеальных условиях потенциал 1,23 В является большим достаточно, чтобы окислить воду до газа O 2 . Под реальным Однако в таких условиях может потребоваться гораздо большее напряжение, чтобы инициировать эту реакцию. (Перенапряжение при окислении воды может достигать 1 В.) Тщательно выбирая электрод для максимального увеличения перенапряжения при окислении воды а затем тщательно контролируя потенциал, при котором ячейка работает, мы можем гарантировать, что в этом реакция.
Таким образом, электролиз водных растворов натрия хлорид не дает таких же продуктов, как электролиз расплава натрия хлорид. Электролиз расплавленного NaCl разлагает это составить его элементы.
| электролизный | ||
| 2 NaCl ( л ) | 2 Na ( л ) + Cl 2 ( г ) |
Электролиз водных растворов NaCl дает смесь водород и газообразный хлор и водный гидроксид натрия решение.
| электролизный | ||
| 2 NaCl ( водн. ) + 2 H 2 O ( l ) | 2 Na + ( водн. ) + 2 OH — ( водн. ) + H 2 ( г ) + Cl 2 ( г ) |
Потому что потребность в хлоре намного превышает потребность для натрия электролиз водного хлорида натрия является более важный процесс с коммерческой точки зрения.Электролиз водного NaCl Решение имеет два других преимущества. Производит газ H 2 . у катода, который можно собирать и продавать. Он также производит NaOH, который можно слить из нижней части электролитической сотовый и продан.
Пунктирная вертикальная линия на приведенном выше рисунке представляет диафрагма, предотвращающая образование Cl 2 на аноде в этой ячейке от контакта с NaOH, который накапливается на катоде.Когда эта диафрагма снимается с ячейка, продукты электролиза водного натрия хлорида реагируют с образованием гипохлорита натрия, который является первым этап приготовления гипохлоритных отбеливателей, таких как Хлорокс.
Cl 2 ( г, ) + 2 OH — ( водн. ) Cl — ( водн. ) + OCl — ( водн. ) + H 2 O ( л )
Электролиз воды
Стандартный аппарат для электролиза воды показан на рисунок ниже.
| электролизный | ||
| 2 H 2 O ( л ) | 2 H 2 ( г ) + O 2 ( г) |
Пара инертных электродов заделана на противоположных концах контейнер, предназначенный для сбора H 2 и O 2 газ выделяется в этой реакции.Затем электроды подключаются. к батарее или другому источнику электрического тока.
Сама по себе вода является очень плохим проводником электричества. Мы поэтому добавьте в воду электролит, чтобы получить ионы, которые могут протекать через раствор, завершая тем самым электрическую схема. Электролит должен быть растворим в воде. Следует также быть относительно недорогим. Самое главное, он должен содержать ионы. которые сложнее окислить или восстановить, чем вода.
| 2 H 2 O + 2 e — Н 2 + 2 ОН — | E o красный = -0.83 В | ||
| 2 H 2 O O 2 + 4 H + + 4 e — | E o Ox = -1,23 V |
Следующие катионы восстанавливаются труднее, чем вода: Li + , Rb + , K + , CS + , Ba 2+ , Sr 2+ , Ca 2+ , Na + и Mg 2+ .Два из этих катионов являются более вероятными кандидатами, чем другие потому что они образуют недорогие растворимые соли: Na + и К + .
Ион SO 4 2- может быть лучшим анионом для использовать, потому что это самый трудный для окисления анион. В потенциал окисления этого иона до пероксидисульфат-иона равен -2,05 вольт.
| 2 СО 4 2- S 2 O 8 2- + 2 e — | E o вол = -2.05 В |
В водном растворе Na 2 SO 4 или K 2 SO 4 подвергается электролизу в аппарате как показано на рисунке выше, H 2 газ собирается на одном электрод и газ O 2 собирается на другом.
Что было бы, если бы мы добавили такой индикатор, как бромтимол? синий к этому аппарату? Бромтимоловый синий желтеет в кислой среде. растворы (pH <6) и синий цвет в щелочных растворах (pH> 7.6). Согласно уравнениям двух полуреакций индикатор должен стать желтым на аноде и синим на катод.
| Катод (-): | 2 H 2 O + 2 e — Н 2 + 2 ОН — | ||
| Анод (+): | 2 H 2 O O 2 + 4 H + + 4 e — |
Закон Фарадея
Закон электролиза Фарадея можно сформулировать следующим образом. г. количество вещества, потребляемого или производимого на одном из количество электродов в электролитической ячейке прямо пропорционально количество электричества, которое проходит через ячейку.
Чтобы использовать закон Фарадея, мы должны признать соотношение между током, временем и количеством электрического заряд, протекающий по цепи. По определению один кулон заряда передается, когда в течение 1 секунды протекает ток 1 А.
1 C = 1 ампер-с
Пример: Чтобы проиллюстрировать, как можно использовать закон Фарадея, давайте рассчитайте количество граммов металлического натрия, которое образуется при катод при 10.Ток 0 ампер пропускается через расплавленный натрия хлорид в течение 4.00 часов.
Начнем с вычисления количества электрического заряда, который протекает через ячейку.
Прежде чем мы сможем использовать эту информацию, нам понадобится мост между эта макроскопическая величина и явление, происходящее на атомный масштаб. Этот мост представлен постоянной Фарадея, который описывает количество кулонов заряда, которое несет моль электронов.
Таким образом, число молей электронов, перенесенных при 144000 кулонов электрического заряда, протекающего через ячейку, могут быть рассчитывается следующим образом.
Согласно полученному уравнению реакции происходит на катоде этой ячейки, мы получаем один моль натрия за каждый моль электронов.
| Катод (-): | Na + + e — Na |
Таким образом, получаем 1.49 моль, или 34,3 грамма натрия в 4,00 часы.
Последствия этого расчета следующие: интересный. Нам пришлось бы проводить этот электролиз более чем два дня, чтобы приготовить полкило натрия.
Мы можем расширить общую схему изложены в этом разделе, чтобы ответить на вопросы, которые могут показаться невозможно на первый взгляд.
границ | Электролиз углекислого газа и воды с использованием новых щелочно-стабильных анионных мембран
Введение
За последнее десятилетие все больший интерес был направлен на использование углекислого газа для производства жидкого топлива и химикатов в качестве средства обеспечения устойчивой, углеродно-нейтральной экономики.Эффективное производство энергоемких продуктов на основе углерода из уловленного и антропогенного CO 2 с использованием возобновляемых источников энергии, таких как солнечная энергия, ветер, атомная энергия и гидроэлектроэнергия, обеспечивает основу для поиска экологически безопасного химического сырья, не получаемого из ископаемого топлива ( Halmann, 1993; Aresta, Dibenedetto, 2007; Aresta, 2010; Whipple, Kenis, 2010; Quadrelli et al., 2011; Sankaranarayanan, Srinivasan, 2012; Hu et al., 2013; Masel et al., 2014a, 2016a; Aresta и другие., 2016).
Эффективное производство окиси углерода (CO) из CO 2 — одно из ключевых направлений в производстве экологически безопасного химического сырья. Это промышленно ценный химикат, который обычно производится из метана с образованием различных соотношений CO и водорода в смеси, называемого синтез-газом. Синтез-газ используется в производстве топлива, такого как дизельное топливо и бензин, а также других химикатов с помощью химии Фишера-Тропша (F-T) с использованием выбранных катализаторов и рабочих условий (Appel, 2013; Costentin et al., 2014; Masel et al., 2014a, 2016a; Лю и др., 2015).
Производство водорода из возобновляемых источников — еще одна важная область применения возобновляемых источников энергии. Водород используется во многих промышленных процессах и является составной частью концепции «водородной экономики». Это способ хранения и выработки возобновляемой энергии, которую можно использовать в качестве топлива для автомобилей и других приложений (Ursua et al., 2012; Министерство энергетики США (DOE), 2018).
Новые мембраны для щелочно-стабильных анионов
КомпанияDioxide Materials (DM) разработала группу новых мембран, функционализированных имидазолом, с использованием основной цепи на основе полистирола, которые удивительно стабильны в сильных щелочных растворах (Masel et al., 2017а, б, в). Эти мембраны теперь доступны исследователям для разработки других технологических приложений. Подробная информация об этих мембранах представлена в следующих разделах.
Sustainion
® Описание преполимерной и анионной мембраныАнионообменные мембраны Sustanion ® основаны на дешевом и распространенном, но, что более важно, щелочно-стабильном полистироловом каркасе. Синтез полимера и последующее изготовление мембраны подробно описаны в нескольких прошлых публикациях (Masel et al., 2016b, 2017d; Куц и др., 2017; Лю и др., 2017а; Саджад и др., 2017). Синтез включает двухэтапный процесс (рис. 1) сополимеризации с последующей функционализацией. Мембрана может быть отлита как пленка или как армированная мембрана с использованием различных армирующих материалов. Хлоридную форму мембраны затем обычно превращают в гидроксидную форму с помощью КОН.
Рисунок 1 . Синтетический путь преполимера при изготовлении анионообменных мембран Sustainion ® .
Вкратце, сополимер стирола и винилбензилхлорида получают путем свободнорадикальной аддитивной полимеризации. Затем сополимерный продукт промывают и осаждают этанолом. Затем его фильтруют, сушат и затем функционализируют 1,2,4,5-тетраметилимидазолом в растворителе Dowanol ® PM (1-метокси-2 пропанол). Дивинилбензол также добавляется в качестве сшивающего агента для улучшения прочности мембраны. Затем литая мембрана активируется в течение 8–16 часов в 1М растворе гидроксида калия для преобразования в форму гидроксида.
Расширение производства мембран
Синтетический способ получения иономера, показанный на рисунке 1, был увеличен до объемов реактора промышленного размера и перенесен в пилотную установку для нанесения покрытий промышленного размера для производства мембран. Производственный цикл мембраны обычно производит от нескольких сотен до тысячи футов мембраны шириной около 24 см. Конечная ширина и общая длина мембраны могут быть изменены в соответствии с требованиями заказчика.
Свойства анионной мембраны
Анионообменные мембраны обычно поставляются в сухой хлоридной форме, нанесенной на полиэтилентерефталатную (ПЭТ) подкладку.Следовательно, их необходимо преобразовать в гидроксидную форму, подвергая их воздействию сильного основания. DM рекомендует вымачивать мембрану в большой ванне с 1М КОН на 24–48 часов, чтобы преобразовать хлоридную форму мембраны в гидроксидную форму. Эта активация также помогает укрепить мембрану за счет сшивания с КОН, как было выявлено в недавнем исследовании ядерной магнитной спектроскопии (ЯМР) (Pellerite et al., 2017). Кроме того, во время этого процесса мембрана набухает и отделяется от полиэтиленовой пленки, которую выбрасывают.
Мембрана имеет ионообменную емкость (IEC) ~ 1,1 ммоль / г, рассчитанную с помощью стандартной методики обратного титрования (Vengatesan et al., 2015). Еще более впечатляющим является удельное сопротивление поверхности (ASR) мембраны. Таблица 1 показывает, что измеренное нормированное сопротивление для Sustanion ® 37–50 в тех же щелочных условиях более чем на порядок ниже, чем у других коммерчески доступных мембран. Анионообменная мембрана показала отличные рабочие характеристики при работе с несколькими ячейками в течение 1 000–3 000 часов и более при электрохимическом испытании ячейки в широком диапазоне pH, что подтверждается опубликованными экспериментальными данными по электролизеру диоксида углерода и щелочной воды (Masel et al., 2016b; Куц и др., 2017; Лю и др., 2017а, б; Саджад и др., 2017). Некоторые из последних результатов освещены в следующих разделах этой статьи.
Таблица 1 . Измерения удельного поверхностного сопротивления (ASR) Sustanion ® 37-50 и других имеющихся в продаже ионообменных мембран в 1M KOH при 60 ° C.
Анионообменные мембраны Sustainion ® претерпевают умеренное набухание, примерно на 5% в поперечном направлении и примерно на 50% по толщине во время преобразования в форму гидроксида с использованием 1М КОН.Это набухание мембраны или высокое поглощение воды (~ 80%) объясняет низкие значения измерения удельного сопротивления (ASR) (то есть высокой ионной проводимости), поскольку водопоглощение кажется важным механизмом для переноса гидроксид-ионов. Признавая потребность в более стабильных по размерам и прочных мембранах, DM теперь также производит более прочные усиленные версии анионообменных мембран Sustanion ® , подходящие для использования в более крупных электролизерах и в более требовательных электрохимических приложениях.Армирующая опора делает эти мембраны более прочными как во влажном, так и в сухом состоянии.
Электрохимическое превращение CO
2 в муравьиную кислотуЗа последние 30 лет многочисленные исследователи изучали эффективность различных катализаторов при электрохимическом восстановлении конверсии CO 2 в формиат / муравьиную кислоту. В различных статьях представлены превосходные сводные обзоры предыдущих экспериментальных работ (Jitaru, 2007; Rosen et al., 2011; Lu et al., 2014; Qiao et al., 2014; Плетчер, 2015; Du, 2017) и не будет здесь подробно описываться. Совсем недавно ряд исследователей пошли еще дальше, проведя исследования и представив отчеты о них, предоставив данные об эффективности полного электрохимического преобразования клеток CO 2 при получении формиата / муравьиной кислоты (Mahmood et al., 1987; Li and Oloman, 2005, 2006, 2007; Oloman, Li, 2008; Whipple et al., 2010; Agarwal et al., 2011; Alvarez-Guerra et al., 2012, 2014; Kopljar et al., 2014; White et al., 2014; Du et al, 2016; Sen et al., 2016).
DM смог успешно производить высокие концентрации чистой муравьиной кислоты непосредственно в электрохимической ячейке в результате электрохимического восстановления CO 2 (Kaczur et al., 2017; Yang et al., 2017a, b). Это снижает потребность в кислотном превращении продуктов на основе солей формиата щелочного металла (например, формиата калия), которые обычно производятся с использованием этих альтернативных электрохимических ячеек и конфигураций процесса.
Конструкция ячейки с муравьиной кислотой
Конфигурация электрохимического элемента с муравьиной кислотой DM основана на конструкции с тремя отсеками, состоящими из анодного отсека, центрального проточного отсека, содержащего катионо-ионообменную среду, в которой продукт муравьиной кислоты собирается и удаляется из электролизера, и катодного отсека, где происходит электрохимическое восстановление CO 2 до формиат-ионов (Kaczur et al., 2017; Ян и др., 2017а, б).
Общая конфигурация электрохимического элемента с муравьиной кислотой показана на рисунке 2A. В анодном отсеке используется титановый анод с покрытием из MMO (смешанный оксид металлов), где деионизированная вода подвергается электролизу с образованием ионов кислорода и водорода (H + ). Катионообменная мембрана, примыкающая к анодному отсеку, используется для блокирования транспорта формиат-анионов к аноду, где он окисляется до CO 2 . Образующиеся ионы водорода проходят через катионообменную мембрану в центральную проточную камеру.Катионная мембрана предпочтительной конструкции представляет собой мембрану типа перфторированной сульфоновой кислоты, которая одновременно устойчива к окислению и эффективна в блокировании транспорта формиат-анионов. В анолите используется деионизированный водный анолит, поскольку анод-мембрана имеет контактное устройство без зазора.
Рисунок 2 . Конструктивная конфигурация электрохимического трехкамерного элемента с муравьиной кислотой показана в (A) . Экспериментальная операционная система с муравьиной кислотой и сводка по производительности показаны в (B) .
В катодном отсеке CO 2 эффективно восстанавливается при низких перенапряжениях для образования с использованием комбинации покрытия наночастиц олова и иономерного катализатора на основе имидазола в структуре углеродного GDE (газодиффузионного электрода). Образующиеся формиат-ионы, а также образующиеся гидроксид и бикарбонат / карбонат-ионы затем проходят через прилегающую анионообменную мембрану Sustainion ® в центральную проточную камеру.
В центральном отделении потока используется катионо-ионообменная среда для обеспечения проводимости раствора, необходимой для продукта муравьиной кислоты, который образуется в отделении.Формиат-ионы, образующиеся в катодном отсеке, проходят через прилегающую анионную мембрану Sustainion ® и объединяются с ионами водорода, переносящимися через катионообменную мембрану из анодного отсека, с образованием продукта чистой муравьиной кислоты. Деионизированная вода, дозированная в центральную проточную камеру, используется для сбора и удаления муравьиной кислоты из камеры. Концентрация муравьиной кислоты зависит от скорости потока воды, поступающей в центральную проточную камеру, и тока рабочей ячейки, образуя конечный продукт из муравьиной кислоты в концентрациях, которые могут находиться в диапазоне от 2 до 30 мас.%, И при высокой эффективности по Фарадею от 85 до 95%.Любые гидроксид-ионы, попадающие в центральную проточную камеру, реагируют с ионами водорода с образованием воды, а любой перенос бикарбонатных / карбонатных ионов будет реагировать с ионами водорода с образованием CO 2 , выходящего с продуктом муравьиной кислоты в виде газообразного CO 2 . Катионо-ионообменная среда, использованная в конструкции, гранулы водородной катионообменной смолы Amberlite ® IR120, обеспечивала улучшенную ионную проводимость в центральном проточном отсеке, поскольку растворы муравьиной кислоты имеют значительно более низкую проводимость.Катионообменная среда обеспечивала более низкое рабочее напряжение ячейки (Yang et al., 2017a).
Экспериментальная операционная система с муравьиной кислотой
На рис. 2В показана схема экспериментальной операционной системы элемента с муравьиной кислотой, а также краткое изложение рабочих характеристик элемента. Ячейка вырабатывала концентрацию муравьиной кислоты от 5 до 30% в зависимости от скорости потока деионизированной воды, подаваемой в центральное отделение за один проход. Диапазон рабочих плотностей тока ячейки FA составляет от 140 до 200 мА · см -2 при соответствующих напряжениях ячейки 3.5 и 4,0 вольт, работающие при комнатной температуре. Эффективность клеток по Фарадею колебалась от 80 до 95% при использовании катионообменной мембраны Nafion ® 324 и анионообменной мембраны Sustainion ® 37-50 в конфигурации ячейки (Yang et al., 2017a).
Клеточная химия с муравьиной кислотой
Элемент с муравьиной кислотой (FA) имеет сложный набор реакций, которые происходят на аноде, катоде GDE и центральном проточном отсеке, который ограничен катионообменной мембраной со стороны анода и анионообменной мембраной со стороны катода. .На рисунке 3 показаны предлагаемые основные и вторичные реакции, а также перенос ионов, которые могут происходить во время работы ячейки.
Рисунок 3 . Конфигурация ячейки DM с 3 отсеками для муравьиной кислоты, показывающая предполагаемые реакции и перенос ионов.
Основные реакции клеток с муравьиной кислотой
Электрохимическое восстановление CO 2 происходит в присутствии воды на катоде с образованием формиатных (HCOO — ) и гидроксидных (OH — ) ионов:
CO2 + h3O + 2e− → HCOO− + OH− (1)Одновременно на аноде происходит окисление воды с образованием газообразного кислорода и ионов водорода (H + ).Ионы водорода на самом деле являются катионами гидроксония или оксония (H 3 O + ) в водных растворах, и в этой статье мы используем H + в качестве заменителя ионов гидроксония.
2h3O → 4H ++ 4e− + O2 (2)И формиат-ионы, и ионы гидроксида мигрируют через анионообменную мембрану в центральную проточную камеру, где они объединяются с ионами водорода, образующимися в анодной камере, проходящей через катионную мембрану, с образованием воды и муравьиной кислоты следующим образом:
H ++ OH− → h3O (3) H ++ HCOO− → HCOOH (4)Клеточные реакции с муравьиной кислотой
Побочные реакции, которые могут происходить на катоде и католите, следующие:
CO2 + h3O + 2e− → CO + 2OH− (5) 2h3O + 2e− → h3 + 2OH− (6) CO2 + OH− → HCO3− (7)Анионы бикарбоната (HCO3-), образующиеся в катодном слое, мигрируют через анионообменную мембрану в центральную проточную камеру, реагируя с ионами водорода, поступающими в центральную проточную камеру из анодной камеры через прилегающую катионную мембрану с образованием CO 2 :
H ++ HCO3− → CO2 + h3O (8)Муравьиная кислота будет потеряна, если она пройдет через катионную мембрану в анолитный отсек, а затем окислится на аноде до CO 2 :
HCOOH → CO2 + 2H ++ 2e− (9)Характеристики клеток с муравьиной кислотой
Ссылка (Ян и др., 2017a) предоставляет подробную информацию о производительности трехкомпонентной ячейки с муравьиной кислотой. На рисунке 4 показаны рабочие характеристики ячейки с 3 отсеками для муравьиной кислоты 2 размером 5 см, имеющей конфигурацию ячейки с использованием анода из спеченного титана с покрытием IrO 2 в поле потока титана, катионной мембраны Nafion ® 324 и Sustanion. ® 37–50 анионообменная мембрана, работающая при плотности тока 140 мА / см 2 . В таблице 2 представлена подробная информация о конфигурации ячейки.Электролизер проработал около 142 часов, при этом концентрация продукта муравьиной кислоты увеличилась с 8,1 до 9,4% масс., И работала с эффективностью Фарадея 80% в начале и 94% ближе к концу цикла, пока не стало возможным. отключение для проверки. Не было отмечено никакого износа компонентов анода / катода ячейки. Ключом к достижению высокой фарадеевской эффективности FA было использование катионной мембраны Nafion ® 324, которая сводила к минимуму перенос ионов формиата / муравьиной кислоты в анолитный отсек.
Рисунок 4 . Рабочие характеристики ячейки с муравьиной кислотой для конфигурации ячейки, приведенной в таблице 2, с использованием анода из спеченного волокна из титана, покрытого катализатором IrO 2 , катионной мембраны Nafion ® 324 и анионообменной мембраны Sustanion ® 37-50.
Таблица 2 . Ячейка с муравьиной кислотой 142 ч, конфигурация электролизера с увеличенным временем работы.
Расчетная проектная потребляемая мощность элемента с муравьиной кислотой находится в диапазоне 4.3–4,7 кВтч / кг ТВС постоянного тока при этих условиях эксплуатации. Это соответствует эксплуатационным расходам на электроэнергию в размере 214–232 доллара США на тонну ТВС при стоимости электроэнергии 0,05 доллара США / кВтч.
Масштабирование будущего и применение продуктов с муравьиной кислотой
Мировой рынок муравьиной кислоты и путь коммерческого химического производства, а также некоторые области применения продуктов показаны на Рисунке 5A.
Рисунок 5 . Мировой рынок муравьиной кислоты (2013 г.), показывающий текущий химический коммерческий процесс путем карбонилирования метанола, и некоторые новые области применения ЖК показаны в (A) .Устойчивый способ получения муравьиной кислоты с использованием возобновляемых источников энергии и производства продуктов в различных товарных категориях показан в (B) .
Устойчивый способ производства муравьиной кислоты из возобновляемых источников энергии показан на Рисунке 5B. Различные области применения продуктов FA включают силос / продукты питания, химикаты, накопление энергии и топливо. Использование муравьиной кислоты в качестве сырья в биологических реакторах, заменяющее сахара и / или сельскохозяйственное зерно, является еще одним многообещающим сырьем.
DM в настоящее время работает с промышленными партнерами над расширением электрохимической технологии муравьиной кислоты.
Электрохимический CO
2 Электролиз: преобразование CO 2 в COЗа последние 20 лет возрос интерес к разработке технологических методов преобразования CO 2 в коммерчески полезный и ценный продукт, такой как CO. CO в сочетании с водородом является основой процесса Фишера-Тропша (F-T), который позволяет производить самые разные виды топлива и химикатов.Одной из важных областей исследований является использование электрохимической обработки для превращения CO 2 в CO. Некоторые из исследований в этой области были обобщены в нескольких обзорных статьях (Appel, 2013; Costentin et al., 2014; Masel et al. , 2014а, 2016б).
Разработка технологии электролизера CO 2 на основе DM для эффективного получения CO с высокой селективностью основана на трех технологических усовершенствованиях. Это:
• Разработка структуры катода GDE, включающей иономер на основе имидазола в качестве сокатализатора с наночастицами Ag, снижая потенциал на катоде для реакции восстановления CO 2 до CO.
• Разработка высокопроводящей и щелочно-стабильной анионной мембраны (мембрана Sustainion ® ), которая может проводить OH — и бикарбонат / карбонат-ионы.
• Разработка анодной структуры ГДЭ на основе наночастиц катализатора IrO 2 , стабильного более 3000 часов работы.
Все эти разработки помогли создать электрохимическую технологию CO 2 , которая может одновременно работать при высоких плотностях тока, высокой селективности по CO и низких потенциалах ячейки.Большая часть недавних работ по технологии электролиза CO 2 резюмирована в различных статьях и патентах (Masel et al., 2014b, 2015; 2016c Masel and Rosen, 2014; Masel and Chen, 2015). Некоторые аспекты конструкции электролизера CO 2 , усовершенствования технологии и производительности описаны в следующих нескольких разделах.
CO
2 Конструкция электролизной ячейкиБазовая конфигурация электролизной ячейки DM CO 2 показана на рисунке 6A.В конструкции ячейки используются титановый змеевиковый анодный токоприемник и змеевиковый катодный токоприемник из графита или нержавеющей стали 316L. В аноде GDE используется катализатор в виде наночастиц IrO 2 на подложке из углеродной бумаги. Катод GDE использует наночастицы Ag с комбинацией иономерного катализатора Sustainion ® на основе имидазола на подложке из углеродной бумаги, которая подавляет образование водорода на катоде, обеспечивая, таким образом, очень высокую селективность от 95 до 99% CO 2 по CO. .
Рисунок 6 . Конфигурация электрохимической ячейки DM CO 2 показана в (A) . Предлагаемый электрохимический внутренний химический состав ячейки CO 2 , показывающий основные реакции и пути протекания ионных частиц, показан в (B) .
CO
2 Клеточная химияНа рис. 6В показаны основные пути прохождения комплексных ионов в электрохимической ячейке CO 2 . Электролизер CO 2 работает с использованием разбавленного 10 мМ раствора анолита бикарбоната калия и увлажненного потока газового католита CO 2 .Высокие концентрации анолита KHCO 3 могут привести к осаждению солей калия в катодном GDE, что приведет к блокированию потока газа CO 2 в катодном змеевидном проточном тракте.
CO
2 Ячейки-катодные реакцииНиже представлены предлагаемые катодные реакции в ячейке CO 2 . CO 2 восстанавливается до CO на катализаторе из наночастиц Ag, и образующиеся гидроксид-ионы транспортируются через анионообменную мембрану или вступают в реакцию с CO 2 с образованием карбонатных / бикарбонатных анионов, которые также будут проходить через анионообменную мембрану.
а. CO 2 реакция восстановления наночастиц Ag-катализатора с образованием CO и гидроксид-ионов:
CO2 + h3O + 2e− → CO + 2OH −− 0,52 В по сравнению с SHE @ pH7 (5)г. CO 2 реакция с гидроксид-ионами с образованием карбонат-анионов:
CO2 + 2OH− → CO3−2 + h3O (10)г. CO 2 реакция с гидроксид-ионами с образованием бикарбонат-анионов:
CO2 + OH− → HCO3− (11)г. Дальнейшая реакция карбонатных ионов с CO 2 с образованием бикарбонатных анионов:
CO3−2 + CO2 + h3O → 2HCO3− (12)e.Побочная реакция электролиза восстановления воды с образованием как газообразного водорода, так и ионов гидроксида:
2h3O + 2e− → h3 + 2OH− (13)CO
2 Анодные реакции элементаНиже представлены предлагаемые анодные реакции в ячейке CO 2 . Анодные реакции сложны и могут представлять собой набор смешанных реакций. Вода может быть подвергнута электролизу на катализаторе окисления наночастиц IrO 2 с образованием ионов кислорода и водорода с альтернативной возможной анодной реакцией, представляющей собой электролиз гидроксид-ионов на катализаторе с образованием кислорода и воды.Присутствие карбонат / бикарбонат-ионов в анолите и их преобразование в CO 2 обеспечивает сложную буферность объемного раствора в отсеке анолита.
а. Электролиз воды на анодном катализаторе с образованием ионов кислорода и водорода при pH 7 и pH 0:
2h3O → O2 + 4H ++ 4e− 0,815 В по сравнению с SHE при pH 7 (11) 2h3O → O2 + 4H ++ 4e− 1,23 В по сравнению с SHE при pH 0 (13)г. Электролиз гидроксид-ионов на анодном катализаторе с образованием кислорода и электронов:
4OH− → O2 + 2h3O + 2e− 0,40 В по сравнению с SHE при pH (14)г.Разложение бикарбоната ионами водорода с образованием CO 2 и воды:
HCO3− + H + → CO2 + h3O (14)г. Разложение карбоната ионами водорода с образованием CO 2 и воды:
CO3−2 + 2H + → CO2 + h3O (15)e. Ионы гидроксида реагируют с ионами водорода с образованием воды:
H ++ OH− → h3O (16)Общий CO
2 Реакции клеток — определение того, являются ли бикарбонат и карбонат преобладающими видами мобильных носителей ионного токаТеоретически комплексный ионный транспорт в ячейке CO 2 состоит в основном из бикарбонатных и карбонатных анионов в качестве преобладающих носителей тока, а также любых гидроксид-анионов, которые не вступили в реакцию с газом CO 2 в реакциях католита в GDE. катод.Экспериментальные исследования соотношений транспорта этих видов анионов в клетке и через мембрану еще полностью не исследованы. Испытания ячейки DM 250 см 2 в LanzaTech (Скоки, Иллинойс) предоставили важные данные о газовом составе анолита в ячейке с помощью ГХ. В таблице 3 показаны некоторые из возможных реакций, основанных на переносе (A) бикарбоната или (B) карбонат-аниона, соответственно, в ячейке. Чистая анодная реакция (17) в Таблице 3A предсказывает, что состав анодного газа должен иметь соотношение CO 2 к O 2 , равное 4: 1, или состав газа, состоящий из 80% CO 2 и 20% O 2 , если бикарбонат был единственным носителем тока аниона в ячейке.В качестве альтернативы, итоговая анодная реакция (20) в Таблице 3B могла бы прогнозировать соотношение 2: 1 CO 2 к O 2 или состав газа, состоящий из 67% CO 2 и 33% O 2 , если карбонат был только анион-носитель тока в ячейке.
Таблица 3 . Сводка реакций с использованием бикарбоната (A) или карбоната (B) в качестве выбранного подвижного аниона через анионную мембрану в ячейке CO 2 .
ИзмерениеDM состава анодного газа электролизера в прошлом показало изменчивость содержания CO 2 в диапазоне от 30 до 60% в зависимости от рабочих условий электролизера.Один комплект для газового анализа ГХ рабочей ячейки 250 см 2 CO 2 в LanzaTech показал следующий состав газа:
Элемент CO 2 обычно имеет объемный pH анолита около 6,0 при работе с 10 мМ электролитом KHCO 3 , что эквивалентно смеси угольной кислоты 50:50 (H 2 CO 3 ) и бикарбонат. Эти результаты показывают, что ионы карбоната потенциально являются основным носителем заряда, поскольку молярное газовое соотношение CO 2 : O 2 составляло примерно 2: 1.Таким образом, окончательный ответ на преобладающие ионные носители заряда в ячейке CO 2 потребует дальнейшего изучения.
CO
2 Производительность ячейкиПроведение длительных испытаний любых электрохимических ячеек является ключом к определению характеристик и стабильности всех компонентов ячеек, особенно мембран и анодно-катодных катализаторов. Здесь мы обсуждаем некоторые долгосрочные характеристики электролизеров DM lab 5 и 250 cm 2 CO 2 .
5,0 см
2 CO 2 Ячейка, долговременная работаВ программе тестирования ячеек DM CO 2 задействовано множество ячеек, оценивая различные составы анионных мембран Sustainion ® , а также конфигурации анодных и катодных составов в течение периодов эксплуатации до 4000 ч и более, чтобы гарантировать, что желаемая клеточная мембрана и катализатор производительность конфигурации стабильная. Детали и данные о работе ячеек подробно описаны в нескольких статьях (Rosen et al., 2013; Лю и др., 2015; Масел и Чен, 2015). Пример длительного испытательного прогона 5,0 см элемента 2 в течение 4000 ч показан на рисунке 7A. График поляризации напряжения ячейки для ячейки 5 см 2 CO 2 , работающей при комнатной температуре (24 ° C), показан на рисунке 7B.
Рисунок 7 . 5,0 см 2 Данные долгосрочных испытаний ячеек, показывающие стабильную работу в течение 4000 ч, показаны слева в (A) . График поляризации напряжения ячейки для 5.0 см 2 CO 2 ячейка, работающая при комнатной температуре, показана справа в (B) .
250 см
2 Конструкция CO 2 Производительность ячейкиЯчейка 5,0 см 2 CO 2 впоследствии была увеличена до ячейки с геометрической активной площадью 250 см 2 . В дополнение к тестированию в DM одна ячейка была отправлена в LanzaTech (Скоки, Иллинойс) для сравнительного тестирования. В таблице 4 показаны подробные сведения о конфигурации ячеек. Ячейка в DM проработала в общей сложности 760 часов до отключения в рамках подготовки к дальнейшим тестовым работам в LanzaTech.На рисунке 8A показаны рабочие характеристики элемента при DM, показывающие стабильный диапазон напряжения 2,9–3,0 В в течение периода тестирования. Плотность рабочего тока электролизера составляла 120 мА / см 2 , при рабочей температуре анолита около 45 ° C, без необходимости какого-либо внешнего охлаждения.
Таблица 4 . 250 см 2 CO 2 Детали конфигурации ячейки.
Рисунок 8 . Характеристики элемента 250 см 2 при DM, показывающие стабильную работу под напряжением в течение примерно 760 ч до отключения, показаны в (A) .Работа на 250 см 2 CO 2 в LanzaTech показывает анализ состава газа ГХ на выходе католита в ячейке в расширенном режиме 90-часового испытательного прогона, показанный в (B) .
250 см
2 CO 2 Тестирование ячеек в LanzaTechРабота ячейки 250 см 2 CO 2 в LanzaTech помогла подтвердить селективность ячейки CO 2 по CO и состав газовых продуктов. На рисунке 8B показаны результаты 90-часового пробного запуска.Компания LanzaTech использовала автоматический ГХ Agilent Technologies Model 490 Micro GC с колонкой Mol Sieve 5A (MS5A) для автоматического анализа и мониторинга состава газового продукта католита клеток с течением времени. Точки выбросов — это случайные всплески анализа в GC-анализе. Селективность по CO в ячейке варьировалась от 97,5% (т.е. содержание H 2 1%) до примерно 99% (содержание H 2 0,38%).
250 см
2 CO 2 Операционная система ячейкиНа рис. 9а показана конфигурация экспериментальной испытательной системы ячейки 250 см 2 CO 2 .На рисунках 9b, c показан элемент Fuel Cell Technologies, который был модифицирован для использования в конструкции элемента DM 250 см 2 CO 2 . На левой фотографии На рисунке 9b показана ячейка целиком, а на правой фотографии на рисунке 9c показана конструкция поля потока на титановом змеевидном аноде, которая была изготовлена для ячейки. Газ CO 2 измеряли с помощью регулятора расхода газа CO 2 и барботировали через резервуар увлажнителя газа, заполненный водой. Увлажненный газ CO 2 входит в верхнюю часть катода ячейки CO 2 и выходит снизу в виде обедненного газового потока CO 2 , содержащего продукт CO и небольшое количество побочного продукта H 2 .Избыточная конденсированная вода собирается и отделяется от газового потока. Типичным газовым продуктом электролизера CO 2 был в основном CO с небольшим количеством побочного продукта H 2 и работающий со стехиометрическим избытком CO 2 . Селективность электролизера по CO колебалась от 95 до 99% в зависимости от приложенной плотности тока и количества избыточного CO 2 сверх стехиометрического, используемого в подаче католитного газа, как показано на Рисунке 8. Анолитный контур состоит из 10 мМ KHCO 3. Электролит , имеющий проводимость около 1.0 мСм, который прокачивался через анод ГДЭ ячейки при выбранных расходах. Теплообменник использовался для регулирования температуры контура анолита путем регулирования потока охлаждающей воды. Контроллер проводимости использовали для управления добавлением концентрированного раствора KHCO 3 в контур анолита по мере необходимости для поддержания проводимости анолита.
Рисунок 9 . Схема экспериментальной испытательной системы с ячейкой 250 см 2 CO 2 показана в (а) .DM модифицировал ячейку электролизера 250 см 2 CO 2 , как показано в (b) слева. В конструкции использовалась конструкция поля течения на титановом змеевидном аноде, как показано в (c) .
CO
2 Развитие ячеекРабота над расширением ячейки DM CO 2 продолжается с другими партнерами. В дополнение к расширению масштабов, продолжаются опытно-конструкторские работы по поиску подходящих стабильных заменителей катализатора из неблагородных металлов для наночастиц IrO 2 , используемых в конструкции анодного GDE.
Расчетная потребляемая мощность процесса ячейки CO 2 с использованием данных ячейки 250 см 2 , составляющая 2,95 В при 30 А (120 мА / см 2 ) с селективностью 98% по CO, была рассчитана как 5,8 постоянного тока. кВтч / кг CO при 45 ° C.
Электролиз щелочной воды
Электролиз в щелочной воде признан зрелой технологией, которая является надежной и безопасной, поскольку срок службы электролизеров достигает 15 лет. Их самым большим преимуществом является то, что они используют обильные катализаторы электродов из неблагородных металлов.В конструкции ячейки обычного щелочного электролизера обычно используется сепаратор диафрагменного типа. Сепаратор обычно требует, чтобы расстояние между анодным и катодным электродами составляло около 2–3 мм друг от друга, чтобы предотвратить переход газа, тем самым ограничивая рабочую плотность тока примерно до 200 мА / см. 2 для работы при разумном рабочем напряжении. и соответствующая общая энергоэффективность. Чтобы увеличить плотность тока при сохранении той же или более высокой энергоэффективности, следующим технологическим шагом будет разработка стабильных щелочно-стабильных анионообменных мембран, которые позволят использовать настоящие водные электролизеры с нулевым зазором.Компания DM разработала технологию электролизеров с щелочной водой, основанную на разработке стабильной анионообменной мембраны. Работа по разработке резюмируется в различных опубликованных статьях и патентах (Плетчер и Ли, 2011; Деавин и др., 2012; Аппель, 2013; Розен и др., 2013; Масел и др., 2016b; Куц и др., 2017; Лю и др., 2017а, б).
Конструкция ячейки электролизера щелочной воды DM
Разработка щелочной стабильной анионообменной мембраны Sustainion ® позволила разработать конструкцию электролизеров с нулевым зазором CO 2 , которые могут фактически улучшить плотность тока на порядок при том же или более низком напряжении ячейки по сравнению с электролизерами. современные диафрагменные электролизеры на основе щелочной воды.Чтобы протестировать анионообменную мембрану Sustainion ® в конфигурации водного электролизера, было принято решение использовать ячейку аналогичной конструкции, рис. 9A, B, которая используется в электролизере CO 2 , но с использованием нержавеющей стали 316L или других материалов. предпочтительны поля потока чистого никеля 200 как в катодной, так и в анодной конструкции.
Химия для щелочных электролизеров
Электролизер со щелочной водой работает с использованием 1 M раствора электролита KOH при температуре от окружающей среды до 60 ° C.Работа при 60 ° C обеспечивает самое низкое рабочее напряжение ячейки с использованием существующих анионообменных мембран Sustainion ® для разделения анодных и катодных реакций.
Реакция между электродами ячейки щелочного электролиза
Мембраны Sustainion ® , которые получают в хлоридной (Cl — ) форме, необходимо преобразовать в гидроксидную (OH — ) форму. Это делается путем вымачивания в 1 М КОН в течение не менее 12 часов. В присутствии электролита КОН и катод, и анод работают при локальном pH, близком к 14.На катоде реакция выделения водорода (HER) использует воду в качестве донора протонов, производя водород и OH — (уравнение 6). Ионы OH — переносятся от катода к аноду и рекомбинируют на аноде с образованием O 2 и электронов (уравнение 14). Общая реакция записана в уравнении 21.
4h3O + 4e− → 2h3 + 4OH− Ec0 = 0,826 В относительно SHE (6) 4OH− → O2 + 2h3O + 4e− Ea0 = −0,404 В относительно SHE (14) 2h3O → 2h3 + O2 E0 = 1,23 В (21)Лабораторная испытательная система для электролиза щелочной воды
На рис. 10А показана общая схема экспериментальной операционной системы щелочного водного электролиза DM 5 см 2 .В нижнюю часть отсеков анолита и католита электрохимической ячейки по отдельности подают перекачиваемый поток 1 М КОН из общей емкости для 1 М раствора КОН для отделения газов. Потоки раствора / газового продукта отсеков анолита и католита отдельно направляются в отдельные секции газоотделителя O 2 и H 2 блока отделения газа / жидкости. Газовые продукты O 2 и H 2 отводятся отдельно от сепаратора. В одной конструкции ячейки DM используются силиконовые гибкие полоски нагревателя, установленные на внешних пластинах анода и катода, для подачи тепла для работы ячейки при 60 ° C.Температура ячейки регулируется с помощью ПИД-регулятора температуры с помощью термопары, установленной на аноде или корпусе катода ячейки.
Рисунок 10 . Экспериментальная испытательная система электролиза щелочной воды для 5 см 2 испытательных ячеек показана в (A) . Типичная циклическая вольтамперограмма электролизера щелочной воды с анионообменной мембраной Sustainion ® на основе функционализации 1-метилимидазолом показана в (B) , а соответствующая циклическая вольтамперограмма показана в (C) .Использовали Pt-катод и анод IrO 2 , и ячейка работала в 1 М КОН при 60 ° C.
Производительность ячейки электролиза щелочной воды
На рис. 10В показана типичная циклическая вольтамперограмма электролизера с щелочной водой с анионообменной мембраной Sustainion ® , основанной на функционализации 1-метилимидазолом. Pt и IrO 2 черный использовались в качестве катода и анода соответственно. Потенциал начала электролиза воды с анионообменной мембраной начинается с 1.42 В, и ток быстро увеличивался при плотности тока 0,52 А / см. 2 (максимальный ток потенциостата) составлял 1,74 В. Длительные испытания проводились при постоянном токе 0,8 А / см 2 с использованием источник питания, и результаты показаны на рисунке 10C. Напряжение на ячейке достигало 2 В за 5 мин и постепенно увеличивалось до 2,3 В за 80 мин. Затем напряжение ячейки быстро увеличивалось и достигало напряжения отключения 3,5 В менее чем за 120 мин. Эти результаты показали, что мембрана на основе 1-метилимидазола работает в щелочном водном электролизере, но не стабильна в 1 М КОН.Это произошло из-за трех активных молекул водорода в имидазольном кольце, которые атакуются гидроксильными радикалами (· ОН) в 1 М КОН, особенно при более высоких температурах.
Для повышения стабильности анионообменной мембраны тетраметилимидазол был привит на стирольную основную цепь вместо 1-метилимидазола. Эта мембрана получила название Sustainion ® 37–50. На рис. 10С показаны поляризационные кривые клетки с мембраной Sustainion ® 37–50, работающей в 1 М КОН при 60 ° C.В ячейке с Pt-катодом и анодом из IrO 2 были достигнуты плотности тока 1 и 3 А / см 2 при 1,62 и 1,77 В соответственно. Для сравнения, ячейка с катодом NiFeCo и анодом NiFeOx достигла 1 и 3 А / см 2 при 1,90 и 2,13 В соответственно. Ячейка с электродами из неблагородного металла / оксида металла и анионообменными мембранами Sustainion ® 37–50 обеспечивает в 5 раз более высокую плотность тока при 1,90 В, чем у коммерческой щелочной воды (200 мА / см 2 при 2,0 В). электролиз с диафрагмами в качестве сепаратора.
Затем нужно было ответить на два вопроса. Имеет ли анионообменная мембрана Sustainion ® долгосрочную стабильность КОН и как долго она может сохранять рабочие характеристики? На рисунке 11A сравниваются характеристики ячейки анионообменной мембраны Sustainion ® 37–50 с коммерческой анионообменной мембраной Fumatech FAS-50 в идентичных ячейках для электролиза воды DM, работающих при постоянной плотности тока 1 А / см. 2 в 1. М КОН при 60 ° С. Результаты показывают, что мембранная ячейка Sustanion ® , работающая при 1 А / см 2 в течение почти 2000 часов, имела скорость увеличения напряжения ячейки всего на 5 мкВ / ч.Это указывает на то, что анионообменная мембрана Sustainion ® 37–50, функционализированная 1,2,4,5-тетраметилимидазолом, химически очень стабильна в КОН по сравнению с мембраной, функционализированной 1-метилимидазолом. Это также подтвердило, что нестабильность функционализированной 1-метилимидазолом мембраны была вызвана активным водородом в кольце. Анионообменная мембрана Fumasep FAS-50 ® показала значительное увеличение напряжения ячейки на 200 мкВ / ч с течением времени и показала высокий ток утечки ячейки 0.2 А / см 2 в точке 200 ч, а затем был отключен.
Рисунок 11 . Сравнение напряжения клеток в зависимости от времени в клетках, оценивающих анионную мембрану Sustainion ® 37-50 и анионообменную мембрану Fumatech Fumasep ® FAS-50 в 1М КОН при 60 ° C, показано в (A) . Ток ячейки щелочного электролиза при приложенном напряжении 2 В для различных мембран в 1M KOH при 60 ° C показан в (B) . Поляризационные кривые той же ячейки, сравнивающей электродные катализаторы из драгоценных металлов (Pt / IrO 2 ) и катализаторы из основных металлов (NiFeCo / NiFe) в 1M KOH при 60 ° C с использованием анионообменной мембраны Sustainion ® 37-50, представлены показано в (C) .
На рис. 11В показан ток ячейки щелочного электролиза при приложенном потенциале 2 В при оценке рабочих характеристик различных промышленных мембран с использованием катода, покрытого катализатором NiFeCo, и анода, покрытого катализатором NiFeOx, работающих в 1 М КОН при 60 ° C. Анионообменная мембрана Sustainion ® показала самый высокий ток ячейки при приложенном напряжении. Это сопоставимо с данными измерений мембраны ASR, приведенными в Таблице 1.
На рисунке 11C показаны поляризационные кривые той же ячейки для сравнения катализаторов электродов из драгоценных металлов (Pt на катоде / IrO 2 на аноде) с катализаторами электродов из основных металлов (NiFe на аноде / NiFeCo на катоде) с использованием Sustainion ® 37– 50 анионообменная мембрана в 1 М КОН при 60 ° C.При плотности тока 1 А / см 2 ячейка с катализаторами из драгоценных металлов работала при напряжении ячейки 1,63 В, а ячейка с катализаторами из неблагородных металлов работала при 1,9 В. Ячейка щелочного электролиза CAPEX (капитальные затраты) и OPEX (эксплуатационные расходы), которые должны будут включать доступность / стоимость как Ir, так и Pt катализаторов в крупномасштабных установках по всему миру, затем станут важными переменными в решении по анализу для установки этих систем.
Ячейка для электролиза щелочной воды в увеличенном масштабе
В промышленных установках для электролиза щелочной водой используются ячейки с геометрической площадью электродов от нескольких сотен см. 2 до нескольких метров. 2 .В настоящее время DM расширяет конструкцию щелочного водного электролизера с нулевым зазором с 5 см 2 до более крупных 100–600 см 2 ячеек. При эксплуатации этих более крупных электролизеров с щелочной водой при высоких плотностях тока 1 А / см 2 или более критически важно управление как водой, так и теплом. Основываясь на расчетах энергии и массы, при эксплуатации элемента 100 см 2 при 1 А / см 2 и 1,90 В потребление воды составит около 806 мл в день с выделением около 67 Вт отработанного тепла, которое необходимо удалить.Отработанное тепло для отдельной ячейки может обрабатываться с помощью воздушного охлаждения, но для большой батареи ячеек потребуется система рециркуляции охлаждающей воды с теплообменником. Для поддержания концентрации и объема жидкого электролита КОН в системе потребуется система подпитки деионизированной водой.
Расчетное энергопотребление электролизера с щелочной водой, работающего при 1 А / см 2 при 1,90 В, было рассчитано как 50,5 кВтч / кг ч / кг ч 2 постоянного тока. Потребление энергии электролизером будет ниже при более низких плотностях рабочего тока, но капитальные затраты на ячейки электролизера будут значительно выше.Все эти факторы необходимо учитывать при сравнении энергопотребления электролизера H 2 с целевыми показателями по электрохимическому водороду DOE, которые имеют энергоэффективность батареи 43 кВтч / кг и нормированную стоимость водорода 2,00 доллара на 2020 год (Министерство энергетики США (DOE ), 2018).
Сводка
Электрохимическая технология преобразования CO 2 в различные продукты, такие как муравьиная кислота и CO, а также водород с использованием щелочных водно-электролизных ячеек, продвигается к коммерциализации с разработкой новых анионообменных мембран Dioxide Materials Sustainion ® .Эти мембраны обладают высокой проводимостью и демонстрируют отличную стабильность в средах с сильнощелочными растворами при температурах до 60 ° C. Электрохимические системы, в которых используются эти новые мембраны, показывают хорошую стабильность при длительных лабораторных испытаниях в течение тысяч часов работы. Эти анионообменные мембраны все еще находятся на стадии разработки, и ведется работа по улучшению их механических свойств и свойств ионной проводимости.
Дальнейшая работа будет сосредоточена на усовершенствовании этих анионообменных мембран, а также на разработке улучшенных катализаторов, которые повысят эффективность всех этих электрохимических технологий.
Авторские взносы
JK, HY, ZL, SS и RM полностью внесли свой вклад в содержание этой статьи. JK, HY и SS работали над разработкой технологии муравьиной кислоты. ZL, SS, RM и JK работали над технологией электролиза щелочной водой. SS, ZL и RM работали над разработкой анионообменной мембраны Sustainion ® . ZL, HY и RM работали над разработкой технологии электролиза CO 2 . Все внесли свой вклад в содержание и редактирование этой статьи.
Заявление о конфликте интересов
Авторы подали несколько патентов на мембраны и конструкции, описанные здесь, включая US 9,370,773, US 9,481,939, US 9,580,824 и заявки на патенты США 15 / 400,775, 15 / 406,909, 15 / 411,831. Все авторы являются сотрудниками Dioxide Materials и имеют финансовую заинтересованность в этих патентах. Компания Dioxide Materials предлагает все наши исследовательские материалы (мембраны, катализаторы и т. Д.) Для продажи другим исследовательским группам, чтобы они могли воспроизвести и использовать полученные данные.
Благодарности
Часть этой работы была поддержана Министерством энергетики по контракту DE-SC0004453, а также частично ARPA-E по контракту DE-AR0000684 и компанией 3M. Мнения здесь принадлежат авторам и могут не отражать мнения DOE или 3M. Мы благодарим коллег за помощь, сотрудников и друзей из 3M. Кроме того, особая благодарность за поддержку со стороны LanzaTech, в частности Шона Симпсона (CSO и основатель), Кристофа Михалчи (директор по ферментации), Брюса Ли (старший).Dev. Engr.) И Nick Bourdakos (старший специалист по ферментации), предоставившие нам свои ценные экспериментальные данные по эксплуатации ячейки DM CO 2 .
Ссылки
Агарвал, А.С., Чжай, Ю., Хилл, Д., и Шридхар, Н. (2011). Электрохимическое восстановление диоксида углерода до формиата / муравьиной кислоты: технико-экономическая осуществимость. ChemSusChem 4, 1301–1310. DOI: 10.1002 / cssc.201100220
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альварес-Герра, М., Дель Кастильо, А., Ирабиен, А. (2014). Непрерывное электрохимическое восстановление диоксида углерода в формиат с использованием оловянного катода: сравнение со свинцовым катодом. Chem. Англ. Res. Des . 92, 692–701. DOI: 10.1016 / j.cherd.2013.11.002
CrossRef Полный текст | Google Scholar
Альварес-Герра, М., Кинтанилья, С., и Ирабиен, А. (2012). Превращение диоксида углерода в формиат с использованием процесса непрерывного электрохимического восстановления в свинцовом катоде. Chem. Англ.J. 207, 278–284. DOI: 10.1016 / j.cej.2012.06.099
CrossRef Полный текст | Google Scholar
Аппель, А. М., Берко, Дж. Э., Бокарсли, А. Б., Доббек, Х., Дюбуа, Д. Л., Дюпюи, М., и др. (2013). Границы, возможности и проблемы биохимического и химического катализа фиксации CO 2 . Chem. Ред. . 113, 6621–6658. DOI: 10.1021 / cr300463y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ареста, М. (2010). Двуокись углерода как химическое сырье .Weinheim: Wiley-VCH, 1–13.
Google Scholar
Ареста М. и Дибенедетто А. (2007). Использование CO 2 в качестве химического сырья: возможности и проблемы. Dalton Trans. 28, 2975–2992. DOI: 10.1039 / b700658f
CrossRef Полный текст | Google Scholar
Ареста М., Дибенедетто А. и Кваранта Е. (2016). Современное состояние и перспективы каталитического процесса конверсии CO 2 в химические вещества и топливо: особый вклад химического катализа и биотехнологии. Catal. J . 343, 2–45. DOI: 10.1016 / j.jcat.2016.04.003
CrossRef Полный текст | Google Scholar
Дэвин, О. И., Мерфи, С., Онг, А. Л., Пойнтон, С. Д., Зенг, Р., и Варко, Дж. Р. (2012). Анионообменные мембраны для щелочных полимерэлектролитных топливных элементов: сравнение боковых бензилтриметиламмониевых и бензилметилимидазолиевых головных групп. Energy Environ. Sci. 5, 8584–8597. DOI: 10.1039 / C2EE22466F
CrossRef Полный текст | Google Scholar
Ду, Д., Лан, Р., Хамфи, Дж., И Тао, С. (2017). Прогресс в разработке неорганических катодных катализаторов для электрохимического превращения диоксида углерода в формиат или муравьиную кислоту. J.Appl. Электрохим. 47, 661–678. DOI: 10.1007 / s10800-017-1078-x
CrossRef Полный текст | Google Scholar
Du, D., Lan, R., Humphreys, J., Sengodan, S., Xie, K., Wang, H., et al. (2016). Достижение высокой селективности и плотности тока для восстановления CO 2 до образования на нанопористых электрокатализаторах из вспененного олова. Chem. Sel. 1, 1711–1715. DOI: 10.1002 / slct.201600451
CrossRef Полный текст | Google Scholar
Халманн, М. М. (1993). Химическая фиксация диоксида углерода: методы переработки CO 2 в полезные продукты. Бока-Ратон, Флорида: CRC Press, 67–127.
Ху, Б., Гилд, К., и Суиб, С. Л. (2013). Термическое, электрохимическое и фотохимическое преобразование CO 2 в топливо и продукты с добавленной стоимостью. J. CO 2 Util. 1, 18–27. DOI: 10.1016 / j.jcou.2013.03.004
CrossRef Полный текст | Google Scholar
Качур, Дж. Дж., Янг, Х., Саджад, С. Д., и Масел, Р. И. (2017). Способ и система электрохимического производства муравьиной кислоты из диоксида углерода , Бока-Ратон, Флорида: заявка на патент США, 2017/0037522.
Google Scholar
Копляр, Д., Инан, А., Виндаер, П., Вагнер, Н., Клемм, Э. (2014). Электрохимическое восстановление CO 2 до формовки при высокой плотности тока с использованием газодиффузионных электродов. J. Appl. Электрохим . 44, 1107–1116. DOI: 10.1007 / s10800-014-0731-x
CrossRef Полный текст | Google Scholar
Куц, Р. Б., Чен, К., Янг, Х., Саджад, С. Д., Лю, З., и Масел, И. Р. (2017). Sustainion Imidazolium-Functionalized Polymers для CO 2 Электролиз. Энергетика . 5, 929–936. DOI: 10.1002 / ente.201600636
CrossRef Полный текст | Google Scholar
Ли, Х., Оломан, К. (2005). Электровосстановление диоксида углерода в реакторе непрерывного действия. J. Appl. Электрохим . 35, 955–965. DOI: 10.1007 / s10800-005-7173-4
CrossRef Полный текст | Google Scholar
Ли, Х., Оломан, К. (2006). Разработка реактора непрерывного действия для электровосстановления диоксида углерода в формиат. часть 1. Переменные процесса. J. Appl. Электрохим . 36, 1105–1115. DOI: 10.1007 / s10800-006-9194-z
CrossRef Полный текст | Google Scholar
Ли, Х., Оломан, К. (2007). Разработка реактора непрерывного действия для электровосстановления диоксида углерода в формиат.Часть 2. Масштабирование. J. Appl. Электрохим. 37, 1107–1117. DOI: 10.1007 / s10800-007-9371-8
CrossRef Полный текст | Google Scholar
Лю З., Масел Р. И., Чен К., Куц Р., Янг Х., Лутц Д. Р. и др. (2015). Электрохимическое производство синтез-газа из воды и углекислого газа с промышленно важными темпами. J. CO 2 Util . 15, 50–56. DOI: 10.1016 / j.jcou.2016.04.011
CrossRef Полный текст | Google Scholar
Лю, З., Саджад, С. Д., Гао, Ю., Янг, Х., Качур, Дж. Дж., И Масел, Р. И. (2017a). Влияние мембраны на электролизер щелочной воды. Intl. J. Hydrogen Energy 42, 29661–29665. DOI: 10.1016 / j.ijhydene.2017.10.050
CrossRef Полный текст | Google Scholar
Лю З., Саджад С. Д., Гао Ю., Качур Дж. Дж. И Масел Р. И. (2017b). Электролизер на щелочной воде с мембранами Sustainion ™: 1 А / см 2 при 1,9 В с катализаторами из неблагородных металлов. ECS Trans .77, 71–73. DOI: 10.1149 / 07709.0071ecst
CrossRef Полный текст | Google Scholar
Лу, X., Люн, Д. Ю. К., Ван, Х., Люн, М. К. Х., и Сюань, Дж. (2014). Электрохимическое восстановление диоксида углерода до муравьиной кислоты. ChemElectroChem 1, 836–849. DOI: 10.1002 / celc.201300206
CrossRef Полный текст | Google Scholar
Махмуд, М. Н., Машедер, Д., и Харти, К. Дж. (1987). Использование газодиффузионных электродов для высокоскоростного электрохимического восстановления диоксида углерода.I. Восстановление на электродах, пропитанных свинцом, индием и оловом. J. Appl. Электрохим . 17, 1159–1170. DOI: 10.1007 / BF01023599
CrossRef Полный текст | Google Scholar
Масел Р. И., Чен К. (2015). Конверсия углекислого газа в топливо и химикаты. Бока-Ратон, Флорида. Патент США 9 193 593.
Масел Р. И., Чен К., Лю З. и Куц Р. (2017b). Ионпроводящие мембраны. Бока-Ратон, Флорида. Патент США 9,580,824.
Масел, Р.И., Чен, К., Лю, З., и Куц, Р. (2017c). Ионпроводящие мембраны. Бока-Ратон, Флорида. Патент США 9370773.
Масел, Р. И., Чен, К., Лю, З., и Куц, Р. (2016c). Электрохимическое устройство для превращения диоксида углерода в продукт реакции . Бока-Ратон, Флорида. Патент США 9,481,939.
Масел, Р. И., Лю, З., и Саджад, С. (2016b). Электролизеры с анионообменной мембраной показывают 1 А / см 2 при напряжении менее 2 В. ECS Trans . 75, 1143–1145.DOI: 10.1149 / 07514.1143ecst
CrossRef Полный текст | Google Scholar
Масел, Р. И., Ни, Р., Лю, З., Чен, К., Куц, Р., и Левински, К. (2014a). Раскрытие потенциала преобразования CO 2 в топливо и химикаты как экономически жизнеспособный путь к CCR. Energy Proc. 63, 7959–7962. DOI: 10.1016 / j.egypro.2014.11.832
CrossRef Полный текст | Google Scholar
Масел Р. И., Розен Б. А. и Чжу В. (2014b). Устройства и процессы для конверсии диоксида углерода в полезные виды топлива и химикаты. Бока-Ратон, Флорида. Патент США 9,181,625.
Масел, Р. И., Саджад, С. Д., Гао, Ю., Лю, З., и Чен, К. (2017a). Ионпроводящие мембраны . Бока-Ратон, Флорида. Патент США 9849450.
Масел Р. И., Салахи-Хогин А. и Розен Б. А. (2015). Катализаторы электрохимической конверсии диоксида углерода. Бока-Ратон, Флорида. Патент США
Масел, Р. И., Шаджад, С. Д., и Пеллерит, М. Дж. (2017d). Способ изготовления анионообменной мембраны .Бока-Ратон, Флорида. Заявка на патент США 2017/0189898.
Масел Р., Лю З., Чжао Д., Чен К., Лутц Д. и Неренг Л. (2016a). «Преобразование CO 2 в химические вещества с упором на использование возобновляемых источников энергии / ресурсов для стимулирования конверсии» в книге «Коммерциализация продуктов на биологической основе: возможности, проблемы, преимущества и риски» RSC Green Chemistry, № 43 , под редакцией С. Снайдера ( Кембридж: Королевское химическое общество), 215–257. DOI: 10.1039 / 9781782622444-00215
CrossRef Полный текст | Google Scholar
Масел, Р.И., Розен Б. А. (2014). A Смеси катализаторов . Бока-Ратон, Флорида. Патент США 8,956,990.
Пеллерит, М., Каплун, М., Хартманн-Томпсон, К., Левински, К.А., Кунц, Н., Грегар, Н. и др. (2017). Полимерные мембраны, функционализированные имидазолием, для топливных элементов и электролизеров. ECS Trans . 80, 945–956. DOI: 10.1149 / 08008.0945ecst
CrossRef Полный текст | Google Scholar
Плетчер Д. (2015). Катодное восстановление углекислого газа — чего можно реально достичь? Мини-обзор. Electrochem. Commun. 61, 97–101. DOI: 10.1016 / j.elecom.2015.10.006
CrossRef Полный текст | Google Scholar
Плетчер, Д., и Ли, X. (2011). Перспективы щелочных электролизеров с нулевым зазором для производства водорода. Внутр. J. Hydrogen Energy 36, 15089–15104. DOI: 10.1016 / j.ijhydene.2011.08.080
CrossRef Полный текст | Google Scholar
Цяо, Дж., Лю, Ю., Хун, Ф., и Чжан, Дж. (2014). Обзор катализаторов электровосстановления диоксида углерода для производства низкоуглеродистого топлива. Chem. Soc. Ред. . 43, 631–675. DOI: 10.1039 / C3CS60323G
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квадрелли, Э.А., Сенти, Г., Дуплан, Дж. Л., и Ператонер, С. (2011). Переработка углекислого газа: новые крупномасштабные технологии с промышленным потенциалом. ChemSusChem 4, 1194–1215. DOI: 10.1002 / cssc.201100473
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Розен, Б.А., Салехи-Кожин, А., Торсен, М.Р., Чжу, В., Уиппл, П. Дж. А., Кенис, П. Дж. А. и Масел, Р. И. (2011). Опосредованное ионной жидкостью избирательное преобразование CO 2 в CO при низких перенапряжениях. Наука 334, 643–644. DOI: 10.1126 / science.1209786
CrossRef Полный текст | Google Scholar
Розен Б. А., Чжу В., Каул Г., Салехи-Ходжин А. и Масел Р. И. (2013). Водное усиление конверсии CO 2 серебра в тетрафторборате 1-этил-3-метилимидазолия. J. Electrochem.Soc . 160, h238 – h241. DOI: 10.1149 / 2.004303jes
CrossRef Полный текст | Google Scholar
Саджад, С., Гао, Ю., Лю, З., Янг, Х., и Масел, Р. (2017). Настраиваемые высокоэффективные анионообменные мембраныustainion ™ для электрохимических применений. ECS Trans . 77, 1653–1656. DOI: 10.1149 / 07711.1653ecst
CrossRef Полный текст | Google Scholar
Сен, С., Скинн, Б., Холл, Т., Инман, М., Тейлор, Э. Дж., И Брушетт, Ф. Р. (2016). Импульсное электроосаждение оловянных электрокатализаторов на газодиффузионные слои для восстановления диоксида углерода с образованием формиата. MRS Adv. 2, 451–458. DOI: 10.1557 / adv.2016.652
CrossRef Полный текст | Google Scholar
Урсуа А., Гандиа Л. М. и Санчис П. (2012). Производство водорода путем электролиза воды: текущее состояние и будущие тенденции. Proc. IEEE 100, 410–426. DOI: 10.1109 / JPROC.2011.2156750
CrossRef Полный текст | Google Scholar
Vengatesan, S., Santhi, S., Jeevanantham, S., and Sozhan, G. (2015). Кватернизованные анионообменные мембраны из полистирола и винилбензилхлорида для электролизеров щелочной воды. J. Pow. Источники 284, 361–368. DOI: 10.1016 / j.jpowsour.2015.02.118
CrossRef Полный текст | Google Scholar
Уиппл, Д. Т., и Кенис, П. Дж. А. (2010). Перспективы утилизации CO 2 прямым гетерогенным электрохимическим восстановлением. J. Phys. Chem. Lett. 1, 3451–3458. DOI: 10.1021 / jz1012627
CrossRef Полный текст | Google Scholar
Уиппл, Д. Т., Финке, Э. К., и Кенис, П. Дж. А. (2010). Микрожидкостной реактор для электрохимического восстановления диоксида углерода: эффект p H. Electrochem. Solid State Lett. 13, B109 – B111. DOI: 10.1149 / 1.3456590
CrossRef Полный текст | Google Scholar
Уайт, Дж. Л., Херб, Дж. Т., Качур, Дж. Дж., Майстрик, П. В., и Бокарсли, А. Б. (2014). Формирование фотонов: эффективное электрохимическое преобразование солнечной энергии за счет восстановления диоксида углерода. J. CO 2 Util . 7, 1–5. DOI: 10.1016 / j.jcou.2014.05.002
CrossRef Полный текст | Google Scholar
Янг, Х., Качур, Дж.Дж., Саджад, С. Д., и Масел, Р. И. (2017a). Электрохимическое преобразование CO 2 в муравьиную кислоту с использованием мембран сустейон®. J. CO 2 Util . 20, 208–217. DOI: 10.1016 / j.jcou.2017.04.011
CrossRef Полный текст | Google Scholar
Янг, Х., Качур, Дж., Саджад, С. Д., и Масел, Р. И. (2017b). CO 2 Превращение в муравьиную кислоту в трехкамерной ячейке с мембранами сустейон ™. ECS Trans . 77, 1425–1431. DOI: 10.1149 / 07711.1425ecst
CrossRef Полный текст | Google Scholar
Что такое электролиз? — Мини-химия
Электролиз — это химическое осаждение соединения на составляющие его элементы под действием электрического тока.
- Через соединение пропускается постоянный ток (соединение может быть в расплавленном или водном состоянии).
- Электрическая энергия (от постоянного тока) преобразуется в химическую энергию (разложение соединения).
- Одним из распространенных примеров является электролиз воды, когда вода разлагается на водород и кислород.
Видео электролиза воды:
Электролитическая ячейка
Основные компоненты электролитической ячейки: батарея, электролиты, электроды
Положительный полюс батареи соединен с положительным электродом (анодом), а отрицательный полюс батареи соединен с отрицательным электродом (катодом).
Электролиты обычно состоят из ионного соединения в растворе или расплавленном состоянии ИЛИ водных растворов кислот или щелочей.
- Электролиты проводят электричество с разложением на электродах.
- Электролиты можно разделить на три категории: неэлектролиты, слабые электролиты и сильные электролиты.
- Сильные электролиты = много ионов, переносящих заряды от одного электрода к другому. Примеры сильных электролитов: сильные кислоты или щелочи (серная кислота, водный гидроксид натрия), солевые растворы (водный хлорид натрия)
- Слабые электролиты = небольшое количество ионов, переносящих заряды от одного электрода к другому.Примеры слабых электролитов: слабые кислоты или основания (этановая кислота, водный аммиак)
- Неэлектролиты = нет ионов, переносящих заряды от одного электрода к другому. Примеры неэлектролитов: чистая вода, органические жидкости или растворители
Электроды — это проводники, через которые электроны входят в электролит и покидают его.
- Анод — это ПОЛОЖИТЕЛЬНЫЙ (+) электрод, с которого электроны покидают электролит (или электрический ток входит в электролит)
- Катод — ОТРИЦАТЕЛЬНЫЙ (-) электрод, с которого электроны входят в электролит (или электрический ток покидает электролит)
- Электроды обычно состоят из инертных материалов (которые не участвуют в каких-либо окислительно-восстановительных реакциях), таких как углерод, платина, титан или нержавеющая сталь.(ПРИМЕЧАНИЕ: в некоторых случаях электроды подвергаются окислительно-восстановительным реакциям во время электролиза.)
Что происходит во время электролиза?
- Отрицательные ионы (анионы) притягиваются к аноду, а положительные ионы (катионы) притягиваются к катоду.
- Когда ионы достигают своих электродов, они разряжаются. (Они теряют или приобретают электроны и образуют нейтральные атомы)
- Следовательно, на аноде анионы разряжаются за счет потери электронов; в то время как на катоде катионы разряжаются за счет усиления электронов.
Электролиз | Encyclopedia.com
Электролиз воды
Производство натрия и хлора
Производство магния
Производство гидроксида натрия, хлора и водорода
Производство алюминия
Рафинирование меди
Гальваника
Ресурсы
Электролиз процесс, вызывающий химическую реакцию при прохождении электрического тока через вещество или смесь веществ, чаще всего в жидкой форме.Электролиз часто приводит к разложению соединения на элементы. Для проведения электролиза два электрода, положительный электрод (анод) и отрицательный электрод (катод) погружаются в материал, подлежащий электролизу, и подключаются к источнику постоянного (постоянного) электрического тока.
Аппарат, в котором проводится электролиз, называется электролитической ячейкой . Корни -lys и -lyt происходят от греческих lysis и lytos , что означает «разрезать или разлагать»; электролиз в электролитической ячейке — это процесс, при котором вещество может разлагаться.
Электролизуемое вещество должно быть электролитом, жидкостью, содержащей положительные и отрицательные ионы и, следовательно, способной проводить электричество. Есть два вида электролитов. Один вид — это раствор ионного соединения любого соединения, которое производит ионы при растворении в воде, например неорганической кислоты, основания или соли. Другой вид представляет собой сжиженное ионное соединение, такое как расплавленная соль.
В любом виде электролита жидкость проводит электричество, потому что ее положительные и отрицательные ионы могут свободно перемещаться к электродам с противоположным зарядом — положительные ионы к катоду и отрицательные ионы к аноду.Эта передача положительного заряда в одном направлении и отрицательного заряда в противоположном направлении составляет электрический ток, потому что электрический ток, в конце концов, всего лишь поток заряда, и не имеет значения, являются ли носители заряда ионами или электронами. В ионном твердом веществе, таком как хлорид натрия, например, обычно фиксированные ионы становятся свободными для движения, как только твердое вещество растворяется в воде или как только оно плавится.
Во время электролиза ионы движутся к электродам с противоположным зарядом.Когда они достигают своих электродов, они подвергаются химическим окислительно-восстановительным реакциям. На катоде, который накачивает электроны в электролит, происходит химическое восстановление — захват электронов положительными ионами. На аноде, удаляющем электроны из электролита, происходит химическое окисление — потеря электронов отрицательными ионами.
В электролизе существует прямая зависимость между количеством электричества, протекающего через элемент, и количеством протекающей химической реакции.Чем больше электронов перекачивается через электролит аккумулятором, тем больше ионов будет вынуждено отдать или принять электроны, тем самым окисляясь или восстанавливаясь. Чтобы произвести химическую реакцию на один моль, через клетку должен пройти один моль электронов. Моль электронов, то есть 6,02 ← × 10 23 электронов, называется фарадеем . Устройство названо в честь Майкла Фарадея (1791–1867), английского химика и физика, открывшего взаимосвязь между электричеством и химическими изменениями.Ему также приписывают первое использование слов анод , катод , электрод , электролит и электролиз .
Могут быть разработаны различные типы электролитических ячеек для решения конкретных химических задач.
Возможно, самым известным примером электролиза является электролитическое разложение воды с образованием водорода и кислорода:
Поскольку вода является таким стабильным соединением, ученые могут осуществить эту реакцию, только закачивая в нее энергию — в данном случае форма электрического тока.Чистая вода, которая не очень хорошо проводит электричество, должна, во-первых, превратиться в электролит путем растворения в ней кислоты, основания или соли. Затем анод и катод, обычно сделанные из графита или какого-либо нереагирующего металла, такого как платина, могут быть вставлены и подключены к батарее или другому источнику постоянного тока.
На катоде, где электроны закачиваются в воду аккумулятором, они захватываются молекулами воды с образованием газообразного водорода:
На аноде электроны удаляются из молекул воды:
Чистый результат эти две электродные реакции, сложенные вместе, составляют
(обратите внимание, что когда эти два уравнения складываются вместе, четыре иона H + и четыре иона OH — с правой стороны объединяются с образованием четырех ионов H 2 O молекулы, которые затем нейтрализуют четыре из молекул H 2 O в левой части.Таким образом, каждые две молекулы воды разложились на две молекулы водорода и одну молекулу кислорода.
Кислота, основание или соль, превратившие воду в электролит, были выбраны таким образом, чтобы ее конкретные ионы не могли окисляться или восстанавливаться (по крайней мере, при напряжении батареи), поэтому они не вступают в химическую реакцию и служат только для проведения течение через воду. Обычно используется серная кислота, H 2 SO 4 .
Путем электролиза поваренная соль, хлорид натрия, NaCl, может быть разложена на элементы, натрий и хлор.Это важный метод производства натрия. Он также используется для производства других щелочных металлов и щелочноземельных металлов из их солей.
Чтобы получить натрий электролизом, ученые сначала расплавят немного хлорида натрия, нагревая его выше точки плавления 1,474 ° F (801 ° C). Затем в расплавленную соль вставят два инертных (не реагирующих) электрода. Хлорид натрия должен быть расплавлен, чтобы ионы Na + и Cl — могли свободно перемещаться между электродами; в твердом хлориде натрия ионы замораживаются.Наконец, ученые пропустят постоянный электрический ток (DC) через расплавленную соль.
Отрицательный электрод (катод) будет притягивать ионы Na + , а положительный электрод (анод) будет притягивать ионы Cl — , после чего происходят следующие химические реакции.
На катоде, куда закачиваются электроны, они захватываются положительными ионами натрия:
На аноде, где выкачиваются электроны, они отрываются от ионов хлора:
(Хлор атомы немедленно объединяются в двухатомные молекулы, Cl 2 .В результате электричество расщепляет поваренную соль на элементы.
Другое важное применение электролиза — производство магния из морской воды. Морская вода является основным источником этого металла, поскольку она содержит больше ионов магния, чем любого другого металла, кроме натрия. Во-первых, хлорид магния, MgCl 2 , получают путем осаждения гидроксида магния из морской воды и растворения его в соляной кислоте. Затем хлорид магния плавят и подвергают электролизу.Подобно получению натрия из расплавленного хлорида натрия, описанному выше, расплавленный магний осаждается на катоде, а газообразный хлор выделяется на аноде. Общая реакция: MgCl 2 → Mg + Cl 2 .
Гидроксид натрия, NaOH, также известный как щелочь и каустическая сода, является одним из наиболее важных промышленных химикатов. По состоянию на 2004 год только в Соединенных Штатах его ежегодно производили более 25 миллиардов фунтов (11 миллиардов килограммов). Мировое производство в том же году превысило 100 миллиардов фунтов (44 миллиарда килограммов).Основным методом его получения является электролиз рассола или соленой воды, раствора поваренной соли, хлорида натрия в воде. Хлор и водород образуются как ценные побочные продукты.
Когда электрический ток проходит через соленую воду, отрицательные ионы хлора, Cl — , мигрируют к положительному аноду и теряют свои электроны, превращаясь в газообразный хлор.
(Затем атомы хлора объединяются в пары, образуя молекулы Cl 2 .) Между тем ионы натрия Na + притягиваются к отрицательному катоду.Однако они не собирают электроны, чтобы стать атомами металлического натрия, как это происходит в расплавленной соли. Это связано с тем, что в водном растворе сами молекулы воды улавливают электроны легче, чем ионы натрия. Таким образом, на катоде происходит
. Ионы гидроксида вместе с ионами натрия, которые уже находятся в растворе, составляют гидроксид натрия, который может быть восстановлен путем испарения.
Этот так называемый процесс хлорно-щелочной является основой отрасли, которая существует уже более ста лет.С помощью электричества он превращает дешевую соль в ценный хлор, водород и гидроксид натрия. Среди прочего, хлор используется для очистки воды, водород используется для гидрогенизации масел, а щелок используется для производства мыла, промышленных стоков и очистителей для духовок, а также бумаги.
Производство алюминия методом Холла было одним из первых применений электролиза в больших масштабах и до сих пор остается основным методом получения этого очень полезного металла. Чарльз М.Холл, 21-летний студент Оберлин-колледжа в Огайо, который искал способ восстановить оксид алюминия до металла, открыл этот процесс в 1886 году. Алюминий был редкой и дорогой роскошью в то время, потому что металл очень реакционноспособен, и поэтому его трудно восстановить химическими средствами. С другой стороны, электролиз расплавленной соли или оксида алюминия затруднен, потому что соли трудно получить в безводной (сухой) форме, а оксид Al 2 O 3 не плавится до температуры 3762 ° F. (2,072 ° С).
Холл обнаружил, что Al 2 O 3 в форме минерального боксита растворяется в другом минерале алюминия, называемом криолитом, Na 3 AlF 6 , и что полученная смесь может быть легко расплавлена. Когда через эту расплавленную смесь проходит электрический ток, ионы алюминия мигрируют к катоду, где они восстанавливаются до металла:
На аноде ионы оксида окисляются до газообразного кислорода:
Расплавленный металлический алюминий опускается на дно. ячейки и может быть снята.
Обратите внимание, что три моля электронов (три фарада электричества) необходимы для производства каждого моля алюминия, потому что на каждом ионе алюминия есть три положительных заряда, которые должны нейтрализоваться электронами. Следовательно, производство алюминия по процессу Холла требует огромного количества электроэнергии. Переработка банок для напитков и других алюминиевых предметов стала важной мерой энергосбережения.
В отличие от алюминия, металлическую медь довольно легко получить химическим способом из руд.Но с помощью электролиза его можно очистить и сделать очень чистым — до 99,999%. Чистая медь важна для изготовления электрического провода, потому что электропроводность меди снижается из-за примесей. К этим примесям относятся такие ценные металлы, как серебро, золото и платина; когда они удаляются электролизом и восстанавливаются, они имеют большое значение для оплаты счетов за электроэнергию.
При электролитическом рафинировании меди нечистая медь образуется из анода в ванне электролита из сульфата меди, CuSO 4 и серной кислоты H 2 SO 4 .Катод представляет собой лист чистой меди. По мере прохождения тока через раствор положительные ионы меди Cu 2+ в растворе притягиваются к отрицательному катоду, где они захватывают электроны и осаждаются как нейтральные атомы меди, тем самым создавая все больше и больше чистой меди на катод. Между тем, атомы меди в положительном аноде отдают электроны и растворяются в растворе электролита в виде ионов меди. Однако примеси в аноде не переходят в раствор, потому что атомы серебра, золота и платины не так легко окисляются (превращаются в положительные ионы), как окисляется медь.Таким образом, серебро, золото и платина просто падают с анода на дно резервуара, где их можно соскрести.
Еще одно важное применение электролитических ячеек — это гальваника серебра, золота, хрома и никеля. Гальваника позволяет получить тонкое покрытие из этих дорогих металлов на поверхностях более дешевых металлов, чтобы придать им внешний вид и химическую стойкость, как у дорогих.
При серебряном покрытии покрываемый объект (например, ложка) изготавливается из катода электролитической ячейки.Анод представляет собой стержень из металлического серебра, а электролит (жидкость между электродами) представляет собой раствор цианида серебра AgCN в воде. Когда через элемент проходит постоянный ток, положительные ионы серебра (Ag + ) из цианида серебра мигрируют к отрицательному аноду (ложке), где они нейтрализуются электронами и прилипают к ложке как металлическое серебро:
Между тем серебряный анодный стержень отдает электроны, превращаясь в ионы серебра:
Таким образом, анодный стержень постепенно растворяется, пополняя запасы ионов серебра в растворе.В результате металлическое серебро переместилось с анода на катод, в данном случае — на ложку. Этот процесс продолжается до тех пор, пока на ложке не будет достигнута желаемая толщина покрытия — обычно всего несколько тысячных дюйма — или пока серебряный слиток полностью не растворится.
При гальванике с серебром цианид серебра используется в электролите, а не другие соединения серебра, такие как нитрат серебра, AgNO 3 , потому что ион цианида, CN — , реагирует с ионом серебра, Ag + , с образованием комплексного иона Ag (CN) 2 — .Это ограничивает поступление свободных ионов Ag + в раствор, поэтому они могут осаждаться на катоде только постепенно. Это обеспечивает более блестящее и прочное серебряное покрытие. Золочение
КЛЮЧЕВЫЕ УСЛОВИЯ
Комплексный ион — Большой ион, состоящий из более мелких ионов, объединенных друг с другом или с другими атомами или молекулами
Фарадея — Единица электрического заряда, равная количеству заряд переносится одним мольом электронов. Один фарадей равен 96 485 кулонам.
Окисление — Процесс, при котором степень окисления атома увеличивается за счет потери одного или нескольких электронов.
Восстановление — Процесс, при котором степень окисления атома снижается за счет получения одного или нескольких электронов.
выполняется примерно так же, с использованием золотого анода и электролита, содержащего цианид золота, AuCN.
КНИГИ
Чанг, Раймонд. Химия . Бостон, Массачусетс: McGraw-Hill, 2002.
Муг, Ричард Сэмюэл. Химия: справочник . Нью-Йорк: Wiley, 2005.
Tro, Nivaldo J. Introductory Chemistry . Верхний Сэдл-Ривер, Нью-Джерси: Pearson Education, 2006.
Роберт Л. Уолке
Электролиз и гальваника — химия для детей
Что такое электролиз?
Вы, должно быть, слышали, что такие металлы, как железо и медь, добываются из железных и медных руд. Электролиз — это процесс отделения или извлечения металла из руды.Электрический ток пропускается через электролит / раствор руды, что приводит к химическим изменениям.
Это химическое изменение таково, что вещество теряет или приобретает электрон. Этот процесс известен как электролиз.
Что такое гальваника?
Гальваника — это практическое применение электролитических ячеек. При этом тонкий слой металла наносится на электропроводящую поверхность. В гальванике идея состоит в том, чтобы использовать электричество для покрытия или покрытия относительно расточного металла тонким слоем другого драгоценного металла, чтобы он выглядел дорого.
Расточный металл, такой как медь, может быть покрыт тонким слоем золота или серебра, и это гальваника. Даже при гальванике требуется пропускать электрический ток через раствор, называемый электролитом, и покрываемый металл погружается в электролит.
Процесс электролиза
Электролиз требует двух противоположно заряженных полюсов. Катод заряжен отрицательно; это место восстановления положительных ионов. Анод заряжен положительно; это место окисления отрицательных ионов.В электролитической ячейке эти два полюса подключены к внешнему источнику питания. Цепь обычно замыкается солевым раствором, называемым электролитом. При производстве металла электролизом на катоде образуется слой металла.
Газообразный водород и газообразный кислород отделяются от воды аналогичным образом.
Процесс гальваники
Гальваника включает пропускание электрического тока через раствор, называемый электролитом. Это делается путем погружения двух электродов в электролит и подключения его к постоянному току.
Если мы покрываем медью немного латуни, нам понадобится медный электрод, латунный электрод и раствор соединения на основе меди, например, раствор сульфата меди.
Мы окунаем два электрода в раствор и соединяем их в цепь, так что медь становится положительным электродом (или анодом), а латунь — отрицательным электродом (или катодом). Когда мы включаем питание, раствор сульфата меди расщепляется на ионы. Положительно заряженные ионы меди притягиваются к отрицательно заряженному латунному электроду и медленно осаждаются на нем, создавая тонкую медную пластину на латунном предмете, на который нужно нанести покрытие.
Для чего нужен электролиз?
- Электролиз используется в производстве таких металлов, как алюминий, натрий, кальций, магний; или даже очистка металлов, таких как медь, золото и серебро.
- В наши дни электролиз воды используется для производства водорода для топлива или выработки электроэнергии с использованием топливных элементов.
- Наша повседневная жизнь была бы очень сложной без электролиза. Пример: щелочь, используемая для изготовления мыла, получается в процессе электролиза.
- Знаете ли вы, что космонавты и люди, которые живут на подводных лодках, получают кислород в процессе электролиза?
Каковы применения гальваники?
- Металлы, такие как золото и серебро, покрываются гальваническим покрытием для украшения. Дешевле иметь позолоченные или посеребренные украшения, чем чистые золотые или серебряные украшения.
- Затем у нас есть металлы, такие как олово или цинк, на которые наносится защитный слой. Это делает такие металлы устойчивыми к коррозии.
- Гальваника также используется для увеличения толщины слоя в металлах. Гальваника металла обеспечивает защиту от коррозии, износостойкость и смазывающую способность.

