ЛЕКЦИЯ № 10. Гальванические элементы. Физическая химия: конспект лекций
Читайте также
ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ
ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ Периодическая система природных элементов, как известно, обрывается на 92-м члене. Самым тяжелым природным элементом является уран. Ни на Земле, ни в приходящих из космоса метеоритах никто не находил каких-либо заметных следов более тяжелых
1. Элементы молекулярно-кинетической теории
1. Элементы молекулярно-кинетической теории Науке известно четыре вида агрегатных состояний вещества: твердое тело, жидкость, газ, плазма. Переход вещества из одного состояния в другое называют фазовым переходом. Вода, как известно, существует в трех агрегатных
ЛЕКЦИЯ № 2. Химическая термодинамика
ЛЕКЦИЯ № 2. Химическая термодинамика
Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.Термодинамика – наука о макросистемах.Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические
Химическая термодинамика
Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.Термодинамика – наука о макросистемах.Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические
ЛЕКЦИЯ № 3. Растворы
ЛЕКЦИЯ № 3. Растворы 1. Общая характеристика растворов Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной
ЛЕКЦИЯ № 4. Катализ
ЛЕКЦИЯ № 4. Катализ 1. История открытия явления катализа
Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К.
ЛЕКЦИЯ № 6. Химическая кинетика
ЛЕКЦИЯ № 6. Химическая кинетика 1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций.Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице
ЛЕКЦИЯ № 7. Коррозия металлов
ЛЕКЦИЯ № 9. Термохимия
ЛЕКЦИЯ № 9. Термохимия 1. Понятие термохимии
Раздел физической химии и химической термодинамики, изучающий тепловые процессы теплоемкости веществ, называется термохимией. ?Q = dU + ?A– первый закон термодинамики. ?Q – не является функцией состояния. P = const || V = const – функции
?Q = dU + ?A– первый закон термодинамики. ?Q – не является функцией состояния. P = const || V = const – функции
ЛЕКЦИЯ № 11. Электрохимия
ЛЕКЦИЯ № 11. Электрохимия 1. Понятие электрохимии Электрохимия – раздел физической химии, который рассматривает системы, содержащие ионы (растворы или расплавы электролитов) и процессы, протекающие на границе двух фаз с участием заряженных частиц.Первые представления о
ЛЕКЦИЯ № 12. Теоретическая электрохимия
ЛЕКЦИЯ № 12. Теоретическая электрохимия 1. Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится
ЛЕКЦИЯ № 13. Электрохимическая кинетика
ЛЕКЦИЯ № 13. Электрохимическая кинетика 1. Основные кинетические характеристики и методы их расчетов
i0 – ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см2
Электрохимическая кинетика 1. Основные кинетические характеристики и методы их расчетов
i0 – ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см2
Спектрограф обнаруживает неизвестные элементы
Спектрограф обнаруживает неизвестные элементы Спектрограф стал незаменимым помощником химика.До появления спектрографа существовали элементы, которые скрывались от глаз химика, от его приборов, от его средств исследования. Чувствительность тех средств исследования,
I. Химические элементы
I. Химические элементы
1. Количество элементов. Периодическая система элементов Менделеева.В отличие от химических соединений, которых в природе существует очень много (3,5 тыс. соединений из общего количества 300 тыс. , известных нам на сегодняшний день), количество простых
, известных нам на сегодняшний день), количество простых
Элементы
Гальванический элемент химический — Справочник химика 21
Если металлические части двух электродов 1 и 2 с различными электродными потенциалами (ф1 ф фа) соединить электронным (металлическим) проводником электрического тока, а их растворы соединить ионным проводником (электролитическим ключом), то по проводнику начнет двигаться поток электрических зарядов (заряженных частиц), а на электродах будут происходить самопроизвольные окислительно-восстановительные реакции.
Различают гальванические элементы химические, у которых э. д. с. возникает вследствие различной химической природы электродов (см. раздел XII. 6), и концентрационные, у которых э. д. с. возникает вследствие [c.144]
В этом случае процессы в гальваническом элементе протекают бесконечно медленно и бесконечно малого изменения внешней разности потенциалов достаточно для того, чтобы электродные процессы стали протекать в обратном направлении. Это означает, что при указанных условиях как электродные процессы, так и реализуемая в гальваническом элементе химическая реакция проводятся обратимо.
В гальваническом элементе химическая энергия превращается в электрическую. Например, в элементе Якоби—Даниэля, состоящем из цинкового и медного электродов, который схематически можно записать [c. 49]
49]
В этом случае бесконечно малого изменения внешней разности потенциалов достаточно для того, чтобы электродные процессы стали протекать в обратном направлении. Это означает, что при указанных условиях как электродные процессы, так и реализуемая в гальваническом элементе химическая реакция проводятся обратимо.
Гальванический элемент. Химические и концентрационные [c.168]
При работе гальванического элемента химическая энергия реакции превращается в электрическую. Если химическая реакция в гальваническом элементе протекает обратимо, то получаемая работа будет максимальной. Это позволяет использовать электродвижущую силу гальванического элемента для определения изменения свободной энергии Гиббса АС проходящей в нем реакции.
Химические процессы всегда сопровождаются рядом физических явлений. Например, при сгорании магния выделяется много света, при сгорании бензина —много тепла. В гальванических элементах химические процессы являются источником электрической [c.5]
В гальванических элементах химические процессы являются источником электрической [c.5]
Понятие о гальваническом элементе. В гальваническом элементе химическая энергия преобразуется в электрическую за счет электронных, т. е. окислительно-восстановительных, реакций. В гальванических элементах реакции получения электрического тока проводятся таким образом, чтобы процесс окисления и процесс восстановления протекали раздельно (на разных электродах). Это и приводит к тому, что на электродах гальванического элемента поддерживается разность потенциалов, определяющая собой электродвижущую силу (э. д. с.) элемента.
Для того чтобы уяснить себе, каким путем в гальванических элементах химическая энергия превращается в электрическую, необходимо рассмотреть процессы, протекающие на отдельных электродах элемента., [c.316]
Система металл, опущенный в раствор его соли , называется электродом, в этой системе осуществляются многие процессы, в частности таковы процессы в гальванических элементах (химических источниках тока).
Преобразование энергии реакций (химической) в электрическую осуществляется в устройствах, называемых химическими источниками тока или гальваническими элементами. Химические же превращения за счет внешней электрической энергии происходят в электролитических ваннах, или электролизерах. [c.235]
Два электрода вместе с электролитическим ключом составляют гальванический элемент — химический источник тока, способный преобразовать энергию химической реакции в электрическую. [c.208]
Так, при разложении воды, солей, щелочей и кислот электрическим током происходит переход электрической энергии в химическую. В гальванических элементах химическая энергия превращается в электрическую. В аккумуляторах при их зарядке происходит переход электрической энергии в химическую, а при разряжении химическая энергия переходит в электрическую. Переход одного вида энергии в другой происходит в строго эквивалентных отношениях, например, 1 ккал эквивалентна 4,182 10 или 4,182 кдж. [c.10]
Переход одного вида энергии в другой происходит в строго эквивалентных отношениях, например, 1 ккал эквивалентна 4,182 10 или 4,182 кдж. [c.10]
Гальванический элемент представляет собой систему, состоящую из проводников первого (металлы) и второго (электролиты) рода, находящихся в контакте друг с другом. На границах раздела различных проводников, например металл—раствор, создаются скачки потенциалов (в дальнейшем—потенциалы), в результате чего в гальваническом элементе возникает электродвижущая сила. При работе гальванического элемента химическая энергия реакции, протекающей в нем, переходит в электрическую энергию. Если химическая реакция протекает в элементе обратимо, то и сама цепь будет обратимой, а получаемая при этом работа—максимальной. [c.280]
При -протекающих в соответствующих устройствах (гальванический элемент) химических реакциях, приводящих к изменению заряда частиц различного вида (окислительновосстановительные реакции), возникает электродвижущая сила (э. д.с.) химическая энергия превращается в электрическую. Протекание реакции в обратном направлении может быть достигнуто приложением достаточно высокой разности потенциалов к электродам электролитической ячейки (электролиз) в этом случае электрическая энергия превращается в химическую. [c.486]
д.с.) химическая энергия превращается в электрическую. Протекание реакции в обратном направлении может быть достигнуто приложением достаточно высокой разности потенциалов к электродам электролитической ячейки (электролиз) в этом случае электрическая энергия превращается в химическую. [c.486]
В гальванических элементах химические реакции окисления и восстановления протекают раздельно — в различных сосудах, называемых полуэлементами, в которых наблюдается подвижное равновесие, [c.164]
Химические процессы всегда сопровождаются рядом физических явлений. Например, при сгорании магния выделяется много света, при сгорании бензина — много тепла. В гальванических элементах химические процессы являются источником электрической энергии и т. д. Изучение этих явлений также представляет одну из важных задач химии. [c.5]
Аккумуляторами называются гальванические элементы, химическая реакция в которых обратима. Мы имеем здесь в виду не термодинамическую обратимость протекания реакции при работе аккумулятора, а возможность регенерирования электродов и электролита пропусканием тока в обратном направлении. В абсолютном большинстве гальванических элементов регенерация продуктов работы элемента и вторичное использование его оказываются практически невозможными такие элементы перестают быть источниками тока, когда реакция достигает состояния равновесия. [c.32]
В абсолютном большинстве гальванических элементов регенерация продуктов работы элемента и вторичное использование его оказываются практически невозможными такие элементы перестают быть источниками тока, когда реакция достигает состояния равновесия. [c.32]
Если пользоваться языком кинетической теории, то эту мысль можно выразить следующим образом. В гальванических элементах химическую энергию (потенциальную и кинетическую энергии упорядоченного движения частиц, соответствующего данной структуре) не нужно вначале полностью превращать в энергию хаотического движения, чтобы потом и лишь ценою огромных потерь хотя бы частично упорядочить движение частиц и, следовательно, получить работу. [c.131]
Будучи качественно различными, формы движения материи могут переходить одна в другую. Так, от сильного трения тела нагреваются и, следовательно, механическое движение переходит в тепловое. В гальваническом элементе химическое движение превращается в движение электронов. Эти переходы свидетельствуют о единстве и непрерывной связи многообразных форм движения материн, о взаимосвязи явлений в природе. [c.3]
Эти переходы свидетельствуют о единстве и непрерывной связи многообразных форм движения материн, о взаимосвязи явлений в природе. [c.3]
Различают два основных типа гальванических элементов химические и концентрационные. Химические цепи. В этих гальванических цепях электроды различны по природе. [c.131]
Термодинамика гальванического элемента. При работе гальванического элемента химическая энергия частично или полностью переходит в электрическую работу. Получаемая работа А при T = onst и p= onst будет максимальной полезной работой. [c.301]
Содержатся в выбросах производств марганца, марганцевой стали, сухих гальванических элементов, химических, пигментов, стекла, резинотехнических изделий, лаков и красок, окислителей, катализаторов, металлургических. [c.79]
Физик А. Вольта, анализируя опыты Гальвани, пришел к выводу, что электрическая энергия, приводящая к сокращению мышц лягушек, возникает в месте соединения двух металлов. На основании своих представлений А. Вольта в 1779 г. создал первый источник химической энергии — вольтов столб, состоящий из ряда медных и цинковых кружков, разделенных смоченными кислотой суконными прокладками. Теория Вольта, со стоящая в том, что электрическая энергия возникает в месте контакта 2-х металлов, долго держалась в науке. Ошибочность теории Вольта показал в 1872 г. Ф. Энгельс. Основываясь на законе сохранения энергии, он пришел к выводу, что источником электрической энергии являются протекающие в гальваническом элементе химические реакции. [c.10]
На основании своих представлений А. Вольта в 1779 г. создал первый источник химической энергии — вольтов столб, состоящий из ряда медных и цинковых кружков, разделенных смоченными кислотой суконными прокладками. Теория Вольта, со стоящая в том, что электрическая энергия возникает в месте контакта 2-х металлов, долго держалась в науке. Ошибочность теории Вольта показал в 1872 г. Ф. Энгельс. Основываясь на законе сохранения энергии, он пришел к выводу, что источником электрической энергии являются протекающие в гальваническом элементе химические реакции. [c.10]
Электрохимическая система, в которой происходит преобразование химической энергии в адектрическую, называется гальваническим элементом Если в гальваническом элементе химическая реакния протекает обратимо, то она может произвести максимальную работу Лтах. которая в [c.60]
В гальваническом элементе химическая энергия превращается в электрическую образующиеся вещества менее энергоемки, чем исходнь. е. В электролизере, наоборот, электрическая энергия превращается в химическую образующиеся вещества более энергоемки, чем исходные. [c.222]
е. В электролизере, наоборот, электрическая энергия превращается в химическую образующиеся вещества более энергоемки, чем исходные. [c.222]
Устройство, схематически изображенное на рис. 6.1, называют гальваническим элементом, а каждый из сосудов, содержащий раствор и платиновую пластину, — электродом или полуэлемеитом, хотя собственно электродом часто называют платиновую или другую пластину, служащую проводником электронов. При проведении реакции в гальваническом элементе химическая энергия превращается в электрическую. Электродвижущая сила ЭДС гальванического элемента может быть измерена с помощью потенциометра. Она непосредственно характеризует способность электронов данного восстановителя переходить к данному окислителю. [c.105]
Будем рассматривать только самопроизвольно протекающие химические реакции, для которых Е>0. Электрохимические цепи такого вида называют гальваническими элементами. Если химическая реакция, протекающая в гальваническом элементе, может быть только экзотермической (АЯсО). Поскольку при ее протекании энтропия уменьшается (Д5работа гальванического элем та должна сопровождаться выделением теплоты. Следовательно, в условиях теплоизоляции электрохимическая система будет нагреваться. Таким образом, при работе гальванического элемента в условиях йЕ/йТэлектрическая работа пЕЕ и выделяется теплота в количестве пРТ АЕ/АТ. Если АЕ/йТ= = 0, то реакция также может быть только экзотермической (АЯработа гальванического элемента, совершаемая за счет убыли энтальпии, не должна сопровождаться тепловыми эффектами. Если с1 /с17>0, то протекающая в гальваническом элементе химическая реакция сопровождается ростом энтропии А5>0. Поэтому при работе такого элемента происходит поглощение теплоты из окружающей среды. Если же электрохимическая цепь изолирована, то она охлаждается. При условии АЕ/йТ О химическая реакция в элементе может быть как экзотермической, так и эндотермической. Если АЯсО, то электрическая работа совершается за счет убыли энтальпии и за счет энтропийного члена 7 d /d7 >0.
Поскольку при ее протекании энтропия уменьшается (Д5работа гальванического элем та должна сопровождаться выделением теплоты. Следовательно, в условиях теплоизоляции электрохимическая система будет нагреваться. Таким образом, при работе гальванического элемента в условиях йЕ/йТэлектрическая работа пЕЕ и выделяется теплота в количестве пРТ АЕ/АТ. Если АЕ/йТ= = 0, то реакция также может быть только экзотермической (АЯработа гальванического элемента, совершаемая за счет убыли энтальпии, не должна сопровождаться тепловыми эффектами. Если с1 /с17>0, то протекающая в гальваническом элементе химическая реакция сопровождается ростом энтропии А5>0. Поэтому при работе такого элемента происходит поглощение теплоты из окружающей среды. Если же электрохимическая цепь изолирована, то она охлаждается. При условии АЕ/йТ О химическая реакция в элементе может быть как экзотермической, так и эндотермической. Если АЯсО, то электрическая работа совершается за счет убыли энтальпии и за счет энтропийного члена 7 d /d7 >0.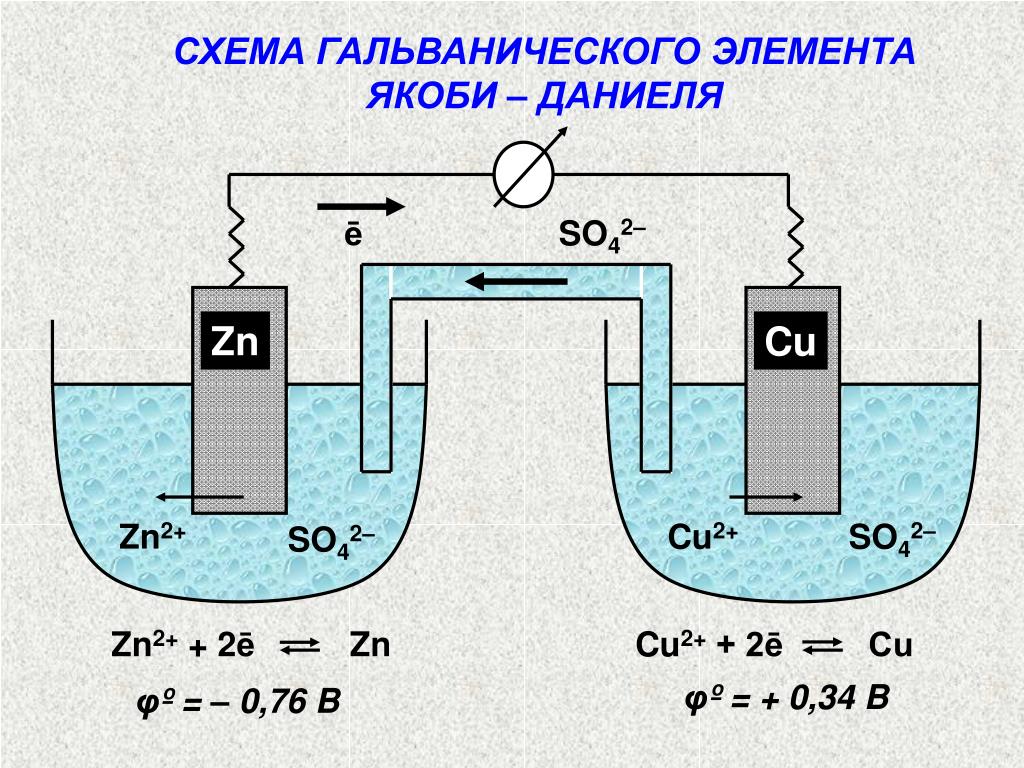 Если АЯ=0, то электрическая работа совершается только за счет роста энтропии в системе. Обычный путь использования химической энергии реакции через выделяющуюся теплоту здесь невозможен, так как тепловой эффект равен нулю. Наконец, если реакция эндотермическая (АЯ>0), но ТАЕ/йТ>АН/пР, то согласно уравнению (VI.24) от гальванического элемента можно получить работу. В этих условиях за счет энтропийного фактора (т. е. за счет роста энтропии системы) не только совершается электрическая работа, но и увеличивается энтальпия системы. Электрохимические цепи, от- [c.121]
Если АЯ=0, то электрическая работа совершается только за счет роста энтропии в системе. Обычный путь использования химической энергии реакции через выделяющуюся теплоту здесь невозможен, так как тепловой эффект равен нулю. Наконец, если реакция эндотермическая (АЯ>0), но ТАЕ/йТ>АН/пР, то согласно уравнению (VI.24) от гальванического элемента можно получить работу. В этих условиях за счет энтропийного фактора (т. е. за счет роста энтропии системы) не только совершается электрическая работа, но и увеличивается энтальпия системы. Электрохимические цепи, от- [c.121]
Для химической реакции в целом происходит взаимосвязанное изменение масс всех компонентов, ( Лхим = 2ц1 — полная работа перемещения масс. Роль п,- — числа молей -го компонента вещества ясна это субстрат переноса. В связи с тем, что ц непосредственно измерить невозможно, необходимо найти способы его вычисления. В частном случае для гальванического элемента химическая работа равна электрической Лхим= эл=—zFE, где Е — мера величины Ац = Цкон—Цисх- В общем случае нет экспериментальных способов измерения р. , но есть способ расчета этой величины. Расчет ц связан с вычислением энергии и энтропии каждого компонента системы. Если величину Р. нельзя измерить, единственный путь — рассчитать ее, пользуясь фундаментальным уравнением Гиббса [c.71]
, но есть способ расчета этой величины. Расчет ц связан с вычислением энергии и энтропии каждого компонента системы. Если величину Р. нельзя измерить, единственный путь — рассчитать ее, пользуясь фундаментальным уравнением Гиббса [c.71]
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ, химические источники тока, состоящие из одной гальванич. ячейки. В состав такой ячейки входит ионпроводящий электролит, два разнородных электрода и реагенты (о принципе действия см. Химические источники тока). В нек-рых случаях электрохимически активный материал электрода может служить реагентом. Г. э. используют как самостоят. источники электрич. энергии или как составные части гальванич. батареи. Г. э. бывают одноразового использования (см. Первичные элементы), многократного действия (см. Аккумуляторы) и с непрерывной подачей реагентов (см. Топливные элементы). Ранее термин — Г. э. относился только к первичным элементам. [c.119]
Различают гальванические элементы ]химические, у которых э. д.с. возникает вследствие различной «химйчёсКЬй природы электродов, и концентрационные, у которых э.д.с. возникает вследствие а) различных активностей электродных растворов, [c.184]
д.с. возникает вследствие различной «химйчёсКЬй природы электродов, и концентрационные, у которых э.д.с. возникает вследствие а) различных активностей электродных растворов, [c.184]
Химические источники электрического тока. Различные виды энергии, необходимые человеку, часто получают из химической энергии, освобождающейся в результате реакций. Превращение хт -мической энергии в теплоту происходит наиболее просто. Оно может быть осуществлено простым сисиганием различных вещеегз на воздухе. Значительно сложнее химическую энергию превращать в электрическую На тепловых электростанциях химическая энергия, содержащаяся в угле или нефти, путем сжигания последних превращается в тепловую, которая при помощи тепловых двигателей превращается в электрическую. Принципиально в гальванических элементах химическая энергия. мо кет превращаться в электрическую с коэффициентом полезного действия (сокращенно к. п. д.), равным 100%. На практике к. п. д., конечно, ниже, но все же достигает У0 о. На тепловых электростанциях значения к. п. д. составляют около 35%. [c.245]
На тепловых электростанциях значения к. п. д. составляют около 35%. [c.245]
Будучи качественно различными, формы движения материи могут переходить одна в другую. Так, от сильного трения тела нагреваются и, следов1ательно, механическое движение переходит в тепловое. В гальваническом элементе химическое движение превращается в движение электронов. Эти переходы свидетель- [c.3]
Электрохимические методы электродвижущие силы гальванических элементов (химических, концентрационных и цепей Якоби — Даниеля) напряжение разложения вольтаметрия амперометрия кулонометрия хронопотенциометрия полярография. [c.37]
При первом методе для какой-либо расплавленной солевой системы строят обратимо работающую химическую гальваническую цепь. Например, для определения потенциала разложения системы I b — КС1 надо построить гальванический элемент (химическую цепь) [c.53]
Гальванический элемент — Справочник химика 21
Стандартные потенциалы дают представления о возможном направлении окислительно-восстановительных химических реакций, однако в реальных условиях это направление может быть иным по следующим причинам.
 Окислительно-восстановительные системы, в зависимости от скорости реакций, протекающих на электродах, подразделяются на обратимые и необратимые. Стандартные потенциалы обратимых систем измерены непосредственно описанным выше способом, тогда как стандартные потенциалы необратимых систем в большинстве случаев находят путем термодинамических расчетов. Вследствие этого на практике их величины оказываются иными, так как на них оказывают большое влияние многие факторы. Например, для необратимых систем не наблюдается закономерного изменения потенциала в соответствии с изменением концентрации компонентов системы, и расчеты, проведенные с использованием стандартных окислительных потенциалов и концентраций компонентов, носят скорее иллюстративный характер, чем отвечают действительным данным. Поэтому гораздо большее практическое значение имеют формальные (реальные) потенциалы окислительно-восстановительных систем. Формальные потенциалы ( ф) находят, измерением э. д. с. гальванического элемента, в котором начальные концентрации компонентов окисли- [c.350]
Окислительно-восстановительные системы, в зависимости от скорости реакций, протекающих на электродах, подразделяются на обратимые и необратимые. Стандартные потенциалы обратимых систем измерены непосредственно описанным выше способом, тогда как стандартные потенциалы необратимых систем в большинстве случаев находят путем термодинамических расчетов. Вследствие этого на практике их величины оказываются иными, так как на них оказывают большое влияние многие факторы. Например, для необратимых систем не наблюдается закономерного изменения потенциала в соответствии с изменением концентрации компонентов системы, и расчеты, проведенные с использованием стандартных окислительных потенциалов и концентраций компонентов, носят скорее иллюстративный характер, чем отвечают действительным данным. Поэтому гораздо большее практическое значение имеют формальные (реальные) потенциалы окислительно-восстановительных систем. Формальные потенциалы ( ф) находят, измерением э. д. с. гальванического элемента, в котором начальные концентрации компонентов окисли- [c.350]Электрохимия имеет очень больщое значение, так как закономерности электрохимии являются теоретической основой для разработки важных технических процессов — электролиза и электросинтеза, т. е. получения химических продуктов на электродах прн прохождении тока через растворы (получение хлора и щелочей, получение и очистка цветных и редких металлов, электросинтез органических соединений). Важной областью практического применения электролиза является гальванотехника (электропокрытие металлами и получение металлических матриц). Другая важная область техники, в основе которой лежат электрохимические процессы, — это создание химических источников тока (электрохимических или так называемых гальванических элементов, в том числе аккумуляторов), в которых [c.383]
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов — двойной вертикальной чертой. Например, схема гальванического элемента, в [c.176]
Стандартный потенциал пары Сс1 /Сс1 правей —0,40 в. Какие электрохимические процессы будут происходить при работе гальванического элемента, построенного из этой пары и нормального водородного электрода Составьте общее уравнение реакции. [c.376]
Если через электрохимическую систему проходит измеримый электрический ток Л оиа перестает быть термодинамически обратимой и в завнсимости от направления тока превращается либо в гальванический элемент (э), либо в электролитическую ванну (в). Полезная работа, произведенная системой в необратимых условиях, всегда меньше, чем в состоянии равновесия. Электрическая энергия, генерируемая гальваническим элементом за счет протекания в ней электрохимической реакции, будет поэтому при отборе тока I меньше, чем в состоянии равновесия (т. е. нри / = 0) [c.22]
Непосредственно измерить разность потенциалов между металлом и раствором очень трудно,но легко измерить разность потенциалов между двумя такими системами, соединив их в гальванический элемент (рис. 56). Любой гальванический элемент состоит из двух полуэлементов, каждый из которых представляет собой окислительно-восстанови- [c.345]
Е — электродвижущая сила обратимого гальванического элемента в стандартных условиях ) [c.102]
Возникновение электрохимии как науки связано с именами Гальвани, Вольта и Петрова, которые на рубеже XVHI и XIX веков открыли и исследовали электрохимические (гальванические) элементы. Деви и Фарадей в первые десятилетия XIX века изучали электролиз. Быстрое развитие электрохимии в конце XIX века связано с появлением теории электролитической диссоциации Аррениуса (1887) и с работами Нернста по термодинамике электродных процессов. Теория Аррениуса развита Дебаем и Гюккелем (1923), которые разработали электростатическую теорию. [c.384]
Оно должно быть больше, чем разность потенциалов между анодом и катодом, иначе говоря, возникающей э. д. с. гальванического элемента (т. е. больше величины электрохимической поляризации). [c.428]
Выше был рассмотрен процесс электролиза, вызываемый внешней э. д. с. источника тока. Наличие источника тока не является, однако, обязательным. Можно провести электролиз так, чтобы анализируемый раствор с погруженными в него электродами представлял собой гальванический элемент с собственным током, за счет которого и происходит электролитическое осаждение определяемого металла на взвешенном катоде. [c.448]
Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). [c.598]
Каждая пара имеет определенный окислительно-восстанови-тельный потенциал и представляет собой полуэлемент. Когда два полуэлемента соединяют проводником первого рода, образуется гальванический элемент, имеющий собственную электродвижущую силу (э. д. с.). Направление этой э. д. с. противоположно той внеш ней э. д. с., которую прилагают при электролизе. Действительно например при электролизе 1 М раствора U I2 потенциал образую щейся у катода пары u +/ u равен стандартному потенциалу ее т. е. +0,34 в (поскольку концентрация Си -ионов равна I г-ион/л а концентрация твердой фазы Си постоянна), потенциал пары I2/2 I равняется +1,36 в, когда раствор становится насыщенным относительно СЬ при давлении его в 1 атм. Как известно, пара с меньшим потенциалом ( u V u) отдает в цепь электроны. Следовательно, при работе возникающего в результате электролиза гальванического элемента на электроде происходит процесс Си—2е- Си +. При этом медь растворяется, окисляясь до Си -+. [c.427]
В таком цикле Карно гальванический элемент при известной температуре поглощает теплоту нагревателя и производит электрическую работу. Последняя может быть затрачена на поднятие тяжести и таким образом сохранена как потенциальная механическая энергия. Заставляя затем элемент работать в условия идеальной тепловой изоляции, можно адиабатно понизить (или г.о-высить) его температуру, после чего, используя сохраненную работу, можно провести химическую реакцию в элементе в обратном направлении, при ином значении электродвижущей силы, а затем адиабатно довести элемент до первоначальной температуры. [c.81]
Измерение ЭJ[eI тp о движущей силы гальванического элемента с последующим расчетом свободной энергии реакции по уравнению [c.102]
В этих условиях корродирующий технический цинк представляет собой совокупность гальванических микроэлементов, в каждом из которых железо является положительным полюсом, а анодно растворяющийся цинк — отрицательным. Коррозию такого технического металла можно на этом осг овании рассматривать как результат действия локальных гальванических элементов. [c.496]
НО погруженный в электролит, выступая в роли активного катода, поддерживает функционирование гальванического элемента в целом, приводя к значительным разрушениям электрода, находящегося в объеме электролита. Аналогичные результаты были получены на бронзовых электродах при испытании в различных топливах и модельных системах (в водных растворах органических и сульфокислот). [c.286]
При определении стандартного потенциала какой-либо данной пары, например Fe VFe2+, ее комбинируют со стандартным водородным электродом в гальванический элемент, как показано на рис. 56. [c.346]
Для этого требуется разработка гальванических элементов, в которых реакции окисления топлива и восстановления кислорода протекают электрохимическим путем. Первые попытки создать такие топливные элементы оказались неудачны1к1и из-за очень малой скорости реакции электрохимического 01видов топлива. Лишь в последние годы в результате применения различных катализаторов и усовершенствования конструкции элементов удалось создать первые удовлетворительно работающие лабораторные макеты топливных элементов, использующих газообразное топливо. Наиболее реакционноспособным видом топлива является водород. Водородно-кислородные элементы обычно изготовляют с применением мелкопорисТых угольных или никелевых электродов, погруженных в шелочной раствор электролита. Схематически такой элемент можио представить в виде [c.603]
Изменение свободной энергии можно определить, проводя реакцию в гальваническом элементе. Изменение энтальпии ДЯ рассчитывается по энтальпиям образования веществ, участвующих в реакции, или по виду или типу связей между атомами в молекулах этих веществ. [c.14]
Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникнет направленное перемещение электронов —электрический ток. При этом энергия химической окислительно-восстановительной реакции превращается в электрическую энергию. Устройства, в которых происходит такое превращение, называются химическими источниками электрической энергии, или гальваническими элементами. [c.176]
Алгебраическая сумма окислительно-восстановительных потенциалов частных реакций определяет электродвижущую силу гальванического элемента и в рассматриваемом случае [c.223]
Схема гальванического элемента [c.223]
Напряжение / для неравновесных электрохимических систем отличается от обратимой э.д.с. В. Напряжение гальванических элементов нри этом меньше, а напряжение на электрохимиче- [c.277]
Наиболее часто в химической термодинамике рассматривается работа электрического тока гальванического элемента А =гРЕ (Е—электродвижущая сила, число Фарадея и г—число грамм-эквивалентов). Величина А охватывает также работы поднятия тяжести, увеличения поверхности фазы и др. [c.117]
Прохождение электрического тока через электрохимическую систему связано ке только с соответствующими химическими превращениями, но и с изменением ее электрических характеристик, прежде всего э.д.с. и электродных потенциалов, ио сравиенпю с их исходными значениями в отсутствие тока. При этом если электрохимическая система является электролизером (электролитической ванной), то напряжение на ней при данной силе тока будет больше обратимой э.д.с. той же системы E (j)>E, и наоборот, если электрохимическая система генерирует ток, т. е. является химическим источником тока — гальваническим элементом или аккумулятором, то его внешнее напряжение будет меньше, чем э.д.с. Еа 1)[c.287]
Если металлы погружены не в нулевые растворы, то на границах электродов с раствором возникают, кроме того, ионные двойные электрические слои. Таким образом, измеряемая э.д.с. гальванического элемента с двумя электродами и без диффузионных потенциалов между жидкими растворами складывается из контактного (вольта) потенциала металлов в воде как изоляторе и разностей потенциалов в ионных двойных слоях ф1 и ф2, возникающих в результате обмена ионами между металлами и раствором [c.536]
Первое предположение о причинах данного явления сводится к тому, что различие между обратимой э.д.с. и напряжением возникает как результат омических потерь напряжения. В этом случае напряжение, необходимое для проведения какой-либо реакции в электролитической ванне, будет слагаться из обратимой э.д.с. Е (определяемой изменением изобарно-изотермического потенциала) и падения напряжения в электролите и в электродах Еом (зависящего от плотности тока). Такое предположение объясняет причину увеличения напряжения на аание при прохождении через нее тока по сравнению с обратимой э.д.с. той же системы. Точно так же уменьшение напряжения гальванического элемента при отборе от него тока можно отнести за счет того, что часть э.д.с. расходуется на преодоление сопротивления в утри самого элемента. Омические потери напряжения являются, таким образом, одной из причин различия между обратимой э.д.с. и рабочим напряжением. Опыт показывает, однако, чго [c.287]
Следует отметить, что метод расчета А G° химических реакций по величине электродвижущей силы точен, но ограничен возможностью равновесного проведения реакций в гальваническом элементе. [c.310]
В общей форме цикл Карно может быть осуществлен и не на основе расширения и сжатия газа, а таким образом, что роль рабочего тела может играть, например, гальванический элемент. [c.81]
Таким образом, постулат о касательной или равенство (IX, 19), сами по себе приложимые только к конденсированным системам (точнее, только к кристаллическим веществам), дают те дополнительные общие основания, которые необходимы для полного расчета равновесия из тепловых данных. При этом расчеты можно осуществить без экспериментальных данных для равновесия (константы равновесия, электродвижущие силы гальванических элементов, в которых протекают химические реакции). [c.317]
И соединим их медным проводом или клеммой (рис. 63). Полученная таким образом система представляет собой, очевидно, гальванический элемент, в котором металл, имеющий меньщий окислительный потенциал (Zn), отдает электроны и переходит в раствор [c.449]
Электрохимическая система, производящая электрическую энергию за счет протекающих в ней химических превращений, называется химическим источником тока или гальваническим элементом (рис, 2, б). Здесь электрод, пос1>1лающий электроны во внешнюю цепь, называется отрицательным электродом или отрицательным полюсом элемента. Электрод, принимающий электроны из внешней цепи, называется положительным электродом или положительным полюсом элемента. [c.13]
Электродвижущая сила описанного гальванического элемента равна [c.309]
К раствору AgNOa, являющемуся э.пектролитом в одном нз полуэлементов гальванического элемента, состоящего из пары Ag /Ag и стандартного водородного электрода, прибавляют эквивалентное количество НС1. Учитывая величину ПРлвсь укажите, вызовет ли это изменение направления тока в элементе. [c.377]
Всякий гальванический элемент состоит из двух электродов — металлов, погруженных в растворы электролитов последние сообщаются друг с другом — обычно через пористую перегородку. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом электрод, на котором осуществляется восстановление,—-катодом. [c.176]
Участки анодной и катодной реакций всегда разделены, для их протекания необходимо перемещение электронов в металле от анода к катоду и соответствующих ионов в электролите. Таким образом, каждая пара соседних анодного и катодного участков в среде электролита образует короткозамкнутый гальванический элемент. Таких постоянно действующих элементов на поверхности металла образуется огромное количество, причем анодные участт ки обычно разрушаются, В качестве примера, иллюстрирующего сказанное, может быть приведен механизм протекания анодных и катодных процессов при электрохимической коррозии железа [291] [c.280]
Из соединений элементов подгруппы марганца наибольшее применение имеет MnOj. Это исходный продукт для получения всех остальных производных марганца. Диоксид применяют также в качестве катализатора, дешевого окислителя, деполяризатора в гальванических элементах и т. д. [c.580]
Общая химия (1984) — [ c.287 , c.290 , c.293 ]
Химия (1986) — [ c.231 ]
Физическая и коллоидная химия (1988) — [ c.239 , c.240 ]
Химия для поступающих в вузы 1985 (1985) — [ c.142 ]
Химия для поступающих в вузы 1993 (1993) — [ c.169 , c.274 ]
Теоретические основы аналитической химии 1987 (1987) — [ c.89 , c.263 ]
Физическая и коллоидная химия (1988) — [ c.0 , c.133 ]
Учебник общей химии (1981) — [ c.158 , c.164 ]
Пособие по химии для поступающих в вузы 1972 (1972) — [ c.89 , c.317 ]
Общая и неорганическая химия Изд.3 (1998) — [ c.245 ]
Общая химия (1979) — [ c.0 ]
Аналитическая химия (1994) — [ c.144 ]
Курс аналитической химии (2004) — [ c.67 ]
Практикум по физической химии изд3 (1964) — [ c.280 ]
Электрохимия растворов издание второе (1966) — [ c.425 ]
Химический анализ (1966) — [ c.0 ]
Физико-химические методы анализа Изд4 (1964) — [ c.300 ]
Практические работы по физической химии (1961) — [ c.173 ]
Химическое разделение и измерение теория и практика аналитической химии (1978) — [ c.266 , c.271 , c.406 ]
Общая химия и неорганическая химия издание 5 (1952) — [ c.331 , c.334 , c.363 ]
Практикум по теоретической электрохимии (1954) — [ c.11 , c.12 , c.26 ]
Теоретическая электрохимия (1959) — [ c.12 , c.201 ]
Инструментальные методы химического анализа (1960) — [ c.37 ]
Качественный анализ (1951) — [ c.261 ]
Качественный анализ 1960 (1960) — [ c.261 ]
Количественный анализ (1963) — [ c.342 , c.343 , c.495 ]
Курс качественного химического полумикроанализа 1962 (1962) — [ c.270 ]
Курс качественного химического полумикроанализа 1973 (1973) — [ c.294 ]
Аккумулятор знаний по химии (1977) — [ c.92 ]
Химия (1985) — [ c.111 ]
Неорганическая химия (1987) — [ c.240 , c.241 ]
Инструментальные методы химического анализа (1960) — [ c.37 ]
Химия (1975) — [ c.250 , c.255 ]
Аналитическая химия Часть 1 (1989) — [ c.105 ]
Аналитическая химия Часть 2 (1989) — [ c.189 ]
Аккумулятор знаний по химии (1985) — [ c.92 ]
Химия (1982) — [ c.88 ]
Основы аналитической химии Часть 2 (1979) — [ c.323 ]
Теоретическая электрохимия Издание 3 (1970) — [ c.12 , c.201 ]
Курс аналитической химии Издание 5 (1982) — [ c.248 ]
Определение рН теория и практика (1968) — [ c.0 ]
Основы физической и коллоидной химии Издание 3 (1964) — [ c.210 ]
Физическая и коллоидная химия (1974) — [ c.274 ]
Курс аналитической химии Издание 5 (1981) — [ c.183 ]
Руководство по электрохимии Издание 2 (1931) — [ c.9 ]
Физико-химические методы анализа Издание 3 (1960) — [ c.252 , c.318 ]
Физико-химические методы анализа Издание 4 (1964) — [ c.300 ]
Курс аналитической химии (1964) — [ c.110 ]
Количественный анализ (0) — [ c.486 ]
Неорганическая химия (1969) — [ c.205 ]
Общая и неорганическая химия (1981) — [ c.223 ]
Лабораторные работы по неорганической химии (1948) — [ c.92 ]
Практикум по физической химии (1950) — [ c.188 ]
Курс физической химии Том 2 Издание 2 (1973) — [ c.488 ]
Курс химического качественного анализа (1960) — [ c.169 ]
Физическая и коллоидная химия (1954) — [ c.0 ]
Теоретические основы общей химии (1978) — [ c.269 ]
Химия Издание 2 (1988) — [ c.133 ]
Курс аналитической химии Издание 2 (1968) — [ c.118 ]
Курс аналитической химии Издание 4 (1977) — [ c.71 ]
Неорганическая химия Изд2 (2004) — [ c.203 ]
Курс качественного химического полумикроанализа (1950) — [ c.188 ]
Краткий курс физической химии Издание 3 (1963) — [ c.404 , c.405 , c.422 ]
Курс химического и качественного анализа (1960) — [ c.169 ]
Курс аналитической химии Кн 2 Издание 4 (1975) — [ c.252 ]
Основы аналитической химии Издание 2 (1965) — [ c.111 ]
Основы общей химии Т 1 (1965) — [ c.203 , c.210 ]
Основы общей химии Том 2 Издание 3 (1973) — [ c.201 , c.206 ]
Общая химия (1968) — [ c.218 ]
Практикум по общей химии (1948) — [ c.145 ]
Практикум по общей химии Издание 2 1954 (1954) — [ c.62 , c.154 ]
Практикум по общей химии Издание 3 (1957) — [ c.158 , c.166 , c.167 ]
Практикум по общей химии Издание 4 (1960) — [ c.158 , c.166 , c.167 ]
Практикум по общей химии Издание 5 (1964) — [ c.171 , c.180 ]
Общая химия Биофизическая химия изд 4 (2003) — [ c.465 ]
Практикум по физической химии Изд 5 (1986) — [ c.262 , c.265 ]
Практикум по физической химии Изд 3 (1964) — [ c.280 ]
Практические работы по физической химии Изд4 (1982) — [ c.130 ]
Физическая химия (1967) — [ c.408 ]
Основы общей химии том №1 (1965) — [ c.203 , c.210 ]
Химия Справочник (2000) — [ c.159 ]
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Показать решение »
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg0 -2e— = Mg2+
К: Cu2+ +2e— = Cu
Mg0 + Cu2+ = Mg2+ + Cu
Mg + CuSO4 = MgSO4 + Cu
Вычислим ЭДС гальванического элемента:
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Mg2+/Mg
E0Cu2+/Cu = +0,337 В
E0Mg2+/Mg = -2,37 В
ЭДС =0,337 + 2,37 = 2,71 В
Определим энергию химической реакции:
ΔG0298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Показать решение »
Решение.
E02H+/h3 = 0,00 В
E0Pb2+/Pb = -0,126 В
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb0 -2e— = Pb2+
К: 2H+ +2e— = H2
Pb0 + 2H+= Pb2+ + H2
Определим электродный потенциал свинца:
E = E° + (0,059/n)lgC
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = E0кат — E0ан = E02H+/h3 — E0Pb2+/Pb
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Ni2+/Ni и E0Cu2+/Cu
E0Ni2+/Ni = -0,250 В
E0Cu2+/Cu = +0,337 В
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni0 -2e— = Ni2+
К: Cu2+ +2e— = Cu0
Ni0 + Cu2+ = Ni2+ + Cu0
Ni0 + CuSO4 = NiSO4 + Cu0
Составим схему гальванического элемента:
(-) Ni0|NiSO4 || CuSO4|Cu0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Ni2+/Ni
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg2+] = 0,001 моль/л, [Pb2+] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Mg2+/Mg и E0Pb2+/Pb
E0Mg2+/Mg = -2,37 В
E0Pb2+/Pb = -0,126 В
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg0 -2e— = Mg2+
К: Pb2+ +2e— = Pb0
Mg0 + Pb2+ = Mg2+ + Pb0
Составим схему гальванического элемента:
(-) Mg0|Mg2+ || Pb2+|Pb0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
E = E° + (0,059/n)lgC
EMg2+/Mg = -2,37 + (0,059/2)lg0,001 = -2,46 В
EPb2+/Pb = -0,126 + (0,059/2)lg1 = -0,126 В
Рассчитаем стандартную ЭДС реакции
ЭДС = Eкат — Eан = EPb2+/Pb — EMg2+/Mg
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Mg2+/Mg, E0Co2+/Co, E0Fe2+/Fe, E0Ag+/Ag
E0Mg2+/Mg = -2,37 В
E0Fe2+/Fe = -0,440 B
E0Co2+/Co = -0,277 B
E0Ag+/Ag = +0,799 B
Протекание реакции возможно при условии, когда E0восст < E0ок.
В нашем случае восстановителем является кобальт и условие E0восст < E0ок соблюдается только для пары
Co – Ag.
Co0 + Ag+ = Co2+ + Ag0
Молекулярное уравнение, например:
Co0 + 2AgNO3 = Co(NO3)2 + 2Ag0
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Co) = 1∙59 = 59 г
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Показать решение »
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
E0Ni2+/Ni = -0,250 В
E0Cu2+/Cu = +0,337 В
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni0 -2e— = Ni2+
К: Cu2+ +2e— = Cu0
Ni0 + Cu2+ = Ni2+ + Cu0
Ni0 + CuSO4 = NiSO4 + Cu0
Составим схему гальванического элемента:
(-) Ni0|NiSO4 || CuSO4|Cu0 (+)
Рассчитаем стандартную ЭДС реакции
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Ni2+/Ni
ЭДС = 0,337 – (- 0,250) = 0,587 В
ЭДС гальванического элемента | Химик.ПРО – решение задач по химии бесплатно
Разберите работу гальванического элемента. Напишите электронные уравнения анодного и катодного процессов, составьте суммарное ионное уравнение окислительно-восстановительной реакции в гальваническом элементе и вычислите ЭДС гальванического элемента.
Мn | MnSO4 || FeSO4 | Fe,
СMn2+=10-2моль/л, СFe2+= 10-2 моль/л.
Решение задачи
ЭДС гальванического элемента
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР.
Мn | MnSO4 || FeSO4 | Fe,
СMn2+=10-2моль/л, СFe2+= 10-2 моль/л.
Пользуясь уравнением Нернста, вычисляем значения электродных потенциалов марганца и железа в растворах заданной концентрации:
E (Mn2+/Mn0) < E (Fe2+/Fe0), следовательно, более активным металлом является марганец, он будет отрицательным электродом – анодом, а железо – катодом.
Таким образом, Mn – анод (А) и Mn – восстановитель, Fe – катод.
(-)Мn | MnSO4 || FeSO4 | Fe (+)
Электроны двигаются от марганеца к железу. ЭДС гальванического элемента
Запишем электронные уравнения процессов, протекающих на электродах, и составим суммарное уравнение.
(-) (А) Mn0 — 2e = Mn2+ — процесс окисления;
(+)(K) Fe2+ + 2e = Fe0 — процесс восстановления.
Mn0+ Fe2+= Mn2+ + Fe0
Записываем молекулярное уравнение окислительно-восстановительной реакции, лежащей в основе работы гальванического элемента:
Mn0+ FeSO4→ MnSO4+ Fe0↓
Рассчитываем ЭДС гальванического элемента:
Ответ:
ЭДС гальванического элемента 0,75 Вольт.
Открытое занятие «Гальванический элемент»
«Электричество в руках химика – это мощное средство тончайшего и направленного воздействия на вещество»
I. Объявление темы урока
Перед вами весьма несложный прибор. Я опускаю
его в раствор поваренной соли и происходит
чудо – лампочка горит.
Вопрос: почему горит лампочка? (Т.к.
есть электрический ток)
Вопрос: основное условие горения
лампочки? (Наличие электрического тока)
Вопрос: откуда электрический ток в
растворе? (Наличие ионов натрия и хлора)
Электрический ток – направленное движение
заряженных частиц.
Вопрос: начиная с этого занятия, мы с
вами, что будем изучать? (Связь химии и
электричества)
Вопрос: каким одним понятием можно
объединить химию и электричество? (Электрохимия)
Электрохимия изучает свойства систем,
содержащих подвижные ионы (растворов, расплавов,
твердых электролитов), и явления, возникающие на
границе раздела фаз вследствие переноса
заряженных частиц.
| ЗНАЮ | ХОЧУ ЗНАТЬ | УЗНАЛ |
(таблица на доске).
При заполнении таблицы необходимо выйти на тему занятия «Гальванический элемент»
II. Сообщение целей и задач (формулируют сами обучающиеся)
Цель занятия – изучить принцип действия гальванического элемента.
Задачи:
– познакомиться с краткой историей создания
ГЭ;
– изучить устройство и химические реакции,
лежащие в основе работы ГЭ;
– научиться составлять схему ГЭ.
Обучающиеся также планируют способы достижения
намеченной цели.
III. Практическая деятельность учащихся
Для дальнейшей работы формируются две команды, распределяются роли в команде, выбирается капитан(модератор).
1. Работа с текстом (с литературой)
Историческая справка
При раскопках парфянского поселения,
существовавшего в Месопотамии 2200 лет назад, была
обнаружена древняя «батарея». С технической
точки зрения она представляет собой
электрохимический источник тока типа
гальванического элемента одноразового действия
и состоит из железного стержня и медного листа,
свернутого в цилиндр вокруг этого стержня; оба
они помещены в керамический горшок из-под
виноградного сока. По-видимому, это устройство
выполняло роль таинственного источника энергии
в процессе нанесения гальванических покрытий из
золота или серебра на поверхность металлических
предметов.
Первый химический источник тока был изобретён
итальянским учёным Алессандро Вольта в
1800 году. Это был элемент Вольта — сосуд
с солёной водой с опущенными в него цинковой и
медной пластинками, соединенными проволокой. В 1836
году английский химик Джон Дэниель
усовершенствовал элемент Вольта, поместив
цинковый и медный электроды в раствор серной
кислоты. Эта конструкция стала называться «элементом
Даниэля». В 1859 году французский
физик Гастон Плантэ изобрёл
свинцово-кислотный аккумулятор. Этот тип
элемента и по сей день используется в
автомобильных аккумуляторах. В 1865 году
французский химик Ж. Лекланше предложил свой
гальванический элемент (элемент Лекланше),
состоявший из цинкового стаканчика,
заполненного водным раствором хлористого
аммония или другой хлористой соли, в который был
помещён агломерат из оксида марганца(IV) MnO2 с
угольным токоотводом. Модификация этой
конструкции используется до сих пор в солевых
батарейках для различных бытовых устройств. В
1890 году в Нью-Йорке Конрад Губерт, иммигрант
из России, создаёт первый карманный
электрический фонарик. А уже в 1896 году
компания National Carbon приступает к массовому
производству первых в мире сухих элементов
Лекланше «Columbia».
Задание: составьте хронологическую таблицу от открытия и до массового производства гальванических элементов.
2. Практическая работа. Изготовление гальванического элемента
Опыт 1. Погрузите железный гвоздь в раствор медного купороса. Опишите свои наблюдения. Напишите уравнение реакции. Составьте электронный баланс.
Опыт 2. В пробирку с раствором ZnSO4 поместите цинковую пластину. В пробирку с раствором CuSO4 поместите медную пластину. Пробирки соедините солевым мостиком. Пластинки с помощью проводов соедините с гальванометром. Опишите свои наблюдения. Почему стрелка гальванометра отклонилась? Запишите химические реакции, происходящие в пробирках. Отсоедините провода от гальванометра.
Рисунок 1. Гальванический элемент Даниэля.
Вы собрали простейший гальванический элемент, который носит название элемента Даниэля в честь Джона Фредерика Даниэля, который изобрел его в 1836г (рисунок 1)
3. Работа с текстом (теоретические выкладки)
Основные составляющие гальванического элемента
Гальванический элемент представляет собой замкнутую систему, состоящую из двух электродов, соединённых между собой внешней цепью – электронный проводник (металл) и внутренний цепью – ионный проводник (растворы электролита, соединённые солевым мостиком). Назван в честь Луиджи Гальвани. В этом элементе химическая энергия превращается в электрическую энергию. В основе работы любого ГЭ лежит разница в активности металлов.
Ряд активности металлов
Li ––> Rb ––> K ––> Ba ––> Sr ––> Ca ––> Na ––> Mg ––> Al ––> Mn ––> Zn ––> Cr ––> Fe ––> Cd ––> Co ––>Ni ––> Sn ––> Pb ––> H ––> Sb ––> Bi ––> Cu ––> Hg ––> Ag ––> Pd ––> Pt ––>Au
Любой гальванический элемент состоит из двух
частей: в первой части происходит полуреакция
окисления (Zn0 – 2е = Zn2+), в другой
– полуреакция восстановления (Cu2+ + 2е = Cu0).
Металлические пластины (могут быть угольные
стержни) называются электродами.
Анодом в электрохимии называется электрод, на котором протекает реакция окисления, т.е. отдача электронов.
В гальванической цепи анод заряжен отрицательно, и он посылает электроны во внешнюю цепь.
Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т.е. присоединение электронов.
В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи.
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля): А(–) Zn | ZnSO4 || CuSO4 | Cu (+)К,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || – солевой мостик.
Задание: напишите схему гальванического элемента для Fe/Cu электродов, погруженных в растворы солей этих металлов. По содержанию текста составьте 5-6 вопросов для другой команды. На выполнение задания – 10 минут.
4. Решение проблемы
Проблема: если поменять местами электроды, то ГЭ работать не будет. Почему?
IV. Осуществление контроля
«Перекрёстный опрос». Модераторы задают вопросы. Представитель команды отвечает.
Заполнение третьей графы таблицы «Знаю. Хочу знать. Узнал»
Вопрос: пользуемся ли мы в быту гальваническими элементами? (Батарейка)
V.Учебное действие. «Работа с текстом»
Батарейка – источник опасности
Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы.
Рисунок 2. Устройство сухого элемента.
Устройство батарейки
Батарейка (сухой элемент, рисунок 2) состоит из
цинкового корпуса, который играет роль анода.
Другой электрод, катод, представляет собой
графитовый стержень, находящийся в середине
элемента. Этот стержень окружен
слоем оксида
марганца и угольной сажи.
В качестве электролита используется толстый
слой хлорида аммония и хлорида цинка. Рассмотрим
реакции, которые происходят в элементе.
А «–»: Zn0 – 2е = Zn2+.
К «+»: MnO2(т) + 2NH4+ + 2e– ––>
Mn2O2(т) + 2NH3(p-p) + H2O(ж)
Внимание! Одним из электродов фактически служит корпус, расходуемый в ходе реакции. Таким образом, если толщина корпуса не одинакова, то на месте самого тонкого участка со временем может образоваться отверстие, через которое будет высыпаться едкое содержимое элемента.
Задание. Назовите химически опасные соединения, которые могут быть угрозой человеку и окружающей среде в случае повреждения корпуса батарейки.
Информация к размышлению.
- При высоких концентрациях цинк – мутаген и онкоген. Вызывает заболевания костно-мышечной системы.
- Марганец действует на организм через органы дыхания. Поражает центральную нервную систему, почки, органы кровообращения и легкие.
- Аммиак — Nh4, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта). При соприкосновении аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями.
Продолжить заполнение графы «УЗНАЛ» в таблице «ЗНАЮ. ХОЧУ ЗНАТЬ. УЗНАЛ»
VI. Рефлексия
Оценочный лист. Тема «Гальванический элемент»
Критерии оценки |
Отметка (+ , –) |
|
|
|
|
|
|
|
|
|
– Спасибо за внимание!
– Жду вас на следующее занятие.
Гальванические элементы
В современной литературе химические источники тока обычно называют гальваническими элементами. Различают первичные элементы (батарейки) и вторичные элементы (аккумуляторы).
Принцип действия любого химического источника тока (ХИТ) заключается в преобразовании химической энергии окислительно-восстановительной реакции в электрическую, причем в случае первичного гальванического элемента или элемента разового использования, химические процессы являются необратимыми, то есть после расхода реагентов такое ХДС больше не сможет работать. Вторичные элементы или элементы многократного использования, используют обратные реакции. В режиме работы (разряжения) аккумулятор является источником тока, в режиме зарядки он потребляет энергию внешнего источника.
Для создания ХДС необходимо иметь два электрода, соединенных проводником, один из которых должен быть способным отдавать электроны, а другой — принимать. Например, такую систему можно составить из двух пластин, изготовленных из различных металлов (то есть, с различными стандартными электродными потенциалами), один из которых (с меньшим стандартным электродным потенциалом) будет окиснюватися (Me — ze-® Mez+), другой — восстанавливаться (Mez+ + ze- ® Me). Обе пластины должны быть погружены в раствор электролита, который будет выполнять функцию переноса заряда от одного металла в другой. То есть в этой конструкции электроны от восстановителя к окисника не передаются в процессе непосредственного контакта с помощью металлического проводника.
Электрод (активная масса) или полуэлемент — это система, которая содержит электропроводящие материалы в контакте с электролитом.
Электрод, на котором идет окисления, называют анодом (А). Электрод, на котором идет восстановление, называют катодом (К). При работе химических источников тока анод считают отрицательно заряженным электродом, а катод — положительно заряженным электродом.
Для раздельного течения процессов окисления и восстановления две пластины (т.е. электроды) нужно разделить пространственно. С этой целью используют так называемую диафрагму (или сепаратор). Кстати, простейший гальванический элемент можно создать даже из подручных материалов, например, если собрать столбик из монет, чередуя монеты из желтого и белого металла, проложив между ними бумагу, смоченный в растворе соли. При этом ЭДС такого элемента будет пропорциональна количеству монет.
Химические источники тока изобретены на основе исследований Л.Гальвані и А.Вольта в конце 18 ст. Физиолог Луиджи Гальвани во время опытов случайно заметил, если проводником соединить два металлы, например медь и железо, и наложить на мышцы мертвого животного, то мышцы начинают сокращаться. Однако, Гальвани объяснил это явление свойствами живой ткани, а не свойствами металлов. Исследования продолжил физик Александро Вольта, собрав электрическое круг из двух металлов, между которыми был прослойка сукна, смоченного раствором присоленої воды, Вольта предложил первый гальванический элемент. Первые варианты конструкции имели положительные электроды из меди или серебра, а негативные — из цинка или олова. Создав впервые в мире ХДС, сам А.Вольта никогда не связывал его действие с химическими процессами между электродами и электролитом, а природу возникновения электродвижущей силы объяснял контактом между металлами. Эта теория была подвергнута критике сторонниками химической и термодинамической теории ЭДС гальванических элементов в первой половине 19 в.
В историческом развитии ХДС одним из главных достижений был элемент Даниэля, усовершенствованный российским ученым Б.С.Якобі (1836 г.).
Этот гальванический элемент имел цинковый отрицательный электрод (анод), погружен в раствор ZnS04, а положительный медь (катод) — погруженный в CuS04. Между растворами была пористая перегородка (предел). Элемент Даниэля-Якоби имел сравнительно простую конструкцию, но с его помощью можно было получать ощутимую емкость. И поэтому он нашел практическое использование в телеграфном связи, электротехнике и в военном деле. Элемент Даниэля-Якоби был ярким доказательством возникновения ЭДС за счет химических реакций на границе металл-раствор. В первой половине 19 в. в разных странах было разработано ряд гальванических элементов, в которых использовали растворы кислот и щелочей. Такие элементы имели сравнительно большие разрядные характеристики, но срок их действия был малым через значительную химическую активность рабочих электролитов. Новым мощным импульсом в развитии ХДС было открыть элемент Лекланше, в котором положительным электродом использован твердый деполяризатор — диоксид марганца. Этот элемент в различных конструктивных модификациях используют и в последнее время. Сравнительная простота конструкции, доступность активных материалов и большой спрос дали возможность изготавливать несколько миллиардов элементов в год.
Новым достижением в развитии источников тока было создание Г.Планте в 1860г. ХДС многократного действия — свинцового аккумулятора. Аккумулятор представлял собой два письма свинца, разделенные сепаратором из губчатой резины. Электролитом была 10% -ная сульфатная кислота.
Важным этапом развития ХДС было создание элементов и аккумуляторов с литиевым и натриевым негативными электродами. Использование щелочных металлов в источниках тока стало возможным благодаря апротонним неводным електролітам, в которых эти металлы химически устойчивы и имеют высокий отрицательный потенциал.
В связи с тем, что ХДС получили чрезвычайно широкое распространение в технике, в настоящее время разработано множество материалов для выработки различных составляющих ХДС, сформулированы основные требования к этим материалам для достижения оптимального качества.
Так, в качестве материала анода преимущественно используют металлы с высоким отрицательным потенциалом (цинк, кадмий, свинец и др.), для катода-соединения, металлы или смеси с положительным потенциалом (Ag2O, NiOOH, MnO2, AgCl, CuCl и др.).
В качестве электролитов используют растворы кислот, щелочей, солей, расплавы или твердые вещества, которые обеспечивают прохождение электрического тока и участвуют в электродных реакциях. Природа и состав электролита в значительной степени зависят от требований по эксплуатации ХДС. Наиболее распространенными являются электролитами растворы h3S04 (свинцовые аккумуляторы), КОН (щелочные ХДС), солей в воде и органических растворителях. Требования к электролитов ХДС: достаточно высокая удельная электропроводность, ионы электролита не должны активно реагировать с электродами, имела агрессивность в отношении деталей источника тока.
Для изготовления диафрагмы (сепаратора) используют химически стойкие пористые диэлектрические материалы, которые предотвращают контакта между электродами. В сепараторах электролит заполняет поры и обеспечивает электропроводность пространства между электродами. В зависимости от типа ХДС и особенностей электролизных реакций, сепаратор должен механически поддерживать активную массу, противодействовать деформации электродов, появлению дендритов, проникновению продуктов разряда электродных материалов к противоположным электродов, а также иметь газопроницаемость. Если электролит находится только в сепараторе, его называют матричным. В этом случае сепаратор является електролітоносієм, а электролит в нем содержится капиллярными силами у поверхности электродов. В отдельных ХДС сепараторы изготавливаются с ультра-микропористых мембран, что представляют собой высокомолекулярные соединения (матрицы) с іоноелектронними свойствами.
Корпус источника тока представляет собой герметичную или напівгерметичну сосуд из металла, полимера, стекла. Выбор материала корпуса определяется свойствами электролита, активных масс и продуктов реакций. Токоотводы (перемычки) изготавливают из металлических проводников коррозиестойких к электролита, активных масс и с наименьшим электрическим сопротивлением.
Особую группу химических источников тока (ХИТ) образуют топливные элементы (электрохимические генераторы), что используют обычные компоненты топлив. На аноде топливных элементов окисляющиеся свайные (Н2, СО, СН4, спирты, бензин, керосин), а на катоде восстанавливаются окислители (О2 воздуха, Н2О2, Cl2 и т. д.). По сравнению с другими источниками электроэнергии на борту летательных аппаратов, топливные элементы имеют очень высокий коэффициент полезного действия и высокую мощность на единицу массы и объема.
Чтобы более детально понять химические процессы, на которых основывается действие гальванического элемента, рассмотрим конкретный пример — медно-цинковый гальванический элемент (Рис. 5).
Он состоит из двух пластин, изготовленных из цинка и меди, которые погружены в растворы сульфата цинка и сульфата купруму, соответственно, соединенных проводником. Стакана с растворами соединены «солевым мостом» (изогнутая стеклянная трубка, заполненная обычно раствором KCl или Nh5NO3) Такая система дает возможность пространственного разделения окислительно-восстановительной реакции: процесс окисления протекает на одном металле (цинка), а процесс восстановления на другом металле (меди). Таким образом, электроны передаются от восстановителя к окисника внешним электрическим кругом. Таким образом, благодаря протеканию этой окислительно-восстановительной химической реакции в медно-цинковом гальваническом элементе образуется непрерывный поток электронов (электрический ток).
На границе цинка с раствором сульфата цинка происходит процесс превращения атомов цинка на ионы, которые гідратуються и переходят в раствор.
17.1: Электрохимические ячейки — Chemistry LibreTexts
Цели обучения
- Чтобы понять основы гальванических элементов
- Для подключения напряжения от гальванического элемента к основной окислительно-восстановительной системе
В любом электрохимическом процессе электроны переходят от одного химического вещества к другому в результате окислительно-восстановительной (окислительно-восстановительной) реакции. Окислительно-восстановительная реакция происходит, когда электроны переходят от окисляемого вещества к восстанавливаемому.Восстановитель — это вещество, которое теряет электроны и окисляется в процессе; Окислитель — это вещество, которое приобретает электроны и восстанавливается в процессе. Соответствующая потенциальная энергия определяется разностью потенциалов между валентными электронами в атомах разных элементов.
Поскольку восстановление невозможно без окисления и наоборот, окислительно-восстановительная реакция может быть описана как две полуреакции , одна представляет процесс окисления, а другая — процесс восстановления.{-}} \ nonumber \]
Каждая полуреакция написана, чтобы показать, что на самом деле происходит в системе; \ (\ ce {Zn} \) — это восстановитель в этой реакции (он теряет электроны), а \ (\ ce {Br2} \) — окислитель (он получает электроны). Сложение двух половинных реакций дает общую химическую реакцию (Уравнение \ (\ PageIndex {1} \)). Окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Как и любое сбалансированное химическое уравнение, весь процесс электрически нейтрален; то есть чистый заряд одинаков для обеих сторон уравнения.
В любой окислительно-восстановительной реакции количество электронов, потерянных в результате реакции (й) окисления, равно количеству электронов, полученному в результате реакции (й) восстановления.
В большинстве наших обсуждений химических реакций мы предполагали, что реагенты находятся в тесном физическом контакте друг с другом. Кислотно-основные реакции, например, обычно проводят с кислотой и основанием, диспергированными в одной фазе, такой как жидкий раствор. Однако с помощью окислительно-восстановительных реакций можно физически разделить полуреакции окисления и восстановления в космосе, если существует полная цепь, включая внешнее электрическое соединение, такое как провод, между двумя полуреакциями.По мере развития реакции электроны текут от восстановителя к окислителю по этому электрическому соединению, производя электрический ток, который можно использовать для выполнения работы. Устройство, которое используется для выработки электричества в результате спонтанной окислительно-восстановительной реакции или, наоборот, которое использует электричество для запуска неспонтанной окислительно-восстановительной реакции, называется электрохимическим элементом .
Есть два типа электрохимических ячеек: гальванические ячейки и электролитические ячейки. Гальванические клетки названы в честь итальянского физика и врача Луиджи Гальвани (1737–1798), который наблюдал, как рассеченные мышцы ног лягушки подергивались при применении небольшого электрического разряда, демонстрируя электрическую природу нервных импульсов.Гальванический (гальванический) элемент использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции (\ (ΔG <0 \)), для выработки электричества. Этот тип электрохимического элемента часто называют гальваническим элементом в честь его изобретателя, итальянского физика Алессандро Вольта (1745–1827). Напротив, электролитическая ячейка потребляет электроэнергию от внешнего источника, используя ее, чтобы вызвать неспонтанную окислительно-восстановительную реакцию (\ (ΔG> 0 \)). Оба типа содержат два электрода , которые представляют собой твердые металлы, подключенные к внешней цепи, которая обеспечивает электрическое соединение между двумя частями системы (рисунок \ (\ PageIndex {1} \)).Полуреакция окисления происходит на одном электроде (анод , ), а полуреакция восстановления происходит на другом (катод , ). Когда цепь замкнута, электроны текут от анода к катоду. Электроды также соединены электролитом, ионным веществом или раствором, который позволяет ионам перемещаться между отсеками электродов, тем самым поддерживая электрическую нейтральность системы. В этом разделе мы сосредоточимся на реакциях, происходящих в гальванических элементах.
Рисунок \ (\ PageIndex {1} \): Электрохимические ячейки. Гальванический элемент (слева) преобразует энергию, выделяемую спонтанной окислительно-восстановительной реакцией, в электрическую энергию, которую можно использовать для выполнения работы. Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, которые соединены внешней электрической цепью; Кроме того, второе соединение, которое позволяет ионам перемещаться между отсеками (показано здесь вертикальной пунктирной линией, обозначающей пористый барьер), необходимо для поддержания электрической нейтральности.Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электроэнергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.{2+} (водн.) + Cu (s)} \ label {20.3.4} \]Эту реакцию можно вызвать, поместив цинковый стержень в водный раствор сульфата меди (II). По мере протекания реакции цинковый стержень растворяется, и образуется масса металлической меди. Эти изменения происходят спонтанно, но вся выделяемая энергия находится в форме тепла, а не в форме, которую можно использовать для выполнения работы.
Рисунок \ (\ PageIndex {2} \): Реакция металлического цинка с водными ионами меди (II) в одном отсеке.{2 +}} \) ионов в растворе уменьшается (Рисунок \ (\ PageIndex {3b} \)). Таким образом, мы провели ту же реакцию, что и с использованием одного химического стакана, но на этот раз окислительная и восстановительная полуреакции физически отделены друг от друга. Электроны, которые высвобождаются на аноде, проходят через провод, создавая электрический ток. Таким образом, гальванические элементы преобразуют химическую энергию в электрическую, которую затем можно использовать для работы. Рисунок \ (\ PageIndex {3} \): Реакция металлического цинка с водными ионами меди (II) в гальванической ячейке.(a) Гальванический элемент можно сконструировать, поместив медную полоску в стакан, содержащий 1 M водный раствор ионов Cu 2 + , и полоску цинка в другой стакан, содержащий 1 M водный раствор Zn. 2 + ионов. Две металлические полоски соединены проводом, по которому течет электричество, а химические стаканы соединены солевым мостиком. Когда переключатель замыкается для замыкания цепи, цинковый электрод (анод) самопроизвольно окисляется до ионов Zn 2 + в левом отсеке, а ионы Cu 2 + одновременно восстанавливаются до металлической меди при медный электрод (катод).(b) По мере развития реакции анод из цинка теряет массу, поскольку он растворяется с образованием ионов Zn 2 + (водн.), в то время как катод Cu набирает массу по мере восстановления ионов Cu 2 + (водн. с металлической медью, которая нанесена на катод. (CC BY-SA-NC; анонимно)Электролит в солевом мостике служит двум целям: он замыкает цепь, неся электрический заряд, и поддерживает электрическую нейтральность в обоих растворах, позволяя ионам перемещаться между ними. Идентичность соли в солевом мостике не имеет значения, пока составляющие ионы не вступают в реакцию или не подвергаются окислительно-восстановительной реакции в рабочих условиях ячейки.{2 +}} \) решение. В отсутствие солевого мостика или какого-либо другого подобного соединения реакция быстро прекратится, поскольку электрическая нейтральность не может быть сохранена.
Вольтметр можно использовать для измерения разницы электрических потенциалов между двумя отсеками. Открытие переключателя, который соединяет провода с анодом и катодом, предотвращает протекание тока, поэтому химическая реакция не происходит. Однако при замкнутом переключателе внешняя цепь замкнута, и электрический ток может течь от анода к катоду.Потенциал (\ (E_ {cell} \)) ячейки, измеренный в вольтах, представляет собой разность электрического потенциала между двумя половинными реакциями и связан с энергией, необходимой для перемещения заряженной частицы в электрическом поле. . В описанной нами ячейке вольтметр показывает потенциал 1,10 В (рисунок \ (\ PageIndex {3a} \)). Поскольку электроны из полуреакции окисления высвобождаются на аноде, анод в гальваническом элементе заряжается отрицательно. Катод, притягивающий электроны, заряжен положительно.
Не все электроды подвергаются химическому превращению во время окислительно-восстановительной реакции. Электрод может быть изготовлен из инертного металла с высокой проводимостью, такого как платина, чтобы предотвратить его реакцию во время окислительно-восстановительного процесса, где он не проявляется в общей электрохимической реакции. Это явление проиллюстрировано в Примере \ (\ PageIndex {1} \).
Гальванический (гальванический) элемент преобразует энергию, выделяемую в результате спонтанной химической реакции , в электрическую энергию.Электролитическая ячейка потребляет электроэнергию от внешнего источника для запуска несамопроизвольной химической реакции .
Пример \ (\ PageIndex {1} \)
Химик построил гальванический элемент, состоящий из двух стаканов. В одном стакане находится полоска олова, погруженная в водный раствор серной кислоты, а в другом — платиновый электрод, погруженный в водный раствор азотной кислоты. Два раствора соединены солевым мостиком, а электроды соединены проволокой.{2+} (водн.) + 2NO (г) + 4h3O (l)} \ nonumber \]
Для гальванического элемента
- запишите половину реакции, которая происходит на каждом электроде.
- указывают, какой электрод является катодом, а какой — анодом.
- указывают, какой электрод является положительным электродом, а какой — отрицательным.
Дано: Гальванический элемент и окислительно-восстановительная реакция
Запрошено: полуреакций, идентичность анода и катода, а также назначение электродов как положительное или отрицательное
Стратегия:
- Укажите полуреакцию окисления и полуреакцию восстановления.Затем определите анод и катод по полуреакции, которая происходит на каждом электроде.
- По направлению потока электронов назначьте каждый электрод положительным или отрицательным.
Решение
A В полуреакции восстановления нитрат восстанавливается до оксида азота. (Оксид азота затем реагировал бы с кислородом воздуха с образованием NO 2 с его характерным красно-коричневым цветом.) В полуреакции окисления металлическое олово окисляется.{-}} \ nonumber \]
Таким образом, нитрат восстанавливается до NO, а оловянный электрод окисляется до Sn 2 + .
Поскольку реакция восстановления происходит на платиновом электроде, это катод. И наоборот, реакция окисления происходит на оловянном электроде, поэтому это анод.
B Электроны текут от оловянного электрода через проволоку к платиновому электроду, где переходят в нитрат. Электрическая цепь замыкается солевым мостиком, который обеспечивает диффузию катионов к катоду и анионов к аноду.{-}} \ end {align *} \]
Pt электрод в растворе перманганата является катодом; в растворе олова — анод.
Катод (электрод в стакане с раствором перманганата) положительный, а анод (электрод в стакане с раствором олова) отрицательный.
Построение диаграмм ячеек (обозначение ячеек)
Поскольку описать словами любой гальванический элемент довольно сложно, были разработаны более удобные обозначения.В этой линейной нотации, называемой диаграммой ячейки, идентичность электродов и химический состав отсеков указываются их химическими формулами, причем анод написан в крайнем левом углу, а катод — в крайнем правом углу. Фазовые границы показаны одиночными вертикальными линиями, а солевой мостик, имеющий две фазовые границы, — двойной вертикальной линией. Таким образом, диаграмма ячейки для ячейки \ (\ ce {Zn / Cu} \), показанная на рисунке \ (\ PageIndex {3a} \), записывается следующим образом:
Рисунок \ (\ PageIndex {4} \): диаграмма ячеек включает концентрации раствора, если они указаны.Термин + M предназначен для обозначения подходящей концентрации вида. Если разновидностью является газ, вместо этого вы подставляете давление.Гальванические элементы могут иметь другое устройство, отличное от примеров, которые мы видели до сих пор. Например, напряжение, создаваемое окислительно-восстановительной реакцией, можно более точно измерить, используя два электрода, погруженные в один стакан, содержащий электролит, замыкающий цепь. Такое расположение уменьшает ошибки, вызванные сопротивлением потоку заряда на границе, называемым потенциалом перехода .Один из примеров гальванического элемента этого типа:
\ [\ ce {Pt (s) \, | \, h3 (g) | HCl (водный, \, 1 \, M) \, | \, AgCl (s) \, Ag (s)} \ nonumber \]
На этой диаграмме ячеек нет двойной вертикальной линии, представляющей солевой мостик, потому что нет солевого моста, обеспечивающего соединение двух разнородных растворов. Более того, концентрации растворов не указаны, поэтому они не включены в диаграмму ячейки. {+} (aq)} \ nonumber \]
Однокамерный гальванический элемент будет первоначально показывать такое же напряжение, как и гальванический элемент, построенный с использованием отдельных отсеков, но он будет быстро разряжаться из-за прямой реакции реагента на аноде с окисленным элементом катодной окислительно-восстановительной пары.{2 +} (водн.) + 2НО (г) + 4х3О (л)} \ nonumber \]
Дано: Гальванический элемент и окислительно-восстановительная реакция
Запрошено: Схема ячеек
Стратегия:
Используя описанные символы, напишите диаграмму ячейки, начиная с полуреакции окисления слева.
Решение
Анодом является оловянная полоска, а катодом — электрод \ (\ ce {Pt} \). Начиная с анода слева, мы обозначим фазовую границу между электродом и раствором олова вертикальной чертой.{-}} \)) не участвует в общей реакции, поэтому не требует специального указания. Катодный отсек содержит водный раствор азотной кислоты, который участвует в общей реакции, вместе с продуктом реакции (\ (\ ce {NO} \)) и электродом \ (\ ce {Pt} \). {2 +} (aq) \, || \, HNO3 (aq) \, | \, NO (g) \, | \, Pt_ ( s)} \ nonumber \]
Концентрации раствора не указаны, поэтому они не включены в эту диаграмму ячеек.+ (aq, \; 1 \, M) \, | \, Ag (s)} \ nonumber \]
Резюме
Гальванический (гальванический) элемент использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции, для выработки электричества, тогда как электролитический элемент потребляет электрическую энергию от внешнего источника, чтобы вызвать реакцию. Электрохимия — это изучение взаимосвязи между электричеством и химическими реакциями. Реакция окисления-восстановления, которая происходит во время электрохимического процесса, состоит из двух полуреакций, одна представляет собой процесс окисления, а другая — процесс восстановления.Сумма полуреакций дает общую химическую реакцию. Общая окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Электрический ток создается потоком электронов от восстановителя к окислителю. Электрохимическая ячейка может либо генерировать электричество в результате спонтанной окислительно-восстановительной реакции, либо потреблять электричество для запуска несамопроизвольной реакции. В гальваническом (гальваническом) элементе энергия спонтанной реакции генерирует электричество, тогда как в электролитическом элементе электрическая энергия расходуется для запуска неспонтанной окислительно-восстановительной реакции.Оба типа ячеек используют два электрода, которые обеспечивают электрическое соединение между системами, разделенными в пространстве. Окислительная полуреакция происходит на аноде, а восстановительная полуреакция происходит на катоде. Солевой мостик соединяет разделенные растворы, позволяя ионам перемещаться в любой раствор, обеспечивая электрическую нейтральность системы. Вольтметр — это устройство, которое измеряет поток электрического тока между двумя полуреакциями. Потенциал ячейки, измеряемый в вольтах, — это энергия, необходимая для перемещения заряженной частицы в электрическом поле.Электрохимическая ячейка может быть описана с использованием линейных обозначений, называемых диаграммой ячейки, в которой вертикальные линии указывают границы фаз и расположение солевого мостика. Сопротивление потоку заряда на границе называется потенциалом перехода.
Ячейки электрохимические
Электрохимическая ячейка, вызывающая внешний электрический ток, может быть создана с использованием любых двух разных металлов, поскольку металлы различаются по своей склонности терять электроны. Цинк легче теряет электроны, чем медь, поэтому размещение металлического цинка и меди в растворах их солей может вызвать прохождение электронов через внешний провод, который ведет от цинка к меди.
Поскольку атом цинка обеспечивает электроны, он становится положительным ионом и переходит в водный раствор, уменьшая массу цинкового электрода. Что касается меди, то два полученных электрона позволяют преобразовать ион меди из раствора в незаряженный атом меди, который осаждается на медном электроде, увеличивая его массу. Две реакции обычно записываются как
Zn (ов) -> Zn 2+ (водн.) + 2e —
Cu 2+ (водн.) + 2e — -> Cu (s)
Буквы в круглых скобках просто напоминают о том, что цинк переходит из твердого вещества в водный раствор (водный раствор) и наоборот для меди.На языке электрохимии типично называть эти два процесса «полуреакциями», которые происходят на двух электродах.
Zn (s) -> Zn 2+ (водн.) + 2e — |
|