Каждый диапазон ФАР излучения имеет определенную функцию для урожая : ReduSystems
Растения используют свет в двух направлениях: фотосинтез и фотоморфогенез (контроль формы и развития). Для фотосинтеза необходимо много света; намного более низкие уровни необходимы для управления формой и развитием. Свет, который растения используют для фотосинтеза называют ФАР-излучением, сокращенно от Фотосинтетически Активной Радиации. Длина его волн находится между 400 и 700 нм. Диапазон волн для фотоморфогенеза несколько шире — от 300 нм (ультрафиолетовый свет) до 800 нм (дальний красный). Таким образом, оставив лишь спектр между 400 и 700 нм и блокировав остальной, вы нарушите другие процессы.
КРИВАЯ МАККРИ
Не весь свет в пределах диапазона ФАР-излучения приводит к равной сумме фотосинтеза. Это показывает кривая МакКри. Есть чёткие пики в красном и синем спектрах; а между ними прогиб. Эта кривая привела к целому ряду недоразумений. Самое распространенное из них в том, что зеленый свет не важен.
ЧЕЛОВЕЧЕСКИЙ ГЛАЗ ПЕРЕДАЁТ ЛОЖНОЕ ВПЕЧАТЛЕНИЕ
Чувствительность человеческого глаза и растения к свету значительно отличаются. Чувствительность человеческого глаза наиболее высока в зоне прогиба кривой McCree. Это означает, что невооружённым глазом вы не сможете определить релевантность конкретного вида освещения или солнцезащитного покрытия. Тем не менее, ранее принятый метод измерения люксов руководствуется этим знанием.
Свет падает на Землю в виде частиц. Эти частицы называют фотонами. В зависимости от спектра света фотоны содержат различное количество энергии. Например, синие фотоны содержат такой уровень энергии, который в 1.75 раза выше, чем у красных фотонов. Но это не имеет значения для фотосинтеза. Он зависит от числа фотонов, а не их энергоемкости. Поэтому действительно имеет значение, как Вы измеряете свет.
При помощи таких инструментов, как соляриметр, можно измерить уровень энергии. Он выражается в ДЖ/см² или Вт/м². Этот показатель даёт представление о том, что растение может сделать со светом, но не очень точно. Значение синего света переоценено, а красного – недооценено.
РЕГУЛИРОВАНИЕ С ПОМОЩЬЮ СОЛНЦЕЗАЩИТНЫХ ПОКРЫТИЙ
Растение использует свет также для своего формирования и развития, то есть морфогенеза. Несколько исследований, используя раскрашенную пленку и светодиоды доказывают, что возможно влиять на развитие растения, регулируя свет. Покрытие ReduHeat оставляет спектр естественного света по всему ФАР диапазону нетронутым, но оно производит более высокое соотношение красного и дальнего красного, что приводит к более компактному росту.
Новые возможности управления спектрами солнечного света в тепличном растениеводстве
Спектральный состав солнечной радиации можно разложить на разные цвета, каждый из которых
оказывает свое воздействие на рост и развитие растений. Наши знания в этой области расширяются, и
мы начинаем применять их на практике.
Растения «видят» разные цвета светового спектра, используя нечто вроде сенсора, который состоит из светочувствительных пигментов. Примерами таких пигментов являются фитохром, криптохром и фототропины. Они чувствительны к разным цветам светового спектра. Например, фитохром чувствителен к красному и дальнему красному, в меньшей мере — к другим. Определённый цвет светового спектра перемещает пигмент внутри растения на соответствующую позицию, вследствие чего в растении активизируются такие процессы, как, например, выработка растительных гормонов.
Расширение знаний в области воздействия светового спектра
Проведение испытаний в климатических камерах непрерывно расширяет наши знания в области воздействия цветов светового спектра на растения. Светодиоды позволяют выбрать цвет, и мы видим, как на него реагирует растение. В результате воздействия красного света растения бывают небольшими и кустистыми; дальний красный свет формирует высокие и вытянутые.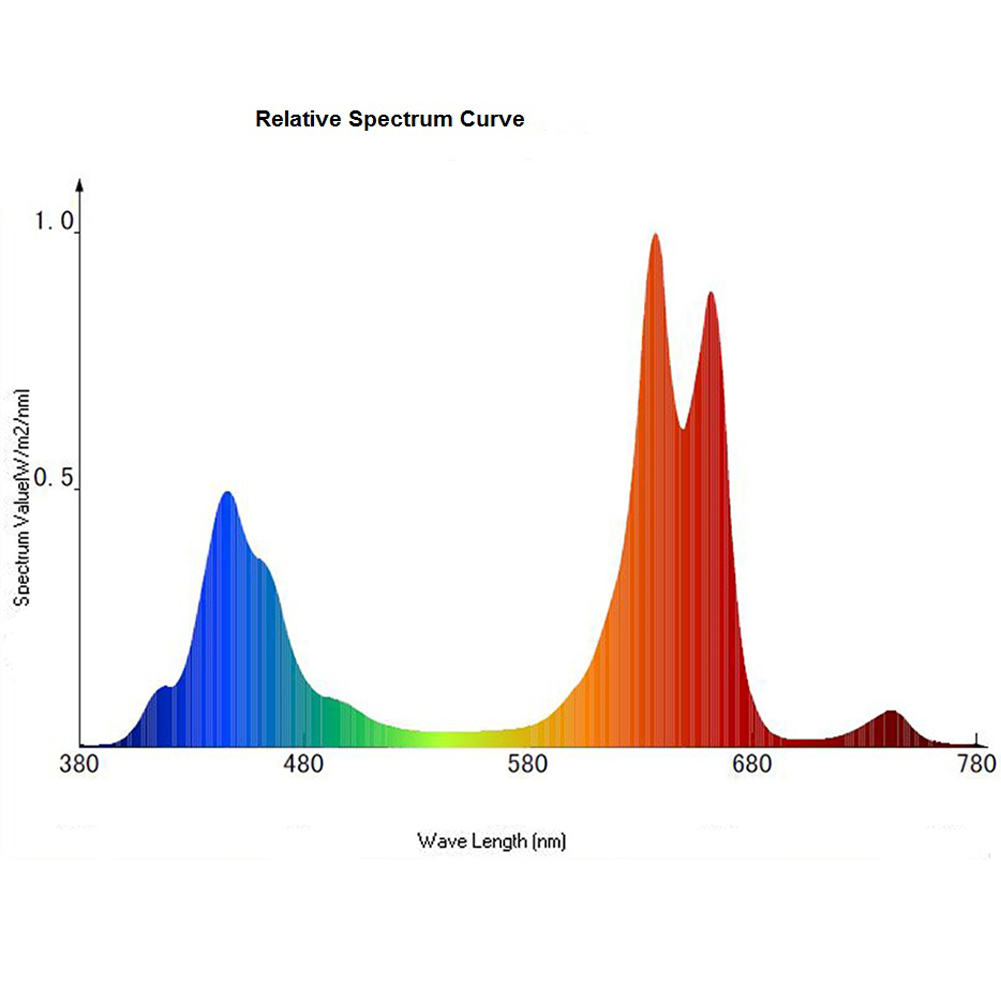 Комбинация красного и дальнего красного света стимулирует начало цветения и само цветение. Синий ведёт к дальнейшему раскрытию устьиц, а также ограничивает количество образующихся устьиц во время формирования листа. Этот свет снижает сопротивляемость системы переноса воды в листьях, а также уменьшает вытягивание растения. В некоторых случаях зеленый свет снижает уровень воздействия синего света.
Комбинация красного и дальнего красного света стимулирует начало цветения и само цветение. Синий ведёт к дальнейшему раскрытию устьиц, а также ограничивает количество образующихся устьиц во время формирования листа. Этот свет снижает сопротивляемость системы переноса воды в листьях, а также уменьшает вытягивание растения. В некоторых случаях зеленый свет снижает уровень воздействия синего света.
Практическое применение пока затруднительно
Это важная информация для растениеводства. Однако, на данный момент, использовать эти знания на практике довольно сложно. В теплице возникает много неожиданных эффектов, поскольку, например, солнечный свет (который содержит в себе все цвета спектра) играет самую важную роль, но также и потому, что состав естественного освещения не постоянен. В некоторых случаях важную роль играют биологические часы растения – так, например, в определенное время дня синий спектр оказывает воздействие,а в другое время – нет .
Знания о воздействии цветов спектра обеспечивают агроному большую гибкость в решениях, но усложняют выбор.
Ассимиляционное освещение, использование экранируемых штор и тип используемого стекла на кровле также оказывает воздействие на световой спектр, влияющий на растения. Таким способом, зачастую не осознавая этого, агрономы уже правляют светом.
Целенаправленное управление светом
Целью, конечно же, является целенаправленное управление светом. Этого можно добиться, изменив соотношение разных цветов спектра. Изначально специалисты рассматривали вариант управления светом при помощи светодиодов. Тем не менее, учитывая нынешний объем знаний в этой области и современные технологии, возможности зачастую ограничены. Например, если бы вы захотели соединить в пропорции 50/50 красный свет и солнечный свет,чтобы горшечные растения не разрослись, вам пришлось бы установить невозможно огромное количество ламп. Кроме того, даже очень небольшое количество дальнего
Использование покрытий позволяет влиять на определенные реакции растений путем фильтрации определенного спектра.
Среди новых разработок – покрытия ReduFlex Blue и ReduFlex Green. Они отражают часть ФАР-света внутри светового спектра, чтобы добиться определенного эффекта для растения. На приведенном выше графике показан уровень отражения по отношению к цвету спектра. В случае применения ReduFlex Blue к растениям проникает относительно больше красного света, чем синего. Поскольку синий свет уменьшает вытягивание растений, это приводит к значительному увеличению длины, например, роз. Мы протестировали ReduFlex Green при выращивании томатов. Это покрытие сохраняет соотношение красного и синего спектров; зеленый свет частично отражается растением, а оставшаяся часть превращается в тепло. Благодаря отсеиванию высокоэнергетического зеленого света сохраняется более низкая температура растения. Это способствует вегетативному росту, что несомненно является преимуществом на объектах выращивания культур с теплым и сухим микроклиматом.
На протяжении многих лет ReduSystems были в первых рядах инновационных технологий. Вместе с ведущими всемирными исследовательскими центрами, университетами и агрономами мы ведем непрерывную разработку новой продукции и тестируем ее. Мы не перестаем внедрять технические новшества для разработки специальных покрытий для выращивания растительных культур. Семейство ReduSystems пополняют исключительно высококлассные продукты, имеющие эффект добавочной стоимости.
Смотрите также
Досветка в теплицах – Теплицы России
Эта статья продолжает тему, затронутую в статье «Светодиодный свет для теплиц» (опубликована на ресурсах www.enova-l.ru и rusteplica.ru). Освещаются аспекты современной тепличной досветки.
ЧТО ДАЛА ПРИРОДА
Основным и наиважнейшим свойством растений является фотосинтез. Суть фотосинтеза состоит в том, что растения используют солнечный свет для того, чтобы преобразовать воду и углекислый газ в кислород и сахара (органику). Т.е. преобразуют солнечную энергию в химическую. Это свойство и использует человек при выращивании различных культур растений.
Т.е. преобразуют солнечную энергию в химическую. Это свойство и использует человек при выращивании различных культур растений.
Безусловно, наиболее благоприятным типом освещения для растений является естественное освещение, характерное ареалам обитания той или иной рассматриваемой культуры. Эволюция делала и делает свое дело.
Единственным источником естественного освещения является солнце. Оно излучает свет, часть которого рассеивается в атмосфере и создает рассеянное излучение. Т.е. следует различать свет, падающий непосредственно от солнца и свет «неба» — солнечного света рассеянного атмосферой. В тени свойства света также меняются за счет частичного и избирательного отражения или поглощения различных спектральных составляющих. Естественное освещение меняется в зависимости от времени суток, состояния атмосферы, погодных условий и времени года. Главная особенность естественного освещения – непостоянство интенсивности и спектрального состава его излучения, которое подвержено влиянию закономерных и случайных факторов.
Природа света носит корпускулярно-волновой характер. Т.е., свет обладает одновременно свойствами частицы и электромагнитной волны. Частица света фотон может иметь различную частоту электромагнитной волны ѵ, величина которой определяет энергию фотона Е:
Е=hѵ, где h = 6.63×10-34 Дж×сек – постоянная Планка.
Как правило, источники света излучают фотоны различных частот, которые в совокупности формируют спектр излучения данного источника света. Для удобства при рассмотрении спектра видимого света оперируют не частотой фотона, а его длиной волны. В данном случае длина волны измеряется в нанометрах. Диапазон фотосинтетической активной радиации (ФАР – излучение, которое усваивается растениями в процессе фотосинтеза) примерно совпадает с диапазоном видимой части света. «Синие» фотоны имеют по сравнению с «красными» более короткую длину волны. Т.е. имеют частоту выше и энергию больше. Разница энергий на границах ФАР составляет почти двукратный размер.
ЧТО ГОВОРИТ НАУКА
Исследования в области фотосинтеза базируются на работах К. А. Тимирязева и на теории фотоэффекта, сформулированной А. Эйнштейном. Согласно этим представлениям считалось, что интенсивность фотосинтеза зависит не от количества поглощенной энергии, а от числа поглощенных фотонов. Как следствие, был сделан вывод, что поглощенная энергия в красном участке спектра используется более эффективно, поскольку энергия «красных» фотонов гораздо меньше по сравнению с «синими». Именно поэтому за границей получила популярность система оценки тепличного света, основанная на измерении фотосинтетического фотонного потока (ФФП), т.е. количества фотонов испускаемых источником света за единицу времени в той части спектра, которая пригодна для фотосинтеза (400-700 нанометров (по некоторым оценкам 320-750 нанометров)). На практике уровень ФФП измеряется в мкмоль/сек (1 моль = 6.023х1023). Оборудование для точного измерения ФФП было и остается достаточно дорогим для общедоступного применения. В СССР, а затем в России широко использовались такие способы оценки, как измерение в люксах и измерение уровня фотосинтетической активной радиации (ФАР), выраженной в ваттах. Измерение в люксах не корректно, поскольку эта единица измерения ориентирована на особенности человеческого зрения и не подходит для объективной оценки тепличных источников света*. С точки зрения вышеописанных представлений измерения ФФП или ФАР не давали полноты картины об эффективности источника света, поскольку не отражали качественный состав спектра излучения этого источника.
В СССР, а затем в России широко использовались такие способы оценки, как измерение в люксах и измерение уровня фотосинтетической активной радиации (ФАР), выраженной в ваттах. Измерение в люксах не корректно, поскольку эта единица измерения ориентирована на особенности человеческого зрения и не подходит для объективной оценки тепличных источников света*. С точки зрения вышеописанных представлений измерения ФФП или ФАР не давали полноты картины об эффективности источника света, поскольку не отражали качественный состав спектра излучения этого источника.
В 2014 году были получены доказательства, что механизм фотосинтеза использует вибронную квантовую когерентность [3]. Суть этого явления состоит в том, что энергия поглощенных фотонов используется растением с очень высокой эффективностью близкой к 100%. Это означает, что энергия любого фотона («голубого» или «красного») используется в полной мере без потерь. Это в свою очередь означает, что интенсивность фотосинтеза все-таки зависит не столько от числа поглощенных фотонов, сколько от количества поглощенной энергии.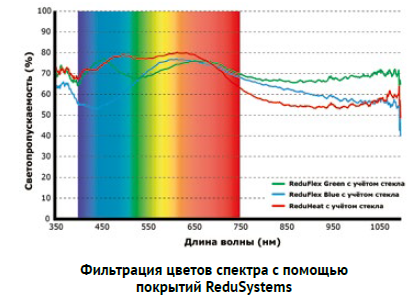 Звучит разумно, поскольку трудно заподозрить природу в неспособности эффективно использовать имеющиеся ресурсы. Современные исследования указывают на то, что растения для улавливания света используют сложный молекулярный комплекс. Молекулы хлорофилла и другие поглощающие свет антенные пигменты способны улавливать фотоны с различными длинами волн из всего диапазона ФАР. В особую группу следует выделить «зеленые» фотоны, которые практически не поглощаются по причине почти полного отражения от поверхности листа.
Звучит разумно, поскольку трудно заподозрить природу в неспособности эффективно использовать имеющиеся ресурсы. Современные исследования указывают на то, что растения для улавливания света используют сложный молекулярный комплекс. Молекулы хлорофилла и другие поглощающие свет антенные пигменты способны улавливать фотоны с различными длинами волн из всего диапазона ФАР. В особую группу следует выделить «зеленые» фотоны, которые практически не поглощаются по причине почти полного отражения от поверхности листа.
Получается, что корректней измерять уровень ФАР в ваттах, а не ФФП в мкмоль/сек. А качество спектра оценивать по степени сходства с естественным освещением. В любом случае, для полноценного роста растений нужны синие и красные спектральные составляющие. С этим согласятся как теоретики, так и практики. Система фотосинтеза растений обладает большой гибкостью по адаптации к условиям окружающей среды, в том числе и к спектральному составу спектра. Но такая адаптация происходит за счет изменения биохимической структуры. И если Вы попытаетесь сильно изменить естественные условия произрастания культуры, то можете получить результат, которого не ждали. Например, «пластмассовые» помидоры или огурцы без вкуса и запаха. Такой результат частично может быть обязанным применению натриевых ламп высокого давления (НЛВД).
И если Вы попытаетесь сильно изменить естественные условия произрастания культуры, то можете получить результат, которого не ждали. Например, «пластмассовые» помидоры или огурцы без вкуса и запаха. Такой результат частично может быть обязанным применению натриевых ламп высокого давления (НЛВД).
Проводить измерения ФАР в ваттах не только удобней, но и дешевле. Цена такого прибора сопоставима с ценой люксметра. Для светодиодных светильников достаточно просто проводить теоретический расчет уровня полезного излучения в ваттах, поскольку все излучение светодиода полностью приходится на область ФАР (400-700 нанометров). Чего нельзя сказать про НЛВД и другие типы тепличных источников света.
Простоту теоретического расчета покажем на примере белого светодиода LH934A от фирмы SAMSUNG. Производитель предоставляет на этот светодиод данные о зависимости рассеиваемой (тепловой) мощности от мощности потребления (см. Рисунок 1). Мощность излучения светодиода в области ФАР рассчитывается как разница между мощностью потребления и рассеиваемой мощностью. Таким образом, выбирая режим работы светодиода путем фиксации мощности потребления, разработчик в состоянии рассчитать мощность излучения. Это очень важно, поскольку потребитель может самостоятельно достаточно просто оценить возможности того или иного светодиодного светильника.
Таким образом, выбирая режим работы светодиода путем фиксации мощности потребления, разработчик в состоянии рассчитать мощность излучения. Это очень важно, поскольку потребитель может самостоятельно достаточно просто оценить возможности того или иного светодиодного светильника.
Рисунок 1. Зависимость рассеиваемой мощности от мощности потребления.
Белый светодиод имеет сплошной спектр, как у естественного солнечного света. Его качественный состав наиболее близок к солнечному излучению по сравнению с другими тепличными источниками света. Для светодиода со цветовой температурой 5000К спектр представлен на рисунке 2.
Фитосветильники, которые используют красные и синие светодиоды имеют дискретный состав спектра (см. Рисунок 3). Легко заметить, что спектр таких фитосветильников в отличии от НЛВД (см. Рисунок 4) имеет высокий уровень «синих» спектральных составляющих (пропорции «синих» и «красных» составляющих могут в принципе регулироваться). Это является безусловным плюсом.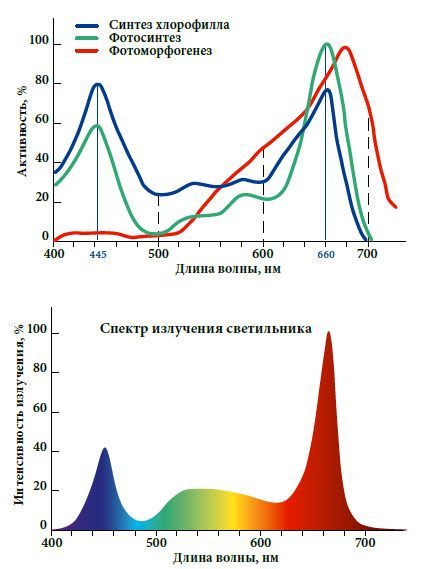 Но этот спектр все-таки сильно отличается от солнечного. Каким образом такая разница может отразиться на качестве роста растений – вопрос, который требует дополнительных исследований.
Но этот спектр все-таки сильно отличается от солнечного. Каким образом такая разница может отразиться на качестве роста растений – вопрос, который требует дополнительных исследований.
Рисунок 2. Спектр белого светодиода со цветовой температурой 4000К и 5000К.
Рисунок 3. Спектр фитосветильников со цветными светодиодами.
Рисунок 4. Спектр НЛВД ДНаз Рефлакс.
*Характерный пример. Модели белых светодиодов выпускаются с широким набором цветовых температур от 2000К до 7000К. Мощность ФАР для всех вариантов цветовых температур для конкретной модели белого светодиода будет неизменной. В то время как уровень светового потока будет различным.
ЕСТЕСТВЕННОЕ ОСВЕЩЕНИЕ
Закономерные факторы, влияющие на изменчивость естественного освещения – высота солнца над горизонтом и географическая широта. К случайным факторам относятся состояние атмосферы (ясно, дождь, туман и т.п.) и эффекты отражения и поглощения света от земли и окружающих предметов.
Рисунок 5. Cпектральная характеристика естественного освещения.
С восходом солнца увеличивается интенсивность света и его цветовая температура. Коротковолновые лучи света (от фиолетового до зеленого) преломляются в атмосфере Земли сильнее, чем длинноволновые (желтые и красные). Поэтому первые и последние лучи солнца – синий и зеленый. Молекулы газов и аэрозоли отвечают за бóльшую часть поглощения излучения. Рассеивание солнечного излучения на каплях воды и кристаллах льда происходит во всем спектральном диапазоне. Молекулы в основном рассеивают излучения коротких длин волн, а аэрозоли – более длинных. Это приводит к увеличению доли коротковолновых составляющих (соответственно и к росту цветовой температуры) по мере продвижения солнца к зениту.
Густота облаков, их высота и расположение по отношению к солнцу, дымка, туман, дождь, снег оказывают значительное влияние на освещенность объектов, контрастность и спектральные характеристики света. Например, при наличии кучевой облачности освещенность незатененных объектов, освещенных солнцем, увеличивается на 25%, а освещенность в тени возрастает в два с половиной раза. Контрастность освещения снижается приблизительно в два раза в сравнении с освещением в безоблачную погоду. При сплошной облачности наблюдается значительное уменьшение освещенности и контрастности освещения.
Контрастность освещения снижается приблизительно в два раза в сравнении с освещением в безоблачную погоду. При сплошной облачности наблюдается значительное уменьшение освещенности и контрастности освещения.
Таблица 1. Спектральные характеристики естественного освещения.
| Фазы дневного освещения | Цветовая температура излучения, К |
| Прямые солнечные лучи при восходе и заходе солнца | 2200 |
| Прямой солнечный свет через час после восхода солнца | 3500 |
| Прямой солнечный свет ранним утром и в предвечернее время | 4000…4300 |
| Солнечный свет в полдень летом | 5400…5800 |
| Рассеянный дневной свет в тени летом | 7000 |
| Рассеянный дневной свет в пасмурную погоду | 7500…8400 |
| Свет от голубого неба | 9500…30000 |
| Данные приведены для средней полосы (широта 550) | |
Таблица 2. Пример освещенности земной поверхности в безоблачную погоду в различные периоды года и часы дня, %.
Пример освещенности земной поверхности в безоблачную погоду в различные периоды года и часы дня, %.
| Месяцы | Время суток, час | ||||||||
| 5 | 7 | 9 | 11 | 13 | 15 | 17 | 19 | 21 | |
| Июнь | 1 | 3 | 6 | 89 | 100 | 89 | 58 | 24 | 1 |
| Май – июль | 1 | 19 | 54 | 79 | 91 | 79 | 51 | 17 | 0 |
| Апрель – август | 0 | 10 | 40 | 64 | 75 | 67 | 39 | 8 | 0 |
| Март – сентябрь | 0 | 1 | 24 | 47 | 58 | 49 | 23 | 1 | 0 |
| Февраль – октябрь | 0 | 0 | 7 | 26 | 35 | 26 | 7 | 0 | 0 |
| Январь – ноябрь | 0 | 0 | 2 | 12 | 19 | 13 | 2 | 0 | 0 |
| Декабрь | 0 | 0 | 1 | 8 | 13 | 8 | 0 | 0 | 0 |
| Данные приведены для средней полосы (широта 550) | |||||||||
Таблица 3. Пример изменение светлого и темного времени суток в течении года.
Пример изменение светлого и темного времени суток в течении года.
Как видно из вышеприведенных таблиц в зависимости от времени года изменяется не только продолжительность светлого времени суток, но и суточный уровень ФАР.
Температура на поверхности солнца составляет около 5770 К. Мощность энергии, излучаемой нашим светилом, составляет около 63 МВт с каждого квадратного метра его поверхности, всего около 3.72х1020 МВт. Плотность энергии солнечного излучения, которое достигает атмосферы Земли, составляет в среднем 1.367 кВт/м2. Эта величина называется солнечной постоянной, флуктуации которой не превышают 0.1%. Максимальная интенсивность излучения приходится на диапазон от 400 до 800 нм (см. рисунок 5). На долю ФАР приходится примерно 50% от всего солнечного излучения, достигающего поверхности Земли. В безоблачный день поток солнечной энергии, достигающий земной поверхности в местный полдень, обычно находится в интервале от 700 до 1300 Вт/м2 в зависимости от широты, долготы, высоты над уровнем моря и времени года.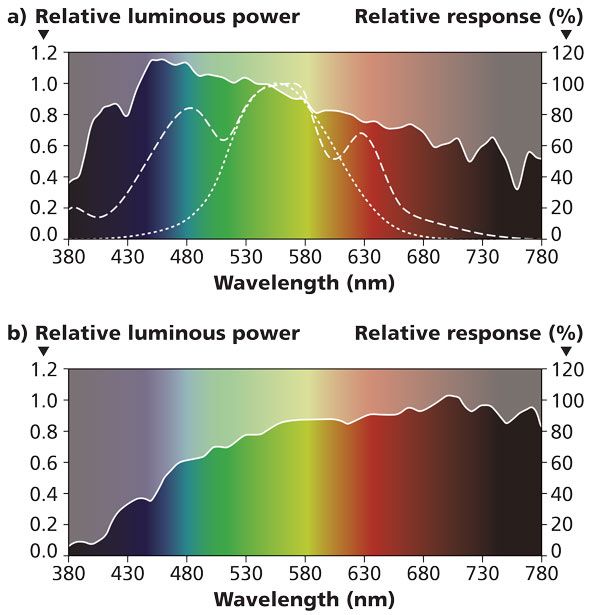
Рисунок 6. Средняя солнечная радиация на территории России (с апреля по сентябрь).
В настоящее время создана база климатологических данных и атлас ресурсов солнечной энергии. Фактологическая основа: данные наземных метеостанций РФ и базы данных NASA SSE. Данные этих служб носят интегральный характер и накапливаются годами. Имеют место быть месячные, сезонные и годовые отклонения от этих усредненных параметров. Помимо этого, количество наземных станций для территории России явно недостаточно для точных оценок по всей территории страны. Погрешность может составлять 0.5 кВт×ч/м2×день. Сами наземные метеостанции ведут постоянный мониторинг солнечной радиации и вблизи их расположения возможно получить довольно исчерпывающую и точную информацию.
Существует еще один интегральный источник информации. По рекомендациям Всемирной Метеорологической Организации (ВМО) в качестве стандартного периода для оценивания климатических переменных, характеризующих текущий или современный климат используется период в 30 лет (в настоящее время это 1961-1990 годы). Термин «норма» по умолчанию означает среднее значение переменной величины за указанный период, а отклонение этой величины от «нормы» называют «аномалией». Доклады об особенностях климата на территории Российской Федерации и аномалиях периодически публикует РОСГИДРОМЕТ.
Термин «норма» по умолчанию означает среднее значение переменной величины за указанный период, а отклонение этой величины от «нормы» называют «аномалией». Доклады об особенностях климата на территории Российской Федерации и аномалиях периодически публикует РОСГИДРОМЕТ.
Несмотря на то, что для некоторых территорий информация по солнечной радиации имеет достаточно большую погрешность, тем не менее, она позволяет сделать приблизительную оценку эффективности осветительной установки для теплицы с конкретными географическими координатами. На основании этих данных ООО «ЭНОВА Лайт» предоставляет своим клиентам бесплатную услугу по расчету эффективности досветки.
КАКОЙ УРОВЕНЬ ДОСВЕТКИ НЕОБХОДИМ?
Сразу следует отметить, что необходимый уровень досветки может охватывать диапазон от единиц до нескольких десятков ватт на квадратный метр в области ФАР. Все зависит от многих факторов, присущих проекту той или иной конкретной теплицы, выбора практики ее использования (сезонное или круглогодичное выращивание, культивируемые виды и сорта растений). С помощью светильников ЭЛ-008МТ-240 производства ООО «ЭНОВА Лайт» достижим уровень облученности 530 Вт/м2, что с лихвой хватает для организации полностью искусственного освещения.
С помощью светильников ЭЛ-008МТ-240 производства ООО «ЭНОВА Лайт» достижим уровень облученности 530 Вт/м2, что с лихвой хватает для организации полностью искусственного освещения.
В первую очередь необходимо выяснить, какой уровень освещенности необходим для культивирования тепличных растений. В этом нам поможет опыт эксплуатации круглогодичных интенсивных производств растительной продукции [6]. Почему именно такой опыт? Потому, что в условиях таких фитокомплексов можно зафиксировать все факторы, влияющие на фотосинтез, на оптимальном уровне. Следовательно, получить объективную оценку о минимально достаточном уровне освещенности для прорастания в закрытом грунте. В условиях теплиц таких условий эксперимента достичь невозможно, поскольку все факторы подвержены постоянным изменениям.
Вспомним, что определяющими параметрами освещения для фотосинтеза являются как мощность излучения, так и длительность его воздействия в течении суток (интегральный параметр — моль/м2/день (DLI) или кВт×ч/м2×день (средняя солнечная радиация в области ФАР)).
Для запуска фотосинтеза необходимо обеспечить минимальный уровень облучения. Этот уровень носит не постоянный характер. Он непосредственно зависит от положения компенсационной точки. Под компенсационной точкой понимается та освещенность, при которой процессы фотосинтеза и дыхания растения уравновешивают друг друга. Положение компенсационной точки зависит от многих факторов. В частности есть сильная зависимость от температуры. Для каждой выращиваемой культуры существуют оптимальные для произрастания диапазоны температур (дневные, ночные, стадийные (в смысле стадий роста)), влажность, баланс питания, состав атмосферы и т.д.
Для получения урожая необходимо обеспечить получение определенного уровня лучистой продуктивной энергии (ФАР) в течении суток (кВт×ч/м2×день).
Итак, согласно результатам исследований различных организаций, имеем следующие результаты (по разным причинам результаты связаны с применением НЛВД):
- 15-30 Вт/м2 – низкая интенсивность ФАР (минимально допустимая): рост вегетативных органов происходит, но не образуются полноценные генеративные органы.
- 40 Вт/м2 – согласно разработкам Института Гипронисельпрома такая ФАР с фотопериодом 14 часов (0.56 кВт×ч/м2×день) является оптимальной нормой облученности в теплице для выращивания рассады.
- 65-90 Вт/м2 – на высокоэффективных фитокомплексах круглогодичного интенсивного производства растительной продукции разработки Агрофизического института достигается высокая урожайность [6]. Разработчик сообщает, что на установках можно получать несколько урожаев в год (томат – 4, перец – 3, огурец – 4÷6, сельдерей листовой, укроп, петрушка – 12÷14, листовая горчица – 16÷18, кресс-салат – 20÷24). Продукция имеет высокие качественные показатели по содержанию витаминов, минеральных элементов и по другим характеристикам пищевой ценности. Содержание нитратов в ней значительно ниже установленных санитарных норм (табл.), полностью отсутствуют пестициды и другие загрязнители.
Коэффициент равномерности облученности 0.55÷0.75. Длительность облучения не указана. Видимо зависит от выращиваемой культуры (12÷16 часов).
- 100 Вт/м2 – согласно разработкам Института Гипронисельпрома такая ФАР с фотопериодом 16 часов (1.6 кВт×ч/м2×день) является оптимальной нормой облученности в теплице для выращивания на продукцию.
- 150-220 Вт/м2 – согласно многим источникам считается оптимальной интенсивностью ФАР, при которой наблюдается максимальное накопление биомассы в единицу времени. Фотосинтез и рост хорошо сбалансированы при фотопериоде 16 часов (2.4÷3.52 кВт×ч/м2×день).
- 280-300 Вт/м2 – верхний разумный предел применения досветки. В зависимости от метода управления искусственным освещением реализуется соответствующий алгоритм отключения досветки.
- 400 Вт/м2 (фотопериод 16ч.-6.4 кВт×ч/м2×день) и более – насыщенная интенсивность ФАР, при которой достигается выход фотосинтеза на плато светового насыщения, т.е. максимальный фотосинтез. Растения приобретают низкорослую форму.
Далее необходимо определиться с практикой использования теплицы (сезонное или круглогодичное).
При круглогодичной практике однозначно потребуется фотопериодическое освещение. Осветительная установка должна будет работать в темное время суток и должна полностью обеспечивать заданный уровень фотосинтеза. Следует отметить, что в данной ситуации выбор мощности осветительной установки начинает свой отсчет с минимально необходимого уровня, который не зависит от географии теплицы!!! От географии будет зависеть время эксплуатации осветительной установки в годовом цикле. По всей видимости минимально необходимым уровнем ФАР осветительной установки следует считать 40 Вт/м2 (при фотопериоде 16 ч — 0.64 кВт×ч/м2×день, при 20 ч — 0.8 кВт×ч/м2×день).
До недавних пор бытовало мнение, что теплицы необходимо размещать в южных широтах, а продукцию доставлять с помощью хорошо отлаженной логистики. Сейчас в Европе благодаря развитию технологий эта концепция пересматривается в пользу размещения теплиц в непосредственной близости от потенциального потребителя. В этом случае продукция в не двусмысленном понимании попадает на прилавки буквально с «грядки». В России с ее просторами и ограниченными логистическими возможностями для многих регионов такой подход к размещению теплиц крайне актуален. Вопреки устоявшимся заблуждениям почти вся территория России имеет уровень облученности гораздо выше, чем могло бы показаться (см. рисунок 6). Некоторые северные территории в теплое полугодие имеют уровень естественного освещения сопоставимый с южными. Хотя из-за различий в микроклимате и топографии местности ошибка в выборе места расположения теплицы на сотню другую километров может привести к существенному уменьшению возможного количества солнечных дней в году.
В южных широтах летняя жара доставляет немало забот для службы эксплуатации теплицы. Необходимость проветривания понижает уровень углекислого газа вокруг растений. В полуденные часы растения могут испытывать стресс от жары. В совокупности эти факторы снижают эффективность фотосинтеза и требуют дополнительных затратных мер по компенсации негативных эффектов.
В северных широтах такая проблема постепенно сходит на нет. Но проявляется другая проблема – сильные морозы зимой. Современные теплоизоляционные материалы помогают довольно успешно решать эту проблему. В некоторых случаях заглубление теплиц до глубины, где температура грунта остается практически неизменной в течении всего года, позволит существенно снизить затраты на отопление.
Возможны различные варианты использования энергии недр как в северных, так и в южных широтах.
При слишком интенсивном облучении скорость темновых реакций фотосинтеза может не успевать за скоростью световых. В этом случае можно попробовать практику прерывистого включения досветки в темное время суток. При этом для более эффективного использования энергии света длительность темновых промежутков должна превышать длительность световых. Эффективность этого метода – научно доказанный факт.
В настоящее время карты ресурсов и базы данных солнечной энергии находятся в открытом доступе. На основании этих данных разработчик может определить условия облученности для различных территорий. Наихудшие условия по естественному освещению приходятся на декабрь месяц в дни зимнего солнцестояния. Именно эти условия предъявляют требования к круглогодичной досветке.
Оценим, что может дать минимальный уровень досветки 40 Вт/м2 с фотопериодом 16÷22 часов для различных территорий. На основании данных геоинформационных систем (ГИС) мы получили показательные результаты (см. таблицу 4). Добавьте к этим результатам суточную дозу досветки (см. таблицу 5) и сделайте вывод. А вывод можно сделать следующий. Уровень досветки мощностью 40 Вт/м2 позволяет реализовать круглогодичное выращивание растений в теплицах практически на всех широтах России. Хотя в северных широтах для адекватных результатов этого уровня явно не достаточно.
Таблица 4.1 . Суммарная солнечная радиация в области ФАР в декабре (кВтч/м2/день).
| Местность | Широта/ Долгота | Рфар. сум. кВтч/м2/день | Продолжительность светового дня, Тсв (час:мин) | Средняя мощность, Рср (Вт/м2) |
| Махачкала | 42/47 | 0.74 | 09:04 | 84 |
| Кисловодск | 43/42 | 0.76 | 08:57 | 85 |
| Мин. Воды | 44/43 | 0.6 | 08:53 | 67 |
| Краснодар | 45/38 | 0.51 | 08:49 | 63 |
| Таганрог | 47/38 | 0.5 | 08:33 | 59 |
| Воронеж | 51/39 | 0.39 | 07:53 | 50 |
| Иркутск | 52.3/104.3 | 0.44 | 07:47 | 57 |
| Новосибирск | 55/82 | 0.25 | 07:16 | 34 |
| Северобайкальск | 55.6/109.3 | 0.33 | 07:12 | 45 |
| С.-Петербург | 59/30 | 0.13 | 06:02 | 22 |
| Магадан | 59/150 | 0.13 | 06:15 | 21 |
| Якутск | 62/130 | 0.06 | 05:19 | 12 |
| Анадырь | 65.1/175.3 | 0.02 | 04:06 | 5 |
| Норильск | 69/88 | 0 | 0 | 0 |
| о. Шмидта | 81/91 | 0 | 0 | 0 |
Таблица 4.2 . Суммарная солнечная радиация в области ФАР в январе и феврале (кВтч/м2/день).
| Местность | Январь | Февраль | ||||
| Рфар. сум. кВтч/м2/день | Тсв (час:мин) | Рср (Вт/м2) | Рфар. сум. кВтч/м2/день | Тсв (час:мин) | Рср (Вт/м2) | |
| Махачкала | 0.89 | 09:25 | 94 | 1.25 | 10:33 | 119 |
| Кисловодск | 0.9 | 09:20 | 97 | 1.35 | 10:30 | 129 |
| Мин. Воды | 0.74 | 09:16 | 80 | 1.12 | 10:28 | 107 |
| Краснодар | 0.62 | 09:13 | 67 | 1 | 10:26 | 99 |
| Таганрог | 0.64 | 08:58 | 71 | 1.05 | 10:18 | 102 |
| Воронеж | 0.5 | 08:24 | 62 | 0.99 | 10:00 | 99 |
| Иркутск | 0.58 | 08:18 | 70 | 1.1 | 09:56 | 115 |
| Новосибирск | 0.25 | 07:53 | 31 | 0.83 | 09:43 | 85 |
| Северобайкальск | 0.44 | 07:45 | 57 | 0.69 | 09:40 | 92 |
| С.-Петербург | 0.22 | 06:52 | 32 | 0.6 | 09:12 | 65 |
| Магадан | 0.21 | 06:55 | 31 | 0.6 | 09:15 | 65 |
| Якутск | 0.14 | 06:16 | 23 | 0.58 | 08:54 | 68 |
| Анадырь | 0.07 | 05:13 | 14 | 0.33 | 08:25 | 39 |
| Норильск | 0.005 | 03:14 | 1 | 0.17 | 07:28 | 23 |
| о. Шмидта | 0 | 0 | 0 | 0 | 0 | 0 |
Таблица 4.3 . Суммарная солнечная радиация в области ФАР в марте и апреле (кВтч/м2/день).
| Местность | Март | Апрель | ||||
| Рфар. сум. кВтч/м2/день | Тсв (час:мин) | Рср (Вт/м2) | Рфар. сум. кВтч/м2/день | Тсв (час:мин) | Рср (Вт/м2) | |
| Махачкала | 1.69 | 11:59 | 141 | 2.15 | 13:26 | 160 |
| Кисловодск | 1.86 | 11:59 | 155 | 2.23 | 13:29 | 165 |
| Мин. Воды | 1.55 | 11:58 | 129 | 2.13 | 13:30 | 158 |
| Краснодар | 1.49 | 11:58 | 124 | 2.1 | 13:33 | 155 |
| Таганрог | 1.49 | 11:58 | 124 | 2.05 | 13:40 | 154 |
| Воронеж | 1.58 | 11:57 | 132 | 1.97 | 13:57 | 141 |
| Иркутск | 1.87 | 11:56 | 157 | 2.44 | 13:59 | 173 |
| Новосибирск | 1.5 | 11:55 | 127 | 2.2 | 14:11 | 156 |
| Северобайкальск | 1.5 | 11:55 | 139 | 2.31 | 14:15 | 162 |
| С.-Петербург | 1.23 | 11:55 | 103 | 1.96 | 14:40 | 134 |
| Магадан | 1.36 | 11:55 | 114 | 2.16 | 14:45 | 147 |
| Якутск | 1.41 | 11:52 | 119 | 2.28 | 14:54 | 152 |
| Анадырь | 0.9 | 11:51 | 76 | 1.78 | 15:10 | 118 |
| Норильск | 0.72 | 11:49 | 61 | 1.72 | 16:14 | 106 |
| о. Шмидта | 0.19 | 12:44 | 15 | 1.25 | 22:00 | 57 |
Таблица 4.3 . Суммарная суточная доза досветки (кВтч/м2/день).
| Мощность досветки (Вт/м2) | Продолжительность досветки (час) | |||
| 16 | 18 | 20 | 22 | |
| 10 | 0.16 | 0.18 | 0.2 | 0.22 |
| 20 | 0.32 | 0.36 | 0.4 | 0.44 |
| 30 | 0.48 | 0.54 | 0.6 | 0.66 |
| 40 | 0.64 | 0.72 | 0.8 | 0.88 |
| 50 | 0.8 | 0.9 | 1.0 | 1.1 |
| 60 | 0.96 | 1.08 | 1.2 | 1.32 |
| 70 | 1.19 | 1.26 | 1.4 | 1.54 |
| 80 | 1.28 | 1.44 | 1.6 | 1.76 |
| 90 | 1.44 | 1.62 | 1.8 | 1.98 |
| 100 | 1.6 | 1.8 | 2.0 | 2.2 |
Данные таблиц 4 и 5 указывают на то, что в летние месяцы в южных и средних широтах возникнет необходимость выключения досветки в полуденные часы. Но полностью отказываться от досветки не придется даже в летние дни. Поддержание фотопериода на должном уровне с одновременным поддержанием достаточно высокой мощности облучения даст по-настоящему повышенную эффективность теплицы.
Если Вы перейдете на более высокие уровни досветки (60÷100 Вт/м2), то получите высокую урожайность качественной продукции в зимние месяцы. В условиях заполярного круга могут быть использованы два типа освещения растений. Первый, это полностью искусственное освещение в закрытых отапливаемых помещениях круглый год. Второй, это по окончании полярной ночи перемещение растений в отапливаемые теплицы (оранжереи). Малые габариты и вес светильников производства ООО «ЭНОВА Лайт» допускают быстрое и легкое их переподключение в нужное место в нужное время. Такое свойство наших светильников может быть полезно для фермерских теплиц. В зависимости от времени года фермер может при ограниченности мощности осветительной установки сконцентрировать свет на отдельных участках теплицы. Чтобы избежать единовременных высоких затрат на осветительную установку фермер может изначально установить минимально необходимый уровень досветки с последующим наращиванием ее мощности по мере возможности.
Немного об уровне досветки 15-30 Вт/м2. Вероятно, для некоторых культур и при определенных условиях можно будет добиться круглогодичного роста. Такой уровень досветки будет хорош для ассимиляционного освещения, который поможет несколько увеличить фотопериод, поднять урожайность и качество продукции. Более низкие уровни досветки тоже имеют право на существование. Но результат будет соответствующий.
Рассчитать параметры осветительной установки для Вашей теплицы можете с помощью калькулятора на нашем сайте www.enova-l.ru.
Продолжение следует. Нам еще есть, что сообщить Вам.
Периодически посещайте наш сайт
Список литературы
- Растения используют квантовые эффекты для усиления фотосинтеза, РИА Новости http://ria.ru/science/20130621/944793248.html#ixzz4ECxU7rZ0, 2013 г.
- Квантовый биокомпьютер, http://www.3dnews.ru/offsyanka/631421/, 2012 г.
- Механизм фотосинтеза использует вибронную квантовую когерентность, http://elementy.ru/novosti_nauki/432292/Mekhanizm_fotosinteza_ispolzuet_vibronnuyu_kvantovuyu_kogerentnost, 2014 г.
- Измерение солнечного излучения в солнечной энергетике, Kipp & Zonen B.V. (www.kippzonen.com), 2016 г.
- http://gisre.ru
- Г.Г. Панова, И.Н. Черноусов, О.Р. Удалова, А.В. Александров, И.В. Карманов, Л.М.Аникина, В.Л.Судаков. Фитокомплексы в России: основы создания и перспективы использования для круглогодичного получения качественной растительной продукции в местах проживания и работы населения // ОБЩЕСТВО, СРЕДА, РАЗВИТИЕ. – 2015, № 4. – с. 196-203.
- Н.Н. Протасова. Светокультура как способ выявления потенциальной продуктивности растений. Физиология растений.1987. Т. 34. Вып. 4.
А. П. Гавриленко – Ген. директор ООО «ЭНОВА Лайт»
344114, г. Ростов-на-Дону, ул. Орбитальная 78/2, к.249.
Телефон: (863)-298-3603, +7-918-558-3603.
[email protected]
Комментарии:
Искусственное освещение для растений
Освещение для растений
Во многих странах климат не позволяет выращивать растения круглой год. К счастью, при использовании искусственного освещения, это становится возможным занятием. Этот процесс требует тщательной подготовки, на мировом рынке представлено множество различных вариантов специального освещения. Тип спектра, длина волны и интенсивность играют ключевую роль в росте и развитии растений. Слишком большое, а также недостаточное количество освещения является распространенной ошибкой у новичков. Важно соблюдать оптимальный баланс между количеством производимого света и количеством выделяемого тепла.
Фотосинтез
Фотосинтезом называют питание высших растений. Он имеет две стадии: световую и темновую. В световой стадии происходят следующие процессы: синтез АТФ, образование НАДФ, фотолиз воды и образование кислорода. В темновую стадию происходит синтез углеводов и образование белков и углеводов, а также связывание углекислого газа в молекулы глюкозы. Процесс происходит в основном в пределах диапазона волн от 400 до 700 nm. Наиболее необходимые — синий (445nm) и красный (660nm).
Для создания искусственного освещения вам потребуется следующее оборудование:
1. Лампа: чаще всего в условиях закрытого грунта используют газоразрядные (ДНаТ, МГЛ, ДРИЗ) или люминесцентные лампы (ЛЛ, КЛЛ), также в последнее время большую популярность имеют светодиодные лампы (LED).
2. Электронный балласт (Дроссель): используется для того, чтобы зажечь, а затем регулировать ток в лампе. Балласты классифицируются как цифровые, электронные или магнитные. Этот выбор может оказать значительное влияние на долговечность, эффективность и мощность ламп. Некоторые лампы не нуждаются в дополнительном оборудовании для розжига.
3. Отражатель (Рефлектор): предназначен для эффективного распределения света лампы в сторону растений. Обычно отражатель уже встроен в светильник.
4. Таймер-розетка: необходим для того, чтобы регулировать режим освещения.
Разберем подробнее некоторые виды ламп, подходящие для выращивания в закрытом помещении:
Флуоресцентные лампы
Люминесцентные лампы бывают линейные люминесцентные (ЛЛ)
и компактные люминесцентные (КЛЛ), их еще называют энергосберегающими (ЭСЛ).
Они доступны различных мощностей и цветовых температур. Лампы обладающие высокой цветовой температурой 6500К (известные, как «холодный белый»), имеют больше «холодного» спектра и подходят для вегетативной фазы, развития рассады и черенков (клонов). Люминесцентные лампы низкой цветовой температуры 2700К («теплый белый») с преобладанием «теплого» спектра и больше подходят для стадии цветения/плодоношения. Лампы ЭСЛ доступны в более высоких мощностях и пригодны для растений, нуждающихся в более высокой интенсивности света. Однако люминесцентные лампы производят меньше люменов на ватт по сравнению с газоразрядными лампами. Следовательно, их использование оправдано на растениях, которые нуждаются в низкой или средней интенсивности света, например, рассады, черенков (клонов), посевной травы, орхидеи и листья салата. В отличие от газоразрядных ламп, они создают минимальное количество тепла, и поэтому не требуют охлаждения. К тому же, например, ЭСЛ лампы идут со встроенным балластом, что делает их использование очень простым.
Плюсы
- Доступная цена
- Низкий уровень производства тепла
- Простое использование
- Отлично подходит для рассады
- Недостаточная интенсивность света для светолюбивых растений
- Для небольших пространств
Газоразрядные лампы
Их использование наиболее оправдано при выращивании светолюбивых растений. Они подходят для многих плодоносящих растений, для многих растений: тропического, субэкваториального и экваториального пояса. При использовании в ограниченных пространствах, при работе, мощные лампы сильно нагреваются и требуют активного охлаждения. Обычно в растениеводстве используются газоразрядные лампы двух видов:
Металлогалогенные МГЛ/ДРИ(з) (англ. МН)
МГЛ/ДРИ(з) как правило, используются для вегетативной фазы и фазы цветения/плодоношения. Их популярность заключается в высокой отдаче люмен на ватт. Они производят ~ в 5 раз больше люменов на ватт, чем лампы накаливания. МГЛ лампы производят в диапазоне от 2700K до 6500K, который отлично имитирует естественное освещение. Лампы, имеющие цветовую температуру 6500К, идеально подходят для создания сильного вегетативного роста, а именно больших листьев и толстых стеблей. МГЛ лампы 3000К так же идеально подходят для создания коротких и плотных растений, которые имеют меньших интервал междоузлий. Растения такой формы, более эффективно расходуют свет.
Плюсы
- Очень близки к спектру естественного солнечного света (6000K)
- Эффективны для вегетативного роста и развития лиственных растений
- Высокий расход электроэнергии
- Требуется балласт, который стоит не дешево
- Требуют активного охлаждения в ограниченных пространствах
Натриевые лампы высокого давления НЛВД или ДНаТ(з) (англ. HPS)
Самые распространенные лампы в растениеводстве. Имеют высокую интенсивность освещения до 150 люмен на ватт. Используются трубчатые и зеркальные. Лампы ДНаТ (HPS) производят больше «теплого» света. Преимущество в зоне красно-оранжевого спектра (2000К) способствует развитию цветов и фруктов. Поэтому ДНаТ больше подходит для плодоносящих растений. Обычная практика использовать лампы ДНаТ для вегетации и цветения, особенно, если растения имеют короткий вегетационный период. Однако, как правило, ДНаТ способствует высокому и вытянутому растению. В растениеводстве лампы ДНаТ считаются универсальными и используются в промышленном масштабе. Некоторые производители, используя современные технологии, добиваются повышения в зоне синего спектра лампы, а также комбинируют разные виды ламп в одной.
Плюсы
- Эффективны для цветения и развития плодов
- Самые распространенные лампы
- Высокий расход электроэнергии
- Требуется балласт, который стоит не дешево
- Требуют активного охлаждения в ограниченных пространствах
LED
Светодиоды являются сравнительно новым источником света. В последнее время мировые производители выпустили светодиоды с интенсивностью до 200 люмен на ватт. Светодиоды, в отличие от других источников света, выгодно отличаются чрезвычайно низким энергопотреблением. Благодаря этому некоторые промышленные теплицы полностью перешли на светодиодное освещение. Ключевая особенность светодиодов — это производство точной световой волны которая необходима именно вашему растению.
Плюсы
- Не требуют активного охлаждения
- Не требуется дополнительное оборудование для розжига
- Перспективная отрасль
- Возможен подбор определенного спектра
- Высокая светоотдача до 200 люмен на ватт
- Высокая стоимость готового изделия
- На российском рынке сложно найти качественный продукт
Продолжение в следующей части…
Свет и его роль
15 декабря 2015 года в гимназии прошел всероссийский тематический урок «Свет в нашей жизни». Целью урока стало привлечение внимания учащихся к важности света, световых и энергосберегающих технологий.
Свет нужен везде: Безопасность движения транспорта на дорогах связана с применением фар, освещением улиц; в военной технике используют осветительные ракеты, прожектора. Свет повышает сопротивляемость организма болезням, улучшает здоровье и настроение человека. Освещение рабочего места повышает работоспособность.
Еще в глубокой древности ученые интересовались природой света. (Евклид, Птолемей, Архимед).
Деятельность человека в начальные периоды его существования — добыча пищи, защита от врагов- была зависима от света. Свет, благодаря тому, что глаз человека способен его воспринимать, является важнейшим средством познания природы. Когда после продолжительной темноты наступает рассвет, то кажется, все оживает: и деревья, и вода. И небо. И птицы. Зрение позволяет нам узнать об окружающем мире больше, чем все остальные органы чувств вместе взятые. Исследование световых явлений позволило создать такие приборы, с помощью которых определили расположение и движение, и даже состав небесных тел. А также удалось заглянуть внутрь тел. С помощью микроскопа рассмотрели состав клетки, изучили строение бактерий, кровяных тел.
Живая природа не может существовать без света, так как солнечная радиация, достигающая поверхности Земли, является практически единственным источником энергии для поддержания теплового баланса планеты. Биологическое действие солнечного света зависит от его спектрального состава, продолжительности, интенсивности, суточной и сезонной периодичности.
Солнечная радиация представляет собой электромагнитное излучение в широком диапазоне волн, составляющих непрерывный спектр. Ультрафиолетовые лучи, губительные для живых организмов, поглощаются слоем озона и до Земли не доходят. Земли достигают главным образом инфракрасные и видимые лучи спектра. Длинноволновые УФЛ отличаются высокой химической активностью. В небольших дозах они оказывают мощное бактерицидное действие, способствуют синтезу у растений некоторых витаминов, пигментов, а у животных и человека — витамина D; кроме того, у человека они вызывают загар, который является защитной реакцией кожи. Инфракрасные лучи также оказывают тепловое действие.
В экологическом отношении наибольшую значимость представляет видимая область спектра, или фотосинтетически активная радиация (ФАР), которая поглощается пигментами хлоропластов и тем самым имеет решающее значение в жизни растений. Видимый свет нужен зеленым растениям для образования хлорофилла. Он влияет на газообмен, стимулирует биосинтез белков и нуклеиновых кислот, повышает активность ряда светочувствительных ферментов.
Огромное влияние на жизнедеятельность растений и животных оказывает соотношение светлого и темного периодов суток в течение года. Регулярность и неизменная повторяемость из года в год данного явления позволила организмам в ходе эволюции согласовывать свои важнейшие жизненные процессы с ритмом этих временных интервалов. Под фотопериодическим контролем находятся практически все метаболические процессы, связанные с ростом, развитием, жизнедеятельностью и размножением растений и животных.
Солнечный свет – мощное лечебное и профилактическое средство, исключительно важное для сохранения здоровья. Датский физиотерапевт Нильс Финзен в 1903 году использовал солнечные лучи для лечения туберкулеза кожи. За эти исследования ему была присуждена Нобелевская премия.
Однако передозировка солнечной радиации может нанести неповторимый вред – вызвать расстройства нервной, сердечно- сосудистой и других важных систем организмов.
Прежде всего, для того, чтобы точно дозировать действие солнечного света на организм, необходимо знать, как изменяется интенсивность его радиации в зависимости от времени года и суток.
Интенсивность прямой солнечной радиации главным образом зависит от высоты стояния солнца над горизонтом: чем выше солнце, тем интенсивнее прямая солнечная радиация. Максимум ее наблюдается в июне, минимум — в декабре.
Самая распространенная причина злоупотребления солнцем — стремление как можно быстрее и сильнее загореть, приобрести красивый цвет кожи.
Как следствие неумелого пользования солнцем происходит: перегревание организма и на коже появляются ожоги, появляется головная боль, недомогание, снижение работоспособности, тепловой или солнечный удар, общая слабость. Поэтому не стоит пренебрегать средствами защиты от солнца и, конечно, носить летом головной убор.
Стоит заметить, что кроме солнечного света в нашей жизни есть свет электрический, который тоже играет немаловажное значение в нашей жизни. Путь развития искусственных источников света — это тяжелый и сложный путь творческих исканий людей. И он далеко не закончен.
Искусственные источники света проникли сейчас во все сферы жизни и деятельности людей и используются там с большой эффективностью. Доказано, что только за счет улучшения освещения можно на 5 — 6 % увеличить производительность труда (а на предприятиях с напряженной зрительной работой — еще выше), повысить качество продукции, снизить брак, предотвратить несчастные случаи, снизить утомляемость работающих, сохранить зрение. Источники света все более преобразуют промышленную технологию и все чаще выступают в роли орудия труда. Источники света оказывают влияние на все отрасли народного хозяйства (промышленность, сельское хозяйство, транспорт и связь), на благоустройство и световое оформление городов, на быт людей, на науку, культуру, медицину и многие другие области человеческой деятельности. Их постоянное совершенствование и умелое использование активно содействуют повышению эффективности общественного производства, подъему качества продукции, улучшению условий жизни людей.
Несмотря на важность искусственного света в нашей жизни, в России существует ряд проблем с электроэнергией:
- Высокие непроизводственные расходы,
- Дефицит энергоресурсов и энергии,
- Нарастающая нагрузка на окружающую среду,
- Геополитические и социальные угрозы.
Итак, сегодня мы узнали, что современное общество немыслимо без повсеместного использования исскуственного света. Осветительные установки создают необходимые условия освещения, которые обеспечивают зрительное восприятие (видение), дающее около 90% информации, получаемой человеком из окружающего мира. Не менее важную роль играет естественный свет. Свет является не только важным условием работы зрительного анализатора, но и биологическим фактором развития организма человека в целом.
Сейчас предлагаю обратиться к способам экономии электрического света. И для нас с вами есть один верный метод – выключать не нужный вам свет.
Свет для растений. Спектр света для растений. Какой свет нужен растениям?
Какой свет нужен растениям?
Ответ на этот вопрос кажется очевидным. Растениям нужен солнечный свет, а если это искусственный свет, то, наверное, спектр излучения «хорошей» лампы должен быть как можно ближе к солнечному. Так ли это?
Лучевая энергия солнца, которая доходит до поверхности земли, состоит из ультрафиолетового излучения (длина волны короче 380 нм), видимого света (от 380 нм до 780 нм) и инфракрасного, т.е. теплового излучения (длина волны больше 780 нм). Пик солнечного света лежит в голубой части спектра при 475 нм.
Глаз человека не воспринимает ни ультрафиолетовые, ни инфракрасные волны, а из видимого спектра наиболее чувствителен к желто-зеленому (555 нм) свету. Красный свет (650 нм) человеческий глаз чувствует в 10 раз хуже, т.е. нужно в 10 раз больше красного света, чем зеленого, чтобы человек воспринял оба света как равные по интенсивности.
А к какому свету более всего чувствителен «глаз» растения, т.е. хлорофилл и другие пигменты, улавливающие свет для фотосинтеза? Наиболее активно фотосинтез идет под действием оранжево- красного света (610-700 нм) с максимумом в красной зоне (675 нм). Второй пик активности находится в сине-голубой части спектра (400-510 нм). Рост растений обеспечивается фотосинтезом, значит, растениям в первую очередь требуется свет, обогащенный теми длинами волн, которые нужны для фотосинтеза.
Таким образом, лампа для освещения рассады совсем не обязательно должна имитировать солнечный свет. Желательно использовать более экономичные лампы, спектр излучения которых обогащен красным и синим светом.
|
Первая характеристика любой лампы — это количество потребляемой электроэнергии, т.е. мощность лампы, выражаемая в ваттах (Вт). При выборе лампы для освещения рассады важно оценить, насколько эффективно расходуется потребляемая энергия, т.е. какая ее часть переходит в свет, полезный для фотосинтеза. Для начала надо узнать, какая часть электроэнергии переходит в излучение в видимой области. |
|
При оценке эффективности лампы, прежде всего надо узнать, какая часть потребляемой электроэнергии превращается в видимый свет. Обычно учитывается не все видимое излучение (380-780 нм), а излучение в диапазоне длин волн от 400 нм. до 700 нм. Область 400-700 нм. называется областью ФАР, т.е. областью фотосинтетически активной радиации. Излучение в области ФАР, как и потребляемая лампой электроэнергия, измеряется в ваттах. Доля потребляемой электроэнергии, которая переходит в видимый свет в области ФАР, у разных ламп отличается в несколько раз, но даже у самых … |
Понравился материал? Поделитесь ссылкой с друзьями в социальной сети:
Если вы нашли ошибку в тексте, пожалуйста, сообщите нам: выделите ее и нажмите: Ctrl + Enter!
Предыдущая статья:Светильник для рассады. Высота подвеса светильника Следующая статья:Лампы для выращивания рассадыВсё о подсветке рассады
Одним из важнейших факторов, влияющих на развитие рассады, является, конечно, освещение. Естественного света в зимне-весенний период ей не хватает, тут необходим источник света искусственного для создания сеянцам более долгого светового дня.Решить эту задачу сейчас несложно: на рынке товаров для садоводов и огородников представлен широчайший ассортимент разнообразных ламп. Но прежде чем отправиться за покупкой, нужно понять: а какая лампа, собственно, требуется?
Очевидно, что досвечивание должно позитивно влиять на жизненно важные процессы растения. За переработку света в питание у наших «зеленых друзей» отвечает хлорофилл. А ему для активной работы требуются световые волны определенной длины. Оптимальной для восприятия хлорофиллом является длина волн в 430-460 и 640-660 нм. Переводя на человеческое восприятие – синий и красный свет. Именно световые волны красных и синих оттенков предпочтительны для фотосинтеза.
Красный свет (640-660 нм) дает толчок к ускоренному росту, быстрому развитию ростка. Синий свет (430-460 нм) дает растениям силу: укрепляются стебли, усиливается развитие корневой системы. Как раз нехватка света этой части спектра приводит к вытягиванию рассады. Комбинация красного и синего света дает растениям то, что им необходимо в определенный период развития.
Определить, какая часть спектра преобладает в той или иной лампе, просто: маркировка «холодный свет» говорит о преобладании волн синего диапазон, «теплый свет» – красного.
Люминесцентные лампы, которые более известны как «лампы дневного света», подходят для досветки рассады, поскольку их спектр свечения включает в себя практически весь волновой диапазон. К минусам таких ламп можно отнести нецеленаправленность подсветки (огни дают рассеянный свет), но положительное влияние, несомненно, будет. Для создания большего эффекта рекомендуется комбинировать люминесцентные лампы теплого и холодного цветов.
Этот вид ламп экономичен и годится для досвечивания больших площадей (например, теплиц). Но и для досвечивания маленькой площади ни хороши, так как характеризуются низкой теплоотдачей. Растениям не угрожает перегрев и пересушивание.
Специально для нужд растениеводов была разработана люминесцентная фитолампа. Конструкторы обеспечили ее правильными пропорциями света красного и синего спектра. В итоге получилась лампа, которая светит неестественным розовым светом, неприятным для человеческого глаза, но очень полезным для растений.
Организовать досветку можно и с помощью газоразрядных ламп. Они бывают ртутные, металлогалоидные и натриевые. Первые не дают растениям того, что нужно, поэтому их лучше не использовать. А вот оставшиеся два вида вполне подойдут. Металлогалоидные лампы дают полный световой спектр. Натриевые излучают мягкий красный и оранжевый свет, необходимый для рассады и приятный глазу. Минус таких ламп: колба сильно нагревается, ее нужно оберегать от попадания капель влаги, иначе возможнее взрыв.
Специальные фитолампы сегодня являются лидером среди устройств, с помощью которых обеспечивается досветка для растений. Они изначально создавались для этой цели, поэтому, естественно, являются оптимальным вариантом. Вне зависимости от конструкции, фитолампа генерирует свет в нужном растениям диапазоне и позволяет растить культуры даже в глухом, без окон, подвале. Конструктивной особенностью таких ламп являются равномерные, не вибрирующее потоки света, от которых растения берут нужное, что называется, по полной программе. А еще фитолампы не нагреваются, долговечны и экономичны, поскольку создавались для решения конкретной задачи, то есть с учетом всех требований к досвечиванию растений.
Конечно, фитолампы применяются не только для выращивания рассады. С их помощью можно улучшать жизнь растений в любом случае. Достаточно выбрать правильную фитолампу.
Биколорная (bicolor spectrum) фитолампа дает основной спектр для придания растению энергии. В свете этой лампы концентрируются только красные и синие оттенки, инфракрасный и ультрафиолетовый свет исключены.
Биколорная фитолампа рекомендуется для досвечивания любых растений на подоконнике, балконе и в местах с минимальным количеством солнечного света. Идеально подходит для выращивания рассады, хороша и для взрослых комнатных растений зимой и вообще в условиях недостаточной освещенности.
Мультиспектральная (multicolor spectrum) фитолампа – уникальное технологическое решение, сочетающее красный, синий и теплый белый свет. Она максимально стимулирует цветение и плодоношение у многих растений. Но и для рассады подходит за счет больших долей красного и синего света, нужных для фотосинтеза в стадии роста. Такая лампа позволяет растениям расти и процветать даже в помещении с полным отсутствием солнечного света. А еще она незаменима при досвечивании загущеннывх посадок.
Полноспектральная (full spectrum) фитолампа представляет собой лампу биколорного спектра с более широким диапазоном пиков в красном и синем поле. Она универсальны и подойдут для разных аздач, так как за счет более широкой зоны спектров позволяют дать растению максимум искусственного света, по действию схожего с солнечным.
Усовершенствованный вариант такой лампы – полноспектральная с добавлением белого света. Может использоваться в жилых помещениях, так как дает теплый белый свет, но содержит волны полезной для растений длины. Под полноспектральной лампой можно держать растение весь вегетационный период – от всходов до плода.
Устройства для фитосвета могут быть различной конфигурации: в форме классической лампы с патроном, панели, прожектора, а также из светодиодов. Последние обретают все большую популярность.
В светодиодных светильниках, лентах или панелях нужный эффект достигается за счет грамотного (в зависимости от задачи) сочетания диодов красного и синего цвета. Все остальные цвета исключены, то есть исключено влияние вредного для растений диапазона, ожоги и обезвоживание листьев, пересушивание почвы и т.д. Важным плюсом светодиодной досветки является малое потребление энергии при сильной отдаче полезного излучения.
При организации досветки для рассады нужно учесть еще два фактора. Первый – расстояние от источника света до сеянцев. Слишком близкое соседство с нагревающейся лампой может привести к ожогу листьев. В этом смысле совершенно безопасны светодиодные светильники: их можно размещать едва ли не вплотную к растениям, которые благодарно реагируют на интенсивность света.
Второй фактор – время досвечивания. В среднем рекомендуется обеспечивать рассаду дополнительным светом 13-14 часов в сутки. В ночное время растения, как и люди, отдыхают. Наиболее светолюбивы туговсхожие растения (сельдерей, редис, репа), им нужна досветка в 12-16 часов. Перцы, томаты, баклажаны, огурцы рекомендуют досвечивать от 8 до 13 часов в день, зеленные культуры – 8-11 часов.
© «В гостях у грядки» №4/2019
Лучший световой спектр для выращивания цветущих растений | Домой Руководства
Дайан Уоткинс Обновлено 15 декабря 2018 г.
Свет жизненно важен для роста и выживания растений. Цветущие растения используют полный спектр видимого света, но некоторые длины волн важнее других. Правильный световой спектр, интенсивность и продолжительность света работают вместе, чтобы вызвать цветение, рост и размножение растений.
Качество света
Спектр видимого света излучает красный, оранжевый, желтый, зеленый, синий, индиго и фиолетовый цвета.Цвета на обоих концах спектра играют наибольшую роль в росте и цветении растений, в то время как желтые и зеленые длины волн играют меньшую роль. Для фотосинтеза растения используют длины волн от 400 до 700 нанометров (нм), что обеспечивает все энергетические потребности растений. Солнечный свет является лучшим источником света для растений и, естественно, обеспечивает все эти длины волн. Для определенных функций растений используются разные длины волн, но все длины волн в этом диапазоне поглощаются в разном количестве.Волны красного и синего спектра поглощаются в большем количестве, в то время как больше зеленого и желтого света отражается, придавая листьям характерный зеленый цвет. По этой причине производители, полагающиеся на искусственное освещение растений, сосредотачиваются на синей и красной частях спектра.
Синий свет
Наиболее важные длины волн синего цвета от 430 до 450 нм. Эта часть спектра также известна как холодный свет. Эти длины волн стимулируют вегетативный рост за счет сильного роста корней и интенсивного фотосинтеза.Синий свет часто используется отдельно на ранних этапах роста растений, например, при выращивании рассады, когда цветение нежелательно.
Красный свет
Более длинные волны света имеют красный цвет. Наиболее важные длины волн красного спектра — от 640 до 680 нм. Эти длины волн способствуют росту стеблей, цветению и производству фруктов, а также производству хлорофилла. Красные волны известны как теплый свет, и они, естественно, более распространены в солнечном свете в более короткие осенние и зимние дни.
Зеленый и желтый свет
Часть зеленого и желтого света, достигающего растения, отражается, придавая ему зеленый цвет. Хотя большая часть поглощаемых длин волн находится в красном и синем диапазонах, растения действительно используют зеленый и желтый свет в процессе фотосинтеза. Источник света, обеспечивающий свет во всем видимом диапазоне, лучше удовлетворит потребности растения.
Интенсивность света
Солнечный свет обеспечивает гораздо большую интенсивность, чем искусственное освещение.Однако не всем растениям нужна одинаковая интенсивность света. Некоторые растения предпочитают высокую интенсивность полного солнца, в то время как другие предпочитают умеренное солнце или тень. При искусственном освещении растение должно быть близко к источнику света для максимальной интенсивности света.
Продолжительность света
Продолжительность света важна, особенно в период цветения. Для выращивания комнатных растений при искусственном освещении обычно требуется от 12 до 14 часов света в день. Темнота важна, чтобы дать растению отдохнуть и вызвать реакцию цветения.Некоторым цветковым растениям, известным как растения короткого дня, для цветения требуются длительные периоды темноты. Короткодневные растения, такие как пуансеттия, хризантемы и июньская клубника, цветут весной, когда дни короче, а ночи длиннее. Растения с длинным днем, такие как лук и шпинат, цветут в конце лета, когда дни длинные, а ночи короткие. Дневно-нейтральные растения цветут независимо от продолжительности темноты, но обычно лучше всего при более продолжительном освещении.
Растения используют только некоторые цвета в солнечном спектре
Теперь, когда биологи из Университета Северной Каролины в Чапел-Хилл обнаружили, что растения могут обнаруживать тени, можно задать следующий справедливый вопрос: когда солнечный свет освещает растение, просто Какую часть спектра солнечного света растения используют в фотосинтезе?
Помните, белый свет состоит из всех цветов спектра.Растения используют часть спектра, которая попадает в видимый диапазон (длина волны 400-700 нм). Это все разные цвета света, которые мы видим. И растения используют все эти цвета для выработки биологической энергии посредством фотосинтеза.
По иронии судьбы, видимый свет составляет около 45 процентов всего солнечного спектра. Это означает, что растения могут использовать только половину солнечной энергии.
Кроме того, цвет света, используемого для фотосинтеза, зависит от пигмента растения.Другими словами, какой бы цвет ни был у растения, это цвет в спектре, который растение отражает, а не поглощает и использует для фотосинтеза. Хлорофилл поглощает все цвета солнечного света, кроме зеленого, поэтому растение кажется зеленым человеческому глазу. Зеленый свет — это то, что отражается.
Хлорофилл использует солнечный свет для производства сахара. Хлорофилл — ключевое вещество в хлоропластах, которые являются центрами производства продуктов питания растительной клетки. Солнечный свет, попадающий на хлоропласты растений, поглощается хлорофиллом, а затем объединяется с углекислым газом и водой с образованием глюкозы или сахара.Затем митохондрии используют сахар, вырабатываемый хлорофиллом, для создания энергии, полезной для растений. В процессе также образуется кислород, что хорошо, потому что растения выделяют его, чтобы мы могли использовать его. Строма, представляющая собой крошечные отверстия на нижней стороне листьев, поглощает углекислый газ, который имеет решающее значение для всего процесса.
Листья медленно теряют хлорофилл в осенние месяцы, потому что деревья прекращают процессы фотосинтеза. Дни становятся короче, а это означает, что солнечного света недостаточно для завершения процесса, и им необходимо экономить энергию.По мере того, как зеленый цвет хлорофилла исчезает, желтые и апельсиновые оттенки, которые были на листьях все это время, становятся видны из-за пищи, хранящейся в листьях.
Удивительно, чего достигают растения, используя только половину полного цветового спектра!
—Фрэнк Графф
Фрэнк Графф, продюсер / репортер UNC-TV, специализируется на еженедельном научном сериале North Carolina Science Now, который выходит в эфир по средам, начиная с августа 2013 года, в рамках программы North Carolina Now на UNC-TV. Помимо создания этих специальных сегментов, Фрэнк предоставит дополнительную информацию, относящуюся к его историям, в этом блоге репортера Science Now в Северной Каролине!
Связанные ресурсы:
Влияние светового спектра на развитие растений
Вы когда-нибудь использовали лампы для выращивания растений? Если да, то вы, вероятно, были поражены влиянием света на развитие вашего растения.Эта статья расскажет вам гораздо больше о влиянии света на развитие растений. Как мы увидим, развитие растений действительно отличается от роста растений. Мы объясним принципы действия света и его взаимодействия с растениями, а также дадим вам несколько практических советов. Правильный выбор лампы может иметь огромное значение для качества и количества вашего урожая.
По CANNA Research
Всем известно, что растениям нужен свет для роста посредством фотосинтеза, процесса, который включает фиксацию энергии и производство сахара.Но помимо обеспечения энергии свет также играет ключевую роль во многих других процессах растений, таких как фотоморфогенез и фотопериодизм. На все эти процессы влияет световой спектр, который представляет собой распределение света по электромагнитному спектру. Чтобы объяснить различные реакции растений на свет, нам сначала нужно подумать о самом явлении света.
Принцип света и его спектр
Свет — это форма излучения, которая принимает форму электромагнитных волн, проходящих через воздух или вакуум.Следовательно, его можно описать с помощью трех физических свойств: интенсивности (или амплитуды), частоты (или длины волны) и направления вибрации (поляризации). Все возможные формы электромагнитного излучения можно описать, поместив их в электромагнитный спектр, см. Рисунок 1.
Когда мы описываем электромагнитный или световой спектр, лучше говорить о длине волны, чем о цвете. Это связано с тем, что видимый свет для человека составляет лишь небольшую часть светового спектра в целом, а именно диапазон длин волн от 400 до 700 нанометров (нм, что составляет 10-9 м).
Рисунок 1: Свет в форме электромагнитных волн описывается электромагнитным спектром. Наиболее важным качеством света для растений является его длина волны или энергосодержание; чем короче длина волны, тем выше энергосодержание.
Как видно из рисунка 1, это очень маленький диапазон. Фактически, это менее 1 процента от всего спектра. Фотосинтетически активное излучение (ФАР) или плотность потока фотосинтетических фотонов (PPFD) — это диапазон света, который может использоваться растениями для фотосинтеза.Однако, поскольку PPFD представляет собой сумму всех фотонов в диапазоне 400-700 нм, два очень разных спектральных распределения могут иметь один и тот же PPFD. Это означает, что нет однозначной связи между PPFD и спектральным распределением. Это также означает, что при сравнении источников света нам необходимо учитывать данные спектрального распределения, а также PPFD.
СветPPFD выражается в мкмоль / м 2 / с и сообщает нам, сколько световых фотонов достигнет заданной площади поверхности ( 2 м) за определенный промежуток времени (секунду).Для иллюстрации: большинству растений требуется минимум 30-50 мкмоль / м. 2 / с PPFD, чтобы оставаться в живых.
Как растение воспринимает свет
Свет не только дает энергию для фотосинтеза, но и служит источником информации для растений. Различные световые спектры дают растению представление об окружающей среде и, следовательно, о том, как оно должно выживать и, надеюсь, процветать и воспроизводиться. В этом смысле состав света так же важен, как и общее количество света, используемого для фотосинтеза.Световой спектр в диапазоне от 300 до 800 нм вызывает у растения реакцию развития. Кроме того, известно, что УФ и инфракрасный (ИК) свет играют роль в морфогенезе растений.
Растение получает информацию от света, который достигает его с помощью специальных пигментов, называемых фоторецепторами. Эти фоторецепторы чувствительны к разным длинам волн светового спектра.
Рисунок 2: растение получает информацию от света через три специальных фоторецептора: фототропины (фот), криптохромы (cry) и фитохромы (phy).Первые два активны в УФ и синем свете, а фитохромы реагируют на красный и дальний красный свет.
Есть три группы фоторецепторов, см. Рисунок 2:
- Фототропины
- Криптохромы
- Фитохромы
Первые два фоторецептора — фототропины и криптохромы — активны в нижнем диапазоне длин волн (УФ (A) и синий). Эти два рецептора, очевидно, выполняют разные функции.Фототропины отвечают за фототропизм или движение растений, а также движение хлоропластов внутри клетки в ответ на количество света. Фототропины заставляют стебли наклоняться к свету, а устьица открываться.
Криптохромы — это пигменты, которые определяют направление света. Подавление удлинения стебля регулируется криптохромами, а также функционированием устьиц, синтезом пигментов и отслеживанием солнца листьями растений. Другие фоторецепторы — фитохромы — чувствительны к красному и дальнему красному свету.Есть две формы фитохрома, Pfr и Pr, которые взаимодействуют. Наибольшее влияние на фотоморфогенез оказывают фитохромы. Удлинение стебля, избегание тени, синтез хлорофилла и реакция цветения — все это функции, которые обычно контролируются фитохромом. См. Нашу статью «Влияние красного и дальнего красного света на цветение», в которой вы найдете гораздо больше информации о фитохромах.
Теперь, когда мы посмотрели на спектр света и фоторецепторы, ответственные за развитие растений, мы подошли к следующему вопросу: как мы можем применить эти знания как производитель? Что делает хороший световой спектр для выращивания? Чтобы ответить на этот вопрос, нам нужно подумать о реакции растения на разные спектры света.Поскольку они попадают в основном в видимый свет, мы можем говорить о «цветах», начиная с наиболее важных для развития растений.
Синий свет (400-500 нм)
Большая доля синего света оказывает ингибирующее действие на удлинение клеток, что приводит к более коротким стеблям и более толстым листьям. И наоборот, уменьшение количества синего света приведет к увеличению площади поверхности листьев и удлинению стеблей. Слишком мало синего света негативно скажется на развитии растений. Многим растениям требуется минимальное количество синего света, которое колеблется от 5 до 30 мкмоль / м 2 / с для салата и перца до 30 мкмоль / м 2 / с для сои.
Взаимодействие красного (600-700 нм) и дальнего красного (700-800 нм) света
Поскольку красный и дальний красный свет имеют более высокую длину волны, они менее энергичны, чем синий свет. В сочетании с сильным влиянием фитохромов, индуцированных красным светом, на морфогенез растений, растениям необходимо относительно больше красного и дальнего красного света.
Две формы фитохрома, Pfr и Pr, играют важную роль в этом процессе. Поскольку в солнечном свете присутствуют и красный, и дальний красный свет, растения в природе почти всегда содержат фитохромы Pfr и Pr.Растение ощущает окружающую среду по соотношению этих двух форм; это называется фотостационарным состоянием фитохрома (ПСС).
Фитохром Pr имеет пик поглощения света на длине волны 670 нм. Когда Pr поглощает красный свет, он преобразуется в форму Pfr. Форма Pfr действует наоборот — когда она поглощает дальний красный свет на пике 730 нм, она превращается в форму Pr. Однако, поскольку молекулы Pfr также могут поглощать красный свет, некоторые молекулы Pfr превращаются обратно в Pr.Из-за этого явления нет линейной зависимости между PSS и отношением красного к дальнему красному. Например, когда соотношение красного и дальнего красного света превышает два, PSS практически не реагирует, и, таким образом, на развитие растений это не влияет. Поэтому лучше говорить о PSS, чем о соотношении красного и дальнего красного света.
Количество Pr и Pfr говорит растению, какой свет оно получает. Когда присутствует много Pr, это означает, что растение получает больше красного света, чем красного света.Когда красного света меньше, обратное преобразование (из Pr в Pfr) затрудняется, что означает, что Pr относительно больше.
Рисунок 3: Поскольку дальний красный свет в основном отражается поверхностью листьев, растение получает (относительно) больше этого света, когда оно теснится с соседними растениями. Чтобы избежать тени, у растения отрастают более длинные стебли, чтобы на него попадало больше света.
В условиях, когда многие растения растут близко друг к другу, весь красный свет солнца используется для процесса фотосинтеза (между 400 и 700 нм), а большая часть дальнего красного света отражается растениями (> 700 нм).Большинство растений, особенно находящихся в тени, в этой ситуации будут получать больше красного, чем красного света. Как следствие, Pr увеличивается, и когда это происходит, растение чувствует, что ему нужно больше света для фотосинтеза, и запускается удлинение стебля (см. Рисунок 3). В результате получаются более высокие растения с большим расстоянием между междоузлиями и более тонким стеблем. Это яркий пример реакции избегания тени, когда растения стремятся захватить больше света, чтобы выжить.
Более высокие растения могут поглощать больше красного света, что увеличивает количество форм Pfr.Это вызовет большее ветвление, более короткие расстояния между междоузлиями и меньший вертикальный рост, чтобы максимизировать поглощение света для фотосинтеза. В результате растения тратят меньше энергии на то, чтобы вырасти как можно более высокими, и тратят больше ресурсов на производство семян и расширение своей корневой системы.
Влияние светового спектра на цветение
На цветение также влияют формы Pr и Pfr. Продолжительность периода времени, в течение которого Pfr является преобладающим фитохромом, является причиной цветения растения.По сути, уровни Pfr сообщают растению, как долго длится ночь (фотопериодизм). Когда солнце садится, количество дальнего красного света превышает количество красного света. В темноте ночи формы Pfr медленно превращаются обратно в Pr. Долгая ночь означает, что для этого преобразования еще есть время. Следовательно, в конце ночного периода концентрация Pfr низкая, и это вызывает цветение растений короткого дня (см. Рисунок 4).
Таким образом, низкое соотношение красного к дальнему красному и, следовательно, ограниченное количество красного света в начале ночи очень важно для цветения растений короткого дня.Исследования, проведенные на трех короткодневных растениях — хризантеме, георгине и африканских бархатцах, — показывают, что, когда ночь прерывается красной вспышкой, вызывающей высокое соотношение красного к дальнему красному, цветение резко снижается. Был также сделан вывод, что один только дальний красный свет не регулирует цветение. Равная или более высокая доля дальнего красного света улучшит цветение растений короткого дня.
Рис. 4: Взаимодействие между формами Pr и Pfr и его влияние на цветение растений короткого дня (SDP) и растений длинного дня (LDP).
Ограниченное влияние зеленого света (500-600 нм) на развитие растений
Часто думают, что только синий и красный свет помогают растениям расти и развиваться, но это не совсем так. Хотя большая часть зеленого света отражается от поверхности растения (именно поэтому мы, люди, видим растения зелеными), сам по себе зеленый свет также может быть полезным для растения. Комбинация разных светлых цветов может привести к более высокому фотосинтезу, чем сумма его частей. Исследования, проведенные на салате, также показывают, что рост растений и биомасса увеличиваются, когда к красно-синему светодиоду добавляется 24% зеленого света, при сохранении равных уровней PAR (150 мкмоль / м 2 / с) между двумя объектами.Это указывает на то, что даже зеленый свет может положительно повлиять на рост растений.
Ультрафиолетовый свет (300-400 нм)
Ультрафиолетовый (УФ) свет влияет и на растения, вызывая компактный рост с короткими междоузлиями и маленькими толстыми листьями. Однако слишком много ультрафиолетового света вредно для растений, поскольку отрицательно влияет на ДНК и мембраны растения. Фотосинтезу может препятствовать слишком много ультрафиолетового света. Исследования показывают, что это происходит при УФ-значениях выше 4 кДж / м 2 / день.
Заключение
Это возвращает нас к общему вопросу «что обеспечивает хороший спектр света для выращивания?» На этот вопрос довольно сложно дать общий ответ, поскольку он сильно зависит от типа растения и требований выращивания. Для «нормального» развития растений рекомендуются следующие спецификации:
- Большинству растений требуется минимальное количество 30-50 мкмоль / м 2 / с фотосинтетический свет, чтобы остаться в живых
- Требуется минимальное количество синего света, которое варьируется от 5 до 30 мкмоль / м 2 / с
- Требуется несколько большая часть красного и дальнего красного света по сравнению с синим светом
- Баланс между красным и дальним красным светом: предпочтительно соотношение красного и дальнего красного света менее 2
- Ограниченное количество УФ-излучения, менее 4 кДж / м 2 / день
Также помните, что:
- Больше синего света приведет к более коротким стеблям и более толстым листьям
- Слишком много дальнего красного света или неравный баланс с красным светом приведет к вытянутым растениям
- Низкое соотношение красного к дальнему и, следовательно, ограниченное количество красного света в начале ночи важно для цветения растений короткого дня
- Один только дальний красный свет не регулирует цветение
- Зеленый свет полезен для фотосинтеза, но не влияет на цветение или развитие растений
Следующий шаг — обеспечить наилучший спектр света для вашей ситуации.Если солнечного света недостаточно, это можно сделать, выбрав хорошую лампу для выращивания. Появление светодиодов в растениеводстве, о котором вы можете подробнее узнать в другой нашей статье, упрощает для производителей оптимизацию светового спектра, чем когда-либо прежде.
Все, что вам нужно знать о спектре света — Urban Ag News
ПРЕСС-РЕЛИЗ — Выбор правильного светового спектра для вашей коммерческой деятельности может оказаться сложной задачей. Многие поставщики светодиодных светильников для выращивания растений имеют противоречивую информацию по этой теме из-за плохого маркетинга или просто отсутствия знаний в области исследований растений и освещения.
В этой статье ученые-эксперты LumiGrow разбирают, что такое световой спектр, как растения реагируют на свет и как световой спектр влияет на рост растений.
Щелкните здесь, чтобы прочитать полное руководство по увеличению светового спектра
Что такое световой спектр?
Спектр света — это диапазон длин волн, создаваемых источником света. При обсуждении светового спектра термин «свет» относится к видимым длинам волн электромагнитного спектра, которые люди могут видеть в диапазоне 380–740 нанометров (нм).Ультрафиолетовый (100–400 нм), дальний красный (700–850 нм) и инфракрасный (700–106 нм) длины волн называются излучением.
Нас, садоводов, больше всего интересуют длины волн, подходящие для растений. Растения обнаруживают длины волн, которые включают ультрафиолетовое излучение (260–380 нм) и видимую часть спектра (380–740 нм), которая включает ФАР (400–700 нм), и дальнее красное излучение (700–850 нм).
Если рассматривать спектр света для садоводства, теплицы и помещения будут отличаться.В помещениях спектр света вашего растения будет учитывать общий спектр света, который получает ваша культура. В то время как в теплице вы должны учитывать, что ваши растения получают комбинацию света для выращивания и солнечного спектра.
В любом случае количество каждого спектра, которое получает ваша культура, будет иметь значительное влияние на рост. Давайте узнаем больше о том, как это работает.
Как растения реагируют на свет?
Растения используют свет для фотосинтеза и фотоморфогенеза.Фотосинтез — это процесс, с помощью которого растения и другие организмы преобразуют энергию света в химическую энергию. Фотоморфогенез относится к тому, как растения изменяют свой рост в ответ на световой спектр.
Одним из примеров фотоморфогенеза является растение, наклоняющееся к источнику света. Свет также влияет на стадии развития растений, такие как прорастание и цветение.
Диапазон света, который растения преимущественно используют для фотосинтеза, составляет 400–700 нм. Этот диапазон называется фотосинтетически активным излучением (ФАР) и включает в себя красный, синий и зеленый диапазоны волн.
Фотоморфогенез происходит в более широком диапазоне от примерно 260–780 нм и включает УФ и дальнее красное излучение.
Знаете ли вы?
Хлорофиллы a и b — это основные фотосинтетические пигменты растений. Важно отметить, что хлорофилл наиболее сильно поглощает красный свет (600–700 нм) и синий (400–500 нм) и минимально поглощает зеленый свет (500–600 нм). Тем не менее, фотосинтез — более сложный процесс, чем просто поглощение хлорофилла, и включает в себя другие химические вещества, взаимодействие которых со световым спектром еще не изучено.
Хотите узнать больше?
В полной версии этой статьи есть еще много чего, чтобы узнать больше — см. Полную публикацию здесь
О LumiGrow
LumiGrow произвела революцию в садоводстве в 2008 году, представив первые интеллектуальные светодиодные лампы для выращивания растений в Северной Америке. Сегодня LumiGrow ведет мир вперед в инновациях в области освещения для выращивания растений с их интеллектуальными светильниками TopLight и BarLight, разработанными для максимизации прибыли производителей. Светильники LumiGrow управляются по беспроводной сети с помощью программного обеспечения smartPAR для оптимизации урожайности, качества и индивидуальных характеристик растений.Светильники LumiGrow можно точно настроить для условий теплицы с помощью отмеченного наградами датчика освещенности smartPAR, чтобы обеспечить стабильное урожайность круглый год при минимальных затратах на электроэнергию.
LumiGrow имеет самую большую в Северной Америке базу по установке интеллектуальных светодиодных светильников для выращивания растений по всему миру. Для получения дополнительной информации о LumiGrow, пожалуйста, посетите www.lumigrow.com
Рост растений и световой спектр
С тех пор, как НАСА начало экспериментировать со светодиодами для выращивания растений в 1980-х, мы знали, что разные световые спектры по-разному влияют на растения.Некоторые спектры стимулируют вегетативный рост, а другие увеличивают урожай цветов и фруктов. Другие спектры, кажется, очень мало влияют на рост растений. Благодаря переменному спектру света, доступному от светодиодов полного спектра, мы, наконец, начинаем понимать взаимосвязь между световым спектром и ростом растений, и hav Как мы измеряем свет e применил эти знания к каждому продаваемому нами УФ-светодиоду для выращивания растений, а не к отметьте универсальность контроллера SolarSystem®.
Как измерить свет?Видимый свет является частью более крупной электромагнитной шкалы, которая включает невидимые спектры, такие как радиоволны и рентгеновские лучи.Каждый спектр представляет собой частоту электромагнитного излучения, измеряемую в нанометрах (одна миллиардная метра):
Похоже, большинство садоводов считают, что лучшие комнатные светильники для выращивания будут иметь такой же световой спектр, как и солнце, — относительно полный спектр частот видимого света. В конце концов, растения эволюционировали миллионы лет, чтобы лучше всего преобразовывать световую энергию в углеводы и сахар.Наиболее доступный свет от солнца находится в средних спектрах, которые мы видим как зеленый, желтый и оранжевый. Это основные частоты, которые используют человеческие глаза. Однако исследования показывают, что это наименее используемые частоты света в растениях. Большая часть фотосинтетической активности происходит в синей и красной частотах, что делает светодиодные лампы полного спектра такими полезными.
Основная причина такого нелогичного использования света растениями, по-видимому, связана с ранними формами бактерий и эволюцией фотосинтеза.Фотосинтез впервые развился у бактерий в течение миллионов лет в первозданном море. Это произошло у бактерий задолго до появления более сложных листовых растений. Эти ранние фотосинтезирующие бактерии широко использовали желтый, зеленый и оранжевый средние спектры для фотосинтеза, которые имели тенденцию отфильтровывать эти световые спектры для растений, развивающихся на более низких уровнях океана. По мере того, как более сложные растения развивались на более низких уровнях, мы оставили только нефильтрованные спектры, не используемые бактериями — в основном в красной и зеленой частотах.Желтый, зеленый и оранжевый свет в основном отражается от поверхности листьев, поэтому фотосинтезирующие растения зеленые.
Есть ли у растений разные спектры света?То, как растения реагируют на свет, важно для понимания фотосинтеза; например, разные световые спектры используются для разных типов роста растений. В листе зеленого растения миллионы фотосинтетических рецепторов. Каждый рецептор включает в себя специализированные пигменты, которые поглощают определенные частоты света во время фотосинтеза.Измеряя количество кислорода, производимого при различных световых спектрах, мы можем измерить количество фотосинтетической активности при каждом световом спектре. В результате была получена очень подробная карта (диаграмма цветовой частоты), на которой спектр света связан с типом роста растений, что помогает найти идеальную длину волны фотосинтеза для каждой конкретной культуры.
Как растения используют разные световые спектры? Ультрафиолетовый свет (10–400 нм)Хотя чрезмерное воздействие излучения в УФ-спектре опасно для флоры, небольшое количество ближнего УФ-света может иметь положительный эффект.Во многих случаях ультрафиолетовый свет очень важен для цвета, вкуса и аромата растений. Это показатель влияния света, близкого к ультрафиолетовому, на метаболические процессы. Исследования показывают, что УФ-свет 385 нм способствует накоплению фенольных соединений, усиливает антиоксидантную активность экстрактов растений, но не оказывает существенного влияния на процессы роста. Также было продемонстрировано, что UVB повышает уровень ТГК в каннабисе *.
Синий свет (430-450 нм)Этот диапазон спектра позволяет криптохромам и фототропинам опосредовать такие реакции растений, как фототропное искривление, ингибирование роста удлинения, движение хлоропластов, открытие устьиц и регулирование роста проростков.Он влияет на образование хлорофилла, процессы фотосинтеза и через систему криптохрома и фитохрома повышает фотоморфогенетический ответ.
С практической точки зрения, эти длины волн стимулируют вегетативный рост и необходимы для освещения сеянцев и молодых растений на вегетативной стадии их цикла роста, особенно когда необходимо уменьшить или устранить «растяжение». Он также стимулирует выработку вторичных пигментов, которые могут улучшить цвета, и, как известно, также стимулирует терпен (т.е. аромат) производство.
Зеленый свет (500–550 нм)Большая часть зеленого света отражается от растений и играет гораздо меньшую роль в росте растений. Однако в этом диапазоне есть некоторые важные аспекты света, поэтому определенное количество света в этом диапазоне спектра является полезным. Зеленый свет иногда используется как инструмент для выявления специфических реакций растений, таких как контроль устьиц, фототропизм, фотоморфогенный рост и сигнализация окружающей среды. В сочетании с синим, красным и дальним красным светом зеленый свет завершает комплексную спектральную обработку для понимания физиологической активности растений.Но какой цвет света лучше всего подходит для фотосинтеза? Функция зеленого света менее изучена, чем другие спектры, и есть только определенные виды растений, которым требуется зеленый свет для нормального роста. Его эффекты, по-видимому, очень специфичны для штамма.
Пигменты, способные впитывать зеленый цвет, находятся глубже в структуре листа. Считается, что из-за того, что зеленый свет отражается от хлорофилла на поверхности листьев и, таким образом, отражается глубже в затененные участки кроны, чем красный и синий, которые легко поглощаются, этот зеленый может фактически поглощаться в основном через нижнюю часть листьев, как он подпрыгивает в затемненных глубинах навеса.
Красный свет (640–680 нм)Красный свет влияет на обратимость фитохрома и является наиболее важным для регуляции цветения и плодоношения. Эти длины волн стимулируют рост стебля и вегетации, цветение и плодоношение, а также производство хлорофилла.
Длина волны 660 нм оказывает очень сильное фотосинтетическое действие. Он оказывает самое сильное действие на всхожесть, цветение и другие процессы, регулируемые поглощающим красный фитохром. Эта длина волны наиболее эффективна для продления светового цикла или ночного прерывания, чтобы вызвать цветение растений длинного дня или предотвратить цветение растений короткого дня.
Дальний красный (730 нм)Несмотря на то, что длина волны 730 нм находится за пределами фотосинтетически активного диапазона, он оказывает самое сильное действие на форму фитохрома, поглощающую дальний красный цвет, превращая его обратно в форму, поглощающую красный цвет. Растения, требующие относительно низких значений фоторавновесия фитохромов для запуска цветочного цикла. Длина волны 730 нм может использоваться в конце каждого светового цикла для стимулирования цветения растений короткого дня, таких как каннабис.
Кроме того, более высокое отношение дальнего красного к красному, чем при солнечном свете, может вызвать реакцию на растяжение тени — когда растение, ощущающее его, затеняется на основе повышенного отношения дальнего красного к красному — и будет растягиваться, чтобы попытаться поднять. его навес над конкурентами.Вот почему слишком много дальнего красного не рекомендуется, если желательны компактные светодиодные лампы для выращивания растений или в целом. Но небольшие количества или FR, предоставляемые California LightWorks в нашем канале R / FR, очень полезны, и по этой причине отношение R к FR фиксировано на одном канале в серии 550.
Использование контроля спектра с каннабисомТочный способ использования света растениями очень специфичен для отдельных видов растений и их естественной среды. Эволюция создала огромное количество разнообразных стратегий роста растений, и невозможно переоценить световые реакции.Однако у нас есть большой практический опыт работы с результатами выращивания каннабиса в помещении. Ниже приведены некоторые общие стратегии и рекомендации, основанные на многолетних практических экспериментах с внутренним освещением, включая светодиодные системы полного спектра.
Самый частый вопрос, который мы получаем от производителей относительно контроля спектра при выращивании каннабиса, — это «Какая оптимальная смесь Spectrum для каннабиса?» И ответ в том, что это зависит от ВАШИХ приоритетов. Смеси разных спектров способствуют разной морфологии растений на разных стадиях роста, и одного идеала просто не существует.И это главное преимущество светодиодов по сравнению с HID — возможность использовать меняющийся спектр света для выращивания растений, чтобы спроектировать растение так, как вы от него хотите.
По сути, существует 5 (или, возможно, больше) различных аспектов конечного продукта в каннабисе, которые определяют его ценность, и разные люди хотят разных вещей.
1) Вес цветка (т. Е. Общий урожай цветов)
2) Плотность цветка (т. Е. Содержание смолы и соотношение масла и воска)
3) Косметическая привлекательность цветка (цвета, структура, а также плотность)
4 ) Аромат (сила i.е. концентрация терпена и сложность аромата)
5) Эффективность (уровни THC и CBD)
Здесь необходимо понимать, что НЕ ИДЕАЛЬНЫЙ СПЕКТР, который оптимизирует ВСЕ эти аспекты конечного продукта одновременно. Каждый из них можно индивидуально оптимизировать с помощью светодиодных светильников для растений, но придется пойти на компромисс.
Цели коммерческого производителя:Какие последователи являются НЕКОТОРЫМИ из типичных целей, которые средний коммерческий производитель может считать наиболее важными:
1) Некоторым производителям может потребоваться максимальный выход МАСЛА для пищевых продуктов и т. Д.а косметические аспекты и аромат цветов не важны. Здесь чрезвычайно важна потенция.
2) Некоторым может потребоваться максимальный выход масла для экстрактов высшего сорта, измельчения и т. Д., Где цветочная косметика не важна, но выход смолы, качество смолы (соотношение масло / воск) и аромат очень важны. Активность также важна и часто измеряется в лаборатории.
3) Некоторым может потребоваться максимальный период урожайности (веса) цветов. На это влияют многочисленные факторы, такие как содержание смолы и содержание смолы.цветочная материя (волокно), воск против масла и т. д., но этих людей волнует только общий урожай цветов по весу. По мере того, как рынок становится все более и более конкурентным, этот образ мышления будет бороться за конкуренцию.
4) Из-за значительной разницы в цене между цветками высшего качества и цветками более низкого качества или уличными цветами (в 2 раза или более) большинство коммерческих производителей в настоящее время стремятся максимизировать урожай цветов высшего качества , т. Е. цветок с высокой привлекательностью при хранении, то есть отличной косметикой, ароматом и плотностью.Эффективность важна и часто проверяется, но обычно считается специфичной для штамма и не считается зависящей от методов культивирования.
Таким образом, во всех этих примерах будут потенциально РАЗНЫЕ идеальные сочетания спектров, и, хотя эти идеальные сочетания спектров полностью не известны, мы можем приблизиться к вам. И обратите внимание, любой источник света с фиксированным спектром, такой как HPS или MH, никогда не сможет достичь идеальных результатов в любой из этих областей. Для этого потребуется переменный контроль спектра.
Также обратите внимание: единственный наиболее важный элемент в урожайности каннабиса — это формирование растения ДО пика цветения, так что свет видят только цветочные участки.Это невозможно переоценить. Лучшее освещение для выращивания в помещении и лучшие питательные вещества не так сильно повлияют на урожай, как обеспечение того, чтобы свет видели только участки цветов и отдельные солнечные листья, а все цветы, оставленные на растении, получали достаточно света. Также критически важными для этого процесса являются правильный дизайн, расположение и высота установки УФ-светодиодов для выращивания растений, чтобы свести к минимуму затенение растений и обеспечить постоянные уровни освещения.
Стадии роста каннабиса:Существует также 4 стадии роста каннабиса, которым предъявляются различные требования к спектру.
- Растительность — На стадии вегетации (VEG) желателен быстрый, здоровый рост растений и корней в целом, и в целом большинство производителей желают максимального роста, но предпочтительны более короткие компактные растения с коротким межузловым расстоянием.
- Предцветок — Предцветок — это период от первого начала цветочного цикла 12/12 до примерно конца второй недели (в 8-недельном цветке) или до тех пор, пока маленькие цветки не начнут преобладать. и быстрый рост замедляется.Опять же, большинство гроверов на этом этапе стремятся максимально увеличить РАЗМЕР, ограничивая при этом растяжение.
- Цветок — пиковый период цветения обычно приходится на 3-7 неделю и это время, когда рост растения (стебля / листа) прекращается и вся энергия растения сосредотачивается на производстве цветов. Обычно целью здесь является максимальный размер материи цветка и хорошая структура.
- Созревание или конец — Период созревания обычно длится от 7 недели до конца (в 8-недельном цветке), когда цветок растет, (т.е. размер) замедляется, а энергия растений переориентируется на производство смол и терпенов. Это период, когда цветок приобретает значительную часть своей плотности, т.е. содержание смолы. Этот переход четко не определен, и у некоторых штаммов в этот период наблюдается значительное увеличение продукции смолы, а у других — не так сильно.
Улучшение каждого аспекта роста растений может быть компромиссом. А также. Обладая основами нашего научного понимания спектра и морфологии растений, мы теперь можем попытаться найти некоторые отправные точки для смесей спектра для различных конечных результатов.Пожалуйста, поймите, это отправные точки для использования, например, ультрафиолетового излучения для растений, и вам нужно будет поэкспериментировать, чтобы достичь идеала для вашей среды, вида и желаемых результатов.
Цель № 1 выше, максимальное содержание МАСЛА в переработанных пищевых продуктах и т. Д.
В этом примере нашей целью является максимальное увеличение количества смолы и действительно выхода THC / CBD в целом. Это включает в себя как цветы, так и листья, стебли и т. Д. Таким образом, хорошей отправной точкой с точки зрения программ Spectrum может быть:
Veg: Очевидно, РАЗМЕР растения является важным фактором в этой точке, поэтому спектр с полностью красным и синим цветом важен.По сути, мы имитируем солнце, но в случае светодиодов исторически наши лучшие результаты в VEG достигаются при сочетании КРАСНОГО / СИНЕГО цветов около 60/40.
Предцветок и цветок: В этом случае, когда важен только выход смолы, а не структура цветка, можно использовать более высокий компонент синего цвета (т.е. ближе к солнцу), чем другие подходы. Хорошей отправной точкой будет 70/30 КРАСНЫЙ / СИНИЙ, но, возможно, даже более синий.
Созревание: Поскольку у нас уже есть дополнительные синие цветы, на этом этапе, вероятно, не требуется никаких изменений в освещении и частоте.
UVB: При таком подходе очень желательно использовать добавки UVB, потому что они могут повысить уровень ТГК на целых 30%. SO UVB следует дополнять минимум в течение последних 5 недель цветения.
Цель № 2 — Смола для экстрактов, дробления и т. Д.В этом примере наши цели аналогичны цели 1 выше, за исключением того, что больше внимания уделяется ароматизаторам. Итак, мы можем следовать примеру 1 выше, за исключением того, что на стадии созревания мы немного уменьшим красный цвет, чтобы увеличить соотношение синий / красный, чтобы больше стимулировать выработку терпена.Скажите 65/35.
UVB: UVB следует использовать на всем протяжении цветка, потому что мы не только хотим увеличить TCH в смоле, но также и производство терпена и других пигментов на всем протяжении цветка.
Цель № 3 — Максимальный урожай цветовУрожайность чистого цветочного вещества может быть повышена, если на всем протяжении всего процесса прогоняться достаточно высокий уровень красного, хорошей отправной точкой будет 80/20. Такой тип вегетативного роста наблюдается при HPS.
Цель № 4 — Максимальный урожай цветов на верхней полке.Этот тип конечного продукта представляет собой подход, при котором способность изменять спектр во все различные периоды роста составляет наиболее важный , и где светодиодные системы гибридного спектра (индивидуальный контроль красного / синего / белого) значительно превосходят все другие типы систем освещения.
Таким образом, хорошей отправной точкой для этого типа роста будет:
VEG: в зависимости от желаемого расстояния между узлами уменьшите соотношение R / B для более коротких междоузлий, Общая рекомендация: 60/40 для коротких плотных междоузлий.Это соотношение находится в миксе спектров CLW VEG.
Перед цветением: Чтобы снова уменьшить растяжение, соотношение R / B можно увеличить до 70/30 в течение первых 2 недель цветения или 75/25 для более высоких растений. Экстра темно-синий стимулирует дополнительные пигменты в этот критический период роста, улучшая цвет и аромат цветов.
Цветок: на этом этапе мы хотим максимизировать РАЗМЕР цветка, поэтому мы увеличим соотношение красный / синий до 80/20. Это соотношение присутствует в миксе спектра California LightWorks Full Cycle или в полностью включенной серии 550.Еще более высокий коэффициент красного (за счет уменьшения синего) можно использовать для дальнейшего стимулирования вегетативного роста растений, но при этом может быть потеряна смола, ароматизатор и вторичные пигменты. Всегда существует компромисс между цветочной массой и смолой (плотностью) / косметическим качеством. Мы не рекомендуем соотношение R / B выше 90/10 и не более недели или двух в середине пика цветения, иначе это повлияет на смолу и аромат. А слишком низкий (например, 60/40) в этот критический период будет способствовать избыточному содержанию листьев в цветах и более пушистой структуре, подобной цветкам на открытом воздухе.
Созревание: Здесь мы снова хотим усилить смолу и терпены (аромат), поэтому мы предлагаем снизить соотношение R / B до 70/30 или даже 60/40 на последние 2 недели. На этом этапе более высокое соотношение синего не изменит структуру цветка и не будет способствовать появлению избытка бутонов, потому что рост цветов замедляется и переходит к образованию смолы. Результаты в этой фазе роста очень зависят от сорта и могут зависеть от изменений питательных веществ, поэтому вам рекомендуется пробовать небольшие изменения при каждом урожае, чтобы постепенно достичь своего идеала.
UVB: В этом случае UVB может быть очень важным, и его можно дополнять либо в последние 4-5 недель, либо даже на протяжении всего цветочного цикла, чтобы стимулировать пигменты и терпены и, самое главное, THC. Обратите внимание, добавки UVB НЕ повышают уровень CBD.
Используя этот четырехэтапный подход к управлению спектром, вы можете по-настоящему оптимизировать косметику, аромат, плотность и цвет, то есть привлекательность вашего цветка на полке, с минимальными потерями или без потери урожайности по сравнению с HPS или другими системами с фиксированным спектром.
ЗаключениеИтак, в заключение, нельзя не подчеркнуть, что эти рекомендации являются лишь отправной точкой для использования светодиодных ламп для выращивания растений. Это потому, что все результаты зависят от сорта и могут также зависеть от других факторов, таких как температура, затенение и питательные вещества.
Приветствуются эксперименты с дополнительными изменениями, такими как варьирование уровней белого (т.е. зеленого) или постепенное изменение уровней вместо простого переключения.Тем не менее, мы предлагаем вам тщательно задокументировать все изменения и ограничить их изменением 5% в любом спектре за фазу роста и только одним изменением за каждый урожай. Слишком много изменений в одном цикле, и вы не узнаете, что к чему. Так что помните, ОДНА ЗАМЕНА ЗА УРОЖАЙ.
Кроме того, были предложения, и тип подъема и спуска типа «Рассвет / Сумерки» для имитации медленных изменений солнечного света имеет ценность, но на сегодняшний день мы не видели надежных универсальных данных в этом отношении. Но такие изменения легко выполнить с помощью контроллера SolarSystem 550.
Получите полный контроль над световым спектром и рост растенийИспользование лучших УФ-светодиодов для растений недостаточно. Поскольку разные растения используют разные части светового спектра на разных этапах, даже лучший свет для выращивания растений в помещении требует универсальной системы управления. Вот где на помощь приходит контроллер SolarSystem®. Он работает с SolarSystem 1100, 550 и 275 и позволяет управлять неограниченным количеством источников света, поэтому он работает независимо от того, используете ли вы один светодиодный светильник полного спектра или несколько источников света в цепочке.Автоматическое программирование позволяет контролировать спектр от 0% до 99% в синем, белом и красном диапазонах; В сочетании с 24-часовым таймером и календарем дня / недели / месяца это позволяет применять УФ-свет для выращивания растений на протяжении всего цикла роста и цветения.
Более подробную информацию о контроллере SolarSystem можно найти на этом веб-сайте. Добавьте его в корзину сегодня или, чтобы получить дополнительную информацию, свяжитесь с нами через Интернет или позвоните по телефону 800-575-3475.
Узнайте, как цветовой спектр светодиодного освещения влияет на рост растений
Оптимальный цветовой спектр для каннабисаВ связи с тенденцией в различных штатах к одобрению медицинской и рекреационной марихуаны, было проведено значительное количество исследований того, как цветовой спектр света влияет на рост растений каннабиса.Как и многие зеленые растения, каннабис содержит концентрации двух форм хлорофилла, А и В. Каждая из этих форм по-разному реагирует на разные длины волн света в цветовом спектре. По мере того, как культиваторы каннабиса улучшают свое понимание того, как различные части цветового спектра света влияют на их культуры и сорта, им потребуются передовые системы освещения для предприятий по выращиванию каннабиса, которые позволят им настраивать и определять световой спектр для лучшего роста растений.
Компания SpecGrade LED сделала еще один шаг вперед в этом управлении с помощью нашей технологии освещения для выращивания растений OpticPAR.Эта технология позволяет производителям регулировать относительную концентрацию различных компонентов цветового спектра в соответствии с потребностями растения в освещении с максимальной точностью на каждой стадии цикла выращивания растения. Как это может работать и комбинации цветовой гаммы, которые может использовать производитель, легко проиллюстрировать на примере выращивания каннабиса.
Большая часть исследований и разработок того, как цветовой спектр освещения влияет на рост растений, была сосредоточена на каннабисе из-за стремительного роста индустрии выращивания каннабиса в помещениях.Культиватор каннабиса, как правило, придерживается определенного набора комбинаций спектра:
- Культиваторы изначально хотят, чтобы у растения каннабис сформировалась прочная корневая структура на стадии прорастания и прорастания. Эту корневую структуру можно улучшить с помощью различных соотношений красного и дальнего красного света с длинами волн 660 нм и 730 нм.>
- При более дальнем красном свете растения каннабиса вырастут выше и будут иметь меньше узлов на листьях. Растение на самом деле хочет больше красного, чем дальнего красного света, и оно эволюционировало в результате естественных процессов, чтобы вырасти, чтобы получить свою долю красного света, когда оно растет на многолюдных полях других растений, которые также стремятся к красному свету.Культиватор может изменять относительное процентное соотношение красного и дальнего красного света для достижения оптимальной высоты и соотношения листьев по мере развития вегетации растений каннабиса.
- Растения каннабиса (как и другие растения) также нуждаются в циклах дня и ночи для правильного развития. Светодиодные системы освещения для выращивания растений идеально подходят для воспроизведения этих циклов, поскольку их можно включать и выключать практически мгновенно, без фазы разогрева. Культиватор может учитывать эти световые циклы выращивания в вариациях цветового спектра, которые используются на протяжении всей жизни растения.
- По мере того, как растение приближается к стадии цветения, ему потребуется более смешанная концентрация всех длин волн света в цветовом спектре. Бутонизация и цветение характеризуются множеством сложных биохимических процессов в растении, и все эти процессы имеют разные потребности в цветовой гамме.
- Когда растения каннабиса находятся на поздней стадии цветения и приближаются к сбору урожая, свет в синем спектре может быть уменьшен.
Вариации цветового спектра — одна из нескольких связанных переменных, которые культиватор захочет контролировать для повышения качества производства каннабиса.Для достижения оптимальных результатов также следует контролировать интенсивность света, температуру и влажность среды выращивания. Усовершенствованные светодиодные светильники для выращивания растений, включая системы, предоставляемые SpecGrade LED, идеально подходят для этих целей.
Светодиодные системы освещения для выращивания растений SpecGrade и наша запатентованная технология OpticPAR характеризуются передовой оптикой, которая была разработана на основе нашего многолетнего опыта в разработке и производстве проектов коммерческого и промышленного светодиодного освещения.Мы предлагаем светильники с отражателями и различные варианты монтажа, которые позволяют производителям настраивать системы внутреннего освещения так, чтобы их растения получали идеальное количество света. Низкие физические температуры, которые являются результатом наших запатентованных систем управления температурой, также снижают нагрузку на системы контроля температуры и влажности, что делает светодиодные лампы для выращивания растений SpecGrade лидером в предоставлении высококачественных световых решений для сельскохозяйственных предприятий любого размера.
Чтобы получить ответы на вопросы о том, как цветовой спектр освещения влияет на рост растений, а также дополнительную информацию о технологии освещения для выращивания растений OpticPAR от SpecGrade LED, посетите наш веб-сайт или позвоните по телефону 888-510-4337, чтобы поговорить с одним из наших специалистов по технологиям освещения для выращивания растений.
Влияние роста растений при различных спектрах света на последующую высокую светостойкость растений розы | ЗАВОДЫ AoB
Аннотация
Фотосинтез определяется как светозависимый процесс; однако на него отрицательно влияет высокая интенсивность света (HL). Чтобы исследовать, может ли память о росте при монохроматическом или комбинационном освещении влиять на реакцию растений на HL, розы выращивали при различных спектрах света [включая красный (R), синий (B), 70:30% красный: синий (RB) и белый (W)] и подвергались воздействию HL (1500 мкмоль м -2 с -1 ) в течение 12 часов.Переходные процессы полифазной флуоресценции хлорофилла а (OJIP) показали, что, хотя монохроматические растения, выращенные с помощью R и B, хорошо работали в контрольных условиях, функциональность их системы транспорта электронов была более чувствительной к HL, чем у растений, выращенных с помощью RB и W. Перед воздействием HL самая высокая концентрация антоциана наблюдалась в растениях, выращенных R- и B, в то время как воздействие HL уменьшало концентрацию антоциана как в R-, так и в B-выращиваемых растениях. Активность аскорбатпероксидазы и каталазы снижалась, а активность супероксиддисмутазы повышалась после воздействия HL.Это вызвало увеличение концентрации H 2 O 2 и содержания малонового диальдегида после воздействия HL. Содержание растворимых углеводов снижалось под воздействием HL, и это снижение было более выражено у растений, выращиваемых R и B. В заключение, выращивание растений в монохроматическом свете снижает способность растений справляться со стрессом HL.
Введение
Свет — это изначальный источник энергии для фотосинтеза и роста растений. Свет запускает широкий спектр сигналов и информации для морфогенеза и многих других физиологических процессов (Chen et al. 2004). Различные характеристики света, такие как спектральный состав (длина волны), интенсивность, продолжительность и направление, могут влиять на рост и развитие растений. Процесс фотосинтеза также чувствителен ко всем аспектам освещения.
Быстрое развитие технологий освещения с использованием светодиодов привело к увеличению применения этой технологии для освещения в закрытых садоводческих системах (Kozai et al. 2015). Светодиоды также привлекательны своей высокой эффективностью излучения, длительным сроком службы, небольшими размерами, низкой температурой, узким спектром и физической надежностью (Tennessen et al. 1994; Kim et al. 2004; Breive et al. 2005; Morrow 2008). Применение светодиодов в садоводстве позволяет использовать определенные длины волн для изучения реакции конкретных растений. Например, освещение между посевными культурами с использованием светодиодов в настоящее время используется для стимулирования фотосинтеза средних и нижних листьев. Однако исследования влияния спектральных длин волн на рост и развитие растений все еще продолжаются.
Реакция растений на свет различается в зависимости от условий освещения, сезона, генотипа, методов выращивания и многих других (Kozai 2016).Хотя свет является источником энергии для фотосинтеза, он может одновременно действовать как фактор стресса. В условиях высокой интенсивности света (HL) или когда растения подвергаются другим абиотическим стрессам (например, засуха), запас энергии (АТФ) и снижение мощности (НАДФН) через фотосистемы (и за счет участия цепи переноса электронов) превышают потребность в метаболических веществах. процессы в реакциях связывания углерода (Miyake et al. 2009; Gu et al. 2017). Накопление активных форм кислорода (АФК) является результатом нарушения между предложением и спросом на конечные продукты переноса электронов.В зависимости от скорости накопления АФК могут оказывать двойное влияние на реакцию растений. В низких концентрациях АФК действуют как сигнал для индукции защитных реакций, в то время как при высоких концентрациях АФК токсичны и вызывают перекисное окисление липидов в клеточных мембранах и вызывают окислительное повреждение клеточных компонентов (Dat et al. 2000; Vranová et al. 2002). Следовательно, в стрессовых условиях функциональность фотосинтеза снижается. Подавление фотосинтеза из-за воздействия интенсивностей HL известно как фотоингибирование.Повреждение, вызванное процессом фотоингибирования, может иметь место во всех компонентах фотосинтетического механизма. Среди них комплекс фотосистемы II (ФСII) цепи переноса электронов считается первичной мишенью фотоингибирования (Vass 2012; Roach and Krieger-Liszkay 2014). Однако фотосинтез как отлаженный процесс использует несколько механизмов, чтобы справиться с фотоингибированием. Рассеяние избыточной энергии в виде тепла является основной защитной стратегией для избавления от повреждений, вызванных интенсивностью HL (Müller et al. 2001). Рассеяние тепла известно как нефотохимическое тушение (NPQ) флуоресценции Chl. Нефотохимическое тушение включает в себя несколько стратегий, в том числе: энергозависимое тушение за счет участия ксантофиллового цикла, конформационные изменения в светособирающем комплексе II (LHCII), известные как переходы состояний, и фотоингибирование, приводящее к снижению квантового выхода как следствие светоиндуцированное повреждение (Müller et al. 2001; Zhao et al. 2017).
Свет поглощается растительными пигментами. Chl a и b — основные фотосинтетические пигменты растений. В основном они поглощают синие и красные волны светового спектра. Каротиноиды со спектром поглощения от 350 до 500 нм также присутствуют во всех системах фотосинтеза на основе хлорофилла. Они способствуют поглощению света антенной системой. Кроме того, каротиноиды помогают растению рассеивать избыточную энергию в виде тепла, чтобы защитить аппарат фотосинтеза от интенсивностей HL (Sharma and Hall 1993).Антоцианы также участвуют в защите фотосинтетического аппарата от повреждений из-за интенсивности HL (Petrella et al. 2016).
Розы — самые известные декоративные растения во всем мире. На рост и развитие, а также на качество растений розы после сбора урожая влияют факторы окружающей среды перед сбором урожая, такие как относительная влажность (RH) и свет (Fanourakis et al. 2013). Вопросы, связанные со светом, привлекали большое внимание в выращивании роз в последние несколько десятилетий.В некоторых местах (особенно в высоких широтах) дополнительное освещение используется для компенсации ограничений солнечного света. В других местах воздействие интенсивностей ГЛ в летнее время отрицательно влияет на урожайность роз. Летом в этих местах часто применяется притенение розовых растений. Более того, во многих местах растения подвергаются воздействию HL лишь на короткое время. Однако и затенение, и HL могут отрицательно влиять на фотосинтез (García Victoria et al. 2011).
Каждая спектральная полоса света может вызывать у растений определенные реакции. Например, красный и синий свет в основном содержат диапазон длин волн, необходимый для электронного возбуждения в фотосинтетическом аппарате (Taiz and Zeiger 2002). Длины волн в диапазоне синего и УФ-диапазона вызывают накопление каротиноидов и антоцианов в листьях (Li and Kubota 2009; Carvalho et al. 2016), а красный свет вызывает накопление углеводов в листьях (Sæbø et al. ). 1995).Поскольку каждая полоса длин волн света может вызывать определенные механизмы и реакции у растений, которые могут влиять на последующие реакции растений на стрессы окружающей среды, в текущем исследовании мы предполагаем, что защитные механизмы против стресса HL будут активироваться / подавляться посредством выращивания растений. при определенных спектрах света, которые впоследствии могут повлиять на реакцию растений на интенсивность HL. Кроме того, поскольку ограниченные длины волн могут вызывать определенные защитные механизмы против HL, растения, выращенные при комбинированных длинах волн, имеют больше возможностей переносить интенсивность HL.
Криптохромы и фототропины являются акцепторами света B, тогда как фитохромы являются более чувствительными акцепторами света R (Whitelam and Halliday 2008). Эти фоторецепторы получают информацию из световой среды и используют эту информацию для модуляции клеточных процессов (Smith 1982). Следовательно, различные пути передачи сигнала участвуют в повышении или понижении регуляции определенных метаболических путей с помощью информации, полученной от конкретного фоторецептора определенной длины волны.Цели настоящего исследования заключались в изучении (i) структуры и функции фотосинтетического аппарата у растений (выращенных при разных световых спектрах), подвергнутых воздействию интенсивности HL, и (ii) механизмов, участвующих в устойчивости к HL у растений розы, выращенных при разном освещении. спектры.
Было показано, что поток энергии и информация, относящаяся к структуре и функциям фотосинтетического аппарата, могут быть проанализированы с помощью данных флуоресценции Chl. Хотя параметры флуоресценции хлорофилла, полученные методом импульса насыщения в адаптированных к свету листьях, дают ценную информацию о потоке энергии через мембраны тилакоидов, эти типы измерений требуют много времени и не полностью подходят для оценки параметров флуоресценции в практических условиях (Brestic and Zivcak 2013).Неразрушающий анализ полифазного транзиента быстрого хлорофилла с помощью так называемого теста OJIP был разработан для быстрой оценки биофизических аспектов фотосинтеза, особенно в стрессовых условиях (Strasser 1995; Mathur et al. 2013). Этот тест основан на потоке энергии в тилакоидных мембранах, который предоставляет подробную информацию о биофизике фотосинтетической системы посредством измерения сигналов флуоресценции (Kalaji et al. 2017). Тест OJIP успешно применялся для изучения фотосинтетического аппарата различных видов растений в условиях абиотического стресса (Panda et al. 2008; Martinazzo et al. 2012; Kalaji et al. 2014; Rapacz et al. 2015; Kalaji et al. 2016). Таким образом, этот тест был использован в текущем исследовании для выявления негативных эффектов стресса HL на фотосинтетический аппарат растений розы.
Материалы и методы
Растительный материал и условия роста
Розы ( Rosa hybrida сорт ‘Avalanche’) были размножены черенками в марте 2017 года на перлитовой среде.Укоренение достигалось через 4–5 недель посадки. Укоренившиеся черенки (длиной 10–15 см с двумя появляющимися листьями) пересаживали в пластиковые горшки диаметром 15 см, содержащие смесь кокопита и перлита (70/30% по объему). После пересадки растения поливали ежедневно в течение 3 дней, а затем орошали раствором Хогланда половинной концентрации. Однородные растения были разделены на четыре камеры роста (по четыре растения на каждую камеру роста) с одинаковыми климатическими условиями (температура: 27 ± 3 ° C; относительная влажность: 50 ± 5%; фотопериод: 12 часов света / 12 часов темноты между 08:00. и 2000 ч).Растения подвергали воздействию четырех различных световых спектров: белого (W), синего (B), красного (R) и 70% красного + 30% синего (RB), обеспечиваемого производственными модулями светодиодов (24-W, Iran Grow Light Co., Иран) при плотности потока фотосинтетических фотонов (PPFD) 250 ± 10 мкмоль м −2 с −1 . Спектр W составлял 41% в диапазоне B и 18% в диапазоне R. Интенсивности фотосинтетического потока фотонов и световые спектры контролировали с помощью люксметра (Sekonic C-7000, Япония). Относительные спектры световых обработок показаны на рис.1. Через четыре недели после роста при различных спектрах света все растения подвергались воздействию HL интенсивности (1500 мкмоль м -2 с -1 ) в течение 12 часов (между 08:00 и 2000 часами) (рис. 2). Чтобы обеспечить такую же температуру во время воздействия на растения интенсивности HL, что и температура в камере роста, растения освещали производственными модулями светодиодов (Iran Grow Light Co., Иран) в диапазоне 400–700 нм в помещении с регулируемой температурой при 21 °. C и 50% относительной влажности. В этих условиях температура была зафиксирована на уровне 27 ° C при интенсивности HL (такая же, как температура в камерах для выращивания).Поскольку такая интенсивность HL вызвала повышение температуры камеры роста (27 ° C), для поддержания той же температуры до и после интенсивности HL такая же температура поддерживалась внутри камер роста во время роста растений. Модуль состоял из 320 светодиодов, оборудованных тремя вентиляторами для уменьшения количества тепла, выделяемого в модуле. Измерение параметров проводилось в двух временных точках: во-первых, в конце роста растений при различных спектрах света с PPFD 250 мкмоль м -2 с -1 , а во-вторых, в конце воздействия на растения HL. интенсивности (1500 мкмоль · м −2 с −1 ).
Рисунок 1.
Спектры света синего (B), красного (R), красного и синего (RB) и белого (W) освещения окружающей среды, измеренные на уровне растений в камерах для выращивания.
Рис. 1.
Спектры света синего (B), красного (R), красного и синего (RB) и белого (W) освещения, измеренные на уровне растений в камерах для выращивания.
Рисунок 2.
Репрезентативные изображения, показывающие растения (A), которые росли в течение 3 недель при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)], камеры роста, которые были использованы для выращивания растений под 250 (B) и 1500 (C) мкмоль м -2 с -1 PPFD.
Рис. 2.
Репрезентативные изображения, показывающие растения (A), которые росли в течение 3 недель при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)], камеры роста которые были использованы для выращивания растений под 250 (B) и 1500 (C) мкмоль · м -2 с -1 PPFD.
Измерения флуоресценции Chl и теста OJIP
Самые молодые полностью развитые листья использовали для измерения максимальной квантовой эффективности PSII ( F v / F m ) с помощью Handy Fluorcam FC 1000-H (Photon Systems Instruments, PSI, Чешская Республика).Неповрежденные листья, прикрепленные к растениям, адаптировали к темноте в течение 20 мин. После адаптации к темноте интактные растения немедленно использовали для измерения F v / F m . Использовалась камера Fluorcam, состоящая из камеры CCD и четырех фиксированных светодиодных панелей, одна пара обеспечивала измерительные импульсы, а вторая пара обеспечивала актиничное освещение и насыщающую вспышку. F v / F m было рассчитано с использованием индивидуального протокола (Genty et al. 1989; Aliniaeifard et al. 2014; Aliniaeifard и van Meeteren 2014). Изображения были записаны во время коротких измерительных вспышек в темноте. В конце коротких вспышек образцы подвергались воздействию насыщающего светового импульса (3900 мкмоль м -2 с -1 ), что приводило к временному насыщению фотохимии и восстановлению первичного акцептора хинона ФСII (Genty и др. 1989). После достижения установившейся флуоресценции две последовательные серии данных флуоресценции были оцифрованы и усреднены: одна во время коротких измерительных вспышек в темноте ( F 0 ), а другая во время вспышки насыщающего света ( F м ). ).Из этих двух изображений F v было вычислено по выражению F v = F m — F 0 . Модель F v / F м была рассчитана с использованием соотношения ( F м — F 0 ) / F м . Максимальная флуоресценция ( F м ′) была определена в адаптированном к свету устойчивом состоянии и использовалась для расчета NPQ в соответствии со следующим уравнением:
Средние значения и стандартное отклонение для изображения были рассчитаны с использованием программного обеспечения Fluorcam версии 7.0.
Переходные процессы полифазной флуоресценции Chl a (OJIP) измеряли с использованием Fluorpen FP 100-MAX (Photon Systems Instruments, Drasov, Чешская Республика) на молодых полностью распустившихся листьях розы после 20-минутной адаптации к темноте. OJIP использовался для изучения различных биофизических и феноменологических параметров, связанных со статусом PSII (Strasser 1995). Измерение переходной флуоресценции было вызвано насыщающим светом ~ 3000 мкмоль м -2 с -1 . Все измерения проводили на 20-минутных адаптированных к темноте растениях.Переходные процессы OJIP были выполнены в соответствии с тестом JIP (Strasser и др. 2000b). Следующие данные из исходных измерений были использованы после экстракции с помощью программного обеспечения Fluorpen: интенсивности флуоресценции при 50 мкс (F50 мкс, считается минимальной флуоресценцией F 0 ), 2 мс (J-шаг, F J ) , 60 мс (I-шаг, F I ) и максимальная флуоресценция ( F м ).
Индекс эффективности был рассчитан на основе поглощения (PI ABS ) и плотностей QA –, восстанавливающих реакционные центры PSII в момент времени 0 и время достижения максимальной флуоресценции.Коэффициенты выходов, включая вероятность того, что захваченный экситон перемещает электрон в цепи переноса электронов за пределы QA — (ψ o ), квантовый выход переноса электронов (φ Eo ), квантовый выход диссипации энергии (φ Do ) и максимальный квантовый выход первичной фотохимии (φ Po ) также были рассчитаны на основе следующих уравнений:
φEo = (1- (F0FM)) ⋅ ψo
Из этих данных следующие были рассчитаны параметры: удельные потоки энергии на реакционный центр (RC) для поглощения энергии (ABS / RC = M 0 · (1 / V Дж ) · (1 / φ Po )), (M 0 = TR 0 / RC-ET 0 / RC), поток захваченной энергии (TR 0 / RC = M 0 · (1 / V Дж )), транспортный поток электронов (ET 0 / RC = M 0 · (1 / V J ) · ψ o ) и поток рассеянной энергии (DI 0 / RC = (ABS / RC) — (TR 0 / RC )).
Измерение пигмента
Содержание Хл и каротиноидов в листьях измеряли по методу, описанному Арноном (1949). Для измерения содержания антоцианов в листьях 1 г ткани листа гомогенизировали в 10 мл метанола и экстракт инкубировали при 4 ° C в темноте в течение ночи. Пульпу центрифугировали (СИГМА-3К30) при 4000 g в течение 10 мин. Антоцианин в супернатанте определяли спектрофотометрически (спектрометр Lambda 25 UV / VIS) при 520 нм в соответствии с методом, описанным Wagner (1979).
Определение содержания перекиси водорода и перекисного окисления липидов
Уровень перекисного окисления липидов в ткани листа определяли на основании содержания малонового диальдегида (МДА, продукт перекисного окисления липидов) в листьях. Малоновый диальдегид определяли реакцией с тиобарбитуровой кислотой (TBA) с помощью незначительной модификации метода, описанного Heath and Packer (1968). Образец листьев 0,25 г гомогенизировали в 5 мл 0,1% трихлоруксусной кислоты (TCA). Гомогенат центрифугировали при 10000 g в течение 5 мин.Четыре миллилитра 20% TCA, содержащего 0,5% TBA, добавляли к 1 мл аликвоте супернатанта. Смесь нагревали при 95 ° C в течение 30 минут, а затем быстро охлаждали на ледяной бане. После центрифугирования при 10000 g в течение 10 мин считывали поглощение супернатанта при 532 нм и вычитали значение неспецифического поглощения при 600 нм. Концентрация МДА была рассчитана с использованием его коэффициента экстинкции, равного 155 мМ -1 см -1 (Heath and Packer 1968).
Содержание пероксида водорода (H 2 O 2 ) измеряли спектрофотометрически после реакции с иодидом калия (KI). Реакционная смесь содержала 0,5 мл 0,1% TCA, супернатант экстракта листьев, 0,5 мл 100 мМ K-фосфатного буфера и 2 мл реагента (1 M KI в / об в свежей бидистиллированной H 2 O). Бланк содержал 0,1% TCA в отсутствие экстракта листьев. Реакцию проявляли в течение 1 ч в темноте, и оптическую плотность измеряли при 390 нм. Количество H 2 O 2 рассчитывали с использованием стандартной кривой, построенной с известными концентрациями H 2 O 2 в соответствии с методом, описанным Patterson et al. (1984).
Определение углеводов
Молодые полностью развитые листья (300 мг свежей массы [FW]) собирали из каждой повторности на обработку и измельчали в жидком азоте, смешивали с 7 мл 70% этанола (мас. / Об.) В течение 5 минут на льду и центрифугировали при 6700 ° C. г в течение 10 мин при 4 ° C. После добавления 200 мл супернатанта к 1 мл раствора антрона (0,5 г антрона, 250 мл 95% H 2 SO 4 и 12,5 мл дистиллированной воды) оптическую плотность регистрировали спектрофотометрически при 625 нм (van Doorn 2012 ).
Для количественного определения крахмала измельчали 0,1 г свежего полностью развитого листа, экстрагировали сахара 80% этанолом и солюбилизировали крахмал, используя 52% хлорную кислоту. Крахмал определяли колориметрически при 630 нм с использованием реакции сахар-антрон-серная кислота на основе метода, описанного McCready et al. (1950).
Определение активности антиоксидантных ферментов
Активность аскорбатпероксидазы (APX) определяли окислением аскорбиновой кислоты (AA) при 265 нм (ε = 13.7 мМ -1 см -1 ) небольшой модификацией метода, описанного Накано и Асада (1981). Реакционная смесь содержала 50 мМ калий-фосфатный буфер (pH 7,0), 5 мМ АК, 0,5 мМ H 2 O 2 и ферментный экстракт. Реакцию начинали добавлением H 2 O 2 . Скорости были скорректированы на неферментативное окисление АК путем включения реакционной смеси без экстракта фермента (слепой образец). Активность фермента выражали в мкмоль AA min -1 на 1 г сырого веса (Nakano and Asada 1981).
Для определения активности каталазы (CAT) разложение H 2 O 2 регистрировали по уменьшению поглощения при 240 нм. Реакционная смесь состояла из 1,5 мл 50 мМ натрий-фосфатного буфера (pH 7,8), 0,3 мл 100 мМ H 2 O 2 и 0,2 мл ферментного экстракта. Одна единица CAT была определена как количество фермента, необходимое для разложения 1 мМ мин. -1 H 2 O 2 . Следовательно, активность CAT выражалась как U g -1 FW min -1 (Díaz-Vivancos et al. 2008 г.).
Активность супероксиддисмутазы (СОД) измеряли в соответствии с методом, описанным Dhindsa et al. (1981). Метод основан на способности SOD ингибировать фотохимическое восстановление нитросинего тетразолия (NBT). Реакционная смесь содержала 50 мМ фосфатный буфер (pH 7-8), 13 мМ метионин, 75 мкМ NBT, 0,15 мМ рибофлавин, 0,1 мМ EDTA и 0,50 мл ферментного экстракта. Рибофлавин был добавлен последним. Реакционную смесь встряхивали и помещали под две люминесцентные лампы мощностью 15 Вт.Реакцию начинали включением света и оставляли на 10 мин. Реакцию останавливали, выключая свет, и пробирки закрывали черной тканью. Поглощение реакционной смеси регистрировали спектрофотометрически при 560 нм. В качестве контроля использовали реакционную смесь без воздействия света. В контроле окраски не наблюдалось. В условиях анализа одна единица активности SOD выражается как количество фермента, которое привело к 50% ингибированию восстановления NBT (Dhindsa et al. 1981).
Статистический анализ
Четыре растения использовали в четырех повторностях для каждой световой обработки. Отдельные растения были взяты как независимые повторы. Измерения проводились в двух временных масштабах: до и после воздействия HL. Чтобы сделать условия окружающей среды в двух временных шкалах похожими, условия окружающей среды внутри камер и между камерами поддерживались как можно более похожими до и после воздействия HL. Для этого в течение этих двух периодов времени в помещении с климат-контролем поддерживались одинаковые температура, относительная влажность, интенсивность и продолжительность освещения.Отбор проб производился на одних и тех же растениях до и после воздействия HL. Данные были подвергнуты двухфакторному дисперсионному анализу (ANOVA), и тест Тьюки был использован в качестве пост-теста. P > 0,05 считалось незначительным. Для статистического анализа использовали GraphPad Prism 7.01 для Windows (GraphPad Software, Inc., Сан-Диего, Калифорния).
Результаты
Переходные процессы полифазной флуоресценции Chl a (OJIP)
В данном исследовании активность ФСII изучалась путем расчета различных параметров флуоресценции Хл в листе в адаптированном к темноте состоянии.Исследование кривой индукции быстрой флуоресценции хлорофилла показало, что все растения давали типичные многофазные кривые с основными этапами OJIP (рис. 3). Для всех растений интенсивность сигнала флуоресценции увеличивалась от исходного уровня флуоресценции ( F 0 ) до промежуточных стадий (J и I), а затем достигала максимального уровня ( F m ). За исключением света R, воздействие HL вызывало снижение интенсивности флуоресценции на всех этапах OJIP.
Рис. 3.
Кривая быстрой индукции флуоресценции хлорофилла, показанная листьями растений розы, подвергшимися воздействию различных световых спектров [синий (B), красный (R), белый (W) и красный и синий (RB)] под 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
Рисунок 3.
Кривая индукции быстрой флуоресценции хлорофилла, показанная листьями растений роз, подвергшихся воздействию различных световых спектров [синий (B), красный (R), белый (W) и красный и синий (RB)] ниже 250 (C) ) и 1500 (HL) мкмоль м −2 с −1 PPFD.
В контрольных условиях (C) самые высокие значения F 0 и F J наблюдались для растений, выращенных в W, а самые низкие значения были обнаружены у растений, выращенных в R (рис. 4A и B). В условиях HL самые высокие значения F 0 , F J , F I и F P наблюдались для растений, выращенных в R, а их самые низкие значения — для растений, выращенных в RB. растения (рис. 4A – D). У всех растений воздействие HL приводило к снижению значений F, и ; однако среди световых обработок изменение F v после воздействия HL было самым низким для растений, выращенных на W (рис.4E). F v / F m также уменьшилось после воздействия HL, и это снижение было наибольшим для монохроматических R- и B-выращенных растений (рис. 4D). Расчетные параметры теста OJIP были значительно изменены из-за воздействия различных световых спектров и HL, и взаимодействия также были значительными для рассчитанных параметров [см. Вспомогательная информация — Таблица S1 ] . Расчетные параметры удельных потоков энергии на реакционный центр, такие как ABS / RC, TR 0 / RC и DI 0 / RC, были увеличены после воздействия HL для всех растений, выращенных в разных световых спектрах, за исключением RB-выращенных. растения (рис.5A, B и D). В случае ABS / RC и DI 0 / RC наибольшая разница между C и HL наблюдалась у монохроматических R- и B-выращенных растений. Не было существенной разницы между C и HL для растений, выращенных в RB. ET 0 / RC был аналогичен при обработке C и HL для растений, выращиваемых R- и B, в то время как он увеличивался у растений, выращенных на W и RB, после воздействия HL (фиг. 5C).
Рисунок 4.
Интенсивность флуоресценции хлорофилла а в тесте OJIP, включая F 0 (A), F J (B), F I (C), F P (D), F v [E; ( F m — F 0 )] и F v / F m (F) от переходной флуоресценции, проявляемой листьями растений розы, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] менее 250 (черные полосы) и 1500 (серые полосы) мкмоль м -2 с -1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Рисунок 4.
Интенсивность флуоресценции хлорофилла а в тесте OJIP, включая F 0 (A), F J (B), F I (C), F P (D), F v [E; ( F m — F 0 )] и F v / F m (F) от переходной флуоресценции, проявляемой листьями растений розы, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] менее 250 (черные полосы) и 1500 (серые полосы) мкмоль м -2 с -1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Рисунок 5.
Удельные потоки энергии на реакционный центр (RC) для поглощения энергии [A; (ABS / RC)], поток захваченной энергии [B; (TR 0 / RC)], транспортный поток электронов [C; (ET 0 / RC)] и поток рассеянной энергии [D; (DI 0 / RC)] от переходной флуоресценции, проявляемой листьями растений роз, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] при 250 ( черные полосы) и 1500 (серые полосы) мкмоль м −2 с −1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Рисунок 5.
Удельные потоки энергии на реакционный центр (RC) для поглощения энергии [A; (ABS / RC)], поток захваченной энергии [B; (TR 0 / RC)], транспортный поток электронов [C; (ET 0 / RC)] и поток рассеянной энергии [D; (DI 0 / RC)] от переходной флуоресценции, проявляемой листьями растений роз, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] при 250 ( черные полосы) и 1500 (серые полосы) мкмоль м −2 с −1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Анализ параметров, оценивающих урожайность и эффективность цепи переноса электронов, показал, что, хотя самые высокие значения для PI ABS , φ Po и φ Eo наблюдались у монохроматических R- и B-выращенных растений в условиях В контрольных условиях их значения были уменьшены больше в условиях HL по сравнению с их значениями у растений, выращенных в W и RB (рис. 6A – C). Воздействие HL привело к увеличению φ , Do и NPQ [см. Вспомогательную информацию — рис.S1 ] на всех заводах; однако самый высокий φ , Do наблюдался в растениях, выращенных в RB, как в контроле, так и в условиях HL (фиг. 6D). Увеличение φ RAV наблюдалось в R- и RB-растениях после воздействия HL (фиг. 6E). Растения, выращенные R- и RB, имели самые высокие значения ψ o в контрольных условиях, в то время как их значения ψ o уменьшались после воздействия HL. Напротив, у растений, выращенных в W и RB, значения ψ o были низкими в контрольных условиях и увеличивались после воздействия HL (рис.6F).
Рисунок 6.
Индекс эффективности на основе поглощения [A; (PI ABS )], максимальный квантовый выход первичной фотохимии [B; (φ Po )], квантовый выход электронного транспорта [C; (φ Eo )], квантовый выход рассеяния энергии [D; (φ Do )], средний (от времени 0 до t FM ) квантовый выход для первичной фотохимии [E; (φ PAV )] и вероятность того, что захваченный экситон переместит электрон в цепи переноса электронов за пределы QA — [F; (ψ o )] от переходной флуоресценции, проявляемой листьями растений роз, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] до 250 (черные полосы) ) и 1500 (серые полосы) мкмоль м −2 с −1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Рисунок 6.
Индекс эффективности на основе поглощения [A; (PI ABS )], максимальный квантовый выход первичной фотохимии [B; (φ Po )], квантовый выход электронного транспорта [C; (φ Eo )], квантовый выход рассеяния энергии [D; (φ Do )], средний (от времени 0 до t FM ) квантовый выход для первичной фотохимии [E; (φ PAV )] и вероятность того, что захваченный экситон переместит электрон в цепи переноса электронов за пределы QA — [F; (ψ o )] от переходной флуоресценции, проявляемой листьями растений роз, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] до 250 (черные полосы) ) и 1500 (серые полосы) мкмоль м −2 с −1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Пигменты
На все фотосинтетические пигменты значительное влияние оказали световые спектры (рис. 7). Chl a [см. Вспомогательную информацию — рис. S2A ] , b [см. Вспомогательную информацию — рис. S2B ] и всего Chl [см. вспомогательную информацию — рис. S2C ] , а также каротиноиды (фиг. 7A) значительно снизились при выращивании роз в синем свете. В случае антоциана взаимодействие между световыми спектрами и интенсивностью света было значительным ( P ≤ 0.01). До воздействия HL самая высокая концентрация антоцианов наблюдалась в растениях, выращиваемых R- и B, в то время как воздействие HL приводило к ~ 50% снижению концентрации антоцианов в растениях, выращенных как R-, так и B; Существенных различий в концентрации антоцианов до и после HL в листьях растений, выращенных W- и RB, обнаружено не было (фиг. 7B).
Рис. 7.
Концентрации каротиноидов (A) и антоцианов (B) и содержание MDA (C) в листьях розовых растений, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] при 250 (черные полосы) и 1500 (серые полосы) мкмоль м -2 с -1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Рис. 7.
Концентрации каротиноидов (A) и антоцианов (B) и содержание MDA (C) в листьях розовых растений, выращенных при различных спектрах света [синий (B), красный (R), белый (W) красный и синий (RB)] под 250 (черные полосы) и 1500 (серые полосы) мкмоль м −2 с −1 PPFD. Столбцы представляют собой средние значения ± стандартное отклонение.
Антиоксидантные ферменты и окислительное повреждение
Аскорбатпероксидаза и СОД значительно зависели от интенсивности света разными способами (рис.8A и B). Независимо от светового спектра, активность APX снижалась после воздействия HL, в то время как активность SOD вызывалась воздействием HL. Активность каталазы снижалась при воздействии HL (фиг. 8C). Наибольшая активность CAT наблюдалась у растений, выращенных в RB, как в контроле, так и в условиях HL. Уровень H 2 O 2 значительно зависит от интенсивности света (рис. 8D). По сравнению с контрольными условиями уровень H 2 O 2 повышался в 10 раз после воздействия HL.На содержание малонового диальдегида также влияла сила света (рис. 7C). По сравнению с контрольными условиями содержание МДА увеличивалось вдвое после воздействия HL. Наибольшее содержание МДА наблюдалось в растениях, выращенных в RB, как в контроле, так и в условиях HL.
Рис. 8.
Активность APX (A), SOD (B) и CAT (C) и H 2 O 2 концентрация в листьях розовых растений, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] под 250 (черные полосы) и 1500 (серые полосы) мкмоль м -2 с -1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Рис. 8.
Активность APX (A), SOD (B) и CAT (C) и H 2 O 2 концентрация в листьях растений розы, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] при 250 (черные полосы) и 1500 (серые полосы) мкмоль м -2 с -1 PPFD. Столбцы представляют собой средние значения ± стандартное отклонение.
Концентрации углеводов
Содержание растворимых углеводов значительно снизилось при воздействии условий HL (рис.9А). Это снижение было больше у растений, выращенных в R- и B (уменьшение на 65% и 79%, соответственно), чем у растений, выращенных в W- и RB (уменьшение на 60% и 49%, соответственно). Наибольшая и наименьшая концентрации растворимых углеводов были обнаружены в растениях, выращиваемых R и B в условиях контроля и HL, соответственно.
Рисунок 9.
Концентрация растворимых углеводов (A) и крахмала (B) в листьях розовых растений, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB) )] менее 250 (черные полосы) и 1500 (серые полосы) мкмоль м −2 с −1 PPFD.Столбцы представляют собой средние значения ± стандартное отклонение.
Рис. 9.
Концентрация растворимых углеводов (A) и крахмала (B) в листьях розовых растений, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий ( RB)] менее 250 (черные полосы) и 1500 (серые полосы) мкмоль м -2 с -1 PPFD. Столбцы представляют собой средние значения ± стандартное отклонение.
Подобно растворимым углеводам, условия HL приводили к снижению концентрации крахмала (рис. 9B). Это снижение составило соответственно 28% и 31% для растений, выращиваемых R- и B, и 46% и 35% для растений, выращиваемых W- и RB.Самая высокая и самая низкая концентрации крахмала были, соответственно, обнаружены в R- и W-выращиваемых растениях как в контроле, так и в условиях HL.
Обсуждение
Реакции фотосинтеза у растений зависят от условий окружающей среды. Считается, что различные характеристики света, включая спектр и интенсивность, имеют самое прямое влияние на фотосинтетические реакции (Chen et al. 2004). В нашем исследовании данные флуоресценции Chl были проанализированы с помощью теста OJIP.Используя этот тест, мы показали, что система ФСII надлежащим образом работает у растений, выращенных в монохроматических R- и B-спектрах. Однако, когда растения, выращенные R- и B, подвергались воздействию условий HL, их PI ABS и ϕ Eo уменьшались, а DI 0 / RC увеличивались по сравнению с их значениями в контрольных условиях (рис. 5–7). С другой стороны, у растений, выращиваемых в W и RB, ψ o и ET 0 / RC увеличивались после воздействия HL (рис. 5 и 7). Эти результаты показали, что выращивание растений в условиях сочетания световых спектров позволило растениям разработать аппарат фотосинтеза с меньшей уязвимостью, чем аппарат фотосинтеза у монохроматически выращенных растений в ответ на стресс HL.PI ABS объединяет потоки энергии от ранней стадии процесса абсорбции до восстановления пластохинона (Strasser et al. 2000a). Согласно предыдущим отчетам, этот параметр очень чувствителен к различным стрессам окружающей среды и успешно используется для измерения фотосинтеза и производительности растений в ответ на различные абиотические стрессы, включая высокие температуры (Martinazzo et al. 2012), соленость (Mathur et al. 2013), дефицит питательных веществ (Kalaji et al. 2014), погружение (Sarkar and Ray 2016), холодное (Rabara et al. 2017) и низкий pH (Long et al. 2017).
В текущем эксперименте, чтобы обеспечить одинаковую температуру до и после HL, внутри камер для выращивания также поддерживалась одинаковая температура (27 ° C), что отрицательно влияло на параметры флуоресценции Chl a, в результате чего значения для были немного ниже 0,8. F v / F m (рис.4). Более низкие фотохимические характеристики ФСII (более низкие PI , ABS и φ Eo ) у монохроматических R- и B-выращенных растений после воздействия HL были связаны с более высоким поглощением световой энергии (ABS / RC), захватом (TR 0 ). / RC) и поток рассеянной энергии (DI 0 / RC) и нижний ET 0 / ABS на реакционный центр (рис.5), что, как следствие, привело к уменьшению квантового выхода электронного транспорта (φ Eo ) и максимального квантового выхода первичной фотохимии (φ Po ) (рис. 6). Увеличение ABS / RC может быть связано с инактивацией реакционных центров и уменьшением активных центров восстановления QA (Strasser and Stirbet 1998). В условиях HL дефектные центры QA-восстановления функционируют как теплоотвод и защищают растение от повреждения HL (Zivcak et al. 2014). Более высокое значение TR 0 / RC привело к более высокому ингибированию повторного окисления QA — до QA (Strasser et al. 2000а). Более высокое значение TR 0 / RC привело бы к более низкому переносу электронов на реакционный центр (ET 0 / RC) (рис. 5), что, в свою очередь, привело бы к уменьшению транспорта электронов при захвате. Фактически, небольшая часть поглощенной энергии передается по цепи переноса электронов (Sarkar and Ray, 2016). Ограничение переноса электронов за пределы ФСII приведет к сверхредукции QA. Яркий свет ограничивает транспорт электронов к комплексу cytb6f и вызывает чрезмерное восстановление QA (Foyer et al. 2012 г.). У растений, выращиваемых в W и RB, поток переноса электронов на реакционный центр и вероятность того, что захваченный экситон переместит электрон в цепи переноса электронов за пределы QA — (ψ o ), увеличиваются после стресса HL (рис. 7). Это показало, что растения, выращенные на W и RB, были более способны переносить электроны от поглощенных фотонов в цепь переноса электронов и дальше QA -1 . Это подтвердило, что растения, выращенные в W и RB, положительно регулируют уровень энергии в реакционных центрах (Strasser et al. 2004) после воздействия HL.
Адаптация растений к преобладающей световой среде отражается в изменении анатомии и морфологии листьев, известном как акклиматизация в процессе развития (Vialet-Chabrand et al. 2017). Быстрое и кратковременное воздействие интенсивностей HL (как это произошло в текущем исследовании) приводит к динамической акклиматизации растений к световой среде (Lawson et al. 2012). Динамические ответы на интенсивность HL включают метаболические модификации, подавление цепи переноса электронов, а также изменения устьичных ответов и скорости активации α (Tinoco-Ojanguren and Pearcy 1995; Lawson et al. 2012 г.). В текущем исследовании основное внимание уделялось динамическим ответам на интенсивность HL. Таким образом, метаболические модификации и изменения в работе системы транспорта электронов были подробно изучены. Подавление системы транспорта электронов было очевидным ответом системы фотосинтеза на условия HL. Антенна, связанная с PSII, представляет собой высокодинамичный комплекс; он собирает и передает световую энергию в реакционный центр ФСII; однако, в зависимости от физиологических потребностей растения, оно может уменьшать количество доставляемой световой энергии, чтобы настроить возбуждение реакционного центра (Horton et al. 1996). Чтобы справиться со стрессом HL, растения рассеивают избыточную энергию в виде тепла с помощью процесса, известного как NPQ флуоресценции хлорофилла. При использовании NPQ энергия возбуждения молекул хлорофилла в антеннах не передается в реакционный центр и будет рассеиваться в виде тепла (Krause and Weis 1991). В соответствии с этим, в текущем исследовании воздействие условий HL привело к увеличению NPQ [см. Вспомогательную информацию — рис. S1, ] .
Метаболические модификации, вызванные HL, изучались путем анализа концентраций углеводов и пигментов одновременно с анализом компонентов окислительного стресса.Концентрация растворимых углеводов и крахмала резко снизилась после воздействия условий HL (рис. 9). Хотя свет является движущей силой фотосинтеза для производства углеводов, наш результат показал, что у растений, выращенных при освещении 250 мкмоль м -2 с -1 последующее воздействие условий HL (1500 мкмоль м -2 с -1 ) резко снизили содержание как растворимых, так и запасных углеводов (рис. 9). Положительные отношения были обнаружены между растворимыми углеводами и крахмалом с PI ABS (рис.10). Это указывает на то, что производительность операционной системы PSII играет важную роль в производстве растворимых углеводов и крахмала в растении розы. Более сильное снижение растворимых углеводов в растениях, выращиваемых R- и B, после стресса HL указывает на более высокую чувствительность их операционной системы PSII к стрессу HL.
Рисунок 10.
Взаимосвязь между показателем эффективности на основе абсорбции (PI ABS ) и концентрацией углеводов (растворимых углеводов и крахмала) в листьях растений розы, выращенных при различных спектрах света [синий (B), красный (R ), белый (W) и красно-синий (RB)] менее 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
Рис. 10.
Зависимость между показателем эффективности на основе абсорбции (PI ABS ) и концентрацией углеводов (растворимых углеводов и крахмала) в листьях растений розы, выращенных при различных спектрах света [синий (B), красный ( R), белый (W) и красно-синий (RB)] менее 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
В нашем исследовании накопление H 2 O 2 было обнаружено после стресса HL (рис. 8).Ранее сообщалось о производстве ROS в результате воздействия различных стрессовых условий окружающей среды (Steffens 2014; Pospíšil 2016). В фотосинтетических системах переноса электронов избыточная световая энергия сверх фотосинтетической способности вызывает производство АФК (Pospíšil, 2016). Неферментативные и ферментативные улавливающие системы участвуют в удалении АФК, образующихся в системе транспорта электронов во время воздействия стрессовых условий (Ahmad et al. 2010). Во время стресса HL баланс между системой очистки и образованием ROS может быть нарушен, что приведет к окислительному повреждению операционной системы PSII и ее компонентов (Aro et al. 1993). Более того, в таких обстоятельствах избыточная энергия, поглощаемая комплексом ФСII, не связана с переносом электронов, что приводит к полному сокращению пула PQ и блокированию электрона (Pospíšil 2016). Чтобы уменьшить восстановление пула PQ, электрон от Q A • — транспортируется к молекуле O 2 и генерирует супероксид-анион. Супероксид-анион-радикал также генерируется во время реакции Мелера на акцепторной стороне фотосистемы I.Этот радикал превращается СОД в H 2 O 2 , а затем в H 2 O с помощью CAT и APX (Caverzan et al. 2012). Мы показали, что в отличие от положительной корреляции между активностью СОД и продукцией H 2 O 2 (рис. 11), CAT и APX негативно регулируют продукцию H 2 O 2 . Накопление H 2 O 2 после стресса HL можно отнести к увеличению активности SOD и снижению активности CAT и APX (рис.8). Ранее сообщалось о фотоинактивации CAT интенсивностью HL. В соответствии с нашими результатами Фейерабенд и его коллеги (1996) показали, что CAT фотоинактивируется при воздействии света B или R.
Рисунок 11.
Взаимосвязь между концентрацией H 2 O 2 и активностью антиоксидантных ферментов (CAT, APX и SOD) в листьях растений розы, выращенных при разных спектрах света [синий (B), красный (R) , белый (W) и красно-синий (RB)] менее 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
Рисунок 11.
Взаимосвязь между концентрацией H 2 O 2 и активностью антиоксидантных ферментов (CAT, APX и SOD) в листьях растений розы, выращенных при разных спектрах света [синий (B), красный (R ), белый (W) и красно-синий (RB)] менее 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
В нашем исследовании была обнаружена отрицательная взаимосвязь между углеводами (растворимые углеводы и крахмал) и концентрацией H 2 O 2 (рис.12). В предыдущих исследованиях сообщалось, что накопление сахара происходит, когда растения выращивают при сильном освещении. Взаимосвязь между сахаром и накоплением АФК — это не просто положительная взаимосвязь. Сообщалось об ускорении определенных путей продукции ROS и замедлении других путей продукции ROS из-за высоких уровней растворимых углеводов (Couée et al. 2006).
Рисунок 12.
Зависимость между концентрацией H 2 O 2 и концентрацией углеводов (растворимых углеводов и крахмала) в листьях растений розы, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] при 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
Рис. 12.
Зависимость между концентрацией H 2 O 2 и концентрацией углеводов (растворимых углеводов и крахмала) в листьях растений розы, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красно-синий (RB)] при 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
Мы обнаружили положительную взаимосвязь между концентрациями антоцианов и PI ABS в нашей экспериментальной установке (рис.13). Наши данные показали, что хотя растения, выращенные при монохроматическом освещении R и B, имели более высокие концентрации антоцианов, что привело к лучшей производительности их операционной системы PSII, их концентрации антоцианов резко снизились после воздействия стресса HL, и в результате их PI ABS также были соответственно уменьшилось. Напротив, концентрации антоцианов в растениях, выращенных на W и RB, не изменялись до или после стресса HL. Следовательно, антоциан защищает фотосинтетический аппарат от стресса HL.По-видимому, отрицательная связь между растворимыми углеводами и накоплением АФК зависит от типа и продолжительности стрессового состояния. Например, воздействие низких температур при нормальной или высокой освещенности может привести к фотоокислительному повреждению (Harvaux and Kloppstech 2001) и накоплению растворимых углеводов. В таких условиях накопление сахара может помочь растениям справиться с повреждением HL (Ciereszko et al. 2001). Накопление углеводов может вызвать выработку антоциана.Халконсинтаза как ключевой фермент биосинтеза антоцианов может быть активирована сигналом от растворимых углеводов (Koch 1996; Deng et al. 2014). Следовательно, стресс HL может вызывать накопление как антоцианов, так и ROS (Steyn et al. 2002; Hatier and Gould 2008). В нашем исследовании уровень растворимых углеводов и антоцианов снизился после воздействия HL на оба монохроматических света, в то время как уровни этого снижения были ниже у растений, выращенных в W и RB.Как следствие, их операционная система PSII подверглась меньшему ущербу (рис. 10 и 13). Антоцианы могут действовать как светофильтры и защищать фотосинтетические компоненты от фотоингибирования, вызванного стрессом HL (Landi et al. 2015).
Рисунок 13.
Взаимосвязь между индексом эффективности на основе абсорбции (PI ABS ) и пигментами (антоциан и каротиноид) в листьях растений розы, выращенных при разных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] при 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
Рис. 13.
Взаимосвязь между показателем эффективности на основе абсорбции (PI ABS ) и пигментами (антоциан и каротиноид) в листьях растений розы, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красно-синий (RB)] при 250 (C) и 1500 (HL) мкмоль м -2 с -1 PPFD.
Выводы
В последнее десятилетие большое внимание уделяется созданию благоприятных условий освещения для выращивания роз.В настоящее время многие исследовательские группы по всему миру сосредотачиваются на вопросах, связанных с оптимальной интенсивностью и спектрами света для розовых растений. Для предотвращения интенсивностей HL при выращивании роз используются затеняющие экраны. Однако и затенение, и HL могут отрицательно влиять на рост растений и фотосинтез. Используя транзиенты полифазной флуоресценции хлорофилла а (тест OJIP), мы показали, что выращивание растений в монохроматическом свете R и B привело к более высокой чувствительности их операционной системы PSII к HL по сравнению с производительностью PSII растений, выращенных RB и W.Активность супероксиддисмутазы увеличивалась, в то время как активность CAT и APX снижалась после воздействия HL. Это привело к накоплению H 2 O 2 после воздействия HL. Отрицательные отношения были обнаружены между углеводами (растворимые углеводы и крахмал) и концентрацией H 2 O 2 , в то время как концентрация углеводов положительно влияла на индекс продуктивности растений. Наше исследование выявило защитную роль антоциана для операционной системы PSII.Производительность фотосинтетических систем в монохроматических R- и B-растениях снизилась из-за резкого снижения концентрации антоцианов после воздействия HL, тогда как растения, выращенные на W и RB, имели одинаковые уровни антоцианов до и после воздействия HL. Это говорит о том, что антоцианы защищали их фотосинтетический аппарат от стресса HL.
Источники финансирования
Мы хотели бы поблагодарить Иранский национальный научный фонд (INSF) (номер гранта 96006991) и Тегеранский университет за их поддержку.
Вклад авторов
S.A. внесла существенный вклад в концепцию и дизайн, а также выполнила статистический анализ, подготовила рукопись и критически отредактировала окончательную версию. ФУНТ. проводил эксперименты, собирал и критически анализировал научную литературу и помогал в написании рукописи. М.А. принимал участие в разработке и планировании экспериментов, подготовке материала для эксперимента и способствовал научному обсуждению полученных результатов.РС. помогал в подготовке материала для эксперимента и принимал участие в разработке, планировании и проведении экспериментов. T.L. участвовал в разработке концепции и плана эксперимента, подготовке материалов, научном обсуждении и критическом пересмотре окончательной рукописи. О.Л. способствовал планированию эксперимента и критическому редактированию окончательной рукописи.
Конфликт интересов
Не объявлено.
Дополнительная информация
Следующая дополнительная информация доступна в онлайн-версии этой статьи —
Таблица S1.Дисперсионный анализ (значения F ) для оцениваемых параметров для растений роз, выращенных при различных световых спектрах, а затем подвергнутых воздействию света высокой интенсивности (1500 мкмоль м -2 с -1 ).
Рисунок S1. Нефотохимическое тушение (NPQ), основанное на параметрах флуоресценции хлорофилла в листьях розовых растений, выращенных при различных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB)] до 250 (черный столбцы) и 1500 (серые столбцы) мкмоль м −2 с −1 плотность потока фотосинтетических фотонов (PPFD).Столбцы представляют собой средние значения ± стандартное отклонение.
Рисунок S2. Концентрации хлорофилла a (A), хлорофилла b (B) и общего хлорофилла (C) в листьях розовых растений, выращенных при разных спектрах света [синий (B), красный (R), белый (W) и красный и синий (RB) )] менее 250 (черные полосы) и 1500 (серые полосы) мкмоль м −2 с −1 плотность потока фотосинтетических фотонов (PPFD). Столбцы представляют собой средние значения ± стандартное отклонение.
Благодарности
Мы благодарим З. Солтани, К. Пирастех и С.Моемени за помощь в проведении экспериментов и измерений, доктору С. Калхору за критическую редакцию рукописи и компании Iran Grow Light за предоставление светодиодов и проекторов.
Цитированная литература
Ахмад
P
,Джалил
CA
,Салем
MA
,Наби
G
,Sharma
S
.2010
.Роль ферментных и неферментативных антиоксидантов в растениях при абиотическом стрессе
.Критические обзоры в области биотехнологии
30
:161
—175
.Aliniaeifard
S
,Malcolm Matamoros
P
,van Meeteren
U
.2014
.Нарушение работы устьиц в условиях низкого VPD: вызвано изменениями в морфологии устьиц и анатомии листа или в передаче сигналов ABA
?Physiologia Plantarum
152
:688
—699
.Aliniaeifard
S
,van Meeteren
U
.2014
.Естественные вариации в ответе устьиц на стимулы закрытия среди образцов Arabidopsis thaliana после воздействия низкого VPD как инструмент для распознавания механизма нарушения функционирования устьиц
.Журнал экспериментальной ботаники
65
:6529
—6542
.Арнон
DI
.1949
.Ферменты меди в изолированных хлоропластах. Полифенолоксидаза в Beta vulgaris 9000 3.
Физиология растений
24
:1
—15
.Aro
EM
,Virgin
I
,Andersson
B
.1993
.Фотоингибирование фотосистемы II. Инактивация, повреждение белков и оборот
.Biochimica et Biophysica Acta (BBA) -Bioenergetics
1143
:113
—134
.Breive
K
,Tamulaitis
G
,Duchovskis
P
,Bliznikas
Z
,Ulinskaite
R
,000
000
000,000 Brasil
Жукаускас
А
.2005
.Мощная светодиодная установка для растениеводства
.Физический журнал D: Прикладная физика
38
:3182
—3187
.Брестик
М
,Живчак
М
.2013
.Флуоресцентные методы PSII для измерения сигнала засухи и высокотемпературного стресса у сельскохозяйственных культур: протоколы и приложения
. ВМолекулярная стрессовая физиология растений
.Индия
:Springer
,87
—131
.Carvalho
SD
,Schwieterman
ML
,Abrahan
CE
,Colquhoun
TA
,Folta
KM
.2016
.Зависящие от качества света изменения морфологии, антиоксидантной способности и образование летучих в базилике душистом ( Ocimum basilicum )
.Границы растениеводства
7
:1328
.Caverzan
A
,Passaia
G
,Rosa
SB
,Ribeiro
CW
,Lazzarotto
F
—Margis
2012
.Реакция растений на стрессы: роль аскорбатпероксидазы в антиоксидантной защите
.Генетика и молекулярная биология
35
:1011
—1019
.Chen
M
,Chory
J
,Fankhauser
C
.2004
.Передача светового сигнала у высших растений
.Ежегодный обзор генетики
38
:87
—117
.Ciereszko
I
,Johansson
H
,Kleczkowski
LA
.2001
.Сахароза и световая регуляция гена индуцируемой холода UDP-глюкозопирофосфорилазы через гексокиназно-независимый и нечувствительный к абсцизовой кислоте путь в Arabidopsis
.Биохимический журнал
354
:67
—72
.Couée
I
,Sulmon
C
,Gouesbet
G
,El Amrani
A
.2006
.Участие растворимых сахаров в балансе активных форм кислорода и ответах на окислительный стресс у растений
.Журнал экспериментальной ботаники
57
:449
—459
.Dat
J
,Vandenabeele
S
,Vranová
E
,Van Montagu
M
,Inzé
D
, 9000Van Breuse
2000
.Двойное действие активных форм кислорода во время реакции растений на стресс
.Клеточные и молекулярные науки о жизни: CMLS
57
:779
—795
.Deng
X
,Bashandy
H
,Ainasoja
M
,Kontturi
J
,Pietiäinen
M
, 9000 2Valkonen
JP
,Elomaa
P
,Teeri
TH
.2014
.Функциональная диверсификация дублированных генов халконсинтазы в биосинтезе антоцианов Gerbera hybrida
.Новый фитолог
201
:1469
—1483
.Dhindsa
R
,Plumb-Dhindsa
P
,Thorpe
T
.1981
.Старение листьев: коррелирует с повышенными уровнями проницаемости мембран и перекисного окисления липидов, а также с пониженными уровнями супероксиддисмутазы и каталазы
.Журнал экспериментальной ботаники
32
:93
—101
.Díaz-Vivancos
P
,Clemente-Moreno
MJ
,Rubio
M
,Olmos
E
,García
JA
Эрнандес
JA
.2008
.Нарушение метаболизма хлоропластов приводит к накоплению АФК в растениях гороха в ответ на вирус оспы сливы
.Журнал экспериментальной ботаники
59
:2147
—2160
.Fanourakis
D
,Pieruschka
R
,Savvides
A
,Macnish
AJ
,Sarlikioti
V
.2013
.Источники изменения срока службы срезанных роз: обзор
.Послеуборочная биология и технология
78
:1
—15
.Feierabend
J
,Streb
P
,Schmidt
M
,Dehne
S
,Shang
W
.1996
.Экспрессия каталазы и ее отношение к световому стрессу и стрессоустойчивости
. В:Физические нагрузки в растениях
.Берлин
:Спрингер
,223
—234
.Фойе
CH
,Neukermans
J
,Queval
G
,Noctor
G
,Harbinson
J
.2012
.Фотосинтетический контроль транспорта электронов и регуляция экспрессии генов
.Журнал экспериментальной ботаники
63
:1637
—1661
.García Victoria
N
,Kempkes
F
,Van Weel
P
,Stanghellini
C
,Dueck
T
,Bruins
000Bruins
.
2011
.Влияние диффузного стеклянного покрытия теплицы на производство и качество роз
. В:Международный симпозиум по передовым технологиям и управлению на пути к устойчивым тепличным экосистемам. Greensys2011 952
,241
—248
.Genty
B
,Briantais
J-M
,Baker
NR
.1989
.Связь между квантовым выходом фотосинтетического транспорта электронов и тушением флуоресценции хлорофилла
.Biochimica et Biophysica Acta (BBA) — Общие субъекты
990
:87
—92
.Gu
J
,Zhou
Z
,Li
Z
,Chen
Y
,Wang
Z
,Zhang
000H
H
2017
.Фотосинтетические свойства и возможности для улучшения фотосинтеза у бледно-зеленого листового риса в условиях высокой освещенности
.Границы растениеводства
8
.Харво
M
,Kloppstech
K
.2001
.Защитные функции каротиноидных и флавоноидных пигментов против избыточного видимого излучения при температуре охлаждения исследованы на мутантах арабидопсиса npq и tt
.Planta
213
:953
—966
.Hatier
J-HB
,Gould
KS
.2008
.Функция антоцианов в вегетативных органах
. ВАнтоцианы
.Springer
,1
—19
.Heath
RL
,Пакер
L
.1968
.Фотопероксидация в изолированных хлоропластах. I. Кинетика и стехиометрия перекисного окисления жирных кислот
.Архив биохимии и биофизики
125
:189
—198
.Horton
P
,Ruban
AV
,Walters
RG
.1996
.Регулирование сбора урожая зеленых растений
.Ежегодный обзор физиологии растений и молекулярной биологии растений
47
:655
—684
.Kalaji
MH
,Goltsev
VN
,Zivcak
M
,Brestic
M
.2017
.Флуоресценция хлорофилла: понимание продуктивности сельскохозяйственных культур — основы и применение
.Бока-Ратон
:CRC Press
.Kalaji
HM
,Jajoo
A
,Oukarroum
A
,Brestic
M
,Zivcak
M
,et
et
Лукасик
И
,Гольцев
В
,Ковш
RJ
.2016
.Флуоресценция хлорофилла А как инструмент для мониторинга физиологического статуса растений в условиях абиотического стресса
.Acta Physiologiae Plantarum
38
:102
Каладжи
HM
,Oukarroum
A
,Александров
V
,c2000c2000 Mouzmanova000,000000 MouzmanovaM
,Самборская
IA
,Cetner
MD
,Аллахвердиев
SI
,Goltsev
V
.2014
.Выявление дефицита питательных веществ в растениях кукурузы и томата с помощью измерения флуоресценции хлорофилла a in vivo
.Физиология и биохимия растений
81
:16
—25
.Kim
SJ
,Hahn
EJ
,Heo
JW
,Paek
KY
.2004
.Влияние светодиодов на чистую скорость фотосинтеза, рост и устьица листьев проростков хризантем in vitro
.Scientia Horticulturae
101
:143
—151
Koch
KE
.1996
.Углеводно-модулированная экспрессия генов в растениях
.Ежегодный обзор физиологии растений и молекулярной биологии растений
47
:509
—540
.Козай
Т
.2016
.Светодиодное освещение для городского сельского хозяйства
. В:Козай
Т
, изд.Светодиодное освещение для городского сельского хозяйства
.Сингапур
:Springer
.Kozai
T
,Niu
G
,Takagaki
M
.2015
.Завод растений: внутренняя вертикальная система земледелия для эффективного производства качественных продуктов питания
.США
:Academic Press
.Krause
G
,Weis
E
.1991
.Флуоресценция и фотосинтез хлорофилла: основы
.Ежегодный обзор физиологии растений и молекулярной биологии растений
42
:313
—349
.Landi
M
,Tattini
M
,Gould
KS
.2015
.Многочисленные функциональные роли антоцианов во взаимодействиях растения и окружающей среды
.Экологическая и экспериментальная ботаника
119
:4
—17
Lawson
T
,Kramer
DM
,Raines
CA
.2012
.Повышение урожайности за счет использования механизмов, лежащих в основе естественной изменчивости фотосинтеза
.Текущее мнение в области биотехнологии
23
:215
—220
.Li
Q
,Kubota
C
.2009
.Влияние качества дополнительного освещения на рост и фитохимические свойства молодого листового салата
.Экологическая и экспериментальная ботаника
67
:59
—64
Long
A
,Zhang
J
,Yang
LT
,X
NW,Tan
LL
,Lin
D
,Chen
LS
.2017
.Влияние низкого pH на фотосинтез, связанные физиологические параметры и профиль питательных веществ цитрусовых
.Границы растениеводства
8
:185
.Martinazzo
EG
,Ramm
A
,Bacarin
MA
.2012
.Флуоресценция хлорофилла а как индикатор температурного стресса в листьях Prunus persica
.Бразильский журнал физиологии растений
24
:237
—246
Матур
S
,Mehta
P
,Jajoo
A
.2013
.Влияние двойного стресса (высокая соль и высокая температура) на фотохимическую эффективность листьев пшеницы ( Triticum aestivum )
.Физиология и молекулярная биология растений
19
:179
—188
.McCready
R
,Guggolz
J
,Silviera
V
,Owens
H
.1950
.Определение крахмала и амилозы в овощах
.Аналитическая химия
22
:1156
—1158
.Miyake
C
,Amako
K
,Shiraishi
N
,Sugimoto
T
.2009
.Акклимация листьев табака к высокой интенсивности света запускает систему окисления пластохинона — соотношение между долей открытых центров ФСII, нефотохимическое тушение флуоресценции хл и максимальный квантовый выход ФСII в темноте
.Физиология растений и клеток
50
:730
—743
.Морроу
RC
.2008
.Светодиодное освещение в садоводстве
.Hortscience
43
:1947
—1950
.Müller
P
,Li
XP
,Niyogi
KK
.2001
.Нефотохимическая закалка. Ответ на избыток световой энергии
.Физиология растений
125
:1558
—1566
.Накано
Y
,Asada
K
.1981
.Перекись водорода улавливается аскорбат-специфической пероксидазой в хлоропластах шпината
.Физиология растений и клеток
22
:867
—880
.Panda
D
,Sharma
S
,Sarkar
R
.2008
.Быстрые переходные процессы флуоресценции хлорофилла как инструменты выбора устойчивости к погружению в рис ( Oryza sativa )
.Индийский журнал сельскохозяйственных наук
78
:933
.Паттерсон
BD
,MacRae
EA
,Ferguson
IB
.1984
.Оценка перекиси водорода в растительных экстрактах с использованием титана (IV)
.Аналитическая биохимия
139
:487
—492
.Petrella
DP
,Metzger
JD
,Blakeslee
JJ
,Nangle
EJ
,Gardner
DS
.2016
.Производство антоцианов с использованием грубого мятлика, обработанного светом высокой интенсивности
.Hortscience
51
:1111
—1120
.Поспишил
П
.2016
.Производство активных форм кислорода фотосистемой II в ответ на световой и температурный стресс
.Границы растениеводства
7
.Rabara
RC
,Behrman
G
,Timbol
T
,Rushton
PJ
.2017
.Влияние спектрального качества монохроматических светодиодных фонарей на рост проростков артишока
.Границы растениеводства
8
:190
.Rapacz
M
,Sasal
M
,Kalaji
HM
,Kościelniak
J
.2015
.Является ли тест OJIP надежным индикатором зимостойкости и морозостойкости мягкой пшеницы и тритикале в изменчивых зимних условиях
?PLoS One
10
:e0134820
.Roach
T
,Krieger-Liszkay
A
.2014
.Регулирование фотосинтетического транспорта электронов и фотоингибирование
.Current Protein & Peptide Science
15
:351
—362
.Sæbø
A
,Krekling
T
,Appelgren
M
.1995
.Качество света влияет на фотосинтез и анатомию листьев проростков березы in vitro
.Культура растительных клеток, тканей и органов
41
:177
—185
.Саркар
R
,Ray
A
.2016
.Устойчивый к погружению рис выдерживает полное погружение даже в соленую воду: зондирование через индукцию флуоресценции хлорофилла a OJIP transients
.Photosynthetica
54
:275
—287
.Шарма
ПК
,Холл
DO
.1993
.Роль каротиноидов в защите от фотоингибирования
. In:Abrol
YP
,Mohanty
P.
,Govindjee
, ред.Фотосинтез: фотореакции на продуктивность растений
.Дордрехт
:469
—478
.Смит
H
.1982
.Качество света, световосприятие и стратегия растений
.Ежегодный обзор физиологии растений
33
:481
—518
.Стеффенс
В
.2014
.Роль этилена и АФК в реакции на засоление, тяжелые металлы и наводнения риса
.Границы растениеводства
5
:685
.Steyn
W
,Wand
S
,Holcroft
D
,Jacobs
G
.2002
.Антоцианы в вегетативных тканях: предлагаемая объединенная функция фотозащиты
.Новый фитолог
155
:349
—361
.Штрассер
BJ
.1995
.Измерение переходных процессов быстрой флуоресценции для решения вопросов, связанных с окружающей средой: тест JIP
. В:Mathis
,Paul
, ред.Фотосинтез: от света к биосфере
.Дордрехт, Нидерланды
:Kluwer Academic Publishers
,977
—980
.Strasser
RJ
,Srivastava
A
,Tsimilli-Michael
M
.2000а
.Переходная флуоресценция как инструмент для характеристики и анализа фотосинтетических образцов
. В:Mohammad
Yunus
,Uday
Pathre
,Prasanna
Mohanty
, ред.Зондирование фотосинтеза: механизмы, регуляция и адаптация
.Лондон и Нью-Йорк
:CRC press
,445
—483
.Штрассер
RJ
,Шривастава
A
,Цимилли-Майкл
MG
.2000b
.Переходная флуоресценция как инструмент для характеристики и анализа фотосинтетических образцов
. В:Mohammad
Yunus
,Uday
Pathre
,Prasanna
Mohanty
, ред.Зондирование фотосинтеза: механизмы, регуляция и адаптация
.Лондон и Нью-Йорк
:CRC press
,445
—483
.Штрассер
RJ
,Стирбет
AD
.1998
.Неоднородность фотосистемы II, исследованная численно смоделированным ростом флуоресценции хлорофилла a (O – J – I – P)
.Математика и компьютеры в моделировании
48
:3
—9
.Strasser
RJ
,Tsimilli-Michael
M
,Srivastava
A
.2004
.Анализ переходной флуоресценции хлорофилла а
. В:Джордж Христос
Папагеоргиу
,Говинджи
, ред.Флуоресценция хлорофилла а
.Дордрехт
:Спрингер
,321
—362
.Taiz
L
,Zeiger
E
.2002
.Физиология растений
.США
:Sinauer Associates
.Теннессен
DJ
,Singsaas
EL
,Sharkey
TD
.1994
.Светодиоды как источник света для исследования фотосинтеза
.Исследования фотосинтеза
39
:85
—92
.Тиноко-Оджангурен
C
,Пирси
R
.1995
.Сравнение влияния качества и количества света на рост, устойчивые и динамические фотосинтетические характеристики трех тропических видов деревьев
.Функциональная экология
9
:222
—230
.фургон Дорн
WG
.2012
.Водные отношения срезанных цветов: обновление
.Обзоры садоводства
40
:55
—106
.Васс
I
.2012
.Молекулярные механизмы фотоповреждения в комплексе фотосистемы II
.Biochimica et Biophysica Acta (BBA) -Bioenergetics
1817
:209
—217
.Vialet-Chabrand
S
,Matthews
JS
,Simkin
AJ
,Raines
CA
,Lawson
T
.2017
.Значение колебаний света для фотосинтетической акклиматизации растений
.Физиология растений
173
:2163
—2179
.Vranová
E
,Inzé
D
,Van Breusegem
F
.2002
.Передача сигнала при окислительном стрессе
.Журнал экспериментальной ботаники
53
:1227
—1236
.Вагнер
ГДж
.1979
.Содержание и вакуоль / экстравакуольное распределение нейтральных сахаров, свободных аминокислот и антоцианов в протопластах
.Физиология растений
64
:88
—93
.Whitelam
GC
,Halliday
KJ
.2008
.Ежегодные обзоры растений, свет и развитие растений
.UK
:John Wiley & Sons
.Zhao
X
,Chen
T
,Feng
B
,Zhang
C
,Peng
S
,Zhang
000
Тао
L
.2017
.Нефотохимическое тушение играет ключевую роль в световой акклиматизации растений риса, различающихся по окраске листьев
.Границы растениеводства
7
.Zivcak
M
,Brestic
M
,Kalaji
HM
,Govindjee
.2014
.Фотосинтетические реакции листьев ячменя, выращенных на солнце и в тени, на яркий свет: связано ли более низкое соединение ФСII в теневых листьях с защитой от избытка света
?Исследования фотосинтеза
119
:339
—354
.© Автор (ы) 2018. Опубликовано Oxford University Press от имени Annals of Botany Company.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 4.0 /), который разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. .